Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de fitopatología
versión On-line ISSN 2007-8080versión impresa ISSN 0185-3309
Rev. mex. fitopatol vol.40 no.1 Texcoco ene. 2022 Epub 03-Oct-2022
https://doi.org/10.18781/r.mex.fit.2109-3
Notas Fitopatológicas
Caracterización y patogenicidad de un aislado de Pythium aphanidermatum causante de ‘damping off’ en plántulas de chile
1 Departamento de Parasitología Agrícola, Universidad Autónoma Agraria Antonio Narro. Calzada Antonio Narro 1923, Buenavista, Saltillo, Coahuila, C.P. 25315, México.
2 Instituto Tecnológico Superior De El Mante. Carretera Federal Libre Mante-Ciudad Valles Km 6.7, Congregación Quintero, Tamaulipas; C. P. 89930, México.
La producción de plántula de chile (Capsicum annuum) es afectada por el complejo de hongos causantes del ‘damping off’, donde sobresalen especies del oomyceto Pythium spp. El objetivo del presente estudio fue identificar el agente causal de la muerte de plantas de chile y evaluar su patogenicidad en semillas y plántulas de chile. Se aisló un oomyceto de crecimiento rápido y agresivo en plantas de chile, identificado morfológicamente como P. aphanidermatum en base a sus estructuras de reproducción sexual y asexual y, mediante técnicas moleculares. Este aislamiento tuvo un alto grado de patogenicidad in vitro en pre-emergencia y post-emergencia en chile, mostrando el 100% de mortalidad. Además, presentó una tasa alta de crecimiento micelial en diferentes medios de cultivo (V8- Agar, Maíz Agar, Maíz Papa Agar, Papa Dextrosa Agar, Czapek y Avena Agar), siendo el medio V8-Agar el único medio donde desarrolló estructuras de reproducción sexual y asexual. El aislamiento, presentó una tasa de crecimiento micelial de 58.3± 0.3 mm/día a 26± 2 °C en el medio PDA. Por su rapidez de crecimiento y su alto grado de patogenicidad in vitro, es un aislado inusual y agresivo para plántula de chile.
Palabras clave: crecimiento; medios de cultivos; oomyceto; virulencia; reproducción
The production of the pepper seedling (Capsicum annuum) is affected by the fungal complex that causes the ‘damping-off’, in which some species of the oomycete Pythium spp., stand out. The objective of the present study was to identify the causal agent of the death of pepper plants and evaluate its pathogenicity in pepper seeds and seedlings. A fast and aggressive growing oomycete was isolate from pepper plants, morphologically identified as P. aphanidermatum based on its sexual and asexual reproduction structures and, by molecular techniques. This isolate had a high degree of in vitro pathogenicity in pre-emergence and post-emergence in chile, showing 100% mortality. In addition, it presented a high rate of mycelial growth in different culture media (V8-Agar, Corn Agar, Corn Potato Agar, Potato Dextrose Agar, Czapek & Oat Agar), being in V8-Agar medium the only medium where it developed reproduction structures sexual and asexual. The isolation presented a mycelial growth rate of 58.3 ± 0.3mm / day at 26 ± 2 °C in PDA medium. Due to its rapid growth and its high degree of pathogenicity in vitro, it is an unusual and aggressive isolate for pepper seedlings.
Key words: growth; culture media; oomycete; virulence; reproduction
En México, la producción de plántula de chile es severamente afectada por la enfermedad conocida como ‘damping off’ o ahogamiento, con pérdidas que oscilan del 10 al 100%. La enfermedad es causada por un complejo de especies de Fusarium, Rhizoctonia, Phytophthora y Pythium (Hernández, 2018), sin embargo, las especies de Pythium se les considera como el principal agente causal (Elshahawy et al., 2018; Hernández, 2018). Pythium es un oomyceto que se diferencia de los hongos verdaderos al poseer celulosa y β-glucanos como constituyentes de su pared celular. Este género tiene distribución mundial y le favorecen climas con alta humedad y temperaturas muy variadas, dependiendo de la especie (Schroeder et al., 2013). La infección inicial se puede originar por un fragmento de micelio en crecimiento o la germinación de zoosporas, oósporas y hasta de un esporangio. En la etapa de penetración, las especies de Pythium requieren de alta humedad y se introduce a través de heridas o ejerciendo presión mecánica y degradación enzimática de los tejidos de la planta. En raíces jóvenes penetra por las puntas de las raicillas (Agrios, 2005). Este microorganismo tiene la capacidad de sobrevivir como saprofito en restos de plantas y como parásito en más de 60 géneros de cultivos pertenecientes a las familias solanáceas, cucurbitáceas, entre otras (Agrios, 2005; Díaz et al., 2011; Valdés et al., 2011). En el establecimiento de charolas o almácigos, el daño por Pythium spp., se presenta en etapa de pre y post-emergencia (Gómez et al., 2011; Grijalba y Ridao, 2017), en las que ocasiona pudrición de semillas, estrangulamiento de la base del tallo, necrosis de raíces, marchitamiento, acame y muerte de plántulas (Gómez y Melero, 2011; D’Angelo, 2016; Rivera y Fernández, 2017). Las plantas adultas generalmente son afectadas a nivel de las raíces con lesiones pequeñas en la epidermis, aunque puede llegar a dañar los frutos expuestos a alta humedad o en postcosecha (Fry et al., 2010; Díaz et al., 2011; Hernández et al., 2018). Este género tiene una alta tasa de crecimiento (Schroeder et al., 2013), pudiendo ser entre 7-34 mm diarios, dependiendo de la especie, la temperatura y del sustrato en el que se desarrolla (Van der Plaats-Niterink, 1981).
Se han documentado aproximadamente 160 especies pertenecientes al género Pythium (Grijalba y Ridao, 2017), donde las de mayor importancia son P. aphanidermatum, P. ultimum, P. debaryanum, P. irregulare, P. myriotylum entre otras (Díaz et al., 2011; Grijalba et al., 2015; Ríos y de Rocha, 2018; Grijalba et al., 2020). La identificación morfológica de Pythium spp., se basa en la forma y dimensiones de las estructuras de reproducción sexual y asexual como son, esporangios, oogonio, tipo de oóspora (aplerótica o plerótica) y el número y posición del anteridio con su unión al oogonio. Debido a que existe mucha variación de estas estructuras entre las especies, resulta difícil su identificación morfológica, por lo que se recurre a la identificación molecular para obtener una caracterización con mayor confiabilidad (Díaz et al., 2011; Schroeder et al., 2013). Durante un recorrido en Julio del 2019 en invernaderos establecidos con chile, en el municipio de Parras de la Fuente, Coahuila, México, se detectó la muerte de plántulas. En esta región no se cuenta con registros de patógenos en chile causantes de “damping off”, por lo que se decidió identificar al agente causal, estudios preliminares indicaron que el Oomyceto asociado a la enfermedad mostró características del género Pythium. Por lo anterior se llevó acabo el presente estudio con los siguientes objetivos. A) Identificar al agente causal de la muerte de plantas de chile en invernaderos de Parras, Coahuila, México y B) Evaluar su patogenicidad en semillas y plántulas además de su comportamiento y tasa de crecimiento en diferentes medios de cultivo en laboratorio.
Ubicación del experimento. Este trabajo se realizó en el Laboratorio de Microbiología del Departamento de Parasitología Agrícola de la Universidad Autónoma Agraria Antonio Narro (UAAAN) ubicada en Calzada Antonio Narro 1923, Buenavista, Saltillo, Coahuila, México.
Aislamiento del fitopatógeno. Se colectaron plántulas de chiles serrano con sintomatología típica de ‘damping off’ o ahogamiento en tres invernaderos de la región de Parras de la Fuente, Coahuila. Las plántulas se trasladaron al laboratorio, donde se lavaron con agua corriente y se separaron las raíces y tallos. Posteriormente, se cortaron en pequeños trozos con ayuda de un bisturí estéril, se desinfectaron en una solución de hipoclorito de sodio al 1% durante 3 min, se lavaron en tres pasos de agua destilada estéril y se dejaron secar sobre papel estraza estéril bajo condiciones asépticas en una cámara de flujo laminar. Las porciones de raíz y tallo se transfirieron a cajas Petri con medio de cultivo V8- Agar (V8A) y se incubaron a 26± 2 °C por 4 días, donde se presentó micelio hialino cenocítico, oogonios, anteridios y esporangios típicos del género Pythium (Van der Plaats-Niterink, 1981). Fragmentos de micelio se transfirieron a medio de cultivo agar agua (AA), 24 h después el aislamiento se purificó transfiriendo puntas de hifas a cajas Petri con medio V8A y se incubó a 26± 2 °C con un fotoperiodo de 12:12 (luz: obscuridad) durante siete días, para su identificación, medición de su tasa de crecimiento y pruebas de patogenicidad.
Identificación morfológica. Se realizó por observaciones directas del crecimiento micelial, formación de esporangios, oogonios y anteridios desarrollados sobre una semilla esterilizada e inoculada con una porción de 3 mm de cultivo de Pythium spp., colocados en una caja Petri con medio de cultivo AA e incubada por siete días, tiempo en el que se formarían las estructuras mencionadas de este oomiceto. Las observaciones se realizaron con un microscopio digital Keyence VHX-7000 y un microscopio compuesto Motic BA210E, en este último se observaron preparaciones microscópicas. La identificación se realizó de acuerdo a las claves descriptivas de Van der Plaats-Niterink (1981).
Caracterización molecular. La confirmación de la identidad de la especie de Pythium sp., se realizó con base a las secuencias espaciadoras transcritas internas (ITS’s) 1 y 4, incluyendo el gen 5.8S DNAr, obtenidas en el Laboratorio Nacional de Biotecnología Agrícola, Médica y Ambiental (LANBAMA) en San Luis Potosí, México. Las muestras fueron secuenciadas con el método de dideoxinucleótidos marcados en el secuenciador 3130 Genetic Analyzer (Applied Biosystems) en un analizador automático de la serie 3500 Genic Analizer. Para amplificar los genes se utilizó un termociclador Verity para PCR de punto final (Applied Biosystems) usando los oligos ITS1 (TCCGTAGGTGAACCTGCGG) e ITS4 (TCCTCCGCTTATTGATATGC) (Al-Sheikh, 2010; Jahén Rivera et al., 2020).
Pruebas de patogenicidad. Se realizaron in vitro en cajas Petri con medio de cultivo AA, mediante dos metodologías; en pre-emergencia y post-emergencia. La primera se realizó mediante la técnica utilizada por Apodaca et al. (2002), que consistió en colocar 10 semillas de chile serrano hibrido Platino en cajas Petri conteniendo AA e inocularlas con una mezcla de micelio, oogonios, oósporas y zoosporas de Pythium. Las semillas inoculadas se incubaron a 26 ± 2 °C con un fotoperiodo de 12:12 (luz: obscuridad) y se evaluó la severidad cada 24 h por 12 días. La segunda metodología se realizó mediante la técnica propuesta por Sánchez et al. (1975) con ligeras modificaciones; se germinaron 50 semillas del mismo hibrido en medio AA, transcurridos cinco días y una vez que se desarrolló el hipocótilo (hp), se transfirieron axenicamente puras en grupos de tres semillas, a nuevas cajas Petri conteniendo AA, dos días después, cuando se observó el desarrollo de su raíz y cotiledones, se transfirió en el centro de las cajas Petri una porción de micelio de Pythium con medio de cultivo de 3 mm de diámetro de siete días de crecimiento que procedía de cajas Petri conteniendo V8A. Las cajas Petri se incubaron a 26 ± 2 °C con un fotoperiodo de 12:12 (luz: obscuridad) y se evaluó la severidad a los cinco días después de la inoculación. En ambas metodologías se utilizó la escala visual de severidad descrita por Apodaca et al. (2002), con modificaciones, donde 0= sin síntomas planta sana, 1= pocos puntos pequeños necróticos en el hp o en cotiledones, 2= necrosamiento en la base del hp, 3= hp necrosado hasta en un 50%, 4= semilla, hp o planta completamente necrosada. Los dos tratamientos (uno con inoculación y el otro sin inoculación) se distribuyeron en un arreglo completamente al azar con tres repeticiones y dos tratamientos. Los datos se sometieron a un análisis de varianza (ANOVA) y prueba de comparación de medias de Tukey (p≤0,05) en el programa estadístico R versión 3.3.1.
Desarrollo de Pythium en diferentes medios de cultivo. Se utilizaron los medios de cultivos V8- Agar (V8A), Maíz Agar (MA), Maíz Papa Agar (MPA), Papa Dextrosa Agar (PDA), Czapek (Czp) y Avena Agar (AvA), en cajas Petri de 9 cm de diámetro. En cada uno de los medios se transfirió una porción de micelio de 3 mm de diámetro de Pythium de dos días de crecimiento en V8A. La medición del crecimiento micelial se realizó a las 24 h después de la siembra. Se utilizó un diseño completamente al azar con cuatro repeticiones (cuatro cajas Petri). Los datos se sometieron a un análisis de varianza (ANOVA) y prueba de comparación de medias de Tukey (p≤0,05) en el programa estadístico R versión 3.3.1.
Identificación morfológica de Pythium sp. El aislamiento obtenido de plantas de chile con síntomas de damping off, presentó hifas toruloides cenocíticas hialinas con diámetro de 5-7 µm (Figura 1-Aa y Da), oogonios terminales esféricos, lisos de 25-28 µm de diámetro (Figura 1- Ba, Ca y Ea), con oóspora aplerotica de 24-26 µm de diámetro (Figura 1Cc y Eb), anteridios diclinos o monoclinos uno por oogonio (Figura 1-Bbc y Cb), esporangios filamentosos, lobulados e irregulares (Figura 1-Fa) y zoosporas (Figura 1Ab). Estas características concordaron al usar las claves taxonómicas de Van der Plaats-Niterink (1981) y Tsuneo (2010) con las de Pythium aphanidermatum. Sin embargo, aunque las características morfológicas observadas en Pythium concuerdan con las descritas por estos dos autores existen diferencias con los tamaños de algunas estructuras; por ejemplo Van der Plaats-Niterink (1981) describe a la hifa con un diámetro de 10 µm, oogonios que miden de 20-25 µm con oóspora aplerotica de 18-22 µm y de uno a dos anteridios por oogonio, mientras que en esta investigación se encontraron hifas de un diámetro de 5-7 µm, oogonios con diámetro de 25-28 µm con oóspora aplerotica de 24-26 de µm y con un solo anteridio por oogonio. Las características observadas en este estudio fueron similares a las observadas por Díaz et al. (2011) donde observó oogonios de 27.5 µm de diámetro y solo un anteridio por oogonio, al igual con Al-Sheikh (2010), que reporta esporangios irregulares, oogonios terminales esféricos de 24 µm de diámetro en promedio, con oóspora aplerotica de 24-26 µm y un anteridio diclino o monoclino.

Figura 1 Pythium aphanidermatum. A) a- hifa cenocítica y b- Zoosporas. B) a- Oogonios terminales esféricos lisos, b y c- Anteridios diclinos. C) a- Oogonio, b- Anteridio monoclino y c- Oóspora aplerotica. D) a- Hifas toruloides. E) a- Oogonio terminal y b- Oóspora aplerotica. F) a- esporangios lobulados
Identificación molecular de Pythium sp. La secuenciación de la región del ADNr ITS-1- del gen 5.8S- ITS-4 del oomiceto mostró un porcentaje de 99.15% de similitud con la secuencia clave de acceso JN695786.1., del Gen Bank, correspondiente a P. aphanidermatum. Lo anterior, permitió tener certidumbre de la identidad del agente causal del “damping off” de plantas de chile en invernaderos de Parras de la Fuente. Otros investigadores para caracterizar esta especie han empleado oligos diferentes como ITS4 e ITS5, ITS1 e ITS2 tal es el caso de Al-Sheikh, (2010) y Díaz et al. (2011), mientras que Grijalba et al. (2015) utilizaron los oligos ITS4 e ITS5, confirmando la identidad de la especie P. aphanidermatum como causante del ahogamiento de plantas de trigo, jitomate y ornamentales, a diferencia de este estudio que reporta el aislamiento de plántulas de chile en invernadero.
Pruebas de patogenicidad. En pre-emergencia, las semillas inoculadas con P. aphanidermatum, mostraron el crecimiento de micelio blanquecino a las 24 h después de la inoculación, lo que no ocurrió en las semillas testigo. Cinco días después de la inoculación se observó la formación del hipocótilo (hp) en los tratamientos sin inocular e inoculado, pero sólo el tratamiento testigo desarrolló la raíz (Figura 2A y C). Doce días después de la inoculación se observó que los tratamientos inoculados con P. aphanidermatum no mostraron desarrollo de cotiledones, ni de raíz y su hipocótilo se encontraba necrosado y con presencia de micelio (Figura 2D), de las 30 semillas inoculadas sólo tres no mostraron desarrollo del hipocótilo, mientras que en el tratamiento testigo las semillas desarrollaron raíz, tallo y cotiledones sin síntomas ni signos del microorganismo (Figura 2B).
En el caso de post-emergencia, en todos los tratamientos inoculados con una porción de micelio de 3 mm de diámetro del cultivo de Pythium, se observó crecimiento micelial a las 24 h después de la inoculación, excepto en el testigo. Tres días después de la inoculación, las plantas mostraron síntomas de necrosis en cotiledones y raíces, además, de abundante micelio (Figura 2E) y a los cinco días mostraron necrosis total (Figura 2F), mientras que los testigos no presentaron síntomas (Figura 2G).
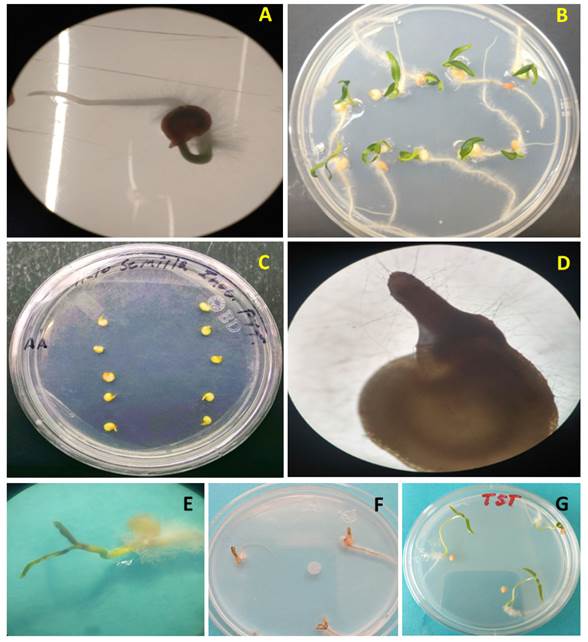
Figura 2 Pruebas de patogenicidad de P. aphanidermatum en semillas y plántulas de chile serrano. A) Tratamiento testigo, semilla de cinco días después de la siembra (dds), B) Tratamiento testigo 12 dds, C) Semillas inoculadas con P. aphanidermatum cinco días después de la inoculación (ddi), D) Semilla inoculada con P. aphanidermatum de 12 ddi, E) Necrosis de los cotiledones y abundante micelio en la raíz 3 ddi, F) Necrosis total de las plántulas 5 ddi, G) Tratamiento testigo con plántulas sin síntomas.
El aislamiento caracterizado como P. aphanidermatum mostró alta patogenicidad en pre y post-emergencia al causar el 100% de mortalidad de las semillas y plántulas de chile serrano, datos similares a los reportados por Grijalba et al. (2015) y Grijalba et al. (2020) en plántulas de jitomate y soya respectivamente. A temperatura superior a 25 °C, al igual que Al-Sheikh (2010) reportó que P. aphanidermatum causa 100% de ‘damping off’ tanto en pre y post-emergencia en trigo. Mientras que Valdez et al. (2011) reportó una reducción del 65% de la germinación de semillas de Jatropha inoculadas con el mismo oomiceto in vitro.
De acuerdo a la escala de severidad de Apodaca et al. (2002), el nivel de daño observado en los tratamientos inoculados se ubicó en el nivel más alto (4) de la escala; donde se detectó necrosis, pudrición de semillas y muerte de la plántula, mientras que los testigos se ubicaron en el nivel 0 de la escala por no presentar signos ni síntomas del microorganismo. Dado lo anterior, se consideró al aislado identificado como P. aphanidermatum como un agente causal severo de “damping off” en pre y post-emergente de plántulas y semillas de chile.
Desarrollo de Pythium aphanidermatum en diferentes medios de cultivo. En el cuadro 1 se observó que 24 h después de la siembra del microorganismo presentó diferencia significativa del crecimiento micelial en los distintos tratamientos, siendo V8A el medio donde P. aphanidermatum logró el mayor crecimiento micelial con 67.7 mm/día, siendo estadísticamente superior al resto de los tratamientos con un incremento del 18% con respecto al tratamiento MA que fue el que obtuvo el menor crecimiento con 57.3 mm/día. Estos crecimientos fueron superiores al reportado por Van der Plaats-Niterink (1981) quien menciona un crecimiento de 30 mm/día para esta misma especie, lo cual pudiera ser un factor implicado en la elevada capacidad patogénica observada sobre semilla y plántulas de chile.
Cuadro 1 Tasa de crecimiento micelial de P. aphanidermatum en 24 h en distintos medios de cultivo.
| Medio de Cultivo | Media del Crecimiento (mm ± DS) |
|---|---|
| V8A | 67.7± 0.7 az |
| MPA | 60.2± 0.7 b |
| PDA | 58.3± 0.3 bc |
| Czp | 58.2± 0.5 bc |
| AvA | 58.1± 0.3 c |
| MA | 57.3± 1.8 c |
z Medias con letras distintas son significativamente diferentes (Tukey; p≤0,05).
El comportamiento de P. aphanidermatum a las 32 h en los distintos medios de cultivo se observa en la Figura 3, donde se aprecia que presentó micelio blanco y algodonoso, excepto en el medio Czp (Figura 3A), donde su micelio fue escaso y superficial al ras del medio de cultivo. En medio MA (Figura 3B), P. aphanidermatum presentó micelio denso, pero menor crecimiento que en MPA (Figura 3C), V8A (Figura 3F) y AvA (Figura 3D). En este último medio, el oomiceto logró desarrollar el micelio más abundante y denso. Sin embargo, fue en V8A donde se presentó la diferenciación celular y se observaron estructuras de reproducción asexual y sexual.
Es importante resaltar que la formación de estructuras de reproducción de Pythium aphanidermatum como esporangios, oogonios y zoosporas sólo ocurrió en el medio V8A en 96 h después de la siembra, ningún de los demás tratamientos estudiados (medios de cultivo) desarrollaron estructuras de reproducción sexual o asexual hasta las 168 h de incubación. Por lo que el V8A por su contenido de nutrientes favoreció el crecimiento y formación de estructuras sexuales y asexuales de P. aphanidermatum, tal y como lo reporta Ko (1998) y González et al. (2014), que medios de cultivo con altos contenidos de azucares (gliceridos) y vitaminas favorecen la producción de oósporas y anteridios de Pythium y Phytophthora. También se observó el crecimiento de micelio algodonoso característico de P. aphanidermatum en el medio de cultivo PDA (Grijalba et al., 2015; Al-Sheikh, 2010). Este fitopatógeno al crecer en medio Czapek mostró un pobre desarrollo al igual que en PDA, siendo en AvA y V8A donde se favoreció el crecimiento de micelio algodonoso.
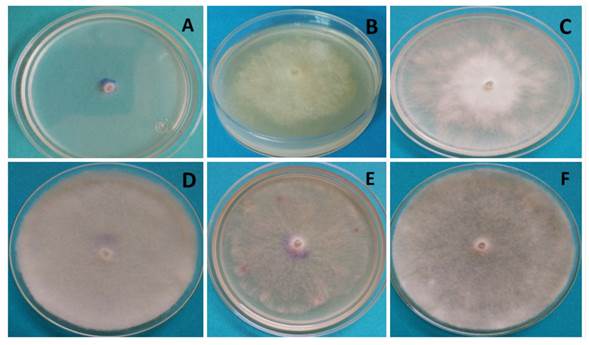
Figure 3 Crecimiento de Pythium aphanidermatum a las 32 h de incubación; A) Medio Czp, B) Medio MA, C) medio MPA, D) Medio AvA, E) Medio PDA, F) Medio V8A.
Se aisló e identificó morfológica y molecularmente a una cepa del oomiceto Pythium aphanidermatum causante de la muerte de plántulas de chile en invernadero de Parras de la Fuente en Coahuila, México. Se determinó que la cepa aislada presentó alta virulencia in vitro en preemergencia sobre semillas y en postemergencia en plántulas de chile serrano. La cepa aislada tiene un rápido desarrollo en diferentes medios de cultivo, siendo en V8A donde presentó mejor desarrollo, además, fue capaz de formar estructuras de reproducción sexual y asexual en dicho medio de cultivo el cual está elaborado a base de jugo de tomate, extractos vegetales y CaCO3.
Agradecimientos
Al CONACYT por la beca otorgada para realizar estudios de Maestría en Ciencias con Especialidad en Parasitología Agrícola.
REFERENCIAS
Agrios GN. 2005. Plant Pathology. 5a Ed., Academic Press. 922 pp. [ Links ]
Al-Sheikh H. 2010. Two pathogenic species of Pythium: P. aphanidermatum and P. diclinum from a wheat field. Saudi Journal of Biological Sciences 17(4): 347-352. https://doi.org/10.1016/j.sjbs.2010.05.001 [ Links ]
Apodaca SMÁ, Zavaleta ME, Garcia ER, Osada KS y Valenzuela UJG. 2002. Frecuencia de Campos Infestados con Fusarium oxysporum f. sp. radicis-lycopersici en Sinaloa, México, y su Control. Revista Mexicana de Fitopatología 20(1): 1-7. http://www.Reddalyc.org.articulo. oa?id=61220101 [ Links ]
Cotilla PL, Díaz RA, Berroa NG y Rodríguez RR. 2007. Influencia de cuatro medios de cultivo sobre el crecimiento micelial de Phytophthora palmivora (Butler) Butl. Centro Agrícola 34(2):49-52. http://cagricola.uclv.edu.cu/descargas/pdf/V34-Numero_2/cag102071543.pdf [ Links ]
D’Angelo OR. 2016. Enfermedad de marchitamiento fúngico en plántulas de lechuga: Un modelo didáctico-experimental para la enseñanza de los postulados de Koch. Revista Eureka sobre Enseñanza y Divulgación de las Ciencias 13(3): 680-685. http://hdl.handle.net/1049818505 [ Links ]
Díaz CM, Rodríguez AG, Silva RHV, Pedraza SME, Salgado GR y Fernández PSP. 2011. Identificación de especies de Pythium aisladas de plantas ornamentales. Revista Mexicana de Ciencias Agrícolas 2(3): 431-443. http://www.scielo.org.mx/scielo.php?script=sci_&piid=S2007-09342011000900003&lng=es&nrm=iso>. ISSN 2007-0934 [ Links ]
Elshahawy I, Abouelnasr HM, Lashin SM and Darwesh OM. 2018. First report of Pythium aphanidermatum infecting tomato in Egypt and its control using biogenic silver nanoparticles. Journal of Plant Protection Research 58(2): 137-151. http://dx.doi.org/10.24425/122929 [ Links ]
Fry W, Grünwald N y Ocotlán JM. 2010. Introducción a los Oomicetes. Editado por Alberto Valencia-Botín. The Plant Health Instructor. http://dx.doi.org/10.1094/PHI-I-2012-0220-01 [ Links ]
Gómez JR, Hernández FLM, Cossio VLE, López AJG y Sánchez LR. 2011. Enfermedades fungosas y bacterianas del cultivo de tomate en el estado de Nayarit. INIFAP, CIRPAC. Campo Experimental Santiago Ixcuintla. Folleto Técnico Núm. 19, Santiago Ixcuintla, Nayarit, México. https://es.readkong.com/page/enfermedades-fungosas-y-bacterianas-del-cultivo-de-tomate-9739198?p=1 [ Links ]
Gómez J y Melero JM. 2011. Patogenia de Pythium aphanidermatum y Pythium spp. sobre plántulas de pepino: I Influencia del cultivar y del sustrato en la gravedad de la enfermedad. Boletín de Sanidad Vegetal 37: 207-223. http://hdl.handle.net/10261/84091 [ Links ]
González PFD, Costales MD y Falcón RAB. 2014. Efecto de diferentes medios de cultivo sobre el desarrollo de Phytophthora nicotianae Breda de Haan. Revista de Protección Vegetal 29(1): 33-41. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1010-27522014000100004&lng=es&nrm=iso>. ISSN 1010-2752 [ Links ]
Grijalba PE, Zapata RL, Palmucci HE y Baron C. 2015. Podredumbre basal de plantas adultas de tomate causada por Pythium aphanidermatum (Oomycota). Boletín de la Sociedad Argentina de Botánica 50(1): 11-15. http://dx.doi.org/10.31055/1851.2372.v50.n1.10843 [ Links ]
Grijalba PE y Ridao ADC. 2017. Control químico de Pythium spp. en plántulas de soja. RIA. Revista de Investigaciones Agropecuarias 43(1): 67-71. http://www.redalyc.org/articulo.oa ?id=86451165010 [ Links ]
Grijalba PE, Ridao ADC and Steciow M. 2020. Damping off on soybean (Glycine max) caused by Pythium aphanidermatum in Buenos Aires Province (Argentina). Revista de la Facultad de Ciencias Agrarias UNCuyo 52(2): 282-288. http://revistas.uncu.edu.ar/ojs3/index.php/RFC A/article/view/3027 [ Links ]
Hernández HEJ, Hernández RI, Almaraz SJJ, López LA, Torres AM, y Morales FFJ. 2018. Caracterización in vitro de rizobacterias y su antagonismo con hongos causantes del Damping off en chile. Revista Mexicana de Ciencias Agrícolas 9(3): 525-537. http://dx.doi.10.29312/remexca.v9i3.335 [ Links ]
Jahén Rivera SN, Gomez Rivera O and Espinosa Victoria D. 2020. Isolation and identification of pathogens causing stem rot of the fig tree (Ficus carica). Revista Mexicana de Fitopatología 38 (2): 269-279. http://dx.doi.org/10.18781/R.MEX.FIT.2001-6. [ Links ]
Ko, WH. 1998. Chemical stimulation of sexual reproduction in Phytophthora and Pythium. Botanical Bulletin of Academia Sinica 39: 81-86. https://pdfs.semanticscholar.org/eb6a/e91e160c2071b24177c26742e14b76d21e21.pdf [ Links ]
Lévesque, CA and De Cock, AWAM. 2004. Molecular phylogeny and taxonomy of the genus Pythium. Mycological Research 108(12): 1363-1383. http://dx.doi.org/10.1017/s0953756 204001431 [ Links ]
Rios TL and De Rocha JRS. 2018. Potencial patogênico de especies do complexo Pythium (Oomycota) para a agricultura familiar no estado do piauí. Pesquisas Botânica 71: 147-158. http://www.anchietano.unisinos.br/publicacoes/botanica/botanica71/012.pdf [ Links ]
Rivera FCH y Fernández PS. 2017. Técnica de evaluación para damping-off en frijol (Phaseolus vulgaris l.) infectado por Pythium aphanidermatum. Tecnociencia Chihuahua 11(2): 41-47. https://vocero.uach.mx/index.php/tecnociencia/article/view/156 [ Links ]
Sánchez LE, Endo RM and Leary JV. 1975. A rapid technique for identifying the clones of Fusarium oxysporum f. sp. lycopersici causing crown and root rot of tomato. Phytopathology 65(6): 726-727. https://www.apsnet.org/publications/phytopathology/backissues/Documents/1975Articles/Phyto65n06_726.PDF [ Links ]
Schroeder KL, Martin FN, De Cock AWAM, Lévesque CA, Spies CFJ, Okubara PA and Paulitz TC. 2013. Molecular detection and quantification of Pythium species: evolving taxonomy, new tools, and challenges. Plant Disease 97(1): 4-20. http://dx.doi.org/10.1094/pdis-03-12-0243-fe [ Links ]
Tsuneo W. 2010. Pictorial atlas of soil and seed fungi: morphologies of cultured fungi and key to species. Third edition. CRC Press_Taylor & Francis, Group Boca Raton London New York. pp. 26-68. ISBN 9781439804193. [ Links ]
Valdés ROA, García ER, Sánchez, SO y Pérez VA. 2011. Aislamiento y patogenicidad de un posible Pythium aphanidermatum en Jatropha Curcas L. no tóxica. Tropical and subtropical agroecosystems 14(2): 649-660. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1870-04622011000200022 [ Links ]
Van der Plaats-Niterink AJ. 1981. Monograph of the genus Pythium. Studies in Mycology 21:1-242. https://www.studiesinmycology.org/sim/Sim21/full%20text.htm [ Links ]
Recibido: 14 de Septiembre de 2021; Aprobado: 22 de Diciembre de 2021











 texto en
texto en 


