Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de fitopatología
versión On-line ISSN 2007-8080versión impresa ISSN 0185-3309
Rev. mex. fitopatol vol.40 no.1 Texcoco ene. 2022 Epub 03-Oct-2022
https://doi.org/10.18781/r.mex.fit.2106-1
Artículos de revisión
Aspectos moleculares de la marchitez vascular del jitomate (Solanum lycopersicum) por Fusarium oxysporum f. sp. lycopersici y del antagonismo por Trichoderma spp.
1 Programa de Bacteriología y Laboratorio Clínico, Facultad de Ciencias de la Salud, Universidad Colegio Mayor de Cundinamarca, Bogotá, CP 110911, Colombia.
Las plantas de jitomate (Solanum lycopersicum) son susceptibles a la infección por diversos patógenos causantes de enfermedades devastadoras como la marchitez vascular, que provoca grandes pérdidas a nivel de producción. El hongo Fusarium oxysporum f. sp. lycopersici (Fol) es uno de los agentes etiológicos de esta enfermedad y su control radica en el uso de fungicidas químicos sintéticos, los cuales, generan un impacto negativo para la salud y para el medio ambiente; por ello, es necesaria la implementación del control biológico como una alternativa más sana y eficiente. Especies del hongo Trichoderma spp. son una opción favorable como biocontroladores frente a este patógeno gracias a sus mecanismos antagónicos determinados por características metabólicas y génicas. Por un lado, para Fol es indispensable la activación de vías de señalización como MAPK Fmk1, MAPK Mpk1 y HOG, mientras que Trichoderma spp. utiliza efectores involucrados en la interacción con la planta como proteínas, enzimas y metabolitos secundarios que también fortalecen su respuesta inmune ante la infección, determinada tanto por Patrones Moleculares Asociados a Patógenos (PAMP) como por efectores. Por consiguiente, este artículo realiza una revisión acerca de dichas características y sugiere una mayor aplicación de herramientas y marcadores moleculares para el manejo de esta enfermedad.
Palabras clave: marchitez vascular; Fusarium oxysporum f. sp. lycopersici; control biológico; Trichoderma spp.
Tomato plants (Solanum lycopersicum) are susceptible to the infection by diverse pathogens that cause devastating diseases such as vascular wilt, which causes great losses at the production level. The fungus Fusarium oxysporum f. sp. lycopersici (Fol) is one of the etiologic agents of this disease and its control lies in the use of synthetic chemicals which generate a negative impact in both health and the environment; thus, it is necessary to implement biological control as a healthier and more efficient alternative. The fungus Trichoderma spp. is a favorable option to be employed as a biocontroller against this pathogen thanks to its antagonist mechanisms, determined by metabolic and genetic characteristics. On the one hand, for Fol it is indispensable the activation of signaling routes such as MAPK Fmk1, MAPK Mpk1 y HOG, while Trichoderma spp. uses effectors involved in the interaction with the plant such as proteins, enzymes and secondary metabolites that also strengthen its immune response against infection, determined by both Pathogen Associated Molecular Patterns (PAMP) and effectors. Therefore, this article makes a review about the mentioned characteristics and suggests a greater application of tools and molecular markers for the management of this disease.
Key words: vascular wilt; Fusarium oxysporum f. sp. lycopersici; biological control; Trichoderma spp.
El jitomate (Solanum lycopersicum) es considerado una de las hortalizas de mayor importancia en muchos países del mundo (González et al., 2012) debido a su amplio consumo, área cosechada, valor económico de su producción, importancia de ingresos de pequeños y medianos productores (Burbano y Vallejo, 2017) y por su elevado aporte nutricional, ya que es fuente de sustancias antioxidantes como licopeno, betacaroteno, flavonoides y vitaminas (Rodríguez-Cabello et al., 2020). Dentro de las variedades cultivadas, las más representativas mundialmente son el chonto, cherry y milano (Miranda et al., 2009).
El cultivo se implementa bajo invernadero o a campo abierto, en suelos aireados, con textura franca y alto contenido de materia orgánica. Además, esta es una hortaliza de clima cálido y moderado, susceptible a heladas y a temperaturas bajas; por ello, crece entre 21 a 24 °C (Florido y Álvarez, 2015), lo que favorece el desarrollo normal de los procesos bioquímicos, el crecimiento vegetativo y fructificación. Actualmente la calidad, rendimiento y producción de este cultivo se ve afectado por numerosos problemas fitosanitarios, algunos generados por diversos microorganismos, lo que ocasiona importantes pérdidas a nivel económico (Henao-Henao et al., 2018). Dentro de estos microorganismos destaca el hongo Fusarium oxysporum f. sp. lycopersici (Fol), un habitante frecuente del suelo, el cual, ingresa a la planta desde la raíz. La producción de proteínas, micotoxinas y otros compuestos, inactiva las defensas del huésped permitiendo la acumulación de micelio fúngico en el xilema, lo que impide el flujo de agua y de nutrientes hasta las hojas y frutos, ocasionando la enfermedad denominada marchitez vascular. Esta es una de las enfermedades más perjudiciales de este cultivo, debido a la fácil propagación del fitopatógeno, la resistencia a condiciones adversas y al alto costo de las medidas de control empleadas para su manejo (Eraso et al., 2014).
Mundialmente, se han implementado diferentes métodos para el control de infecciones por hongos en los cultivos, tales como el uso de fungicidas sistémicos y diversos agroquímicos, estos además de su costo elevado, no son completamente efectivos o pueden incluso perder su efectividad, originando microorganismos multirresistentes (Sood et al., 2020), afectando a su vez tanto la salud humana como la calidad del medio ambiente. Algunos fungicidas comúnmente utilizados son los benzimidazoles y se ha comprobado que dichos compuestos son capaces de causar mutagénesis de diferentes tipos en las plantas que entran en contacto con ellos (Villa-Martínez et al., 2014). Por estas razones, actualmente es necesario reducir el uso de fungicidas para el control de enfermedades fúngicas, y se piensa en el control biológico como una alternativa saludable, eficiente y económica para sobrellevar esta problemática, consiguiendo resultados favorables no solo en el tratamiento de la enfermedad, sino también en el desarrollo de la planta.
En los últimos años se han elaborado productos para el cuidado de los cultivos agrícolas incluyendo el uso del género Trichoderma spp., el cual, es un antagonista ampliamente estudiado en el control de enfermedades debido a su facilidad para ser aislado, cultivado y gracias a su rápido crecimiento en un gran número de sustratos (Ronnie-Gakegne y Martínez-Coca, 2018). Este hongo, incluido dentro de los agentes de control biológico de origen microbiano (ACB-M), tiene la capacidad de suprimir el desarrollo de patógenos en plantas, colonizar sus tejidos internos y, además, estimular su crecimiento (Córdova-Albores et al., 2021). Trichoderma spp. puede ser utilizado como biocontrolador frente a Fol, gracias a su capacidad de quimiotaxis, antibiosis y micoparasitismo (Cubillos et al., 2011). La activación de estos mecanismos implica la producción de metabolitos y compuestos específicos como enzimas hidrolíticas, sideróforos, antibióticos, factores de crecimiento de plantas, entre otros (Poveda et al., 2020).
Vargas-Hoyos y Gilchrist-Ramelli (2015) y Herrera-Téllez et al. (2019), han determinado experimentalmente tanto in vivo como in vitro, que Trichoderma spp. muestra un evidente efecto antagónico frente a Fusarium spp., resaltando las especies T. harzianum, T. viride y T. asperellum como las de mayor efectividad en su actividad antifúngica. La reducción de la presencia del patógeno y, por tanto, los síntomas de marchitez en las plantas de jitomate, es gracias a su producción de diferentes enzimas hidrolíticas y metabolitos secundarios, brindando así capacidad de inhibición y degradación celular. De igual manera, evidenciaron que estas especies son capaces de estimular el crecimiento vegetal, incluida la tasa de crecimiento absoluto, el peso fresco y seco, e inducir la resistencia sistémica en las plantas (Vargas-Hoyos y Gilchrist-Ramelli, 2015; Herrera-Téllez et al., 2019).
Uno de los principales inconvenientes para llevar a cabo un adecuado manejo de esta enfermedad en el cultivo de jitomate, es la escasa aplicación de la información relacionada con la interacción planta-patógeno-antagonista, que permita esclarecer la maquinaria de resistencia de la planta, los mecanismos que emplea el hongo para evadir esta respuesta y cómo el antagonista puede modular estos mecanismos en plantas y patógenos, esto como factores a tener en cuenta al momento de diseñar estrategias de control eficientes para esta enfermedad (González et al., 2012).
De acuerdo con lo anterior, el presente artículo tiene como objetivo realizar una revisión acerca de las interacciones génicas y metabólicas entre la planta de jitomate (Solanum lycopersicum), Fusarium oxysporum f. sp. lycopersici y Trichoderma spp., que dan lugar a un efecto antagónico, el cual es aprovechado como una alternativa de prevención, control y tratamiento de la marchitez vascular. Esta información contribuye esencialmente a comprender el patrón de virulencia de Fol y ayuda al desarrollo de marcadores moleculares para las estrategias del manejo de la enfermedad.
Proceso de infección y reacciones involucradas
Fol es un hongo patógeno que se encuentra comúnmente en el suelo y es causante de la marchitez en más de 150 hospederos. Su capacidad de supervivencia le permite superar condiciones adversas debido a sus estructuras de resistencia conocidas como clamidosporas, con capacidad de vivir indefinidamente incluso sin la presencia de un huésped, pero una vez que entran en contacto con éste la infección vascular progresa (Srinivas et al., 2019). La interacción planta-patógeno, incluye la secreción de proteínas, metabolitos y factores de virulencia específicos, los cuales, pueden ser identificados mediante la genómica, metabolómica y proteómica (Manikandan et al., 2018; Padilla-Ramos et al., 2021). Estos estudios han proporcionado nuevos conocimientos sobre la diafonía molecular que se produce entre Fol y su hospedero (González-López et al., 2021).
El ciclo de vida de las especies de Fusarium spp. se divide en etapa latente, parasitaria y saprófita (Villa-Martínez et al., 2014). En la fase latente, debido a la microbiostasis, se inhibe el crecimiento del micelio, las clamidosporas y los conidios hasta que entran en contacto con exudados, que sirven como fuente de carbono, nitrógeno y ácidos orgánicos, reconociendo señales específicas y estimulando su germinación. Posteriormente, en la fase parasitaria, las hifas del hongo se unen a las raíces de la planta ingresando en ellas y una vez dentro, el micelio avanza por la endodermis hasta alcanzar el sistema vascular de la planta (Cruz et al., 2012) o xilema, tejido donde se da el flujo del agua y nutrientes, y ahí se genera la producción de microconidios que germinan en nuevas hifas. Durante esta fase se identifican efectores como enzimas y pequeñas proteínas ricas en cisteína que posibilitan el estilo de vida parasitario de Fol y actúan suprimiendo las defensas del hospedero o interfiriendo con su reconocimiento por parte de este. Luego, el hongo utiliza el sistema vascular de la planta para poder diseminarse rápidamente en dirección ascendente dentro del apoplasto celular y finalmente, producir factores de virulencia, causando de esta manera el colapso del tejido al detenerse la absorción y translocación de nutrientes en la planta (Okungbowa y Shittu, 2012; González et al., 2012).
Los síntomas iniciales que presentan las plantas infectadas incluyen una coloración pálida en las hojas, pérdida prematura de hojas primarias e inferiores, crecimiento retardado y una coloración pardo-oscura en el xilema de la planta, signo característico de la enfermedad. El marchitamiento de las hojas, la pudrición de la raíz y finalmente la muerte, son una clara señal de la enfermedad en su estado más avanzado. Así mismo, el hongo puede diseminarse hacia la superficie y el exterior de la planta cuando su hospedero muere, regresando al suelo y esporulando de manera abundante para continuar con su proceso de patogénesis en plantas adyacentes, o bien permaneciendo en estado latente hasta encontrar un nuevo estímulo (Cardona-Piedrahita y Castaño-Zapata, 2019).
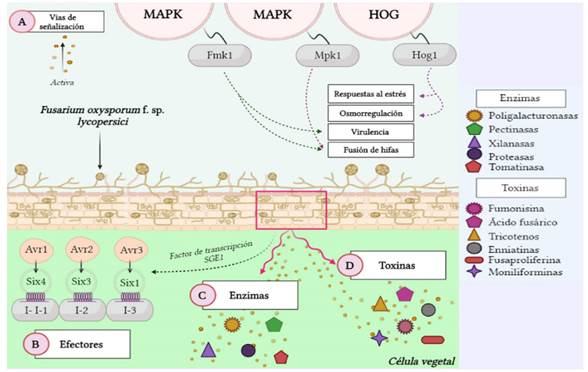
El desarrollo de la enfermedad a nivel molecular comienza una vez que Fol identifica al hospedero, y allí se activan dos vías de señalización identificadas como MAPK y HOG (respuesta de glicerol de alta osmolaridad) activadas por los genes Fmk1, Mpk1 y Hog1, respectivamente. Cada vía tiene un papel específico durante la infección. El gen Fmk1 tiene funciones relacionadas con la virulencia y fusión de hifas. Mpk1 está relacionado con características de la pared celular como su integridad y remodelación, y el crecimiento y fusión de hifas vegetativas. Y Hog1 está relacionado con las respuestas al estrés y de osmorregulación (García-Enciso et al., 2017; Sharma y Marques, 2018). Otros genes necesarios para el desarrollo de la enfermedad son Fgb1, Fga1, Fga2, Fpd1 y FOW2. Los dos primeros codifican las subunidades β y α de la proteína G respectivamente, logrando controlar el crecimiento, desarrollo y virulencia de las hifas, así como su morfogénesis y conidiación. Fga2 y Fpd1 juegan un papel crucial en la patogenicidad (García-Enciso et al., 2017), y FOW2 es importante en la invasión inicial del tejido de la raíz, en el crecimiento invasivo y colonización de los tejidos vegetales por este patógeno (Hu et al., 2015).
Además de los efectores mencionados, Fol cuenta con una serie de proteínas secretadas en el xilema (Six), importantes en la colonización del tejido vascular y el desarrollo de los síntomas de marchitez. Estas están codificadas por genes de avirulencia (Avr) en el hongo, cuya expresión está regulada por el factor de transcripción SGE1. Los genes Avr son identificados por genes receptores de la planta de jitomate (genes R), también conocidos como genes de inmunidad (genes I) (Gawehns et al., 2015). Así mismo, la presencia de genes Avr y R refleja lo establecido en la hipótesis denominada “gen por gen”, la cual hace énfasis en que para cada gen involucrado en la resistencia del huésped existe un gen correspondiente en el patógeno con el cual interactúa, es decir, la interacción y compatibilidad entre los genes Avr y los genes R dará como resultado el éxito o fracaso de la infección en la planta de jitomate (Thrall et al., 2016).
Six1, codificada por el gen Avr3, requiere la presencia de células vegetales vivas y su secreción se realiza inmediatamente después de la penetración de la corteza de la raíz (García-Enciso et al., 2017). Ésta se acumula en la savia del xilema al igual que Six3, Six5 y Six6 y de manera conjunta, Six1, Six3 y Six4, junto con sus correspondientes genes Avr, activan la resistencia del hospedero, mediada por los genes I de la planta de jitomate. De este modo, Six4 (Avr1), Six3 (Avr2) y Six1 (Avr3) son reconocidos por los genes I e I-1, I-2 e I-3 de la planta, respectivamente (Petit-Houdenot y Fudal, 2017; Carmona et al., 2020).
Fol también tiene la capacidad de secretar otras enzimas que aumentan su virulencia e intervienen en su patogenicidad. Las poligalacturonasas, pectinasas, xilanasas y proteasas son importantes en la degradación de la pared celular vegetal, al igual que la tomatinasa, codificada por el gen TOM1, responsable de inhibir la respuesta de defensa vegetal, permitiendo el desarrollo de la infección (De Sain y Rep, 2015). En cuanto a toxinas, la fumonisina, el ácido fusárico, los tricotecenos A y B, enniatinas, fusaproliferina y moniliforminas son unas de las más relevantes producidas por Fol, y tienen la capacidad de romper la permeabilidad de la membrana celular en la planta e impedir la habilidad de estas para controlar la pérdida de agua y nutrientes. También, suprimen la absorción de oxígeno mitocondrial y son capaces de conjugarse con elementos como Cu, Zn, Co y Fe formando complejos que hacen que estos minerales no estén disponibles para las plantas (Figura 1) (Li et al., 2013).
Respuesta inmune de la planta y capacidad de resistencia
Biológicamente, la barrera de defensa más superficial de la planta es la cutina, la cual, la protege de microorganismos y demás factores en el ambiente; sin embargo, cuando la planta resulta infectada internamente por un patógeno como Fusarium spp., éste pasa rápidamente a través de los espacios intercelulares y al ser reconocido como agente extraño, la calosa, la lignina y la suberina se encargan de engrosar la pared celular para que se dificulte la propagación del micelio. Bioquímicamente, se sintetizan toxinas y se produce una gran variedad de compuestos antimicrobianos como los glicosídicos, fenólicos, azufrados, lactonas insaturadas, entre otros. Finalmente, el reconocido aspecto necrótico de la enfermedad es producto de una respuesta hipersensible, en la cual se lleva a cabo una muerte celular programada en torno al foco de infección debido a un cambio metabólico y transcripcional que permite la acumulación de fitoalexinas en el tallo y logra una posterior resistencia sistémica adquirida en caso de volverse a presentar el mismo agente infeccioso u otro con patogénesis similar (De Miguel-Rojas, 2014).
Para hacer frente a la afectación causada por Fol, la planta de jitomate efectúa dos respuestas básicas. En primer lugar, se hace posible la detección e identificación de muchos microorganismos tanto patógenos como no patógenos, además, a nivel celular se moviliza calcio hacia el citosol para producir proteínas quinasas, se generan especies reactivas de oxígeno (ROS) y se activan genes de inmunidad (genes R) gracias a patrones moleculares asociados a patógenos (PAMP). En segundo lugar, se presenta la inmunidad activada por efectores, que responde a la presencia de patógenos y factores de virulencia, desarrollando diversos mecanismos tales como la producción de tilosas y la retención de H2O2, que funcionan como barreras para evitar que las infecciones progresen (García-Enciso et al., 2017; Andrade-Hoyos et al., 2015). Este segundo tipo de inmunidad, también conocido como resistencia sistémica adquirida, está mediado por la señalización hormonal del ácido salicílico (SA) (Aamir et al., 2018).
Como parte de los PAMP activados en la enfermedad por marchitez se consideran moléculas como la quitina asociada a la membrana, los glucanos (especialmente β-1,6-glucano) y algunas glicoproteínas, codificadas por el gen Fem1. Cada uno de estos elementos puede ser reconocido por el sistema defensivo de la planta, ya que tiene receptores de reconocimiento de patrones (PRR) (Figura 2). La síntesis de quitina es codificada por el gen chsV, su expresión depende de la vía de señalización Fmk1-MAPK, su unión a los receptores es directa y puede permitir la inducción de genes de defensa contra hongos patógenos. Por otro lado, la presencia de glucanos no ha sido muy estudiada en el jitomate, pero se sabe que puede ser muy útil para detectar fragmentos del patógeno que esté causando daño (García-Enciso et al., 2017).
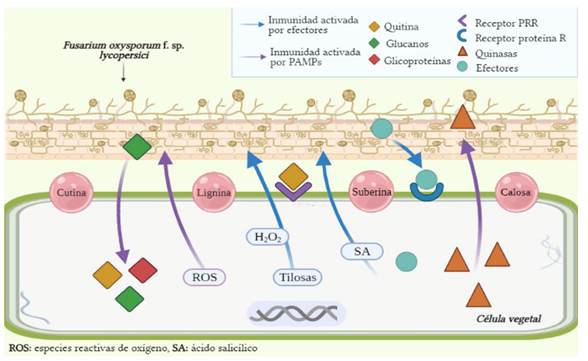
Figura 2 Interacción génica y metabólica entre la planta de jitomate y Fusarium oxysporum f. sp. lycopersici (Fuente: Autores).
Con respecto a la genética de resistencia del huésped, los genes I, ubicados en los cromosomas 11 y 7 de la planta, son esenciales de acuerdo con la acción de las diferentes razas de Fol; así, los genes I e I-1 otorgan resistencia a la raza 1, el gen I-2 controla la resistencia contra las razas 1 y 2 y el gen I-3 controla la resistencia contra la raza 3 de Fol. En el jitomate, la resistencia parcial a Fol también está mediada por el gen Frl, ubicado en el brazo largo del cromosoma 9 (Gonzalez-Cendales et al., 2015; Pérez-Almeida et al., 2016).
Por otra parte, se ha investigado la capacidad de factores de transcripción como las proteínas WRKY, que en el jitomate comprenden un total de 83 genes. Estos funcionan como reguladores positivos o negativos (Bai et al., 2018) y reconocen una secuencia de ADN no codificante conocida como W-box (TTGACC/T) que regula la expresión de manera directa o indirecta y activa o inactiva otros genes, pudiendo controlar procesos biológicos como el crecimiento de las plantas y su respuesta al estrés biótico y abiótico (Aamir et al., 2019; Mohanta et al., 2016).
Aspectos relevantes en la interacción Trichoderma spp. - Fusarium oxysporum f. sp. lycopersici
Los hongos del género Trichoderma spp. están distribuidos de forma ubicua en todo el mundo e incluyen diferentes especies con la capacidad de colonizar las raíces de una amplia gama de plantas y, además, antagonizar y eliminar otros hongos (Domínguez et al., 2016). Dichas propiedades antagónicas se basan en la activación de mecanismos de acción que controlan el desarrollo de fitopatógenos. Entre estos, destacan la competencia por espacio y nutrientes, el micoparasitismo, la antibiosis y la producción de metabolitos secundarios, enzimas, compuestos volátiles y no volátiles, entre otros (Hernández-Melchor et al., 2019; Martínez et al., 2013).
Durante el proceso de infección, Trichoderma spp. activa estos mecanismos con el objetivo de regular el desarrollo de Fol. La competencia por nutrientes y espacio constituye un mecanismo antagónico muy importante. Este ocurre solo cuando los recursos como los nutrientes del suelo y el espacio son limitados (Sood et al., 2020). Trichoderma spp. produce metabolitos secundarios capaces de inhibir o disminuir el crecimiento y otras actividades de Fol, lo que le confiere ventajas ecológicas sobre sus competidores ya que utiliza los recursos disponibles en el suelo para su crecimiento, dejando al fitopatógeno con nutrientes insuficientes para su desarrollo. Se ha demostrado que la competencia por el nitrógeno, el carbono y el hierro es un mecanismo asociado con el control biológico o la supresión del marchitamiento por Fusarium spp. (Sánchez-Espinosa et al., 2020). Las bajas concentraciones de estos nutrientes conducen a una germinación reducida de los conidios, un crecimiento más lento del tubo germinativo de Fol y un número reducido de sitios de infección, lo que lo vuelve ineficaz para causar enfermedad (Vos et al., 2015; Nusaibah y Musa, 2019).
Por otro lado, el micoparasitismo es un mecanismo directo de control biológico en el que Trichoderma spp. actúa detectando y parasitando fitopatógenos (Nusaibah y Musa, 2019). En este mecanismo, Trichoderma spp. crece quimiotrópicamente hacia Fol y se adhiere a sus hifas a través de carbohidratos, los cuales, se unen a las lectinas del patógeno. Esta adhesión se acompaña de la formación de estructuras conocidas como apresorios, que se enrollan alrededor de las hifas del patógeno (Sharma y Sharma, 2020). Una vez lo reconoce y se adhiere, el micelio de Trichoderma spp. se enrolla en el micelio del fitopatógeno, acompañado de la segregación de enzimas hidrolíticas que degradan la pared celular (CWDE), como lo son las quitinasas, glucanasas (β-1,3-glucanasa, β-1,6-glucanasa), celulasas, lacasas y proteasas (Silva et al., 2019). Las cepas microbianas que sintetizan dichas enzimas pueden provocar la formación de exoelicitores (inductores de resistencia de la propia pared celular) y endoelicitores (inductores de resistencia de la pared celular de la planta) (Jaroszuk-Ściseł et al., 2019). También, las proteínas G heterotriméricas son indispensables para la señalización intracelular y participan en la percepción de las señales del huésped, activando así el ataque micoparásito en Trichoderma spp. (Alfiky y Weisskopf, 2021).
La antibiosis es una estrategia utilizada por Trichoderma spp. para su defensa y para inhibir el crecimiento de fitopatógenos. Este hongo puede segregar antibióticos como terpenos, trichodermina, trichozianina, gliovirina, gliotoxina, viridina, pironas y peptaiboles (Khan et al., 2020; Mukherjee et al., 2012). Otros metabolitos incluyen tricolina, ácido harcianico, ácido heptelídico, 6-pentil-α-pirona, terpenoides, policétidos y sesquiterpenos, los cuales, penetran en el micelio del patógeno y actúan de manera sinérgica en la degradación de la pared, digiriendo su contenido intracelular (Sharma y Sharma, 2020; Wu et al., 2017; Matarese et al., 2012; Ojha y Chatterjee, 2011). Los metabolitos secundarios y los antibióticos son los factores químicos más importantes que produce Trichoderma spp. para eliminar los hongos fitopatógenos. Por lo tanto, es importante señalar que, entre mayor producción de metabolitos, existirá una mayor acción antagónica. Esto convierte a Trichoderma spp. en el antagonista más comúnmente empleado como agente de control biológico (BCA) (Sonkar, 2019).
Papel de Trichoderma spp. en el biocontrol de la marchitez
Algunas especies de Trichoderma spp. interaccionan benéficamente con la planta de jitomate (Solanum lycopersicum), favoreciendo su desarrollo y activando su sistema de defensa contra diversos fitopatógenos. Cada interacción está mediada por metabolitos y genes expresados diferencialmente y se puede deducir que las proteínas codificadas por estos, también llamadas efectores permiten establecer estas relaciones (Ramirez-Valdespino et al., 2019).
Las moléculas efectoras se han estudiado detalladamente debido a que juegan un papel importante en interacciones dañinas y en interacciones simbióticas. Como parte de su mecanismo de acción, Trichoderma spp. expresa efectores involucrados en la interacción con las plantas, induciendo su sistema de defensa y promoviendo el crecimiento de estas (Guzmán-Guzmán et al., 2017). Uno de los grupos más abundantes de efectores en este hongo corresponden a pequeñas proteínas ricas en cisteína (SSCP), que se agrupan en diferentes familias de proteínas como lo son: a) las ceratoplataninas, las cuales tienen la capacidad de inducir respuestas de defensa en la planta; b) proteínas de tiorredoxina, identificadas como posibles efectores durante interacciones micoparasitarias; c) hidrofobinas, que median la interacción entre el hongo y superficies hidrofóbicas, favoreciendo así el crecimiento y la creación de defensas en la planta; d) glicosil-hidrolasas, que participan en la inducción de genes implicados en la defensa y desencadenan la biosíntesis de etileno y la respuesta hipersensible; y e) proteínas con dominios CFEM (Commonly Found in Extracelular Membranes), descritas como receptores celulares y transductores de señales en interacciones hospedero-patógeno (Figura 3) (Ramírez-Valdespino et al., 2019; Kubicek et al., 2019; Guzmán-Guzmán et al., 2017).

Figura 3 Acción de Trichoderma spp. como biocontrolador de la marchitez (Fusarium oxysporum f. sp. lycopersici) en el cultivo de jitomate (Fuente: Autores).
Ahora bien, el mecanismo genético de biocontrol inducido por Trichoderma spp. está mediado por la regulación transcripcional de genes inducibles por estrés y por la activación de una respuesta sistémica adaptativa, la cual está modulada a través de una expresión inmediata de los genes WRKY de la planta. Esta respuesta consta de una cascada compleja que puede involucrar fitohormonas o puede incorporar auxinas, ácido abscísico (ABA), citoquininas (CK) y brasinoesteroides para formar vías de señalización o comunicación cruzada como la inducida por ácido jasmónico y etileno (JA/ET) o la dependiente de ácido salicílico (SA). Así, el factor de transcripción WRKY sirve de convergencia entre las vías de señalización SA (resistencia activada por los PAMP) y JA (resistencia activada por proteínas WRKY que contiene tanto Trichoderma spp. como la planta) (Aamir et al., 2019). Todos estos procesos en conjunto llevan a una simbiosis facultativa entre la planta hospedera del patógeno y Trichoderma spp., donde se establecen ventajas recíprocas (Manganiello et al., 2018).
Tanto los procesos que hacen posible la infección en el jitomate como los que activan la respuesta al ataque del patógeno y los que desencadenan la cascada reguladora del antagonista pueden dar a conocer una actividad molecular amplia y compleja, y debido a que todas las interacciones llevadas a cabo requieren de una serie de estímulos y reacciones simultáneas, resulta complicado comprender esta relación de forma aislada; por lo tanto, el éxito de la interacción no debe depender únicamente de que las moléculas desempeñen cada una de las funciones. El estado fisiológico de los tres participantes, así como su umbral de percepción hacia las señales moleculares intercambiadas también son factores importantes. Esta regulación no depende únicamente del trasfondo génico del hongo, las señales generadas por la planta y por el antagonista también son importantes (Ramirez-Valdespino et al., 2019).
Conclusión
La enfermedad de marchitez vascular en plantas de jitomate, ocasionada por Fusarium oxysporum f. sp. lycopersici (Fol), cada vez cobra mayor relevancia debido a que genera pérdidas importantes a nivel de producción y, por tanto, ocasiona un impacto económico negativo. Para contrarrestar esta problemática, actualmente es más frecuente y estudiada la implementación de diversos microorganismos, entre estos Trichoderma spp., que puedan hacer frente a este tipo de afectaciones en la agricultura y particularmente en cultivos de importancia comercial como es el caso del jitomate, y se ha aprovechado su potencial benéfico de interacción con especies vegetales y antagónico con microorganismos patógenos, como una opción viable de control biológico en pro de mejorar su capacidad de resistencia y un crecimiento y desarrollo idóneos.
Resulta esencial resaltar la importancia de la genómica, metabolómica, proteómica y transcriptómica, entre otras herramientas moleculares, que actualmente permiten develar rutas implicadas tanto en la patogénesis como en la generación de una respuesta inmune en plantas y en la producción de metabolitos en organismos antagonistas, lo que hace posible comprender de manera más específica las relaciones planta-patógeno-biocontrolador y a largo plazo contemplar opciones útiles para inhibir el efecto de fitopatógenos. A partir de este análisis y como posible estrategia para un mayor aprovechamiento de las interacciones entre estos microorganismos, se sugiere la puesta en marcha de investigaciones mayormente enfocadas hacia el mejoramiento genético y el desarrollo de marcadores moleculares a partir de la biobalística y otros sistemas actuales para la transferencia y secuenciación de genes como los involucrados en la simbiosis entre Trichoderma spp. y la planta de jitomate, facilitando la producción de cultivos más resistentes, sostenibles, rentables, y menos perjudiciales tanto para el medio ambiente como para la salud de los consumidores, al disminuir el uso habitual de químicos agrícolas.
Literature cited
Aamir M, Singh V, Dubey M, Kashyap S, Zehra A, Upadhyay R and Singh S. 2018. Structural and functional dissection of differentially expressed tomato WRKY transcripts in host defense response against the vascular wilt pathogen (Fusarium oxysporum f. sp. lycopersici). PLoS One 13(4): 1-43. https://doi.org/10.1371/journal.pone.0193922 [ Links ]
Aamir M, Kashyap S, Zehra A, Dubey M, Singh V, Ansari W, Upadhyay R and Singh S. 2019. Trichoderma erinaceum bio-priming modulates the WRKYs defense programming in tomato against the Fusarium oxysporum f. sp. lycopersici (Fol) challenged condition. Frontiers in Plant Science 10(911): 1-21. https://doi.org/10.3389/fpls.2019.00911 [ Links ]
Alfiky A and Weisskopf L. 2021. Deciphering Trichoderma-plant-pathogen interactions for better development of biocontrol applications. Journal of Fungi 7(1): 61. https://doi.org/10.3390/jof7010061 [ Links ]
Andrade-Hoyos P, Molina E, De León C, Espíndola M, Alvarado D y López A. 2015. Mecanismos de defensa en portainjertos de aguacate ante Phytophthora cinnamomi Rands. Revista Mexicana de Ciencias Agrícolas 6(2): 347-360. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-09342015000200010 [ Links ]
Bai Y, Sunarti S, Kissoudis C, Visser R and Van der Linden C. 2018. The role of tomato WRKY genes in plant responses to combined abiotic and biotic stresses. Frontiers in Plant Science 9(801): 1-7. https://doi.org/10.3389/fpls.2018.00801 [ Links ]
Burbano E and Vallejo F. 2017. Production of “chonto” tomato lines, Solanum lycopersicum Mill., with expression of the sp gene responsible of determinate growth. Revista Colombiana de Ciencias Hortícolas 11(1): 63-71. http://dx.doi.org/10.17584/rcch.2017v11i1.5786 [ Links ]
Cardona-Piedrahita L y Castaño-Zapata J. 2019. Comparación de métodos de inoculación de Fusarium oxysporum f. sp. lycopersici, causante del marchitamiento vascular del tomate. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales 43(167): 227-233. http://dx.doi.org/10.18257/raccefyn.854 [ Links ]
Carmona S, Burbano-David D, Gómez M, Lopez W, Ceballos N, Castaño-Zapata J, Simbaqueba J and Soto-Suárez M. 2020. Characterization of pathogenic and nonpathogenic Fusarium oxysporum isolates associated with commercial tomato crops in the andean region of Colombia. Pathogens 9(70): 1-23. https://doi.org/10.3390/pathogens9010070 [ Links ]
Córdova-Albores L, Zelaya-Molina L, Ávila-Alistac N, Valenzuela-Ruíz V, Cortés-Martinez N, Parra-Cota F, Burgos-Canul Y, Chávez-Díaz I, Fajardo-Franco M and Santos-Villalobos S. 2021. Omics sciences potential on bioprospecting of biological control microbial agents: the case of the Mexican agro-biotechnology. Mexican Journal of Phytopathology 39(1): 147-184. https://doi.org/10.18781/r.mex.fit.2009-3 [ Links ]
Cruz M, Hoyos L y Melgarejo L. 2012. Respuesta fisiológica de la gulupa (Passiflora edulis) frente al ataque por Fusarium spp. Universidad Nacional de Colombia 5(1): 91-112. https://repositorio.unal.edu.co/bitstream/handle/unal/11145/07_Cap05.pdf?sequence=2&isAllowed=y [ Links ]
Cubillos J, Páez A y Mejía L. 2011. Evaluación de la capacidad biocontroladora de Trichoderma harzianum Rifai contra Fusarium solani (Mart.) Sacc. asociado al complejo “secadera” en maracuyá, bajo condiciones de invernadero. Revista Facultad Nacional de Agronomía Medellín 64(1): 5821-5830. https://www.redalyc.org/articulo.oa?id=179922364008 [ Links ]
De Sain M and Rep M. 2015. The role of pathogen-secreted proteins in fungal vascular wilt diseases. International Journal of Molecular Sciences 16(10): 23970-23993. https://doi.org/10.3390/ijms161023970 [ Links ]
Domínguez S, Rubio M, Cardoza R, Gutiérrez S, Nicolás C, Bettiol W, Hermosa R and Monte E. 2016. Nitrogen metabolism and growth enhancement in tomato plants challenged with Trichoderma harzianum expressing the Aspergillus nidulans acetamidase amdS gene. Frontiers in Microbiology 7(1182): 1-14. https://doi.org/10.3389/fmicb.2016.01182 [ Links ]
Eraso C, Acosta J, Salazar C y Betancourth C. 2014. Evaluación de cepas de Trichoderma spp. para el manejo del amarillamiento de arveja causado por Fusarium oxysporum. Revista Ciencia & Tecnología Agropecuaria 15(2): 237-249. https://doi.org/10.21930/rcta.vol15_num2_art:363 [ Links ]
Florido M y Álvarez M. 2015. Aspectos relacionados con el estrés de calor en tomate (Solanum lycopersicum L.). Revista Cultivos Tropicales 36(1): 77-95. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0258-59362015000500008 [ Links ]
García-Enciso E, Benavidez-Mendoza A, Flores-López M, Robledo-Olivo A, Juárez-Maldonado A and González-Morales S. 2017. A molecular vision of the interaction of tomato plants and Fusarium oxysporum f. sp. lycopersici. IntechOpen 6(1): 80-99. http://dx.doi.org/10.5772/intechopen.72127 [ Links ]
Gawehns F, Ma L, Bruning O, Houterman P, Boeren S, Cornelissen B, Rep M and Takken F. 2015. The effector repertoire of Fusarium oxysporum determines the tomato xylem proteome composition following infection. Frontiers in Plant Science 6(967): 1-17. https://doi.org/10.3389/fpls.2015.00967 [ Links ]
Gonzalez-Cendales Y, Catanzarit A, Baker B, Mcgrath D and Jones DA. 2015. Identification ofI-7expands the repertoire of genes for resistance to Fusarium wilt in tomato to three resistance gene classes. Molecular Plant Pathology 17(3): 448-463. https://doi.org/10.1111/mpp.12294 [ Links ]
González I, Arias Y y Peteira B. 2012. Aspectos generales de la interacción Fusarium oxysporum f. sp. lycopersici-tomate. Revista Protección Vegetal 27(1): 1-7. http://scielo.sld.cu/pdf/rpv/v27n1/rpv01112.pdf [ Links ]
González-López M, Jijón-Moreno S, Dautt-Castro M, Ovando-Vásquez C, Ziv T, Horwitz B and Casas-Flores S. 2021. Secretome analysis of Arabidopsis-Trichoderma atroviride interaction unveils new roles for the plant glutamate: glyoxylate aminotransferase GGAT1 in plant growth induced by the fungus and resistance against Botrytis cinerea. International Journal of Molecular Sciences 22(13): 6804. https://doi.org/10.3390/ijms22136804 [ Links ]
Guzmán-Guzmán P, Alemán-Duarte M, Delaye L, Herrera-Estrella A and Olmedo-Monfil V. 2017. Identification of effector-like proteins in Trichoderma spp. and role of a hydrophobin in the plant-fungus interaction and mycoparasitism. BMC Genomics 18(16): 1-20. https://doi.org/10.1186/s12863-017-0481-y [ Links ]
Henao-Henao E, Hernández-Medina C, Salazar-González C, Velasco-Belalcazar M and Gómez-López E. 2018. Molecular identification of Fusarium isolates associated with passion fruit in five locations from Valle del Cauca, Colombia. Mesoamerican Journal of Agronomy 29(1): 53-61. https://doi.org/10.15517/ma.v29i1.27114 [ Links ]
Hernández-Melchor D, Ferrera-Cerrato R y Alarcón A. 2019. Trichoderma: Importancia agrícola, biotecnológica, y sistemas de fermentación para producir biomasa y enzimas de interés industrial. Chilean Journal of Agricultural & Animal Sciences 35(1): 98-112. http://dx.doi.org/10.4067/S0719-38902019005000205 [ Links ]
Herrera-Téllez V, Cruz-Olmedo A, Plasencia J, Gavilanes-Ruíz M, Arce-Cervantes O, Hernández-León S and Saucedo-García M. 2019. The protective effect of Trichoderma asperellum on tomato plants against Fusarium oxysporum and Botrytis cinerea diseases involves inhibition of reactive oxygen species production. International Journal of Molecular Sciences 20(8): 1-13. https://doi.org/10.3390/ijms20082007 [ Links ]
Hu Z, Parekh U, Maruta N, Trusov Y and Botella J. 2015. Down-regulation of Fusarium oxysporum endogenous genes by host-delivered RNA interference enhances disease resistance. Frontiers in Chemistry 3(1): 1-10. https://doi.org/10.3389/fchem.2015.00001 [ Links ]
Jaroszuk-Ściseł J, Tyśkiewicz R, Nowak A, Ozimek E, Majewska M, Hanaka A, Tyśkiewicz K, Pawlik A and Janusz G. 2019. Phytohormones (auxin, gibberellin) and ACC deaminase in vitro synthesized by the mycoparasitic Trichoderma DEMTKZ3A0 strain and changes in the level of auxin and plant resistance markers in wheat seedlings inoculated with this strain conidia. International Journal of Molecular Sciences 20(19): 4923. https://doi.org/10.3390/ijms20194923 [ Links ]
Khan R, Najeeb S, Hussain S, Xie B and Li Y. 2020. Bioactive secondary metabolites from Trichoderma spp. against phytopathogenic fungi. Microorganisms 8(6): 817. https://doi.org/10.3390/microorganisms8060817 [ Links ]
Kubicek C, Steindorff A, Chenthamara K, Manganiello G, Henrissat B, Zhang J, Cai F, Kopchinskiy A, Kubicek E, Kuo A, Baroncelli R, Sarrocco S, Ferreira E, Vannacci G, Shen Q, Grigoriev I and Druzhinina I. 2019. Evolution and comparative genomics of the most common Trichoderma species. BMC Genomics 20(485): 1-24. https://doi.org/10.1186/s12864-019-5680-7 [ Links ]
Li C, Zuo C, Deng G, Kuang R, Yang Q, Hu C, Sheng O, Zhang S, Ma L, Wei Y, Yang J, Liu S, Biswas M, Viljoen A and Yi G. 2013. Contamination of bananas with bauvericin and fusaric acid produced by Fusarium oxysporum f. sp. cubense. PLoS One 8(7): 1-11. https://doi.org/10.1371/journal.pone.0070226 [ Links ]
Matarese F, Sarrocco S, Gruber S, Seidl-Seiboth V and Vanacci G. 2012. Biocontrol of Fusarium head blight: interactions between Trichoderma and mycotoxigenic Fusarium. Microbiology Society Journal 158(1): 99-101. https://doi.org/10.1099/mic.0.052639-0 [ Links ]
Manikandan R, Harish S, Karthikeyan G and Raguchander T. 2018. Comparative proteomic analysis of different isolates of Fusarium oxysporum f.sp. lycopersici to exploit the differentially expressed proteins responsible for virulence on tomato plants. Frontiers in Microbiology 9(420): 1-13. https://doi.org/10.3389/fmicb.2018.00420 [ Links ]
Manganiello G, Sacco A, Ercolano MR, Vinale F, Lanzuise S, Pascale A, Napolitano M, Lombardi N, Lorito M and Woo S. 2018. Modulation of tomato response to Rhizoctonia solani by Trichoderma harzianum and its secondary metabolite harzianic acid. Frontiers in Microbiology 9(1966): 1-15. https://doi.org/10.3389/fmicb.2018.01966 [ Links ]
Martínez B, Infante D y Reyes Y. 2013. Trichoderma spp. y su función en el control de plagas en los cultivos. Revista de Protección Vegetal 28(1): 1-11. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1010-27522013000100001 [ Links ]
Miranda D, Fischer G, Barrientos J, Carranza C, Rodríguez M and Lanchero J. 2009. Characterization of productive systems of tomato (Solanum lycopersicum) in producing zones of Colombia. Acta Horticulturae 821(821): 35-46. https://doi.org/10.17660/ActaHortic.2009.821.2 [ Links ]
Mohanta T, Park Y and Bae H. 2016. Novel genomic and evolutionary insight of WRKY transcription factors in plant lineage. Scientific Reports 6(37309): 1-19. https://doi.org/10.1038/srep37309 [ Links ]
Mukherjee P, Horwitz B and Kenerley C. 2012. Secondary metabolism in Trichoderma - a genomic perspective. Microbiology Society Journal 158(1): 35-45. https://doi.org/10.1099/mic.0.053629-0 [ Links ]
Nusaibah S and Musa H. 2019. A review report on the mechanism of Trichoderma spp. as biological control agent of the basal stem rot (BSR) disease of Elaeis guineensis. IntechOpen 6(1): 1-12. https://doi.org/10.5772/intechopen.84469 [ Links ]
Ojha S and Chatterjee N. 2011. Mycoparasitism of Trichoderma spp. in biocontrol of fusarial wilt of tomato. Archives of Phytopathology and Plant Protection 44(8): 771-782. https://doi.org/10.1080/03235400903187444 [ Links ]
Okungbowa F and Shittu H. 2012. Fusarium wilts: an overview. Environmental Research Journal 6(2): 83-102. https://www.researchgate.net/profile/Hakeem-Shittu/publication/292243135_Fusarium_Wilts_An_Overview/links/56b252c908ae795dd5c7b24f/Fusarium-Wilts-An-Overview.pdf [ Links ]
Padilla-Ramos R, Salas-Muñoz S, Velázques-Valle R and Reveles-Torres L. 2021. A novel molecular approach in the study of parasite-host interaction. Mexican Journal of Phytopathology 37(1): 95-114. https://doi.org/10.18781/r.mex.fit.1808-6 [ Links ]
Pérez-Almeida I, Morales-Astudillo R, Medina-Litardo R, Salcedo-Rosales G, Dascon A y Solano-Castillo T. 2016. Evaluación molecular de genotipos de tomate por su resistencia a Meloidogyne incognita, Fusarium oxysporum y Ralstonia solanacearum con fines de mejoramiento. Revista Bioagro 28(2): 107-116. http://www.ucla.edu.ve/bioagro/Rev28%282%29/5.%20ms%201540.pdf [ Links ]
Petit-Houdenot Y and Fudal I. 2017. Complex interactions between fungal avirulence genes and their corresponding plant resistance genes and consequences for disease resistance management. Frontiers in Plant Science 8(1072): 1-8. https://doi.org/10.3389/fpls.2017.01072 [ Links ]
Poveda J, Abril-Urias P and Escobar C. 2020. Biological control of plant-parasitic nematodes by filamentous fungi inducers of resistance: Trichoderma, mycorrhizal and endophytic fungi. Frontiers in Microbiology 11(992): 1-14. https://doi.org/10.3389/fmicb.2020.00992 [ Links ]
Ramírez-Valdespino C, Casas-Flores S and Olmedo-Monfil V. 2019. Trichoderma as a model to study effector-like molecules. Frontiers In Microbiology 10(1030): 1-14. https://doi.org/10.3389/fmicb.2019.01030 [ Links ]
Rodríguez-Cabello J, Pérez-González A, Ortega-García L y Arteaga-Barrueta M. 2020. Estudio hidrosostenible en el cultivo del tomate, su efecto en el rendimiento y calidad del fruto. Cultivos Tropicales 41(2): 1-15. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0258-59362020000200006&lng=es&nrm=iso [ Links ]
De Miguel-Rojas C. 2014. Papel de los reguladores moleculares Fbp1 y Bmh2 en la virulencia de Fusarium oxysporum. Departamento de genética de la Universidad de Córdoba. https://helvia.uco.es/xmlui/bitstream/handle/10396/12019/2014000000949.pdf?sequence=1 [ Links ]
Ronnie-Gakegne E y Martínez-Coca B. 2018. Antibiosis y efecto de pH-temperatura sobre el antagonismo de cepas de Trichoderma asperellum frente a Alternaria solani. Revista de Protección Vegetal 33(2): 1-9. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1010-27522018000200008&lng=es&nrm=iso&tlng=es#B7 [ Links ]
Sánchez-Espinosa A, Villarruel-Ordaz J and Maldonado-Bonilla L. 2020. The cause and potential solution to the Fusarium wilt disease in banana plants. Terra Latinoamericana 38(2): 435-442. https://doi.org/10.28940/terra.v38i2.617 [ Links ]
Sharma I and Sharma A. 2020. Trichoderma-Fusarium interactions: A biocontrol strategy to manage wilt. Pp: 167-185. In: Sharma A and Sharma P (eds.). Trichoderma: Host pathogen interactions and applications. USA. 331p [ Links ]
Sharma L and Marques G. 2018. Fusarium, an entomopathogen-a myth or reality? Pathogens 7(4): 1-15. https://doi.org/10.3390/pathogens7040093 [ Links ]
Silva R, Neves V, Stecca A, Vieira E, Ferreira E and Ulhoa C. 2019. Trichoderma/pathogen/plant interaction in pre-harvest food security. Fungal Biology 123(8): 565-583. https://doi.org/10.1016/j.funbio.2019.06.010 [ Links ]
Sonkar P, 2019. Determination of interaction between Trichoderma asperellum and Fusarium oxysporum sp. by digital light microscopy and confocal microscopy. Journal of Microbial & Biochemical Technology 11(1): 1-4. https://doi.org/10.4172/1948-5948.1000407 [ Links ]
Sood M, Kapoor D, Kumar D, Sheteiwy M, Ramakrishnan M, Landi M, Araniti, F and Sharma A. 2020. Trichoderma: the “secrets” of a multitalented biocontrol agent. Plants 9(6): 1-25. https://doi.org/10.3390/plants9060762 [ Links ]
Srinivas C, Nirmala D, Narasimha K, Dhananjaya C, Lakshmeesha T, Singh B, Kumar N, Niranjana S, Hashem A, Alqarawi A, Tabassum B, Fathy E, Nayaka C and Srivastava R. 2019. Fusarium oxysporum f. sp. lycopersici causal agent of vascular wilt disease of tomato: biology to diversity-a review. Saudi Journal of Biological Sciences 26(7): 1315-1324. https://doi.org/10.1016/j.sjbs.2019.06.002 [ Links ]
Thrall P, Barrett L, Doods P and Burdon J. 2016. Epidemiological and evolutionary outcomes in gene-for-gene and matching allele models. Frontiers in Plant Science 6(1084): 1-12. https://doi.org/10.3389/fpls.2015.01084 [ Links ]
Vargas-Hoyos H y Gilchrist-Ramelli E. 2015. Producción de enzimas hidrolíticas y actividad antagónica de Trichoderma asperellum sobre dos cepas de Fusarium aisladas de cultivos de tomate (Solanum lycopersicum). Revista Mexicana de Micología 42(1): 9-16. http://www.scielo.org.mx/scielo.php?pid=S0187-31802015000200003&script=sci_arttext [ Links ]
Villa-Martínez A, Pérez-Leal R, Morales-Morales H, Basurto-Sotelo M, Soto-Parra J y Martínez-Escudero E. 2014. Situación actual en el control de Fusarium spp. y evaluación de la actividad antifúngica de extractos vegetales. Acta Agronómica 64(2): 194-205. http://dx.doi.org/10.15446/acag.v64n2.43358 [ Links ]
Vos C, De Cremer K, Cammue B and De Coninck B. 2015. The toolbox of Trichoderma spp. in the biocontrol of Botrytis cinerea disease. Molecular Plant Pathology 16(4): 400-412. https://doi.org/10.1111/mpp.12189 [ Links ]
Wu Q, Sun R, Ni M, Yu J, Li Y, Yu C, Dou K, Ren J and Chen J. 2017. Identification of a novel fungus, Trichoderma asperellum GDFS1009, and comprehensive evaluation of its biocontrol efficacy. PLoS One 12(6): 1-20. https://doi.org/10.1371/journal.pone.0179957 [ Links ]
Recibido: 21 de Junio de 2021; Aprobado: 28 de Noviembre de 2021











 texto en
texto en