Trichoderma (Ascomycota: Hypocreales) es un hongo cosmopolita que incluye a más de 100 especies presentes en diferentes zonas climáticas y se encuentra colonizando a una amplia gama de nichos, incluidas plantas vivas y muertas, suelo, sedimento, materia orgánica, tejido animal, entre otros (Wang y Zhuang, 2020; Nuangmek et al., 2021). Trichoderma spp. poseen un metabolismo versátil que les da capacidad de controlar a diversos fitopatógenos debido principalmente a la producción de enzimas hidrolíticas, competencia por espacio y nutrientes, inducción de resistencia en el hospedero, antibiosis, micoparasitismo, entre otros (Gamarra et al., 2017; Zhou et al., 2020). Existe un progreso significativo sobre los mecanismos reguladores que utilizan las distintas especies para establecerse en hábitats terrestres o marinos (Gal-Hemed et al., 2011; Su et al., 2018). Se ha reportado que unas de las diferencias consisten en la producción más eficiente de metabolitos secundarios (6-pentil-α-pirona y trichodermacetonas). Así como mayor producción de enzimas (quitinasa y β-1,3-endoglucanasa) (Kim et al., 2020). Dentro de las especies de Trichoderma más importantes como agentes de biocontrol hacia fitopatógenos se encuentran: T. reesei, T. koningii, T. asperellum, T. viride, T. harzianum, T. aureoviride, entre otros (Brito et al., 2020; Alfiky y Weisskopf, 2021).
Este género es utilizado para desarrollar bioproductos comerciales para el control de enfermedades en las plantas (Singh y Jadon, 2019; Carrillo et al., 2020); sin embargo, existen casos de baja eficiencia en el control de fitopatógenos, debido a que las diversas especies de Trichoderma que componen los bioproductos comerciales son originarios de regiones edafoclimáticas diferentes a la zona geográfica donde se aplica (Harman et al., 2010). Por lo tanto, es importante la selección de microorganismos nativos adaptados a las condiciones edafoclimáticas de la región donde se pretende realizar el biocontrol de las enfermedades en plantas (Al-Mekhlafi et al., 2019; Tegene et al., 2021). Alrededor del mundo, se desarrollan actividades agrícolas bajo climas desérticos con limitadas precipitaciones durante el año y temperaturas extremas con más de 40 °C. Los suelos en las zonas semiáridas son comúnmente alcalinos con pobre materia orgánica (Yang et al., 2019; Elnashar et al., 2021), por lo tanto, las plantas agrícolas que crecen sobre estas condiciones necesitan de la aplicación de bioproductos que permitan lograr una mayor productividad y calidad de la cosecha, de tal manera que el estudio de Trichoderma spp. nativos de zonas desérticas son un importante recurso para la sostenibilidad de los cultivos agrícolas (Torres-De la Cruz et al., 2015; Michaud, 2018). En México, existen escasos estudios relacionados a la obtención de aislados nativos de Trichoderma asociado a suelos de zonas desérticas. Por lo anterior, el objetivo del presente estudio fue el aislamiento, identificación y caracterización de especies de Trichoderma como biocontroladores de zonas semiáridas hacia hongos fitopatógenos.
Materiales y métodos
Sitio de estudio y muestro. Durante el año 2019-2020, cepas de Trichoderma spp. fueron aisladas en Baja California Sur, México. En la zona de estudio predomina el clima semiárido con temperatura máxima de 44 °C y mínima de 16 °C, con precipitaciones de 122.5 mm/año. El tipo de vegetación predominante es el matorral xerófilo. Los muestreos se realizaron en seis sitios (Figura 1). Las Pocitas (24° 24’ 30.13N-111° 5’ 53.55”O y 57 msnm), El Cajete (24° 12’ 56.95”N-110° 35’ 17.21”O y 17 msnm), El Saltito (24° 14’ 8.03”N-110° 12’ 10.36”O y 55 msnm), Los Encinos (24° 0’ 9.02”N-110° 9’ 29.95”O y 530 msnm), El Triunfo (23° 47’ 39.2”N-110° 7’ 6.56”O y 516 msnm) y Los Barriles (23° 42’ 7.72”N-109° 44’ 39.69”O y 170 msnm). En cada sitio, se colectaron 10 muestras de suelo de 2 kg a una profundidad de 30 cm de la rizósfera de Pachycereus pringlei y Jatropha cinerea (especies representativas del matorral xerófilo) (Siddiquee, 2017). Las muestras fueron almacenadas en bolsas estériles a 20 °C.
Aislamiento e identificación. El aislamiento de Trichoderma spp. se realizó en el laboratorio de Fitopatología del área de agronomía en la Universidad Autónoma de Baja California Sur, México. El procedimiento fue mediante el método propuesto por Karthikeyan et al. (2008). De cada muestra homogenizada de suelo se colectó una submuestra de 50 g y se agregó a un matraz con 450 mL de agua destilada estéril y se agitó por 20 min. De 1 mL de la mezcla fue tomado para realizar diluciones seriadas hasta obtener 10-3, 10-4 y 10-5. De cada dilución, una alícuota de 200 μL, se estrío uniformemente en cajas Petri con Papa-Dextrosa-Agar (PDA, Bioxon) y se incubaron a 28 °C por siete días. Después de cinco días de incubación se cuantificaron las unidades formadoras de colonias (UFC) que aparecieron de color verde. Se realizaron resiembras en PDA hasta la obtención de cultivos puros. Los aislamientos de Trichoderma spp. fueron identificados con las claves taxonómicas propuestas por Rifai (1969), Barnett y Hunter (1972) y Bissett et al. (2015). Las características morfológicas macroscópicas observadas fueron: color de micelio, textura de micelio y formación de anillos concéntricos. Mientras que las características microscópicas determinadas bajo un microscopio compuesto (Labomed LX 400) fueron: forma de conidios, fiálides y presencia de clamidosporas.
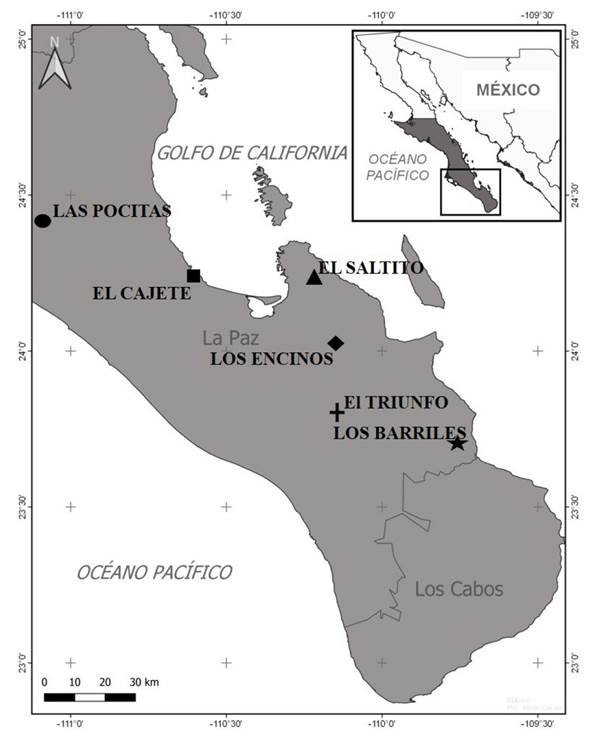
Figura 1 Sitios de estudio para el muestreo de suelo y el aislamiento de especies de Trichoderma en Baja California Sur, México.
Abundancia y frecuencia de ocurrencia de Trichoderma. La abundancia y frecuencia de Trichoderma spp. se determinó con la cuantificación de las colonias de cada área de estudio mediante la fórmula propuesta por Muniappan y Muthukumar (2014): Abundancia = Número de UFC de un hongo en la muestra/Número total de UFC de todos los hongos en cada muestra × 100 y se expresó en UFC g-1. La frecuencia de ocurrencia (F) se calculó siguiendo la fórmula F (%) = # agroecosistemas con una especie de hongo/# agroecosistemas examinados × 100. Estos experimentos se realizaron con cinco repeticiones y evaluados dos veces en el tiempo.
Antagonismo de Trichoderma spp. vs. hongos fitopatógenos. Se evaluó in vitro la actividad antagónica por el método de cultivo dual de los aislamientos de Trichoderma que presentaron la mayor velocidad de crecimiento micelial hacia cinco hongos fitopatógenos (Fusarium oxysporum, Fusarium solani, Rhizoctonia solani, Colletotrichum gloeosporioides y Alternaria alternata) obtenidos del cepario del Laboratorio de fitopatología. Su patogenicidad fue evaluada previamente en estudios anteriores (Camacho-Aguiñiga, 2016; Núñez-Madera et al., 2016; Rodríguez-Macías, 2016). Los microorganismos fueron cultivados en cajas Petri con PDA por siete días a 28 °C. Posteriormente, de los cultivos se tomó un disco de 5 mm de diámetro de cada Trichoderma y fitopatógeno y se depositaron ambos en los extremos de la caja a 6 cm de distancia entre sí. Las cajas Petri se incubaron a 28 °C por cinco días y se midió en cm el crecimiento micelial del fitopatógeno con relación al del Trichoderma. Un grupo de cajas Petri fueron sembradas con un Trichoderma proveniente del producto comercial Tricho-Sin® a base de T. harzianum (Usado comúnmente en la agricultura orgánica de la región) más los fitopatógenos. Como tratamiento control, cajas Petri fueron sembradas en un extremo solo con cada hongo. El porcentaje de inhibición (PI) se determinó siguiendo la fórmula de Otadoh et al. (2011): PI (%) = R1-R2/R1 × 100. Donde R1 = Crecimiento micelial del hongo en las cajas control y R2 = Crecimiento micelial del hongo en presencia del antagonista. Se realizaron 10 repeticiones por tratamiento y el experimento fue repetido dos veces en el tiempo.
Análisis estadísticos. Los datos se analizaron mediante análisis de varianza unidireccional (ANOVA) utilizando el software STATISTICA 10.0 (paquete de software StatSoft, Tulsa, OK) y se utilizó la prueba de Duncan (p≤0.05) para la separación de medias. Antes del análisis de varianza, los porcentajes se transformaron en arcoseno-raíz cuadrada.
Resultados y discusión
Aislamiento e identificación de aislados de Trichoderma. Se obtuvieron 18 aislamientos agrupados en siete especies: T. harzianum, T. viride, T. atroviride, T. asperellum, T. longibrachiatum, T. koningii y Trichoderma sp. (Cuadro 1). Conidios globosos a subglobosos fueron observados en T. atroviride, T. viride, T. longibrachiatum y Trichoderma sp. Sin embargo, fue elipsoidal en T. asperellum, T. harzianum y T. koningii. Cinco especies (T. atroviride, T. harzianum, T. longibrachiatum, T. viride y Trichoderma sp.) mostraron de dos a tres zonas concéntricas de conidiación, mientras que dos especies registraron conidiación dispersa en un solo anillo (T. koningii y T. asperellum). Las fiálides presentaron forma globosa en el centro excepto en T. viride, T. koningii y T. asperellum, las cuales mostraron morfología delgada. En la mayoría de las especies las fiálides tendían a agruparse en 2-3 verticilos, excepto T. harzianum y T. longibrachiatum que mostraron disposición solitaria. Estas características coinciden con las señaladas en las claves taxonómicas anteriormente mencionadas. En Trichoderma sp. aunque presentó morfología colonial típica del género y similitudes microscópicas, algunas características variaron como la forma de los conidios, su disposición y el cuerpo fructífero.
Cuadro 1 Características morfológicas de diferentes especies de Trichoderma aisladas de zona semiáridas del Noroeste de México.
| Especie | Colonia | Micelio | No. anillos | Conidias | Fiálides |
|---|---|---|---|---|---|
| T. atroviride | Verde oscuro | Plano | 2 | Globosa | Agrupadas en 2-3 verticilos |
| T. asperellum | Verde oscuro | Plano | 1 | Elipsoidal | Agrupadas en 2-3 verticilos |
| T. harzianum | Verde oscuro | Algodonoso | 2 | Elipsoidal | Solitarias |
| T. longibrachiatum | Verde ligero | Algodonoso | 2 | Globosa | Solitarias |
| T. viride | Verde oscuro | Algodonoso | 3 | Globosa | Agrupadas en 2-3 verticilos |
| T. koningii | Verde ligero a azul verdozo | Algodonoso | 1 | Elipsoidal | Agrupadas en 2-3 verticilos |
| Trichoderma sp. | Verde ligero | Algodonoso | 2 | Sub-globosa | Agrupadas en 2-3 verticilos |
La presencia de estas especies pueden representar posibles biotipos resistentes a factores estresantes. Osorio-Concepción et al. (2013), mencionan que la variabilidad de aislados en un lugar, puede ser estimulada por factores de estrés como la luz, falta de nutrientes o cambios en pH. Al-Ani (2018) y Bononi et al. (2020), mencionan que el rápido crecimiento de Trichoderma spp. y su habilidad para crecer en diferentes sustratos, ha permitido su aislamiento en diversos suelos alrededor del mundo. Sin embargo, aunque este género ha sido estudiado en diversas zonas desérticas (Sharma et al., 2019; Ma et al., 2020) este es el primer reporte de su aislamiento de una zona semiárida del Noroeste de México. La identificación de especies de Trichoderma mediante morfología sigue siendo un método eficiente en la identificación de este hongo (Wu et al., 2017; Asis et al., 2021). Las especies de T. harzianum, T. atroviride, T. asperellum, T. koningii, T. longibrachiatum y T. viride ya han sido reportadas como agentes de biocontrol de fitopatógenos en diversos cultivos (Miguel-Ferrer et al., 2021; Hewedy et al., 2020; Naeimi et al., 2020; Shamurailatpam y Kumar, 2020; Ayele et al., 2021).
Abundancia y frecuencia de ocurrencia de Trichoderma spp. La abundancia de Trichoderma spp. fue significativamente diferente (Duncan, p≤0.05) entre los sitios de estudio (Figura 2). Las Pocitas presentó la mayor abundancia de Trichoderma spp., mientras que la menor población del hongo fue cuantificada en El Cajete. En relación a la frecuencia de ocurrencia de los aislamientos de Trichoderma spp. se encontraron diferencias entre los sitios de estudio (Figura 3). En El Saltito se presentó el mayor número de Trichoderma spp.: T. harzianum, T. atroviride, T. asperellum, T. longibrachiatum, T. viride y Trichoderma sp. y en Los Barriles se presentó el nivel más bajo de ocurrencia con solo tres especies: T. koningii, T. atroviride y T. asperellum.
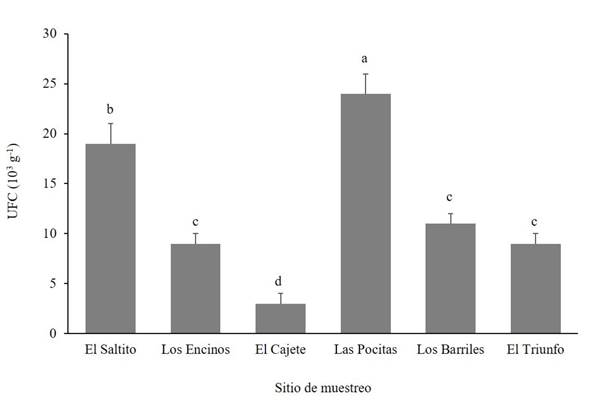
Figura 2 Abundancia de especies de Trichoderma aislados en diferentes sitios semiáridos del Noroeste de México. UFC = Unidades Formadoras de Colonias.
En algunos sitios geográficos donde la precipitación es alta, hay disponibilidad de materia orgánica y plantas hospederas, la abundancia de Trichoderma es mayor (Harman et al., 2004; Garnica-Vergara et al., 2016). En las zonas semiáridas donde prevalecen las altas temperaturas durante casi todo el año, un factor limitante es la humedad, que afecta negativamente a las plantas e indirectamente disminuye la diversidad y abundancia de los microorganismos del suelo (Silva et al., 2020), como bacterias, hongos, actinomicetos, asociados a plantas de interés agronómico, forestal, entre otras (Long et al., 2021; Yang et al., 2021). Aunque Trichoderma spp. es uno de los hongos más abundantes en el suelo, su ocurrencia generalmente es baja en suelos desérticos y está asociada a la escasa presencia de especies vegetales y a condiciones edafoclimáticas extremas, al respecto Gherbawy et al. (2004), identificó en suelos del Valle del Nilo solamente dos especies: T. harzianum y el anamorfo Hypocrea orientalis, miembro del género T. longibrachiatum.Montoya-González et al. (2016) señalan que el ambiente seco y la falta de materia orgánica reducen la presencia y diversidad de microorganismos del suelo. Estas características pueden estar relacionadas con la baja población que se presentó en el sitio de El Cajete, por la escasa vegetación y la textura arenosa del suelo, carente de materia orgánica. Aunque se destaca que el número de especies fue mayor al del sitio de Las Pocitas. Estas especies podrían poseer mayor capacidad de producción de compuestos para su adaptación a ambientes extremos.
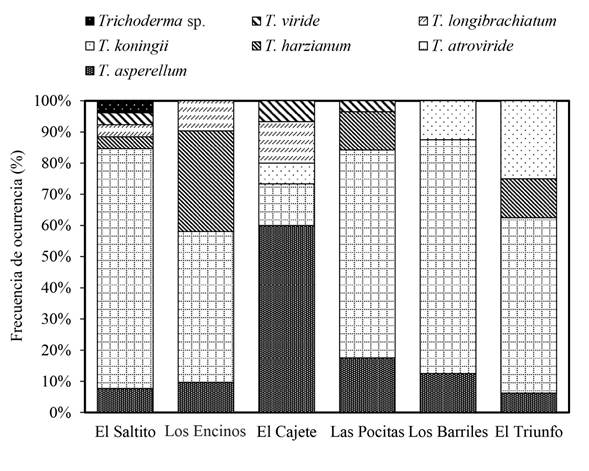
Figura 3 Frecuencia de ocurrencia de especies de Trichoderma en diferentes sitios semiáridos pertenecientes al municipio de La Paz, del Noroeste de México.
Antagonismo in vitro. El porcentaje de inhibición (PI) de diversos hongos fitopatógenos fue significativamente diferente (Duncan, p≤0.05) entre las especies de Trichoderma (Cuadro 2). Esta respuesta puede ser debido a la capacidad diferencial de cada especie en la producción de compuestos, así como la velocidad de reacción ante los distintos factores. Al respecto, Hewedy et al. (2020), señalan que la diferencia en la inhibición de los fitopatógenos entre los aislamientos de Trichoderma spp. se debe principalmente a su habilidad para adaptarse y crecer bajo diversos sustratos y a su capacidad antagónica mediada por su versatilidad para ejercer diversos mecanismos antagónicos. Por lo anterior, su plasticidad le permite sobrevivir en suelos de climas extremos como del norte de México. T. koningii inhibió a todos los hongos fitopatógenos (F. oxysporum, F. solani, R. solani, A. alternata y C. gloeosporioides) superando al antagonismo ejercido por el resto de los microrganismos incluido al producto comercial Tricho-Sin®. T. harzianum fue el que causó la menor inhibición en los fitopatógenos (Figura 4). Estos resultados coinciden con lo reportado por Elshahawy et al. (2017) quienes comprobaron la efectividad de T. koningii comparada con T. album, T. harzianum, T. viridey T. virens en el control de Sclerotium cepivorum. Mientras que Katyayani et al. (2020) evaluó el efecto inhibidor de T. harzianum, T. viride y T. koningii sobre Fusarium oxysporum f. sp. ciceri determinando a T. koningii el de mayor eficiencia de inhibición en el crecimiento micelial del patógeno. Esta efectividad de T. koningii puede ser debido a mecanismos mayormente eficientes no solo en el control de patógenos, sino también en la tolerancia a diferentes tipos de estrés. Al respecto, Nykiel-Szymańska et al. (2018) reportaron que T. koningii produce específicamente metabolitos de tipo declorados e hidroxilos que le proporcionan una alta tolerancia al cobre y los cuales posiblemente pueden estar asociados a sus diferentes mecanismos de acción.
Cuadro 2 Efecto de Trichoderma spp. sobre la inhibición de hongos asociados a enfermedades bajo condiciones in vitro.
| Especie | Porcentaje de Inhibición (%)y | ||||
|---|---|---|---|---|---|
| Fusarium oxysporum | Fusarium solani | Rhizoctonia solani | Alternaria alternata | Colletotrichum gloeosporioides | |
| T. asperellum | 70 bz | 64 c | 56 b | 69 b | 63 b |
| T. harzianum | 60 d | 63 c | 40 d | 56 d | 50 d |
| T. koningii | 75 a | 73 a | 62 a | 73 a | 69 a |
| T. longibrachiatum | 69 b | 68 b | 56 b | 61 c | 62 b |
| T. atroviride | 63 c | 68 b | 55 b | 68 b | 62 b |
| Trichoderma sp. | 63 c | 64 c | 50 c | 68 b | 63 b |
| T. viride | 64 c | 64 c | 51 c | 69 b | 62 b |
| Tricho-Sin® | 64 c | 54 d | 57 b | 69 b | 56 c |
yPI = Porcentaje de inhibición.
zLetras diferentes significa diferencia significativa entre tratamientos de acuerdo con la prueba de Duncan p≤0.05.
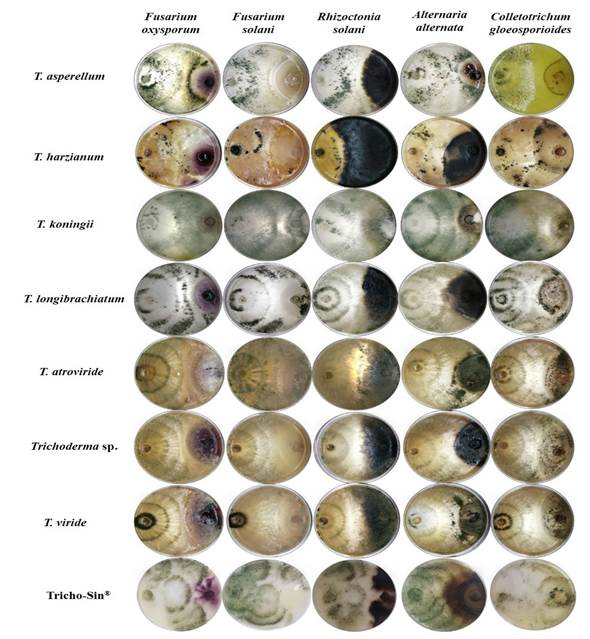
Figura 4 Antagonismo in vitro de especies de Trichoderma aisladas de zonas semiáridas contra hongos fitopatógenos.
Cheng et al. (2012), reportaron que la eficacia de la mayoría de las especies de Trichoderma (incluidas T. asperellum, T. harzianum, T. koningii, T. longibrachiatum, T. atroviride y T. viride) consiste en inhibir el crecimiento de las hifas de los hongos fitopatógenos al provocar vacuolización citosólica y lisis en las hifas, mientras que Kashyap et al. (2020), lo asocia a la reducción de la esporulación de los hongos. Otros mecanismos antagónicos que ejerce Trichoderma spp. en la inhibición in vitro e in vivo de los fitopatógenos es la producción de enzimas hidrolíticas (chitinasa y β-1,3-glucanasa) que degradan la pared celular del hongo (Ruangwong et al., 2021), compuestos volátiles orgánicos (azetidina, 2-feniletanol y hexadecanoato de etilo) con actividad antimicrobiana (Dini et al., 2021), producción de antibióticos (Bae et al., 2016), competencia por espacio y nutrientes como la sacarosa y glucosa (Liu et al., 2021), inducción de resistencia sistémica del hospedero (Li et al., 2018), entre otros. Debido a que la supervivencia, el establecimiento y la actividad antagónica de especies de Trichoderma en campo son aún inconsistentes, es de vital importancia realizar estudios encaminados en comprender la ecología y la dinámica de las poblaciones de Trichoderma en el suelo para lograr una protección eficiente de los cultivos.
Conclusiones
Siete especies de Trichoderma fueron identificadas: T. asperellum, T. atroviride, T. harzianum, T. koningii, T. viride, T. longibrachiatum y Trichoderma sp. Las Pocitas presentó mayor población y frecuencia de ocurrencia de Trichoderma spp., mientras que en El Saltito se observó mayor variabilidad de especies al identificar a T. harzianum, T. atroviride, T. asperellum, T. longibrachiatum, T. viride y Trichoderma sp. En el antagonismo T. koningii presentó la mejor respuesta de inhibición en el crecimiento de F. oxysporum, F. solani, R. solani, A. alternata y C. gloeosporioides, comparado con el resto de las especies y el producto comercial de T. harzianum Tricho-Sin® . El conocimiento de las diferentes especies de Trichoderma presentes en la región, será de gran relevancia para futuros estudios relacionados a la selección de cepas nativas de zonas semiáridas que puedan ser utilizadas en condiciones ambientales extremas contra patógenos de raíz en plantas de interés agrícola.











 texto em
texto em 


