La cebolla (Allium cepa) es considerada uno de los ingredientes indispensables en la dieta y cultivada alrededor del mundo (Joaheer et al., 2019). En México es el tercer cultivo de mayor importancia en las hortalizas, con una producción de 85,104 t para el año 2018 en un área sembrada aproximada de 7,329 ha, dejando una derrama económica de 26,029,376 millones de dólares (FAO, 2020). Baja California es el principal estado productor de cebolla con superficie sembrada de 3,443 ha, mientras que Puebla ocupa el quinto lugar con 2,480 ha con un rendimiento de 21,371 t ha-1 (SIAP, 2020).
Las enfermedades causadas por hongos que se presentan con mayor frecuencia en esta hortaliza, y pueden afectar follaje, raíz y fruto durante las etapas de precosecha y postcosecha (Ji et al., 2018). Algunas de las enfermedades con mayor incidencia en el género Allium son causadas por Rhizoctonia solani, Brotrytis allii, Aspergillus niger, Colletotrichum circinans y Fusarium spp. (Montes-Belmont et al., 2003), este último es considerado como el principal devastador de este cultivo durante los últimos años (Abdalla et al., 2019). La pudrición basal ocasionada por el género Fusarium spp., se encuentra ampliamente distribuida a nivel mundial, convirtiéndose en una limitante en zonas productoras de cebolla y ajo (Kiehr y Delhey, 2015). Las principales especies del género Fusarium que daña al cultivo de cebolla alrededor del mundo son F. proliferatum, F. solani y F. oxysporum reduciendo hasta un 50% su rendimiento (Haapalainen et al., 2016), donde los principales síntomas de las plantas de cebolla son: marchitamiento, pudrición de raíces y de la placa basal del bulbo (Sanogo y Zhang, 2015). En México, el género Fusarium es responsable de diversas enfermedades en cultivos de cebolla (Montes-Belmont et al., 2003). Por eso su importancia en la presente investigación.
Los productos de síntesis química se han empleado por décadas para el control de estas enfermedades (Gan y Wickings, 2017). Sin embargo, el uso de éstos está relacionado con la generación de resistencia, daños al ambiente y la salud humana (Andrade-Hoyos et al., 2019). Por lo tanto, el control biológico se considera una de las prácticas eficientes y ecológicamente viables para el desarrollo de una agricultura sostenible (Pérez-Torres et al., 2018).
El género Trichoderma contiene especies antagonistas capaces de controlar un amplio número de hongos que afectan a las plantas de interés agrícola (Romero-Arenas et al., 2017). El éxito y su uso en la agricultura se debe a sus mecanismos de acción como la competencia por espacio, micoparasitismo, antibiosis (Nawrocka et al., 2018), y la producción de compuestos volátiles (Hernández-Melchor et al., 2019). En consecuencia, los objetivos de este trabajo fueron caracterizar morfológicamente aislados fúngicos del género Fusarium asociados a bulbos de cebolla en la comunidad rural La Soledad, Chietla, Puebla-México y determinar la capacidad antagónica in vitro de T. harzianum T-H4 sobre aislados fúngicos del cultivo de cebolla.
Zona del aislamiento. Se colectaron muestras de tejido vegetal con pudrición a nivel de tallo (disco basal) o bulbo, y poco desarrollo radicular en una parcela de 3 144.3 m2 de cultivo de cebolla variedad “Crystal white” con antecedentes de alta incidencia fúngica durante la producción verano-otoño 2019 (18° 27’ 39.3258” y -98° 37’ 11.2614”). La parcela agrícola corresponde a la comunidad La Soledad, perteneciente al municipio de Chietla del estado de Puebla, con un clima desértico cálido (Bwh) y precipitación media de 700 mm (García, 2004). El muestreo fue dirigido hacia individuos con síntomas asociados al género Fusarium; todas las muestras se mantuvieron en bolsas de plástico dentro de una hielera hasta su traslado al laboratorio.
Aislamiento de Fusarium sp. de tejidos vegetales. Se seleccionaron 30 bulbos para ser desinfestados con agua corriente e hipoclorito de sodio al 10%. Se colocaron porciones de bulbos en cámaras húmedas; para esto se utilizaron cajas de polietileno y papel filtro estéril húmedo, finalmente las cajas de polietileno se incubaron a 28 °C, por 10 días. Una vez terminado el tiempo de incubación, el tejido muerto de los bulbos se cortó en secciones de 0.5 cm2, se desinfestaron con hipoclorito de sodio al 1.5% y se lavaron tres veces con agua destilada. Se secaron con papel estéril y finalmente se sembraron en cajas Petri con medio de cultivo Papa Dextrosa Agar (PDA) a una temperatura de 28 °C con luz ambiental, por tres días. Las colonias desarrolladas fueron aisladas y purificadas mediante cultivos monospóricos, siguiendo las indicaciones de Morales et al. (2020).
Caracterización morfológica. La identificación de las colonias fúngicas obtenidas se realizó mediante el análisis de características morfológicas asociadas al género Fusarium con claves taxonómicas de identificación de Barnett y Hunter (2006), en un sistema de micro cultivo en un microscopio óptico (Carl Zeiss, Jena, Alemania) a 1000x magnificaciones (Samson et al., 2014). Para la evaluación del desarrollo micelial, se inocularon fragmentos de los aislados promisorios en cajas Petri con PDA, se incubaron bajo oscuridad a 28 °C por 10 días y se midió el diámetro micelial cada 12 h para estimar la velocidad de crecimiento (cm), la cual se calculó con la función de crecimiento lineal y=mx + b (donde ‘y’ es la distancia, ‘x’ es el tiempo y ‘b’ el factor constante) y se expresó en centímetros por día (cm d-1) (Zeravakis et al., 2001). El diámetro se midió con un vernier digital (CD-6 Mitutoyo), siempre en la misma dirección -por triplicado-, la cual fue establecida al azar para cada repetición, se usó solo el promedio para calcular la velocidad de crecimiento micelial por día.
Identificación molecular. Se extrajo ADN de conidios, conidióforos y micelio de los aislados obtenidos con características morfológicas asociadas a Fusarium, mediante el método CTAB 2% (Rivera-Jiménez et al., 2018). El ADN se re-suspendió en 100 mL de agua HPLC estéril y se cuantificó mediante espectrofotometría (Nanodrop 2 000 C, Thermo Scientific). Posteriormente, se diluyó a 20 ng mL-1 y se almacenó a -20 °C. Para la amplificación se utilizó los cebadores ITS1 e ITS4 (White et al., 1990), y 15 μL de mezcla de reacción que contenían 0.18 μL de cada cebador, 0.18 μL de dNTP, 0.9 μL de ADN polimerasa GoTaqVR (Promega), 3 μL de suspensión de ADN y 10.56 μL de agua destilada. La amplificación se realizó en un termociclador de ADN Peltier (PTC-200, Bio-Rad), 95 °C por 1 min; 35 ciclos a 95 °C por 30 s; 55 °C por 1 min; extensión de 72 °C por 45 s; finalmente 72 °C por 5 min (Salazar-González et al., 2016). Los productos de PCR amplificados se verificaron mediante electroforesis en gel de agarosa al 1.5% (Seakem) y se purificaron con ExoSAP-IT (Affymetrix); ambas cadenas se secuenciaron en el Colegio de posgraduados con BigDye Terminator v3.1 (Applied Biosystems) en un secuenciador analizador genético 3 130 ×L (Applied Biosystems, Foster City, CA) y el software Bioedit 7.0.4.1 de acuerdo con las instrucciones del fabricante. La secuencia obtenida fue depositada en la base de datos del National Center for Biological Information (NCBI) del Gen Bank, y se comparó con cinco accesos (Cuadro 1) disponibles en la base de datos del NCBI para corroborar su identidad (Nei y Kumar, 2000).
Pruebas de patogenicidad in vitro . Se implementaron los postulados de Koch para confirmar la patogenicidad de Fusarium sp. Se utilizaron semillas certificadas de cebolla variedad Crystal white con un porcentaje de germinación del 90%, las cuales fueron desinfectadas previo a su uso. Se colocaron seis semillas por caja Petri y una vez germinadas se colocaron discos de 5 mm de diámetro con micelio de Fusarium sp., en el centro de la caja Petri por triplicado con dos repeticiones; como grupo control se utilizó un disco de 5 mm de diámetro de agar-agua estéril. Las semillas se incubaron dentro de una cámara ambiental con temperatura controlada (22 ± 2 °C) y en total oscuridad, hasta que el 90% de las semillas del grupo control hubieran germinado. Después de ese periodo, se utilizó como criterio de germinación una longitud de radícula mayor de 5 mm, se registra el crecimiento o alargamiento de la radícula de ambos grupos (OECD, 1984; USEPA, 1996). Los datos registrados se sometieron a la prueba de normalidad de Shapiro y Wilk (p<0.05), así mismo, se compararon en base a la prueba t de student para muestras apareadas (p<0.05) (Iturbide-Zuñiga et al., 2017). Finalmente, se tomaron secciones pequeñas (aprox. 1 × 1 cm) de radículas con síntomas de enfermedad, se esterilizaron en la superficie con hipoclorito de sodio al 1% durante 10-30 s y se enjuagaron tres veces con agua destilada estéril para el re-aislamiento, los segmentos fueron colocados en medio PDA, se incubaron bajo oscuridad a 28 °C por 10 días. Posteriormente el aislado se observó en el microscopio óptico para confirmar que se tratara de la cepa CFbC a través de claves taxonómicas de identificación (Barnett y Hunter, 2006).
Cuadro 1 Especies del complejo de F. incarnatum-equiseti y secuencias del GenBank para corroborar identidad de la cepa CFbC.
| No. Accesión | Complejo de especie | Lugar | Hospedante | Pb | Identidad |
|---|---|---|---|---|---|
| KP026922 | F. incarnatum-equiseti | USA | Citrullus lanatus | 550 | 100% |
| HM999942 | F. incarnatum-equiseti | Ecuador | Piper reticulatum | 519 | 100% |
| HQ625642 | F. incarnatum-equiseti | Nicaragua | Phaseolus vulgaris | 399 | 100% |
| KX375792 | F. incarnatum-equiseti | Colombia | Musa paradisiaca | 440 | 100% |
| KY461086 | F. incarnatum-equiseti | Brasil | Schinus terebinthifolia | 363 | 100% |
Evaluación de antagonismo de T. harzianum ante Fusarium sp. en cultivos duales. La evaluación del antagonismo se realizó con la cepa T-H4 de T. harzianum, aislada de la raíz de Persea americana, cuya secuencia se incluyó en la base de datos del National Center for Biological Information (NCBI) con el número de acceso MK779064.1, misma que está en el laboratorio de Eco-Campus Valsequillo, del Instituto de Ciencias, Benemérita Universidad Autónoma de Puebla (BUAP) (Andrade-Hoyos et al., 2020). Se utilizó la técnica de cultivo dual de acuerdo con Andrade-Hoyos et al. (2019) -por triplicado- para determinar el porcentaje de inhibición de crecimiento radial con la fórmula PICR= [(R1-R2/R1) x 100] para cada ensayo evaluado por un lapso de 10 días. Los datos registrados se sometieron a la prueba de normalidad de Shapiro y Wilk (p<0.05), así mismo, se compararon en base a la prueba t de student para muestras apareadas (p<0.05) en el paquete estadístico IBM SPSS Statistics versión 25 (Iturbide-Zuñiga et al., 2017). El experimento se repitió dos veces para su validación. Para complementar las evidencias del antagonismo, se comparó y clasificó cada ensayo con la escala establecida por Bell et al. (1982): I) crecimiento de T. harzianum cubrió toda la superficie del medio y redujo la colonia de Fusarium sp., II) crecimiento de T. harzianum cubrió al menos 2/3 partes del medio, III) T. harzianum y Fusarium sp., crecieron 1/2 y 1/2 de la superficie del medio, uno no se sobrepuso al otro, IV) Fusarium sp., creció al menos 2/3 partes del medio y resistió a la invasión de T. harzianum y V) crecimiento de Fusarium sp., cubrió toda la superficie del medio.
Identificación. Utilizando la estrategia propuesta de aislamiento, sólo una colonia asociada al género Fusarium fue obtenida. La cepa CFbC se caracterizó por presentar un crecimiento radial con una velocidad de crecimiento de 0.5294 ± 0.0833 cm d-1, rango que concuerda con el estudio de Groenewald et al. (2006). El aspecto de la colonia de la cepa CFbC fue abundante micelio aéreo, al principio de color blanco, pero al madurar se tornan ligeramente color café canela, al reverso de la placa, se muestra una coloración ligeramente naranja (Figura 1a y b). La cepa CFbC presentó hifas septadas, hialinas, macroconidios tabicados con cinco septos, falcados, con una curvatura distintiva de longitud de 60 -120 µm aprox. (Figura 1c), con pared gruesa que en su parte ventral se arquea ligeramente y en la parte dorsal se arquea abruptamente, con una célula basal en forma de pie y la parte apical filamentosa. Las características morfológicas mencionadas anteriormente, coincidieron con las descritas por Barnett y Hunter (2006) y Leslie y Summerell (2006) para Fusarium sp.
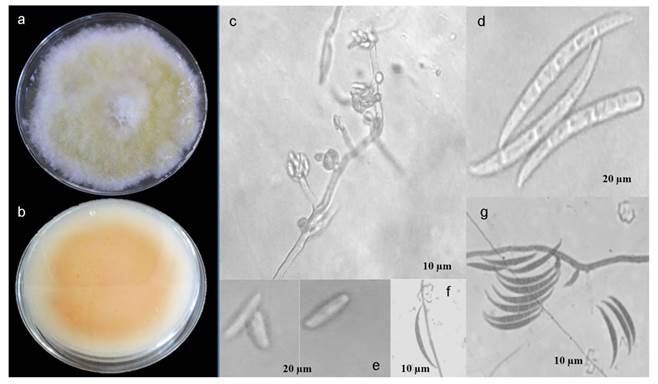
Figura 1 a) Colonia de Fusarium sp. en medio PDA, b) Reverso de colonia en PDA, coloración naranja, c) Monofiálides cortas y microconidios agrupados en falsas cabezas, d) Macroconidios tabicados con cinco septos, e) Microconidias, f y g) Macroconidias con curvatura distintiva, 40 X.
Con la amplificación de la región ITS ribosomal se obtuvo un producto de 533 pb de la cepa CFbC, que presentó 100% de identidad con el complejo de especies Fusarium incarnatum-equiseti (Cuadro 1) de acuerdo con la base de datos del Gen Bank, esta secuencia se incluyó en la base de datos NCBI con el número de acceso MN612793.1.
Pruebas de patogenicidad. Ocho días después de la inoculación in vitro con la cepa CFbC todas las plantas comenzaron a mostrar síntomas, presentando un porcentaje de germinación del 95%. Los resultados de las pruebas de patogenicidad se presentan en la Figura 2, donde se observa un crecimiento radicular menor a 5 mm (Figura 2a), ahorcamiento apical, necrosis en la radícula (Figura 2b), y colonización en las plántulas a nivel de germinación de semilla en placas con agar agua (Figura 2c), resultados positivos para la inoculación de Fusarium sp. En las plántulas empleadas como testigos no se observaron síntomas (Figura 2d), comprobando con ello los postulados de Koch.

Figura 2 Germinación de semillas inoculadas con Fusarium sp. a) Crecimiento raíz mínimo y necrosis, b) Ahorcamiento y necrosis, c) Colonización en parte apical, d) Testigo sin síntomas.
En la prueba de patogenicidad, se observó una reducción del 42.02% en el crecimiento radicular, mostrando diferencias significativas. Los postulados de Koch se confirmaron mediante el re-aislamiento de Fusarium sp. de rizomas de plántulas germinadas a los 10 días pos-inoculación. Este patógeno ha sido reportado por Dauda et al. (2018) quienes realizaron un primer reporte sobre la enfermedad de muerte regresiva de la cebolla causada por F. equiseti en Nigeria.
Evaluación del antagonismo de T. harzianum sobre Fusarium sp., en cultivo dual. Se presentaron zonas de interacción entre T. harzianum (T-H4) y Fusarium sp. (CFbC), donde se observó competencia de espacio y nutrientes. La reducción en la tasa de crecimiento en cultivos duales es un indicador de la capacidad antagónica de Trichoderma (Guigón-López et al., 2010). En el presente estudio, el crecimiento de Fusarium sp. en confrontación con la cepa T-H4 fue claramente inhibido a partir del día 5 (Figura 3a). Al evaluar el PICR se detectaron diferencias significativas (P ≤ 0,0001) en la prueba de t de student, con un valor de t= 92.57. El PICR fue de 76.24% (Figura 4b), valor que se clasifica en la clase II (Figura 4a) de acuerdo con la escala establecida por Bell et al. (1982). Michel-Aceves et al. (2005), reportan el 73% de inhibición de crecimiento radicular al evaluar el efecto antagónico de aislados nativos de Trichoderma spp., sobre el crecimiento de F. subglutinans, resultados similares en el presente estudio. Por otro lado, Jagraj et al. (2018) reportan un valor de 75.9% para F. oxysporum frente a T. harzianum, mayor a T. viride y T. koningii con 67.7 y 55.6% respectivamente, esto para cepas aisladas de plantas de jitomate.
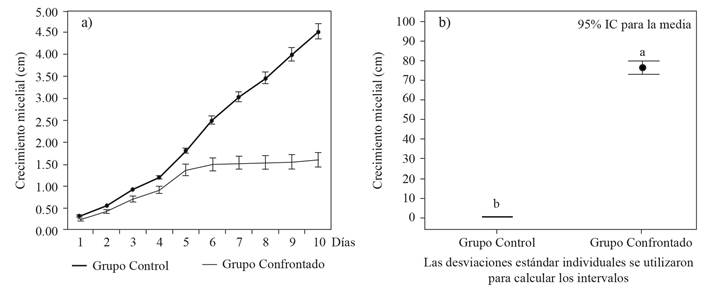
Figura 3 Comparación del crecimiento micelial y PICR. a) Crecimiento de Fusarium sp. en presencia y ausencia de T. harzianum b) Porcentaje de inhibición del crecimiento radial (PICR) de Fusarium sp. a 10 días de la inoculación en presencia y ausencia de T. harzianum. *Medias con letras diferentes indican diferencias significativas con la prueba de t de student (p≤0.05).
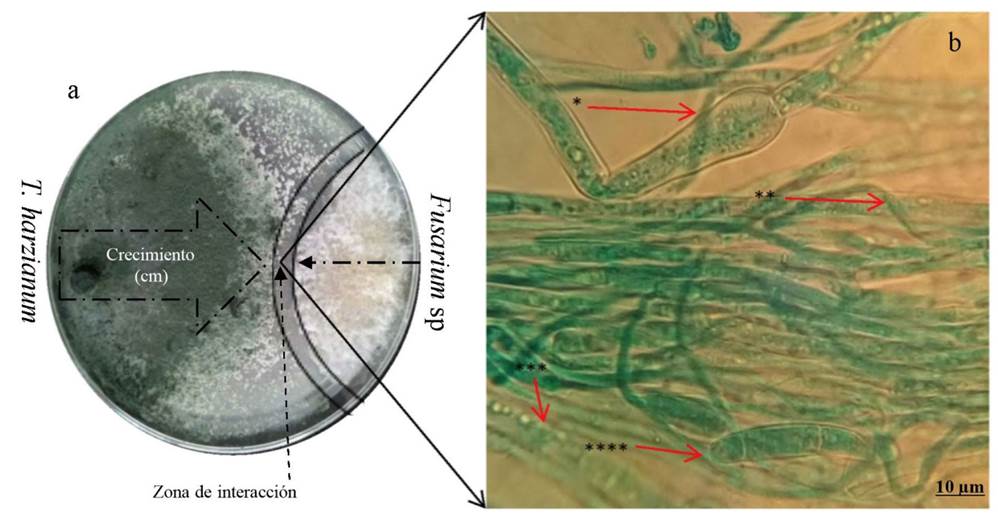
Figura 4 a) Antagonismo de la cepa T-H4 de T. harzianum frente a Fusarium sp., donde se observa una clase II en la escala de Bell et al . (1982), b) Micoparasitismo de T. harzianum sobre las hifas y conidios de Fusarium sp., * hinchamiento de hifa, ** enrollamiento de hifa, *** granulaciones dentro de hifa, **** hinchamiento de macroconidio.
Reyes et al. (2008), notificaron que una de las características significativas de Trichoderma es su elevada velocidad de crecimiento, y la secreción de metabolitos secundarios de diferente naturaleza, que frenan el crecimiento de otros competidores. Asimismo, el micoparasitismo es otro de los mecanismos de acción del género Trichoderma. En este caso se logró observar hinchamientos en macroconidias e hifas, así como ruptura de septos, presencia de granulaciones y vacuolización de hifas por T. harzianum (Figura 4b), esto reafirma la elevada capacidad micoparasítica de la cepa T-H4. Duarte-Leal et al. (2018) observaron micoparasitismo entre hifas de T. asperellum (Ta.25), donde penetró y causó lisis en hifas de Fusarium oxysporum f. sp. ciceri (F-50) como lo reportado en la presente investigación. Los resultados corroboraron lo notificado por Gonzálezet al.(2012) y Hyderet al. (2017), sobre la degradación enzimática de la pared celular de los hongos fitopatogénicos durante la acción micoparasítica, que causa lisis y con ello la desorganización del contenido citoplasmático que, según estos autores, está relacionada con la acción de las enzimas quitinasas, β-1,3-glucanasas, β-1,6-glucanasas, α-1,3-glucanasas y proteasas excretadas porTrichodermaspp. Además, Leónet al.(2012) observaron presencia de estrangulamiento y lisis de las paredes de las hifas, seguidas de una desintegración y degradación de las paredes celulares deFusariumsp., al enfrentarse a las cepasTb111 yTc241 deTrichodermaspp.
Las interacciones hifales que intervienen en el parasitismo son mediadas por la actividad enzimática del antagonista, que permite la penetración, deformación, desintegración y muerte de las hifas del patógeno (Leónet al., 2012), por lo que aquellas cepas que exhiben un alto potencial enzimático tienden a poseer un mayor efecto micoparasítico (Gonzálezet al., 2012); de ahí la importancia de la selección de cepas con varios tipos de interacciones hifales.
Las pruebas de antagonismo reflejan la capacidad y variabilidad genética del antagonista y del fitopatógeno para resistir el antagonismo y realizar una selección preliminar de las cepas antagónicas más eficientes para ser evaluadas en condiciones de campo, así como para complementar y determinar su capacidad biocontroladora (Morales et al., 2020).
Se logró identificar a Fusarium sp. asociado a la podredumbre basal, proveniente de bulbos del cultivo de cebolla (Allium cepa) variedad Crystal white, ubicada en La Soledad, perteneciente al municipio de Chietla del estado de Puebla, México. La cepa de T. harzianum T-H4 mostró adecuada capacidad antagónica in vitro frente a Fusarium sp., con un PICR de 76.24%. Es necesario verificar en campo la capacidad antagonista de T. harzianum T-H4 frente a la cepa CFbC, así como su identificación por el factor de elongación de la traducción 1α (EF1α), para así recomendar su uso como alternativa a los productores de cebolla de la región.











 texto en
texto en 


