La calabacita (Cucurbita pepo) es una de las principales especies de cucurbitáceas (Zitter et al., 2004). La producción de calabacita está limitada por agentes bióticos y abióticos durante todo su ciclo de cultivo, siendo la etapa de plántula una de las más críticas. Existen numerosos patógenos que pueden afectar las semillas y plántulas, causando ahogamiento en preemergencia o postemergencia. Los agentes causales más comunes del ahogamiento de plántulas en cucurbitáceas son: Fusarium oxysporum (Vakalounakis y Chalkias, 2004), Phytophthora capsici (Hausbeck y Lamour, 2004), Rhizoctonia solani (Scheuerell et al., 2005) y Pythium spp. (Deadman et al., 2002; Scheuerell et al., 2005). En las dos últimas décadas, el uso de plaguicidas sintéticos ha disminuido considerablemente debido al desarrollo de nuevas estrategias de control como los bioplaguicidas (Ongena y Jacques, 2007). Una de las especies más usadas como bioplaguicida es Bacillus subtilis, debido a que ésta produce antibióticos, lipoproteínas y enzimas hidrolíticas, que le confieren actividad antifúngica, convirtiéndola en un excelente agente de control biológico de fitopatógenos (Ongena y Jacques, 2007). De forma específica, se ha reportado su actividad sobre organismos que inducen ahogamiento de plántulas, y sus efectos benéficos sobre las plántulas tratadas (Cavaglieri et al., 2005; Sharma y Sharma, 2008). B. subtilis produce tres familias de polipéptidos cíclicos (surfactinas, iturinas y fengicinas) relacionadas con su actividad antagónica contra bacterias, hongos y oomicetes. Estas lipoproteínas también están asociadas a una mayor capacidad de colonización de las raíces vegetales de la cepa bacteriana que las produce, e intervienen en la estimulación de la respuesta de defensa de la planta (Ongena y Jacques, 2007; Villareal-Delgado et al., 2017). Además de los polipéptidos cíclicos, B. subtilis produce compuestos antimicrobiales, que le confieren una mayor capacidad para el control de fitopatógenos (Hamdache et al., 2011; Wise et al., 2012). Por lo anterior, B. subtilis es una alternativa promisoria para el control biológico de fitopatógenos (Falardeau et al., 2013; Khedher et al., 2015). Hasta el momento, los datos publicados sobre la efectividad de la cepa QST 713 de B. subtilis para el control combinado de F. oxysporum, P. capsici y R. solani son escasos. Por lo anterior, la presente investigación tuvo como objetivo identificar morfológicamente a los agentes causales asociados al ahogamiento en plántulas de calabacita y determinar la efectividad de B. subtilis cepa QST 713 sobre la incidencia de la enfermedad producida por la inoculación combinada de los hongos aislados.
En el ciclo primavera-verano 2019, se colectaron plántulas de calabacita (Cucurbita pepo) con síntomas de ahogamiento en Cuautla, Morelos. El aislamiento de los hongos asociados a los síntomas se realizó a partir de cortes de raíces y tallos, de acuerdo con los descrito por Ayala-Armenta et al. (2020). La caracterización morfológica se realizó a 40X en un microscopio compuesto CX31RBSFA (Olympus®, Japón), donde se midieron 50 estructuras reproductivas de cada aislado. La identificación se realizó con base en claves taxonómicas especializadas (Leslie y Summerell, 2006; Sneh et al., 1991; Erwin y Ribeiro, 1996). Para corroborar la patogenicidad de los aislados se realizaron los Postulados de Koch usando plántulas sanas de calabacita. La prueba de patogenicidad se realizó dos veces seleccionando el aislamiento más virulento de cada especie.
Para la evaluación de B. subtilis contra los hongos aislados, se usaron semillas de calabacita var. Grey zucchini. El tratamiento fungicida presente en las semillas se eliminó de acuerdo con lo descrito por Márquez-Licona et al. (2018). Siete días después de la siembra, las plántulas emergidas se trasplantaron a vasos de poliuretano de 500 mL, que contenían sustrato estéril a base de Peat Moss y agrolita (75:25 v/v). Los tratamientos evaluados consistieron en tres concentraciones de la cepa QST 713 de B. subtilis (Serenade ASO®) (2, 4 y 6×107 UFC mL-1) y metil tiofanato + propamocarb clorhidrato aplicado de manera preventiva y curativa (Cuadro 1). Se determinó la incidencia del ahogamiento de plántulas de calabacita causado por la infección combinada de los hongos aislados y en condiciones de invernadero (24 °C y 70% HR). La evaluación de los tratamientos se realizó por duplicado. La viabilidad del producto comercial se determinó sembrando una alícuota del mismo en cuatro cajas Petri con medio de cultivo PDA. Las cajas se incubaron en oscuridad a 36 °C por 48 h. La evaluación de la viabilidad se realizó por duplicado. El inóculo se incrementó en medios de cultivo específicos para cada patógeno (SNA, V8 Agar y PDA). La carga de inóculo de cada patógeno aplicado por planta, se ajustó a una concentración de 4×105 UFC usando un hemacitómetro (Marienfeld®). La inoculación de los patógenos se realizó tres días después del trasplante. El producto biológico a base de B. subtilis se aplicó dos veces en las plántulas de calabacita, la primera al trasplante y la segunda seis días después del trasplante, depositando en ambos casos 5 mL de la suspensión al cuello de la plántula. El tratamiento químico preventivo se aplicó al momento del trasplante y el curativo a 72 h después de la inoculación de los patógenos depositando 5 mL de la solución al cuello de la plántula. Para determinar la efectividad de los tratamientos sobre la enfermedad, la incidencia del ahogamiento en las plántulas de calabacita se registró cada 24 h, a partir del momento de la inoculación de los patógenos. El análisis estadístico incluyó las evaluaciones a los tres, seis, nueve y 12 días. La unidad experimental constó de 100 plántulas, los datos obtenidos se analizaron con base al modelo de un diseño de bloques completos al azar, con cuatro repeticiones por tratamiento. Los datos se sometieron a un análisis de varianza y comparación múltiple de medias mediante el método de la diferencia significativa honesta de Tukey, a un nivel de significancia del 5%, usando el software estadístico SAS® Systems for Windows V 9.4. La evaluación de la fitotoxicidad de los tratamientos se realizó usando la escala porcentual propuesta por la European Weed Research Society (https://www.ewrs.org/). Con el propósito de corroborar la presencia de los patógenos inoculados en las plantas enfermas, se hicieron reaislamientos en medio de cultivo PDA. Al final del experimento, las plantas que sobrevivieron se mantuvieron en observación por 14 días más.
Cuadro 1 Tratamientos evaluados para el control del ahogamiento de plántulas de ca labacita (Cucurbita pepo) bajo condiciones de invernadero.
| Tratamiento | Concentración | Inóculoz |
|---|---|---|
| Testigo inoculado | Sin tratamiento | Inoculado |
| B. subtilisy | 2×107 UFC mL-1 | Inoculado |
| B. subtilisy | 4×107 UFC mL-1 | Inoculado |
| B. subtilisy | 6×107 UFC mL-1 | Inoculado |
| Metil tiofanato + Propamocarb clorhidrato (P) | 105 ppm + 868 ppm | Inoculado |
| Metil tiofanato + Propamocarb clorhidrato (C) | 105 ppm + 868 ppm | Inoculado |
| Testigo absoluto | Sin tratamiento | Sin inoculación |
y Cepa QST 713 = Serenade ASO®. z F. oxysporum + P. capsici + R. solani aplicando 4×105 UFC de cada uno por planta. P: tratamiento preventivo. C: tratamiento curativo.
Se obtuvieron 100 aislamientos a partir de las plántulas de calabacita con síntomas de ahogamiento recolectadas en Cuautla, Morelos, donde se identificaron a Phytophthora capsici, Rhizoctonia solani y Fusarium oxysporum (Figura 1) en 62, 26 y 12%, respectivamente. Las pruebas de patogenicidad demostraron que los organismos aislados eran patogénicos. Las plantas inoculadas con P. capsici mostraron síntomas de ahogamiento cuatro días después de la inoculación, mientras que las plantas inoculadas de forma independiente con F. oxysporum y R. solani desarrollaron síntomas de la enfermedad a los seis días después de la inoculación. En la presente investigación, los síntomas se presentaron antes con respecto a lo observado por Chehri et al. (2010) quienes observaron síntomas de ahogamiento siete días después de la inoculación de P. capsici y F. oxysporum en cucurbitáceas. Los medios de cultivo SNA, PDA y Jugo V8-Agar permitieron el incremento de inóculo de F. oxysporum, R. solani y P. capsici respectivamente. La bacteria B. subtilis cepa QST 713 (Serenade ASO®) colonizó la caja de Petri 48 h después de la siembra incubándola a 36 °C, demostrándose así la viabilidad del producto comercial. Los síntomas iniciales de ahogamiento en las plantas de calabacita se observaron a las 72 h después de la inoculación. El síndrome concuerda con lo descrito por Koike et al. (2007).
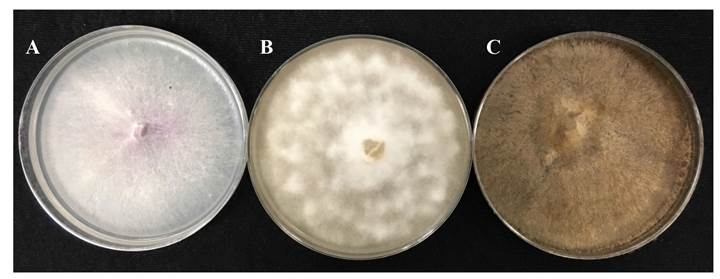
Figura 1 Colonias de Fusarium oxysporum en medio de cultivo SNA (A), Phytophthora capsici en V8 Agar (B) y Rhizoctonia solani en medio PDA (C) aisladas de plántulas de calabacita (Cucurbita pepo) con síntomas de ahogamiento. As pecto de las colonias 12 días después de la siembra en medios selectivos.
La incidencia de la enfermedad presentó una relación directamente proporcional respecto al tiempo trascurrido después de la inoculación. A los 12 días después de la inoculación de los patógenos en las plantas testigo alcanzaron un 100% de incidencia de la enfermedad, mientras que las plantas del testigo absoluto permanecieron sanas. La incidencia promedio de la enfermedad en los tratamientos evaluados se presenta en el Cuadro 2. A los tres días después de la inoculación (ddi) (primera evaluación), el testigo inoculado con el tratamiento metil tiofanato + propamocarb clorhidrato (preventivo) y los tratamientos de B. subtilis 2×107 y 4×107 UFC mL-1 presentaron una incidencia de la enfermedad de 2 y 2.5% respectivamente, siendo estadísticamente diferentes respecto al resto de los tratamientos evaluados, los cuales se mantuvieron sanos. En la segunda evaluación (seis ddi), el testigo inoculado alcanzó una incidencia promedio de 60%, mientras que los tratamientos a base de B. subtilis 2×107 y 4×107 UFC mL-1 presentaron una incidencia de la enfermedad de 31.8 y 33.8% correspondientemente. Los tratamientos de B. subtilis 6×107 UFC mL-1 y el metil tiofanato + propamocarb clorhidrato (curativo) fueron estadísticamente iguales, mientras el metil tiofanato + propamocarb clorhidrato (preventivo) y el testigo absoluto fueron estadísticamente iguales, con 0% de incidencia de la enfermedad. En la tercera evaluación (nueve ddi), la tendencia anterior se mantuvo solo con un incremento en los porcentajes de incidencia de la enfermedad. El testigo inoculado alcanzó una incidencia promedio de 75%, mientras que los tratamientos de B. subtilis 2×107 y 4×107 UFC mL-1 presentaron una incidencia de la enfermedad de 33.8 y 38.8%, respectivamente. Los tratamientos de B. subtilis 6×107 UFC mL-1 y el metil tiofanato + propamocarb clorhidrato (curativo) fueron estadísticamente iguales, mientras el metil tiofanato + propamocarb clorhidrato (preventivo) y el testigo absoluto también fueron estadísticamente iguales, con 0% de incidencia de la enfermedad. Finalmente, en la cuarta evaluación (12 ddi), el testigo inoculado alcanzó una incidencia promedio de 100%, mientras que el tratamiento B. subtilis 2×107 UFC mL-1 la incidencia se incrementó a 41.3% y en el tratamiento B. subtilis 4×107 UFC mL-1 la incidencia se incrementó a 38.8%; sin embargo, ambos tratamientos (2×107 y 4×107 UFC mL-1) fueron estadísticamente iguales. En los tratamientos B. subtilis 6×107 UFC mL-1 y el metil tiofanato + propamocarb clorhidrato (curativo) presentaron un incremento del 2% en la incidencia de la enfermedad respecto a lo registrado en la tercera evaluación siendo estadísticamente iguales. Por último, las plantas tratadas con metil tiofanato + propamocarb clorhidrato (preventivo) se mantuvieron sanas, es decir, con 0% de incidencia de la enfermedad.
Cuadro 2 Eficiencia de B. subtilis en la incidencia del ahogamiento (F. oxysporum, P. capsici y R. solani) de plántulas de calabacita (Cucurbita pepo) bajo condi ciones de invernadero.
| Tratamiento | Incidencia promedio de plántulas de calabacita (%) | |||
|---|---|---|---|---|
| 3 ddi | 6 ddi | 9 ddi | 12 ddi | |
| Testigo inoculado | 2.5a | 60.0a | 75.0a | 100.0a |
| B. subtilis 2×107 UFC mL-1 | 2.5a | 33.8b | 38.8b | 41.3b |
| B. subtilis 4×107 UFC mL-1 | 2.0a | 31.3b | 33.8b | 38.8c |
| B. subtilis 6×107 UFC mL-1 | 0.0b | 14.8c | 16.8c | 18.3d |
| Metil tiofanato + Propamocarb clorhidrato (P) | 0.0b | 0.0d | 0.0d | 0.0e |
| Metil tiofanato + Propamocarb clorhidrato (C) | 2.5a | 12.0c | 14.8c | 16.3d |
| Testigo absoluto | 0.0b | 0.0d | 0.0d | 0.0e |
| DMS (5%): | 1.3 | 5.5 | 5.8 | 2.37 |
| CV: | 43.5 | 10.9 | 9.8 | 3.31 |
Los valores medios seguidos por las mismas letras dentro de la misma columna son esta dísticamente iguales (P≤0.05), según el método de la diferencia significativa honesta de Tukey. ddi: días después de la inoculación. P: tratamiento preventivo. C: tratamiento curativo.
Los resultados obtenidos en la presente investigación sobre la efectividad de B. subtilis corresponden a lo reportado por otros investigadores. Se ha demostrado consistentemente que B. subtilis es eficiente para el control de F. oxysporum (Mejía-Bautista et al., 2016), Fusarium sp. (Illa et al., 2020), P. capsici (Khalaf y Raizada, 2018) y R. solani (Brewer y Larkin, 2005) en diferentes hospedantes, incluyendo cucurbitáceas. De igual forma, los resultados obtenidos con la aplicación de metil tiofanato, concuerdan con los resultados de investigaciones previas que documentan la efectividad de este fungicida metil benzimidazol carbamato para el control de F. oxysporum en varios hospedantes (Nel et al., 2007; Tarekegn et al., 2007). Asimismo, el metil tiofanato reduce efectivamente la infección por R. solani en diferentes hospedantes (Hancock, 1993; Kumar et al., 2003; Olaya et al., 1994). El propamocarb clorhidrato es un ingrediente activo ampliamente usado para el control de oomicetes, incluyendo Phytophthora spp. en cucurbitáceas (Deadman et al., 2002).
Posterior a los 12 días de la evaluación del experimento, no se observó incremento en el porcentaje de plantas enfermas en los tratamientos. Ninguno de los tratamientos evaluados causó fitotoxicidad en las plántulas de calabacita. En el reaislamiento de hongos fitopatógenos recuperados de las plántulas del testigo inoculado se obtuvo una frecuencia de 50, 35 y 15% para P. capsici, R. solani y F. oxysporum, datos que coincidieron en frecuencia de las plántulas colectadas en campo. Lo anterior sugiere que los síntomas de ahogamiento observados en la inoculación combinada se deben principalmente a la infección por P. capsici. Los síntomas iniciales, causados por la inoculación combinada, se presentaron en un periodo más corto que lo observado en la inoculación individual de los patógenos (Fernández-Herrera et al., 2007), lo que indica que la inoculación conjunta de F. oxysporum, P. capsici y R. solani fue más agresiva, presentando un periodo de incubación de solo 72 h. En el presente estudio, se observó de manera cualitativa un mayor desarrollo radical de las plantas tratadas con B. subtilis. Aun cuando ninguno de los tratamientos a base de B. subtilis protegieron completamente a las plántulas de calabacita de la infección conjunta de F. oxysporum, P. capsici y R. solani, se observó la siguiente tendencia: a mayor concentración de la bacteria, se registró una menor incidencia de la enfermedad. El tratamiento con B. subtilis a 6×107 UFC mL-1, fue estadísticamente igual que el tratamiento químico curativo, lo que demuestra la factibilidad de su uso en el manejo biológico de la enfermedad. En el caso del tratamiento químico preventivo fue estadísticamente igual que el testigo absoluto, corroborándose así la efectividad del control químico. No obstante, dentro de la tendencia actual en la reducción del uso de moléculas sintéticas en la producción agrícola, el uso preventivo de productos biológicos es la respuesta ecológicamente viable para el manejo de la enfermedad. En estudios posteriores se sugiere evaluar concentraciones más altas de B. subtilis.
Los productos evaluados contribuyeron consistentemente a disminuir la incidencia de la muerte de plántulas de calabacita. El producto biológico a base de B. subtilis a una concentración de 6×107 UFC mL-1 protegió más del 80% de las plántulas de calabacita inoculadas con F. oxysporum, P. capsici y R. solani, teniendo una efectividad estadísticamente igual al tratamiento curativo de metil tiofanato + propamocarb clorhidrato. Mientras que el tratamiento preventivo de metil tiofanato + propamocarb clorhidrato protegió al 100% de las plántulas de la inoculación de los tres patógenos.











 texto en
texto en 


