En Colombia se cultivan diferentes variedades de mango (Mangifera indica) con una producción de 321,083 t en 28,000 ha, para el consumo en fresco y el procesamiento agroindustrial (MINAGRICULTURA, 2018). Este cultivo es importante en el aporte de la economía campesina ya que es típicamente minifundista (Alvarado y Moreno, 2012) y tiene características de baja tecnificación y asistencia técnica. Así mismo, se cultiva en predios manejados con buenas prácticas de acuerdo con la experiencia y capacidad económica de inversión de los productores (Asmar, 2021). El mango cv. Azúcar es una variedad colombiana que se caracteriza por ser un fruto ovalado y pequeño, de escasa fibra, buen aroma y sabor; presenta, especialmente en la pulpa madura, un contenido importante en fenoles totales y carotenoides, que le confieren potencial antioxidante, así como compuestos activos y nutricionales benéficos para la salud y es considerado como un fruto muy rentable porque presenta el mejor precio comparado con otras variedades durante 10 meses del año (Corrales-Bernal et al., 2014).
Consecuentemente, se hace necesario continuar trabajando en la implementación de tecnologías en pre y poscosecha que permitan obtener frutos de calidad fitosanitaria y organoléptica para posicionar el mango Azúcar en los mercados internos y externos. Esto lo han realizado durante los últimos tres años, productores que tienen predios cultivados con mango Azúcar ubicados en el departamento del Magdalena, en donde se han incrementado las exportaciones entre 2018 y 2020, con un crecimiento anual del 33% (Asmar, 2021).
Sin embargo, una de las principales limitantes en su producción y poscosecha es la antracnosis, enfermedad causada por Colletotrichum gloeosporioides, la cual es la más importante en la producción de mango en el mundo (Kamle y Kumar, 2016). En campo, el hongo produce infecciones quiescentes en frutos inmaduros, las cuales se desarrollan durante la poscosecha a causa del ambiente y maduración del fruto, provocando pérdidas que pueden superar el 50% (Arauz, 2000; Prusky et al., 2013; Kamle y Kumar, 2016). Su control se realiza principalmente con fungicidas sistémicos; aunque son eficientes, presentan efectos negativos como la residualidad o la generación resistencia en el hongo, siendo su uso cada vez menos aceptados por los países importadores, ya que su toxicidad es potencialmente nociva para el consumidor (Bautista-Rosales et al., 2014; Chechi et al., 2019).
De acuerdo con esto, el uso de alternativas de control inocuas y eficientes se plantea como una necesidad. El control biológico es una estrategia que involucra el uso de microorganismos como levaduras y bacterias, las cuales se caracterizan por tener rápido crecimiento sobre la superficie vegetal, con la producción de metabolitos que inhiben el crecimiento de fitopatógenos y por tolerar, en el caso de algunas cepas, condiciones extremas como bajas temperaturas, baja actividad de agua (aw) y presencia de fungicidas (Lastochkina et al., 2019; Liu et al., 2013). De igual manera se plantea la aplicación de biopolímeros como la quitina al fruto, ya que su carácter catiónico presenta actividad antifúngica mediada por la interacción de sus grupos amino libres (cargados positivamente en medio ácido), modificando la permeabilidad de la membrana plasmática, alterando su función, o formando películas en el fruto que cambian la atmósfera interna favoreciendo su conservación (Ban et al., 2015; Bautista-Baños et al., 2006
Algunos estudios han mostrado la eficacia de alternativas para el manejo de enfermedades poscosecha como tratamientos físicos en frutas y en vegetales (Usall et al., 2016) dentro de los cuales se encuentra la hidroterapia, realizada por inmersión, enjuague o cepillado; en la inmersión se aplican temperaturas entre 43 °C y 53 °C por periodos que van de minutos hasta 2 horas de acuerdo con la especie de la fruta y estado de madurez, en tanto que el enjuague y cepillado son empleados de 10 a 25 segundos a temperaturas entre 43 °C y 53 °C (Fallik, 2004). El tratamiento por inmersión es el más reportado y puede llegar a estimular respuestas de defensa contra la antracnosis en frutos sin afectar negativamente su calidad sensorial y física (Vilaplana et al., 2018), siendo efectivo contra otros patógenos en poscosecha como Botrytis cinerea y Alternaria alternata (Fallik et al., 1996).
Se ha observado que el uso combinado de diferentes alternativas puede aumentar el efecto de las alternativas individuales (Perez et al., 2016). El éxito del uso de las alternativas combinadas radica sus diferentes modos de acción, por ejemplo, los tratamientos físicos actúan sobre las superficies sellando o curando aberturas y como desinfectantes de superficies limitando los sitios de infección del patógeno, mientras que la aplicación posterior de antagonistas o compuestos bioactivos provee una acción protectora persistente a través de la restricción de infecciones secundarias (Zhang et al., 2017).
Teniendo en cuenta el potencial de uso de estas alternativas en el control de Colletotrichum gloeosporioides durante la poscosecha de mango Azúcar en Colombia, el objetivo de este estudio fue determinar la eficacia mediante el uso de antagonistas microbianos, un tratamiento hidrotérmico a 53 °C y quitina en diferentes concentraciones, así como la combinación de los mejores tratamientos.
Materiales y métodos
Este trabajo se realizó en el Laboratorio de Microbiología Agrícola del Centro de Investigación Tibaitatá de la Corporación Colombiana de Investigación Agropecuaria AGROSAVIA.
Material vegetal y patógeno. Se utilizaron frutos de mango variedad Azúcar (susceptible a la antracnosis) en etapa de madurez fisiológica (ligeramente verde con tonalidad amarilla rosada y pulpa amarilla), asintomáticos a cualquier patología, con un tamaño entre 8 a 10 cm y peso promedio de 100 g, provenientes de un cultivo comercial del municipio de Ciénaga (departamento del Magdalena, Colombia). Para reducir la expresión de infecciones quiescentes del patógeno, la fruta se sometió a un tratamiento hidrotérmico a 53 °C por 5 minutos (baño termostatado Memmert WNB 14) y atemperando por inmersión en agua a 17 °C por 10 min, posteriormente con una aguja de disección estéril se realizaron dos heridas de 2 mm de profundidad en una de las caras del fruto, separadas 5 cm entre sí (basado y modificado de la metodología de Trinidad-Angel et al, (2017)).
Para seleccionar el patógeno se evaluaron tres aislamientos (Y1, Y2, Y3), seleccionando Y3 (C. gloeosporioides), proveniente de frutos de mango variedad Yulima, identificado por su morfología y seleccionado por su patogenicidad al realizar los postulados de Koch (datos no mostrados). Su inoculo se obtuvo a partir de conidios colectados de cultivos en Agar Papa Dextrosa (PDA, Oxoid®) incubados a 25 °C durante 10 días, a partir de los cuales se realizó una suspensión de 1x105 conidios mL-1 en agua destilada estéril.
Eficacia de microorganismos antagonistas en el control de la antracnosis. El Banco de Germoplasma de Microorganismos de AGROSAVIA proporcionó los microorganismos antagonistas que en estudios previos se caracterizaron y mostraron control sobre diferentes patógenos (Zapata y Cotes, 2013; Díaz-García et al., 2015), los cuales correspondieron a las bacterias Bacillus amyloliquefaciens Bs006 (Gámez et al., 2015), Bacillus safensis AP280 y Lysinibacillus xylaniticus AP282; y las levaduras Candida oleophila Lv037, Pichia onychis Lv297 y Rhodotorula glutinis Lv316 (Moreno et al., 2012; Zapata et al., 2011). Para su crecimiento, las bacterias fueron cultivadas en caldo Luria Bertani (LB, Oxoid®) y las levaduras en caldo extracto de malta y levadura (YM, Oxoid®) a 125 rpm, 28 °C durante 48 y 72 horas respectivamente. Para el inóculo se realizaron suspensiones en agua destilada estéril a concentraciones de 1x108 células mL-1 para las bacterias y 1x107 células mL-1 para las levaduras. La fruta se inoculó mediante inmersión en las suspensiones de cada microorganismo durante 10 min; posteriormente se secaron a 18 °C y sobre las heridas se inoculó una gota de 5 μL del patógeno.
Eficacia de los aditivos quitinosos en el control de la antracnosis. Se empleó quitina (Sigma® C7170) en concentraciones de 0.5; 0.8; 10; 100 y 1000 mg L-1. Se realizó la inmersión de la fruta en la suspensión del aditivo en cada concentración definida por 10 min, se secaron a 18 °C y sobre las heridas se inoculó una gota de 5 μL del patógeno.
Eficacia de la combinación de alternativas en el control de la antracnosis en mangos inoculados con C. gloeosporioides. Se plantearon cuatro tratamientos para determinar la eficacia en el control de la antracnosis en mangos inoculados con C. gloeosporioides (Cuadro 1). Primero se realizó el tratamiento hidrotérmico, luego se realizaron las heridas en los frutos y se depositaron en las suspensiones de los microorganismos controladores o la concentración de quitina (10 mg L-1) durante 10 min, se secaron e inocularon con el patógeno a la concentración descrita previamente y se almacenaron en cámaras húmedas.
Eficacia en infecciones quiescentes de C. gloeosporioides: Se evaluaron los mismos tratamientos mencionados anteriormente (Cuadro 1) sobre infecciones quiescentes de C. gloeosporioides pero sin realizar inóculo del patógeno. Inicialmente se realizó el tratamiento hidrotérmico, posteriormente los frutos se dispusieron en las suspensiones de los microorganismos controladores durante 10 minutos; para el tratamiento que contenía quitina esta se agregó durante el tratamiento hidrotérmico; posteriormente se dejaron secar y se almacenaron en cámaras húmedas.
Cuadro 1 Combinación de tratamientos evaluados para el control de la antracnosis a partir de la ino culación de C. gloeosporioides Y3 en frutos de mango cv. Azúcar.
| Tratamiento |
|---|
| Control: 53 °C 5 min |
| 53 °C 5 min + AP282 |
| 53 °C 5 min + Lv316 |
| 53 °C 5 min + Quitina 10 mg L-1 |
| 53 °C 5 min + Quitina 10 mg L-1 |
Para los tratamientos donde se determinó la eficacia de los microorganismos y las diferentes concentraciones de los sustratos quitinosos, los frutos se dispusieron en cámaras húmedas (Humedad relativa (HR) del 90%) almacenándolas a 23 °C durante siete días, condiciones óptimas para el patógeno y severas para la selección de las alternativas; por otra parte, los frutos correspondientes a la combinación de alternativas se almacenaron en cámaras húmedas a 13 °C durante 19 días como una aproximación al almacenamiento de la fruta.
Variables evaluadas. Como variable respuesta se calculó la eficacia en el control de la enfermedad, aplicando la fórmula de Schneider-Orelli: Porcentaje de eficacia = ((b - k) / (100 - k)) * 100, donde b= área bajo la curva de la enfermedad (AUDPC) en el tratamiento de acuerdo con el diámetro de la lesión en los frutos y k= AUDPC en el control patógeno (Koller et al., 2016). Se tomó en cuenta la distribución irregular de las lesiones de la enfermedad, por lo que en las infecciones quiescentes se empleó la escala de severidad de la enfermedad de Brodrick (1978, citado por Corkidi et al., 2006) (Cuadro 2, Figura 1).
Cuadro 2 Escala para la evaluación de severidad de an tracnosis causada por C. gloesosporioides en mango cv. Azúcar. Valores en porcentaje de área del fruto con síntomas.
| Nivel | Área afectada |
|---|---|
| 0 | 0 % |
| 1 | 1-5 % |
| 2 | 6-9 % |
| 3 | 10-49 % |
| 4 | 50-100 % |
Diseño experimental y análisis de datos. Los bioensayos se establecieron bajo un diseño de bloques completamente al azar, la unidad experimental consistió en tres frutos, con tres repeticiones y dos réplicas, contando con un control sin tratar y un control patógeno. Se realizó un análisis de varianza y una prueba de comparación de medias de Tukey (p≤0.05), empleando el software estadístico Statistix 10.0.
Resultados
Eficacia de microorganismos antagonistas en el control de la antracnosis. Se observó una diferencia en el desempeño de los microorganismos entre las dos réplicas realizadas en tiempos diferentes, pudiendo estar influenciado por la incidencia de las infecciones quiescentes; sin embargo, para la réplica uno en los tratamientos AP282, Bs006 y Lv316 se observó la mayor eficacia en el control de la enfermedad con valores entre el 62% y 65%, mientras que en la réplica dos la mayor eficacia se obtuvo con AP282 (49%) siendo además el tratamiento más consistente de acuerdo con la réplica uno (Figura 2).
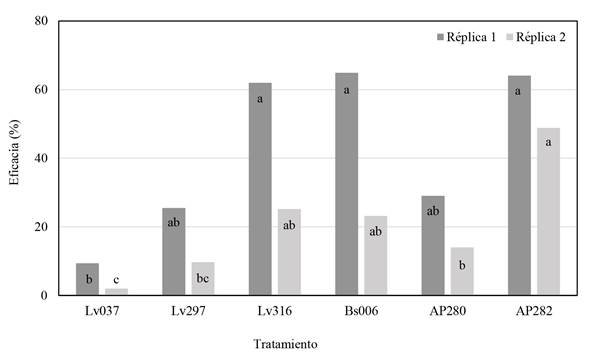
Figura 2 Eficacia de los antagonistas microbianos en la reducción de la antracnosis en frutos de mango cv. Azúcar inocula dos con C. gloeosporioides Y3 después de siete días de almacenamiento a 23 °C. Columnas con la misma letra no son significativamente diferentes de acuerdo con la prueba de Tukey (*= P>0.05).
Eficacia de los aditivos quitinosos en el control de la antracnosis. Las diferentes concentraciones de quitina evaluadas presentaron algún porcentaje de control; sin embargo, la concentración de 10 mg L-1 con una eficacia del 42% en la réplica uno y 49% en réplica dos presentó la mayor protección frente al crecimiento de C. gloeosporioides, siendo además el tratamiento más consistente (Figura 3).
Eficacia de la combinación de alternativas en el control de la antracnosis en mangos inoculados con C. gloeosporioides. Todos los tratamientos mostraron algún nivel de control sobre el desarrollo de la enfermedad en los mangos inoculados con C. gloeosporioides; sin embargo, la combinación del tratamiento hidrotérmico y el temperado de los frutos en la suspensión de L. xylaniticus AP282 presentó el mayor control con una eficacia del 84%, en tanto que al evaluar únicamente el tratamiento hidrotérmico se obtuvo el menor desempeño con un 19% de eficacia (Figura 4).

Figura 3 Eficacia de la quitina en diferentes concentraciones sobre la reducción de la antracnosis en frutos de mango cv. Azúcar inoculados con C. gloeosporioides Y3 después de siete días de almacenamiento a 23 °C. Columnas con la misma letra no son significativamente diferentes de acuerdo con la prueba de Tukey (*= P>0.05).
Eficacia de la combinación de alternativas en el control de la antracnosis a partir de infecciones quiescentes de C. gloeosporioides. Con respecto a la reducción en la expresión de las infecciones quiescentes, se observó que al combinar el tratamiento hidrotérmico con la adición de quitina o el posterior temperado de los frutos en las suspensiones de L. xylaniticus AP282 o R. glutinis Lv316, se redujo la incidencia de las infecciones con mayor eficacia en el control de la enfermedad en comparación con solo el tratamiento hidrotérmico, y aunque estos tratamientos superaron el 80% de eficacia fue la combinación de la hidroterapia y la inmersión en la Lv316 con un 89% el más destacado (Figuras 5 y 6).
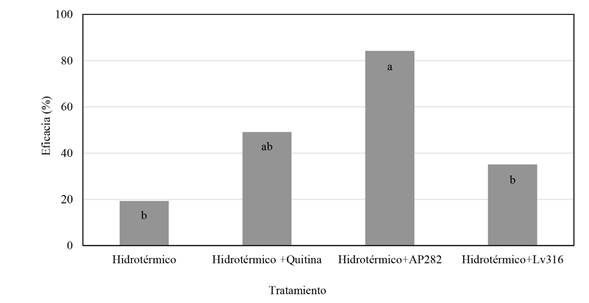
Figura 4 Eficacia de la combinación de tratamientos en la reducción de la antracnosis en frutos de mango cv. Azúcar ino culados con C. gloeosporioides Y3 después de 15 días de almacenamiento a 13 °C. Columnas con la misma letra no son significativamente diferentes de acuerdo con la prueba de Tukey (*= P>0.05).

Figura 5 Eficacia de la combinación de tratamientos en la reducción de la antracnosis a partir de infecciones quiescentes de C. gloeosporioides en frutos de mango cv. Azúcar después de 19 días de almacenamiento a 13 °C. Columnas con la misma letra no son significativamente diferentes de acuerdo con la prueba de Tukey (*= P>0.05).

Figura 6 Síntomas de antracnosis en frutos de mango cv. Azúcar tratados con la combinación de tratamientos en almacena miento a 13 °C. Superior: Frutos inoculados con C. gloeosporioides Y3 después de 15 días de almacenamiento. Infe rior: Infecciones quiescentes de C. gloeosporioides en los frutos tratados después de 19 días de almacenamiento.
Discusión
Lysinibacillus xylaniticus AP282, R. glutinis Lv316 y quitina (10 mg L-1) mostraron control de la antracnosis en los frutos inoculados con el patógeno en condiciones de almacenamiento que favorecían su desarrollo (HR del 90% a 23 °C) y posteriormente, al evaluarse en una condición más cercana al almacenamiento comercial (13 °C) mantuvieron o aumentaron su protección y redujeron además la expresión de infecciones quiescentes. Mientras que la aplicación única del tratamiento hidrotérmico mostró una eficacia del 19%, pero al combinarse con el temperado en la suspensión de los antagonistas o la adición de quitina, la eficacia aumentó, particularmente en el caso de las infecciones quiescentes.
En este sentido, el desarrollo de C. gloeosporioides puede limitarse por la ausencia de nutrientes como nitrógeno orgánico y microelementos como hierro, necesarios para la germinación de los conidios y posteriores procesos de infección de tejidos, de igual forma por la exposición a metabolitos producidos por microorganismos antagonistas que puedan tener acción sobre el desarrollo del patógeno a partir de las infecciones quiescentes (Liu et al., 2013).
Bacterias y levaduras presentan mecanismos de acción que pueden inhibir el desarrollo de diferentes patógenos, siendo estos la competencia por espacio y nutrientes, la producción de antibióticos, sideróforos, el parasitismo y la inducción de respuestas de defensa en las plantas (Rungjindamai, 2016). Aunque se conoce muy poco de los mecanismos de acción de L. xylaniticus, se sabe que otras especies de este género, como Lysinibacillus sphaericus ZA9 tienen la capacidad de inhibir in vitro el crecimiento de Aspergillussp., A. alternata, Bipolaris spicifera, Curvularia lunata y Sclerotiniasp., mediante la secreción de sideróforos, ácido cianhídrico (HCN), quitinasas, proteasas y lipasas, compuestos tipo clicloalcano y quinolina (Naureen et al., 2017). Sin embargo, para tener claridad con respecto a cómo L. xylaniticus AP282 ejerce control sobre C. gloeosporioides Y3 es necesario determinar sus mecanismos de acción.
De otra parte, R. glutinis puede competir por espacio y nutrientes con diferentes patógenos, estudios han demostrado la capacidad de esta levadura para colonizar heridas en frutos de fresa y peras, observando una rápida colonización de heridas y control sobre B. cinerea a 20 °C sin afectar parámetros de calidad como pérdida de masa, firmeza y acidez (Zhang et al., 2008, 2010). Adicionalmente, R. glutinis produce ácido rodotorúlico, sideróforo que quela el hierro presente en el sustrato ofreciéndole una ventaja competitiva (Calvente et al., 1999). Para R. glutinis Lv316, en estudios desarrollados por Zapata y Cotes, (2013) se obtuvo un control del 60% para B. cinerea en cultivos comerciales de mora, superior al obtenido con aplicaciones de Procloraz (58%) y Carbendazim (27%), relacionándose con la reducción de las infecciones quiescente en las flores.
En cuanto a la quitina por su carácter catiónico presenta actividad antifúngica mediada por la interacción de sus grupos amino libres (cargados positivamente en medio ácido) con los residuos negativos de las moléculas en la pared de los hongos, modificando la permeabilidad en la membrana plasmática provocando homeostasia iónica de K+y Ca2+causando la pérdida de pequeñas moléculas como fosfatos, nucleótidos y sustrato de reacciones enzimáticas que eventualmente afectan el metabolismo fúngico (Ban et al., 2015; Bautista-Baños et al., 2006). Lucas-Bautista et al. (2019), encontraron mayor contenido de quitinasas en cáscaras maduras de papaya liofilizadas (29.000 unidades de quitinasa (UQ) g-1) a las contenidas en cáscaras maduras congeladas (1.500 UQ g-1), además de determinar que la quitina contenida en C. gloeosporioides como patógeno presente en la poscosecha de papaya puede tener hasta un 20.6%.
Si bien los tratamientos hidrotérmicos tienden a sellar o curar las heridas limitando los sitios de penetración para los patógenos (Schirra et al., 2000), mediante la adición de quitina (10 mg L-1) o el temperado de la fruta en las suspensiones de L. xylaniticus AP282 o R. glutinis Lv316 se puede reducir las infecciones secundarias potencializando el control; sin embargo, es necesario desarrollar estudios tendientes a desarrollar bioplaguicidas con base en los microorganismos seleccionados, los cuales permitan su implementación a escala comercial, por otra parte, teniendo en cuenta la eficiencia de la quitina, es necesario contar con un sustituto comercial considerando que en este trabajo se utilizó quitina grado reactivo.
La inoculación de microorganismos antagonistas durante el temperado posterior al tratamiento hidrotérmico ha mostrado un alto potencial en la reducción de daños por patógenos en poscosecha, Karabulut y Baykal (2004) observaron que la incidencia de B. cinereayPenicillium expansum en melocotones disminuía al someterse a un tratamiento hidrotérmico a 55 °C por 10 segundos y posterior inoculación con C. oleophila. De otra parte, es posible que con la aplicación conjunta de los antagonistas se pueda potenciar aún más el control, tal como lo demostraron Carrillo-Fasio et al., (2005) quienes evaluaron aislamientos del género Bacillus y Rhodotorula solos y en combinación, encontrando un mayor control sobre antracnosis en frutos de mango Kent al aplicar la mezcla de biocontroladores.
En este sentido, el control de las infecciones quiescentes mediante el tratamiento hidrotérmico con adición de quitina a 10 mg L-1 o el posterior temperado de la fruta en la suspensión de R. glutinis Lv316 o L. xylaniticus AP282 puede ser una estrategia para tratar el mango Azúcar inmediatamente después de su cosecha, permitiendo el establecimiento de los microorganismos en la fruta para aumentar su capacidad protectora durante el almacenamiento.
Conclusiones
La combinación del tratamiento hidrotérmico a 53 °C por 5 minutos con adición de quitina a 10 mg L-1 o el posterior temperado de los mangos en las suspensiones de R. glutinis Lv316 o L. xylaniticus AP282 presentó una eficacia del 83 al 89% en el control de la antracnosis originada partir de las infecciones quiescentes de C. gloeosporioides, alternativas que pueden considerarse en el tratamiento poscosecha del mango cv. Azúcar.











 texto en
texto en 



