La diversidad genética de los diferentes tipos de chiles en México es poco estudiada, encontrando que gran variedad de estos son nativos, como los denominados Poblanos (Toledo-Aguilar et al., 2016). En el año 2018, el chile Poblano (Capsicum annuum) presentó un área de siembra de aproximadamente 17,729.80 ha, con una producción de 391,133.26 t dejando una derrama económica de $ 3’038,997.37 millones de pesos (SIAP, 2020). El chile poblano tiene gran importancia gastronómica, económica y social por ser un ingrediente básico de platillos tradicionales e influencia culinaria de otros alimentos en el mundo, representando uno de los ejes de desarrollo o aglutinadores de empleo e ingreso en las regiones (Rodríguez et al., 2007; Pérez-Carrasco et al., 2017).
En la comunidad de Santa María Tecomavaca, en el estado de Oaxaca, México, se cultiva el chile Miahuateco, que es una variedad de chile Poblano y actualmente la producción en la región se ve comprometida por la presencia de enfermedades fungosas. El género Capsicum presenta mayor incidencia fungosa en la etapa de plántula, estas enfermedades son causadas por patógenos como Phytophthora sp., Rhizoctonia sp. y Fusarium spp., que provocan la pérdida de más de un tercio de la producción del cultivo. El principal síntoma es la muerte prematura de las plantas, al causar la obstrucción y desequilibrio del funcionamiento de los haces vasculares, además de presentar defoliación, cambios de color, rizado del follaje, daño a estructuras reproductivas, maduración adelantada e irregular pudrición de la raíz y necrosis en el tallo (Rivera-Jiménez et al., 2018; Guenoun et al., 2019). Fusarium oxysporum y F. solani se han aislado de la pudrición de la corona y la base del tallo de plantas maduras de chile Poblano en vivero, además F. solani es el agente causal de marchitez y necrosis en raíz y tallo de chile Chilaca en Queréndaro, Michoacán, México (Rivera-Jiménez et al., 2018; Reyes-Tena et al., 2019).
Los productos de síntesis química se han empleado por décadas para el control de estas enfermedades (Gan y Wickings, 2017). Sin embargo, su uso está relacionado con la generación de resistencia en fitopatógenos, daños al ambiente y salud humana (Chen et al., 2014; Andrade-Hoyos et al., 2019). Ante esta situación, el control biológico se considera una práctica eficiente y ecológicamente viable para el desarrollo de una agricultura sostenible (Pérez-Torres et al., 2018).
El género Trichoderma contiene a las especies antagonistas más relevantes para el biocontrol de hongos fitopatógenos, utilizado principalmente por productores orgánicos y de buenas prácticas agrícolas para el manejo de enfermedades y potenciador de compost (Romero-Arenas et al., 2017; Launio et al., 2020). El éxito y uso en la práctica agrícola, se debe a sus mecanismos de acción como la competencia por espacio, micoparasitismo, antibiosis (Nawrocka et al., 2018) y la producción de compuestos volátiles (Hernández-Melchor et al., 2019). En trabajos previos, T. harzianum T-H4 presentó el mayor porcentaje de inhibición (78.3%) contra Phytophthora cinnamomi que T. koningiopsis T-K11 in vitro (Andrade-Hoyos et al., 2020). Así mismo la cepa T-H4 presentó 63.6% de PICR y clase III de la escala de Bell contra Fusarium sp. (Morales et al., 2020). En consecuencia, el objetivo de este trabajo de investigación fue: Evaluar la actividad antagónica de dos cepas de Trichoderma (T-H4 y T-K11), versus F. solani MX-MIC 798 en la germinación de semilla y vigor de plántulas de chile Miahuateco para la comunidad de Santa María Tecomavaca, Oaxaca, México.
Materiales y métodos
Antagonismo de T. harzianum y T. koningiopsis ante F. solani en cultivos duales. La evaluación del antagonismo se realizó con las cepas T-H4 de T. harzianum y T-K11 de T. koningiopsis, ambas aisladas de la raíz de Persea americana, cuyas secuencias se encuentran en la base de datos del National Center for Biological Information (NCBI) con el número de acceso MK779064.1 y MK791648.1, respectivamente. Así mismo, se utilizó la cepa MX-MIC 798 de F. solani con número de acceso MK532475, la cual fue donada por el Laboratorio de Patología Vegetal del Instituto de Investigaciones Agropecuarias y Forestales de la Universidad Michoacana. Todo el material biológico está resguardado en el laboratorio 204 del Eco-Campus Valsequillo del Instituto de Ciencias de la Benemérita Universidad Autónoma de Puebla (BUAP).
Para la evaluación del desarrollo micelial, se sembraron fragmentos de 5 mm de diámetro de F. solani (MX-MIC 798), T. harzianum (T-H4) y T. koningiopsis (T-K11) en cajas Petri con PDA (Agar de Papa y Dextrosa), cada uno por triplicado y se incubaron en condiciones de oscuridad a 28 °C por 10 días. Se midió el diámetro micelial cada 12 h para estimar la velocidad de crecimiento (cm), la cual se calculó con la función de crecimiento lineal y=mx + b (donde ‘y’ es la distancia, ‘x’ es el tiempo y ‘b’ el factor constante) y se expresó en centímetros por día (cm d-1) (Zeravakis et al., 2001). El diámetro del crecimiento milcelial se determinó con un vernier digital (CD-6 Mitutoyo) tomando la misma dirección por triplicado.
La técnica de cultivo dual se utilizó de acuerdo con Andrade-Hoyos et al. (2019) por triplicado para determinar el porcentaje de inhibición de crecimiento radial (PICR) para cada ensayo evaluado, por un lapso de 10 días con la fórmula PICR= [(R1-R2/R1) x 100]. Donde R1 es el diámetro del testigo (promedio del crecimiento radial de los triplicados de cada cepa) y R2: es el diámetro del organismo ensayado. Para complementar las evidencias del antagonismo, se comparó y clasificó cada ensayo con la escala establecida por Bell et al. (1982) (Cuadro 1).
Cuadro 1 Escala de antagonismos propuesta por Bell et al. (1982).
| Clase | Características |
|---|---|
| I | Crecimiento de Trichoderma spp., que cubrió toda la superficie del medio y redujo el crecimiento micelial del patógeno. |
| II | Crecimiento de Trichoderma spp., que cubrió al menos 2/3 partes del medio. |
| III | Trichoderma spp., y fitopatógeno crecieron 1/2 y 1/2 la superficie del medio, uno no se sobrepuso al otro. |
| IV | Hongo patógeno creció al menos 2/3 partes del medio y resistió a la invasión de Trichoderma spp. |
| V | Crecimiento del patógeno que cubrió toda la superficie del medio. |
Pruebas en vivero para analizar el porcentaje de germinación y podredumbre de plántulas. Se utilizaron semillas de chile Miahuateco, proporcionadas por productores de la comunidad de Santa María Tecomavaca en el estado de Oaxaca. El ensayo se llevó bajo condiciones controladas en el vivero del Eco-Campus Valsequillo, ICUAP-BUAP. Previo a la germinación de semillas; estas se desinfectaron con hipoclorito de sodio al 0.3% (v/v) durante 10 min, se enjuagaron tres veces con agua estéril y se secaron con papel estéril (Illa et al., 2019). La inoculación del patógeno F. solani se realizó en una suspensión salina estéril a una concentración de 1x108 conidios mL-1 por medio de una cámara de Neubauer (PAUL MARIENFELD), en 400 semillas para cada tratamiento en estudio; una vez impregnado el patógeno y secas las semillas, se procedió a inocular T. harzianum y T. koningiopsis. La inoculación se realizó a través de una suspensión de teliósporas a una concentración de 1x108 conidios mL-1 para dos tratamientos por separado, cada uno de ellos con 400 semillas (Reyes-Tena et al., 2019).
Una vez inoculados las semillas con los hongos, las semillas se colocaron en charolas germinadoras con Peatmoss y Agrolita (1:1 v/v), previamente esterilizado a 121 °C y 15 lb de presión (Mannai et al., 2018). Las semillas fueron sembradas mediante un procedimiento mecánico estandarizado; el sustrato húmedo se depositó a tres cuartas partes de la capacidad total de la cavidad, se colocó una semilla por cavidad a una profundidad de 1 cm (Castillo-Aguilar et al., 2015). Se utilizó Mancozeb 80® como tratamiento químico, donde se siguió las recomendaciones del productor para la producción de plántula (1 kg de semilla por 5 g de producto), además se utilizó un tratamiento control; el cual consistió en semillas desinfectadas en una solución estéril de agua destilada y sacarosa al 3%, sin presencia de actividad fúngica. Por último, se cubrieron las charolas con plástico negro por 10 días, y se mantuvo la temperatura entre 10 y 27 °C para la germinación (Castillo-Aguilar et al., 2015). Los porcentajes de germinación de semillas se calcularon de acuerdo con la siguiente fórmula: Germinación de semillas (%) = (número de semillas germinadas/número total de semillas) × 100 (Al-Fadhal et al., 2019). Los datos se tomaron en el momento que el tratamiento control presentó una germinación ≥ 90%.
Mortalidad e índice de severidad en plantas de 40 ddt. Se utilizaron 1,500 plántulas de chile Miahuateco de 15 días de emergencia proporcionadas por productores de la comunidad. El ensayo se llevó bajo condiciones a campo abierto en la comunidad de Santa María Tecomavaca, entre los paralelos 17° 51’ y 18° 03’ de latitud norte; los meridianos 96° 57’ y 97° 15’ de longitud oeste con una altitud entre 400 y 2 600 m. Los climas predominantes en la zona son seco cálido (40.5%) y semiseco cálido (17.5%) (INEGI, 2017). La preparación del terreno se realizó por productores de la comunidad tres meses antes del establecimiento del cultivo. Se llevó a cabo una labor de arado de 50 cm de profundidad para disminuir la compactación y favorecer el drenaje y dos volteos de 30 cm de profundidad para airear el suelo. La fecha de trasplante fue el 27 de marzo de 2018 a una profundidad de 3 cm. Se fertilizó con 90-80-80 de N, P y K a los 15 días (ddt). El diseño experimental fue bloques al azar con tres repeticiones, la densidad de población fue de seis plantas por m2. Durante el desarrollo del cultivo se realizaron riegos con intervalos de cinco a seis días, aplicados antes que la humedad del suelo alcanzara el 50% de la capacidad de campo (Vázquez-Casarrubias et al., 2011).
La inoculación de F. solani (MX-MIC 798) se realizó al cuello de cada una de las plantas de chile (100 plántulas por tratamiento distribuidas en cinco bloques al azar) con 1 mL de solución a una concentración de 1x108 conidios. Después de 36 h se procedió a inocular las plantas con cepas de Trichoderma (T-H4 y T-K11) a una misma concentración que del patógeno (1x108 conidios mL-1), por cada cepa, aplicado a la raíz para todos los tratamientos. Para el tratamiento químico, se aplicó Mancozeb 80® al tercer día, de acuerdo con las recomendaciones del proveedor (480 g 200 L-1 de agua por ha). El tratamiento control únicamente se aplicó agua estéril sin presencia de actividad fúngica. Las plantas se mantuvieron durante 40 días en campo. La severidad de la enfermedad se calculó en la porción infectada en relación con la longitud total de las raíces (Perveen et al., 2010) y clasificada en la escala de 0 a 3 donde, 0 = 0 a 25% de severidad, 1 = 26 a 50%, 2 = 51 a 75% y 3 = 76 a 100% (Bokhari y Perveen, 2013).
Finalmente, se realizó el re-aislamiento a la sexta semana en campo. Se tomaron secciones pequeñas (aprox. 1 × 1 cm) de raíz con síntomas de enfermedad, se esterilizaron con hipoclorito de sodio al 1% durante 30 s y se enjuagaron tres veces con agua destilada estéril, los segmentos fueron colocados en medio PDA, se incubaron bajo oscuridad a 28 °C por 10 días. Las colonias desarrolladas fueron purificadas por cultivos monospóricos o punta de hifa y se identificaron las estructuras con claves taxonómicas de Barnett y Hunter (1998) en un sistema de micro cultivo con un microscopio óptico (Carl Zeiss, Jena, Alemania) a 1000x magnificaciones (Samson et al., 2014) y se conservaron en una solución de glicerol al 20% a -84 °C (Morales et al., 2020).
Análisis estadístico. Los datos se analizaron con ANOVA (dos vías) en el paquete estadístico IBM SPSS Statistics versión 25. La velocidad de crecimiento y la tasa de desarrollo fueron las variables de respuestas con tres repeticiones y se validó por duplicado en un diseño estadístico completamente al azar. Se realizó una comparación de medias por el método de Tukey-Kramer con un nivel de probabilidad de p≤0.05. El PICR, el porcentaje de germinación, la mortalidad (%) y la severidad de enfermedad fueron expresados en porcentajes y transformados con arco-coseno angular √x+1. Posteriormente, se sometieron a un análisis de varianza (dos vías), al igual que las variables altura total, altura raíz y altura planta sin raíz; se utilizó la prueba de Tukey-Kramer para determinar las diferencias significativas entre los tratamientos con una significancia de p≤0.05. Así mismo, el PICR se compararon en base a la prueba t de student para muestras apareadas (p≤0.05) utilizando el mismo paquete estadístico.
Resultados y discusión
Evaluación del antagonismo de T. harzianum y T. koningiopsis ante F. solani en cultivo dual. Se presentaron zonas de interacción entre T. harzianum (TH-4) y T. koningiopsis (T-K11) frente a F. solani (MX-MIC 798), donde se observó un parasitismo a las 132 h. La tasa de desarrollo y la velocidad de crecimiento tuvieron diferencias significativas (p≤0.05), donde T. harzianum obtuvo el valor más alto (Cuadro 2) con 0.972±0.008 mm h-1 y 1.3238±0.0024 cm d-1, respectivamente. Morales et al. (2020) presentaron una velocidad de crecimiento mayor que en el presente estudio para la cepa TH-4 con 1.86± 0.22 cm d-1 y 1.67 ± 0.01 mm h-1 para la tasa de desarrollo. F. solani presentó la menor velocidad de crecimiento (0.4718±0.00063 cm d-1). Un estudio realizado por Andrade-Hoyos et al. (2019) reafirman los resultados obtenidos en la presente investigación, donde diferentes especies de Trichoderma spp., poseen superioridades sobre el crecimiento micelial de F. oxysporum (0.22 mm). La reducción en la tasa de crecimiento en cultivos duales es un indicador de la capacidad antagónica de Trichoderma (Guigón-López et al., 2010). El porcentaje de inhibición de crecimiento radial (PICR) de F. solani ejercido por T. koningiopsis y T. harzianum presenta diferencias significativas (p < 0.0001) a partir del día ocho (Cuadro 2), donde la cepa T-H4 presentó 1.33% mayor a T. koningiopsis T-K11 y una clasificación clase II (Figura 1 A y B) de acuerdo con la escala que estableció Bell et al. (1982).
Cuadro 2 Tasa de desarrollo, velocidad de crecimiento, porcentaje de inhibición de crecimiento radial de Tricho derma y F. solani bajo condiciones In vitro.
| Nombre | Tasa de desarrollo (mm h-1)y | Velocidad de crecimiento (cm d-1)y | PICRz | Clase Antagonismo |
|---|---|---|---|---|
| T. harzianum | 0.972±0.08a | 1.3238±0.024a | ||
| T. koningiopsis | 0.912±0.012b | 1.2369±0.063b | ||
| F. solani | 0.391±0.019c | 0.4718±0.006c | ||
| F. solani vs. T. harzianum | 53.33±0.20a | II | ||
| F. solani vs. T. koningiopsis | 52±0.002b | III | ||
yLetras diferentes significa diferencia significativa entre tratamientos de acuerdo con Tukey-Kramer para p≤0.05.
zMedias con letras diferentes, indican diferencias significativas con la prueba de t de student (p≤0.05).
La presente investigación coincide con Sundaramoorthy y Balabaskar (2013), donde encontraron una inhibición del 53% de crecimiento micelial de F. oxysporum f. sp. lycopersici. Asimismo, Jagraj et al. (2018) reportan un PICR de 55.6% para F. oxysporum frente a T. koningiopsis, para cepas aisladas de plantas de jitomate. Michel-Aceves et al. (2019) obtuvieron un antagonismo clase II sobre F. oxysporum con T. harzianum, que fueron resultados similares a los obtenidos en la presente investigación.
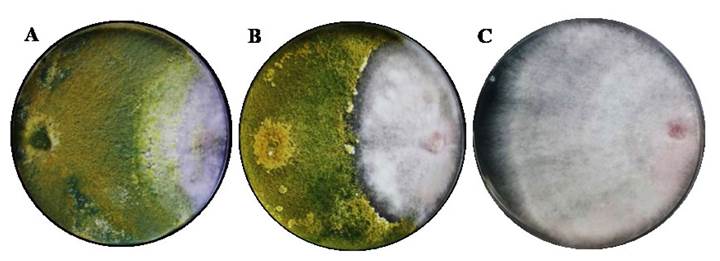
Figura 1 Antagonismo de Trichoderma con F. solani en escala deBell et al. (1982), a las 132 h en cajas con medio PDA, incubados a 28 °C por 10 días, (A) antagonismo clase II de T. harzianum (T-H4) y F. solani (MX-MIC 798), (B) antagonismo clase III de T. koningiopsis (T-K11) y F. solani (C) F. solani sin interacción.
Suárez et al. (2008) presentaron 12 aislamientos de T. harzianum confrontados para F. solani, donde obtuvieron un PICR entre el 60 y 70% del antagonismo. Nagendran et al. (2016) reportaron que 15 aislados de Trichoderma spp., alcanzaron más del 50% de inhibición sobre el crecimiento micelial de F. solani; donde la cepa Phyto-4 obtuvo la mayor inhibición (66.1%). De igual manera, Sánchez-García et al. (2017) reportan un PICR de 59.1% para F. solani frente a T. harzianum (Tri-4), resultados superiores a los obtenidos en el presente trabajo. Esto indica que probablemente, T. harzianum puede tener una tasa de incorporación de nutrientes y un metabolismo superior a F. solani, así como distintos mecanismos de secreción de enzimas hidrolíticas; entre ellas celulasas, quitinasas, glucanasas, xylasas y proteasas, las cuales pueden estar implicadas en los mecanismos de biocontrol, permitiéndole aprovechar mejor los nutrientes del medio y privar al patógeno de utilizar los recursos (Michel-Aceves et al., 2005). Además T. harzianum es capaz de inhibir del crecimiento de fitopatógenos porque produce numerosos antibióticos como tricodermina, suzukacilina, alameticina, dermadina, penicilina, tricotecenos, tricorzianinas, entre otros (Andrade-Hoyos et al., 2020).
El micoparasitismo es otro mecanismo de acción que presenta el género Trichoderma. En esta investigación, se logró observar granulación de la cepa MX-MIC 798 inducida por T. harzianum, así como ruptura de septos y estrangulación (Figura 2). Esto resalta la eminente capacidad micoparasítica de la cepa TH-4. Duarte-Leal et al. (2017) observaron micoparasitismo entre hifas de T. asperellum (Ta.25) donde se observó lisis en hifas de F. oxysporum f. sp. ciceri (F-50), como lo reportado en la presente investigación. Otros estudios realizados por Hyder et al. (2017), hacen referencia sobre la degradación enzimática de la pared celular de los hongos fitopatogénicos durante la acción micoparasítica, que causa lisis y con ello la desorganización del contenido citoplasmático. En el presente trabajo, para T. koningiopsis, no se logró observar el mecanismo de micoparasitismo ni ruptura de septos.
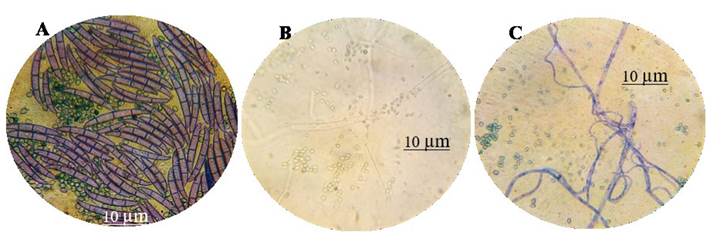
Figura 2 Micoparasitismo de T. harzianum (T-H4) sobre F. solani (MX-MIC 798) en medio PDA, incubados a 28 °C por 10 días; A) interacción de conidios de T. harzianum vs. macroconidios septados de F. solani; B) granulación y ruptura de septos de la cepa MX-MIC 798 inducida por T. harzianum; C) estrangulamiento de hifas de F. solani por la cepa TH-4.
La tasa de crecimiento y las pruebas de antagonismo son herramientas para predecir y determinar la capacidad biocontroladora. De acuerdo con Morales et al. (2020) estos estudios permiten la selección de cepas antagónicas eficientes para ser evaluadas en condiciones de campo y obtener mejores resultados.
Porcentaje de germinación y podredumbre causada por F. solani en plántulas de chile Miahuateco en vivero. La germinación de semillas del tratamiento control se presentó a los 12 días en 91%, con diferencias significativas (p= 0.0023) respecto a los tratamientos restantes (Cuadro 3), donde se observó el efecto de la inoculación de F. solani (MX-MIC 798), que afectó el cuello de la raíz al provocar podredumbre y muerte de la planta, así como el porcentaje de germinación más bajo (30%). En esta investigación, las semillas de chile Miahuateco inoculadas con la cepa MX-MIC 798 tratadas con T. harzianum T-H4 mostraron 82% de germinación; un valor aún más alto que lo reportado por Ezziyyani et al. (2004) donde obtuvieron un porcentaje de germinación del 60% en semillas de pimiento tratadas con T. harzianum a los 10 días. En las plantas no tratadas e inoculadas con F. solani, la podredumbre de la raíz alcanzó el nivel 4.0 y una mortalidad de 70% (Cuadro 3) en la escala propuesta por Ezziyyani et al. (2004). Madhavi et al. (2006) reportaron un porcentaje de germinación del 90.3% en plántulas de chile (C. annuum) inoculadas con T. harzianum-m1 y F. solani en invernadero, resultados similares a los encontrados en la presente investigación.
Cuadro 3 Efecto de la actividad antagónica de T. harzianum y T. koningiopsis sobre la germinación y podredumbre causada por F. solani en semillas de chile Miahuateco, bajo condiciones de vivero.
| Tratamientos | Germinación(%)y | Severidadz | Podredumbre causada por F. solani (%) | |
|---|---|---|---|---|
| F. solani (MX-MIC 798) | 30d | 4 | 80 | |
| F. solani vs. T. harzianum (T-H4) | 82b | 1 | 25 | |
| F. solani vs. T. koningiopsis (T-K11) | 74c | 2 | 30 | |
| F. solani vs. Mancozeb 80® | 72c | 2 | 30 | |
| Tratamiento control | 91a | 0 | 0 | |
zEvaluación realizada en la escala graduada de 0 (ningún síntoma) a 5 (planta muerta) propuesta por Ezzi yyani et al. (2004).
yLetras diferentes significa diferencia significativa entre tratamientos de acuerdo con Tukey-Kramer para p≤0.05.
Los antagonistas microbianos redujeron significativamente (22%) la podredumbre de semillas en chile Miahuateco causada por F. solani en vivero, T. harzianum presentó el porcentaje más bajo de mortalidad en plántulas (18%), superior a la cepa T-K11, que obtuvo 26%. El grupo tratado por Mancozeb 80® redujo la mortalidad de semillas en un 28% y no presentó diferencias significativas con T. koningiopsis; el tratamiento control representó el 91% de viabilidad en la germinación de semillas (Cuadro 3).
El tratamiento químico Mancozeb 80® presentó resultados altos de mortalidad, lo que puede indicar generación de resistencia por parte de F. solani ante este fungicida. Algunos fungicidas utilizados como los triazoles, tienden a desarrollar resistencia a la población de hongos por factores génicos (acumulable con el tiempo) ya que poseen un sólo sitio de acción (Leroux y Walker, 2011; Ziogas y Malandrakis, 2015). Chen et al. (2014) reportaron que Fusarium fujikuroiutiliza un mecanismo de resistencia generado por la mutación de la β2tub ante el fungicida carbendazim, lo que dificulta su manejo, sin embargo, abre la posibilidad de generar nuevas medidas de control con agentes antagonistas.
Mortalidad e índice de severidad en plantas de 40 ddt. Las plántulas de chile variedad Miahuateco que fueron inoculadas con F. solani al momento del trasplante, presentaron pudriciones en la raíz a los 40 días después de la inoculación; se observaron lesiones alargadas de color rojizo que cubrían 10% de la superficie total de la raíz principal, además, se pudo apreciar manchas café-rojizas en la porción del tallo que se encuentra por debajo del suelo y una pérdida considerable de raíces laterales, esto coincidió con lo descrito por Agrios (2006).
Los resultados de campo mostraron que los tratamientos con actividad antifúngica fueron efectivos para reducir entre el 48 y 51% de mortalidad por marchitez y pudrición de la raíz en plantas de chile Miahuateco bajo infección inducida y, disminuyó 50% la severidad de la enfermedad a los 40 ddt (Cuadro 4). La cepa T-H4 presentó el porcentaje más bajo de mortalidad (48%) de plantas; sin embargo, no presentó diferencias significativas con el fungicida Mancozeb 80®, que representó el 47% de mortalidad. De manera similar, Thangavelu et al. (2004) mostraron que T. harzianum (Th-10) controló eficazmente el marchitamiento fusarial del banano, comparable al control químico. Nagendran (2016), encontró el porcentaje máximo (36.9%) de reducción de la enfermedad con la cepa Phyto-6, además mostró una menor severidad en la marchitez, como se observó en la presente investigación. T. koningiopsis T-K11 obtuvo el 51% de mortalidad, presentando diferencias significativas con el grupo control (23%), que obtuvo la mortalidad más baja.
Durante el desarrollo de las plantas infectadas por F. solani, presentaron síntomas de amarillamiento en la parte basal, aclaramiento de nervaduras en un 30% de las hojas, como lo describieron Black et al. (1993) en plantas de chile (C. annuum) que sobrevivieron a la infección en campo. El análisis de varianza de altura total de la planta presentó diferencias altamente significativas (p= 0.0002) entre los tratamientos. Mancozeb 80® obtuvo la mayor altura (25.6±2.78 cm), seguido por las plantas inoculadas por T. harzianum (24±1.98 cm) y T. koningiopsis (21±1.81 cm), de manera recurrente, la menor altura se presentó en plantas inoculadas con F. solani con 16±0.28 cm, como se muestra en la Figura 3A. Agrios (2006), menciona que las plantas afectadas por Fusarium sp., reducen su crecimiento debido a la capacidad del patógeno de colonizar raíces, lo que impide una adecuada nutrición de la planta.
Cuadro 4 Actividad antagónica de Trichoderma sobre el porcentaje de mortalidad a los 40 ddt y severidad de la enfermedad inducida por F. solani en cultivo de chile Miahuateco.
| Tratamientos | Mortalidad(%)z | Severidad de la enfermedad | Tamaño de planta sin raíz (cm)z | Tamaño de raíz (cm)z | Altura total (cm)z |
|---|---|---|---|---|---|
| F. solani (MX-MIC 798) | 86±1.34a | 3 - 76% | 12±1.12c | 1.3±0.12 | 16±0.28c |
| F. solani vs. T. harzianum (T-H4) | 48±1.16c | 1 - 25% | 18±1.97a | 2.1±0.09b | 24±1.98a |
| F. solani vs. T. koningiopsis (T-K11) | 51±1.31b | 2 - 51% | 17±2.62ab | 1.9±0.30b | 21±1.81a |
| F. solani vs. Tratamiento químico (Mancozeb 80®) | 47±1.36c | 1 - 25% | 21±2.15a | 2.6±0.26a | 25.6±2.78a |
| Grupo control | 23±0.38d | 0 - 0% | 16±0.02b | 1.6±0.18b | 18.4±1.08b |
Evaluación realizada en la escala graduada de 0 a 3 donde, 0 = 0 a 25% de severidad, 1 = 26 a 50%, 2 = 51 a 75% y 3 = 76 a 100% propuesta por Bokhari y Perveen, 2013.
zLetras diferentes significa diferencia significativa entre tratamientos de acuerdo con Tukey- Kramer para p≤0.05.
El género Trichoderma puede parasitar hongos patógenos y producir antibióticos. Además, presenta efectos positivos en el crecimiento de las plantas, el rendimiento, la absorción de nutrientes, la eficiencia en la utilización de fertilizantes y la resistencia sistémica a las enfermedades de las plantas (Hyder et al., 2017; Andrade-Hoyos et al., 2020). En un estudio realizado por Cole y Zvenyika (1988), observaron que la infección causada por F. solani en plantas de tabaco, podría controlarse al aplicar T. harzianum en los procedimientos de manejo de enfermedades. Así como se demostró por un estudio realizado por Yedidia et al. (1999) al inocular T. harzianum en el crecimiento temprano, donde mejoró la absorción de nutrientes por la planta. Estos trabajos concuerdan con los estudios de Tsegaye-Redda et al. (2018) quienes mencionan que Trichoderma sp., tiene la capacidad de antagonizar a los fitopatógenos presentes en el suelo, así como también induce la promoción del crecimiento de las plantas y protege a las plantas del estrés biótico y abiótico. Los estudios de Dubey et al. (2007) han sido confirmados en el caso de T. harzianum, donde ha mejorado la germinación de las semillas, la sanidad de las raíces y la longitud de los brotes, además de aumentar la frecuencia de plantas sanas, como lo confirmado en la presente investigación.
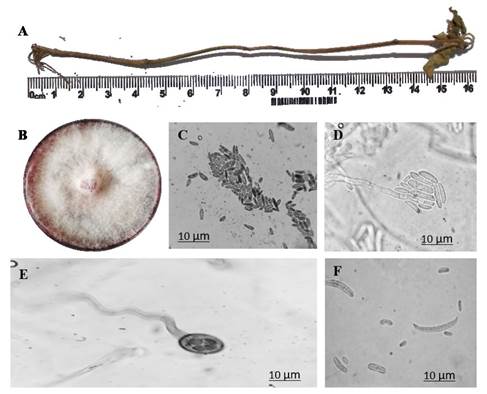
Figura 3 Estructuras de reproducción de F. solani (MX-MIC 798) de 10 días en medio PDA a 28 °C. A) planta muerta de Capsicum annuum variedad Miahuateco inoculada con F. solani MX-MIC 798, B) colonia de F. solani en medio PDA; C) microconidios de F. solani; D) fiálides y microconidios en falsas cabezas de F. solani; E) clamidosporas de F. solani; F) micro y macroconidios de F. solani.
Transcurridos 40 ddt con la cepa MX-MIC 798 y que indujo desarrollo de lesiones necróticas en raíces y tallos de las plantas evaluadas, se procedió al re-aislamiento con el fin de cumplir con los postulados de Koch. Las colonias fúngicas desarrollaron micelio aéreo abundante, de textura algodonosa y de color blanco con tonalidad púrpura (Figura 3B), más intenso en el centro del medio de cultivo (Rentería-Martínez et al., 2018). La duración del micro-cultivo para observar las clamidosporas fue de 14 días, de macroconidias siete días, así como de fiálides y microconidias con cuatro días. Se logró observar micelio septado y abundantes microconidias en forma ovoide de tamaño promedio de 2.4 x 6.3 μm de largo por 2 x 4 μm de ancho (Figura 3C), además de macroconidias con la típica forma de hoz o de luna, de uno a cuatro septos (Figura 3F), de tamaño promedio de 2.4 x 4.1 μm de ancho y 11.8 x 36.4 μm de largo (Barnett y Hunter, 1998). Así también se observaron clamidosporas (Figura 3E) con un diámetro entre de 8.4-10.5 μm, características morfométricas peculiares de estos fitopatógenos reportados por Montealegre et al. (2003).
Conclusiones
Las cepas T. harzianum (TH-4) y T. koningiopsis (T-K11), mostraron antagonismo clase II y III respectivamente, ejercido en F. solani en la escala de Bell, además, T. harzianum TH-4 mostró mayor tasa de desarrollo, velocidad de crecimiento y porcentaje de inhibición de crecimiento radial PICR sobre F. solani MX-MIC 798 (53%) en condiciones in vitro.
En condiciones de vivero, T. harzianum TH-4 (82%) y T. koningiopsis T-K11 (74%) presentaron mejor respuesta en la germinación de plantas de chile variedad Miahuateco; presentando el porcentaje de germinación mayor en comparación al tratamiento químico (72%), sin embargo, T. harzianum TH-4 redujo en un 75% la podredumbre causada por la cepa F. solani.
En la comunidad de Santa María Tecomavaca en el estado de Oaxaca, México, Trichoderma harzianum (T-H4) y el tratamiento químico Mancozeb 80® presentaron la mejor respuesta en la reducción de mortalidad y severidad de la enfermedad de plantas de chile Miahuateco a los 40 ddt.











 texto en
texto en 


