El frijol (Phaseolus vulgaris) es uno de los principales cultivos en Sinaloa, México. Su producción es afectada por diversos factores, entre los que destacan las enfermedades fungosas como el tizón sureño Sclerotium rolfsii (teleomorfo Athelia rolfsii), el cual causa pudrición de la raíz y tallo. S. rolfsii es un patógeno polífago reportado en zonas tropicales y subtropicales, asociado con pérdidas económicas significativas (Gholami et al., 2019). Para el control de la enfermedad se utilizan tratamientos químicos, pero se requieren esfuerzos para la implementación de estrategias amigables con el ambiente para el manejo de la enfermedad.
Se han reportado microorganismos del suelo con potencial para el control de S. rolfsii en algunos cultivos, pero los estudios realizados en el cultivo de frijol son escasos. Volpiano et al. (2018) reportaron que el tratamiento con Rhizobium spp. (SEMIA 439 y SEMIA 4088) reducen la incidencia en 18.3 y 14.5%. Sin embargo, se recomienda el uso de cepas nativas en el control biológico del patógeno, porque exhiben tolerancia a las condiciones ambientales locales y muestran un mayor potencial en el control de la enfermedad. Con base en lo anterior, el objetivo del presente estudio fue seleccionar cepas bacterianas de la rizósfera del cultivo de frijol recolectadas en los Municipios de Ahome, Guasave y Angostura, Sinaloa, México durante el ciclo agrícola 2018-2019 y determinar su potencial para el control de Sclerotium rolfsii.
Aislamiento bacteriano. Se realizaron muestreos dirigidos a cultivos de frijol, en etapa vegetativa, en tres municipios de Sinaloa. Se recolectaron muestras de suelos de la rizósfera de plantas asintomáticas, se incluyeron cuatro localidades (con 10 lotes cada una) en cada uno de los municipios (Ahome, Guasave y Angostura), con un total de 12 muestras compuestas. En el laboratorio se mezclaron 5 g de muestra de suelo en 50 mL de solución salina estéril al 0.85% para realizar diluciones seriales hasta 10-4; enseguida 100 µL de las dos últimas diluciones se distribuyeron por triplicado en cajas Petri con agar nutritivo (AN, BD Bioxon®), las cajas se incubaron a 25 °C durante 24 h. Las colonias se purificaron, con base en su color y forma, y se conservaron a -70 °C en glicerol al 15%.
Aislamiento e identificación de S. rolfsii. Los aislados de S. rolfsii se obtuvieron a partir de esclerocios presentes en plantas de frijol en campos agrícolas del Municipio de Ahome, Sinaloa, los cuales se desinfestaron, sembraron y purificaron en medio PDA. La confirmación de la patogenicidad del aislado de S. rolfsii utilizado en este estudio, se evidenció a través de la inoculación en semillas de frijol, la corroboración de síntomas a los 13 días después de la inoculación y el re-aislamiento del hongo, bajo condiciones de invernadero. La identificación preliminar del patógeno se efectuó mediante estudios morfológicos de las hifas, colonias miceliales y esclerocios (Nandi et al., 2017). La identidad se confirmó mediante la amplificación y secuenciación de un fragmento de la región ribososomal, con los oligonucleótidos ITS4/ITS5 (5’-TCCTCCGCTTATTGATATGC-3’ y 5’-GGAAGTAAAAGTCGTAACAAGG-3’) que amplifican ~ 587 pb (White et al., 1990).
Prueba de antagonismo de bacterias contra S. rolfsii. La evaluación del antagonismo in vitro de las bacterias en estudio se realizó mediante la técnica de cultivo dual en cajas Petri con PDA (Yánez-Mendizábal et al., 2011), como testigo se utilizaron cajas Petri con PDA solo con S. rolfsii. Las cajas se incubaron a 25 °C hasta que el crecimiento del micelio en el testigo alcanzó 4 cm de diámetro. Se calculó el porcentaje de inhibición del crecimiento micelial (PIRG) de acuerdo a los procedimientos descritos por Kumar et al. (2011), con la fórmula PIRG = (R1-R2 / R1) multiplicado por 100, donde R1 es el crecimiento radial del patógeno y R2 es el crecimiento radial del patógeno que interactúa con las bacterias.
Pruebas de hemólisis. Se realizaron pruebas de hemólisis (Forbes et al., 2002) a los aislamientos bacterianos que mostraron porcentajes de inhibición mayor a 40%. Se utilizaron cajas de medio de cultivo agar-sangre a las cuales se les realizaron perforaciones de 0.5 cm de diámetro. Los aislados bacterianos se cultivaron en 5 mL de medio Luria Bertani (LB) a 30 °C y 250 rpm durante 24 h. De cada aislado bacteriano se centrifugó 1 mL a 13,000 rpm por 5 minutos, se tomaron 100 µL del sobrenadante y se colocaron en las perforaciones de las cajas de agar-sangre. Las cajas se incubaron por 24 h a 37 °C. Los criterios de la prueba de hemólisis fueron los siguientes: hemólisis alfa (α-hemólisis) o hemólisis parcial cuando se presenta un halo con obscurecimiento verde en el medio de cultivo; hemólisis beta (β-hemólisis) o hemólisis total cuando de observa un halo claro del medio de cultivo por el efecto de lisis total de los eritrocitos, y hemólisis gama (γ-hemólisis) o no hemolítico si el medio de cultivo no presenta ningún tipo de aclaramiento (Forbes et al., 2002).
Evaluación de bacterias antagonistas in planta. Para esta evaluación se seleccionaron los tres aislados con mayor porcentaje de inhibición, no hemolíticos. Se colocó un disco de 0.5 cm de PDA con crecimiento activo del hongo en macetas con vermiculita/arena (1:1, v/v) estéril, sobre éste se sembró la semilla de frijol previamente desinfestada con NaClO al 0.5%. A cada semilla en el sustrato se le agregó 1 mL de suspensión bacteriana (COHUI 06, SANMI 02 o GLS 06) en medio LB, incubada durante 24 h (Densidad óptica a 595 nm = 1.0). Las semillas testigo se trataron con 1 mL de medio LB sin bacteria. Se utilizaron 10 plantas por tratamiento, se distribuyeron en un arreglo completamente al azar y se mantuvieron en condiciones controladas (8 h de luz/16 h de oscuridad, 25 °C) durante 13 días.
La efectividad biológica de los tratamientos en el control de la enfermedad se determinó con base en la incidencia (número de plantas con síntomas entre el total de plantas evaluadas en cada tratamiento por 100) (Cuadro 2). También se evaluó el índice de severidad con la escala de 0 a 4 (Moreno y Acevedo, 2002), donde: 0 = sin daños; 1= 1-25% de hojas amarillas y marchitamiento inicial del tallo; 2= 26-50% de hojas amarillentas y comienzo de la muerte del tallo; 3= 51-75% de hojas necróticas amarillentas y muerte progresiva de tallos y 4= 76-100% de tejido necrótico, micelio en crecimiento y esclerocios. Además, se registraron las variables altura de planta, peso fresco y seco, tanto de la raíz, como de la parte aérea (datos no mostrados). Los datos se sometieron a la prueba de normalidad de Shapiro-Wilk y se recurrió a las pruebas no paramétricas Kruskal-Wallis y Mann-Whitney con un valor de p<0.05.
Identificación molecular. Los aislados de bacterias con mayor porcentaje de inhibición se identificaron molecularmente, se partió de ADN genómico extraído con DNAzol® (Invitrogen, Cat. No. 10503-027), que se utilizó como templado para amplificar un fragmento de ~1400 pb de la región 16S rADN por PCR, con los oligos F2C/C (5´-AGA GTT TGA TCA TGG CTC-3´ y 5´- ACG GGC GGT GTG TAC-3´) (Shi et al., 1997). Los productos de PCR se visualizaron por electroforesis en un gel de agarosa al 0.8% (p/v). Después se realizó la purificación de los productos de PCR, con el kit QIAquick® PCR Purification kit (QIAGEN, Cat. No. 28104), los productos purificados se secuenciaron en ambas direcciones. Las secuencias obtenidas se compararon con el banco de datos del National Center for Biotechnology Information (NCBI; http://www.ncbi.gov), en la plataforma BLASTn para determinar la similitud de las secuencias obtenidas con los organismos que mostraran una identidad mayor al 90%. El árbol filogenético se construyó en el programa MEGA X (Kumar et al., 2018) con el método neighbor-joining (Saitou y Nei, 1987) y el modelo de sustitución de dos parámetros (Kimura, 1980). La solidez de la topología se evaluó mediante la prueba de bootstrap con 1000 réplicas.
Se aislaron un total de 65 bacterias de la rizósfera del cultivo de frijol, con un porcentaje de inhibición in vitro contra S. rolfsii que osciló de 2.5 hasta 65% (Cuadro 1). Solo 14 aislados mostraron un porcentaje de inhibición superior a 40%. En las pruebas de hemólisis (Forbes et al., 2002), seis presentaron hemólisis total (β), dos hemólisis parcial (α) y seis resultaron no hemolíticas (γ) (Cuadro 1).
Cuadro 1 Inhibición del crecimiento micelial del Sclerotium rolfsii (in vitro) con aislados bacterianos de la rizósfera del cultivo de frijol, colectados de los Municipios de Ahome, Guasave y Angostura, Sinaloa, México.
| Aislado | Municipio | Inhibición (%) | Hemólisis | Aislado | Inhibición (%) | Municipio | Hemólisis |
|---|---|---|---|---|---|---|---|
| ALHU03 | Angostura | 40 | β | GSI 03 | 7.5 | Guasave | |
| ALHU04 | Angostura | 22.5 | GSI04 | 12.5 | Guasave | ||
| ALHU05 | Angostura | 17.5 | JJR01 | 15 | Guasave | ||
| ALHU06 | Angostura | 25 | JJR03 | 20 | Guasave | ||
| ALHU07 | Angostura | 20 | JJR04 | 7.5 | Guasave | ||
| CAMA01 | Ahome | 12.5 | JJR05 | 7.5 | Guasave | ||
| CAMA02 | Ahome | 17.5 | JJR06 | 20 | Guasave | ||
| CAMA03 | Ahome | 7.5 | JJR07 | 10 | Guasave | ||
| CAMA04 | Ahome | 12.5 | JJR71 | 15 | Guasave | ||
| COHUI02 | Ahome | 2.5 | MS01 | 27.5 | Angostura | ||
| COHUI03 | Ahome | 15 | MS03 | 17.5 | Angostura | ||
| COHUI04 | Ahome | 20 | MS04 | 25 | Angostura | ||
| COHUI41 | Ahome | 32.5 | MS05 | 45 | Angostura | β | |
| COHUI06 | Ahome | 55 | γ | OLLE02 | 17.5 | Angostura | |
| COHUI05 | Ahome | 7.5 | OLLE71 | 62.5 | Angostura | β | |
| COHUI07 | Ahome | 22.5 | OLLE72 | 40 | Angostura | β | |
| COHUI08 | Ahome | 17.5 | OLLE74 | 52.5 | Angostura | β | |
| COHUI09 | Ahome | 47.5 | γ | PALM01 | 23.5 | Angostura | |
| EB03 | Guasave | 25 | PALM02 | 17.5 | Angostura | ||
| EB11 | Guasave | 27.5 | SANMI01 | 45 | Angostura | α | |
| EB12 | Guasave | 12.5 | SANMI02 | 60 | Angostura | γ | |
| EBAN01 | Angostura | 22.5 | SANMI03 | 5 | Angostura | ||
| EBAN02 | Angostura | 22.5 | SANMI05 | 30 | Angostura | ||
| EBAN04 | Angostura | 5 | SANMI06 | 50 | Angostura | γ | |
| GLS01 | Guasave | 25 | SANMI07 | 7.5 | Angostura | ||
| GLS02 | Guasave | 5 | ZI 01 | 27.5 | Ahome | ||
| GLS03 | Guasave | 17.5 | ZI 02 | 25 | Ahome | ||
| GLS04 | Guasave | 22.5 | ZI 03 | 40 | Ahome | β | |
| GLS05 | Guasave | 42.5 | α | ZI 04 | 12.5 | Ahome | |
| GLS06 | Guasave | 65 | γ | ZI 09 | 7.5 | Ahome | |
| GLS07 | Guasave | 25 | ZI 05 | 12.5 | Ahome | ||
| GSI01 | Guasave | 15 | ZI 06 | 45 | Ahome | γ | |
| GSI02 | Guasave | 32.5 |
β = hemólisis total, α = hemólisis parcial, γ = no hemolítica.
Los tres aislados, no hemolíticos, con mejor porcentaje de inhibición in planta, correspondieron a Acinetobacter pittii (COHUI06), Pseudomonas putida (SANMI02) y Burkholderia sp. (GLS06) (Figura 1). Para la evaluación in planta, las plantas originadas de las semillas tratadas con Burkholderia sp. mostraron incidencia y severidad de 40 y 50%, respectivamente (Cuadro 2), mientras que las plantas donde se utilizaron P. putida y A. pittii, aun cuando mostraron inhibición del crecimiento in vitro, éstas no ejercieron control de la enfermedad bajo condiciones de invernadero, pues los índices de severidad fueron similares a los de las plantas testigo inoculadas sólo con el patógeno (Cuadro 2). Esto sugiere que los resultados de los efectos de antagonismo observados in vitro no siempre correlacionan con los resultados observados in planta, como ocurre con Pseudomonas fluorescentes contra Gaeumannomyces graminis var. tritici, donde se observó efecto in vitro, pero su eficacia in vivo no se manifestó (Elsherif y Grossmann, 1994).
El potencial de los microorganismos para producir compuestos antimicrobianos in vitro varía con respecto a lo que ocurre in situ; esto debido a que la disponibilidad de nutrientes para las bacterias es mayor en el medio artificial que en la rizósfera (Köhl et al., 2019). Por lo que los metabolitos producidos in vitro pueden no expresarse in situ o tienen una función menor (Hennessy et al., 2017). Además, los experimentos de antagonismo in vitro sin ningún contacto con la planta excluyen otros modos de acción bacteriana, por ejemplo, la capacidad de inducir resistencia sistémica (Köhl et al., 2019) por lo que no se descarta la posibilidad de que los aislados que no mostraron antagonismo in vitro puedan inducir otros mecanismos de acción contra S. rolfsii en la planta.
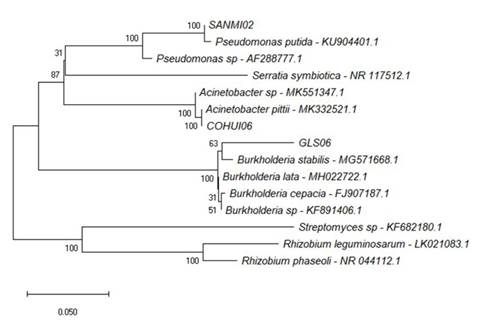
Figura 1 Relación filogenética de los aislados COHUI 06, SANMI 02 y GLS 06 basada en la secuencia del gen 16S rARN y comparada con secuencias de la base de datos de GenBank en NCBI.
Cuadro 2 Efecto de las cepas bacterianas en la incidencia y severidad del tizón sureño (S. rolfsii) en plantas de frijol bajo condiciones de invernadero.
| Tratamiento | Incidencia | Severidad | ||
|---|---|---|---|---|
| (%) | Escala 0-4 (%) | Mediana | Rango | |
| CTRL | 0 | 0.0 (0) | 0.0 | 22.5az |
| COHUI 06 | 0 | 0.0 (0) | 0.0 | 22.5a |
| COHUI 06+SR | 100 | 3.6 (90) | 100 | 62.3bc |
| GLS 06 | 0 | 0.0 (0) | 0.0 | 22.5a |
| GLS 06+SR | 60 | 1.7 (43) | 37.5 | 42.7ab |
| SANMI 02 | 0 | 0.0 (0) | 0.0 | 22.5a |
| SANMI 02+SR | 100 | 4.0 (100) | 100 | 65.5c |
| SR | 100 | 3.7 (93) | 100 | 63.5c |
zLetras diferentes, por columnas, indican diferencias significativas (p≤0.05), n = 10. CTRL (sin bacteria, sin S. rolfsii), COHUI 06 (solo bacteria COHUI 06), COHUI 06 + Sr (bacteria COHUI 06 + S. rolfsii), GLS 06 (solo bacteria GLS 06), GLS 06 + Sr (bacteria GLS 06 + S. rolfsii), SANMI 02 (solo bacteria SANMI 02), SANMI 02 + Sr (bacteria SANMI 02 + S. rolfsii) y Sr (solo S. rolfsii).
Tanto especies del género Pseudomonas como de Acinetobacter se han propuesto como promotoras del crecimiento vegetal por la capacidad para solubilizar fosfato, producir ácido indol acético, fijar nitrógeno y producir sideróforos (Daur et al., 2018; Qessaoui et al., 2019). A. pittii JD-14 es eficaz para aumentar el crecimiento, y el peso fresco y seco en alfalfa (Daur et al., 2018), la cepa evaluada en el presente estudio promovió aumento del peso seco de la raíz (dato no mostrado). En el caso de P. putida no mostró promoción de crecimiento en la variedad de frijol evaluada (dato no mostrado).
Especies de Acinetobacter se han reportado como antagonistas de patógenos de hongos. Acinetobacter sp. (5H2) y A. lwoffii (A5) inhibieron 69.4 y 62.7% respectivamente, el crecimiento in vitro de Corynespora cassiicola y redujeron significativamente la severidad del patógeno en Hibiscus sabdariffa (Patricio-Hernández et al., 2020). La especie A. pittii evaluada en esta investigación no fue eficiente para el control de S. rolfsii in planta.
El género Burkholderia, de taxonomía compleja, es uno de los dominantes en la microbiota de la rizósfera. El grupo B. cepacia, incluye especies promotoras del crecimiento vegetal y agentes de control de fitopatógenos (Eberl y Vandamme, 2016; Rojas-Rojas et al., 2019); en frijol se ha aislado y evaluado B. contaminans UFLA02-27, esta cepa es capaz de solubilizar fosfato, fijar nitrógeno y presenta antagonismo a Fusarium oxysporum f. sp. phaseoli (Da Silva et al., 2012). Especies de este grupo tienen potencial biotecnológico en la agricultura porque producen una amplia variedad de enzimas hidrolíticas y compuestos bioactivos pero su uso es restringido por los riesgos que representan como patógenos oportunistas en personas inmunocomprometidas (Eberl y Vandamme, 2016; Rojas-Rojas et al., 2019; Espinosa-Victoria et al., 2020).
Burkholderia sp. (cepa GLS06), la cual resultó no hemolítica (Cuadro 1), comparte alrededor del 95% de homología con secuencias del gen 16S de especies del grupo de B. cepacia (GenBank: MG571668.1, MH022722.1, FJ907187.1); se ha reportado que la homología del gen 16S de las especies del grupo B. cepacia es alta (>97.5%) (Da Silva et al., 2012), nuestro análisis limita al aislado GLS06 a nivel género; se requiere de análisis concatenado con distintos marcadores para determinar la especie.
Burkholderia sp. (GLS06) aislada de muestras de rizósfera de frijol colectadas en Guasave, Sinaloa, México, mostró potencial en el control de la pudrición sureña del frijol causada por S. rolfsii, lo que justifica estudios futuros a nivel invernadero y campo para determinar su potencial como agente de biocontrol en un sistema de manejo integrado de la enfermedad, esto en estricto apego a los criterios éticos relativos al cuidado de la salud humana y el ambiente.











 texto en
texto en 


