El Agave tequilana variedad Azul, se utiliza como materia prima para la elaboración del tequila. México es el único productor de ésta bebida a nivel mundial, contando con la Denominación de Origen del Tequila (DOT) desde 1977. Esta bebida también se encuentra respaldada por la NOM-006-SCFI-2012. La condición DOT restringe la siembra de Agave tequilana var. Azul para producción de tequila en cinco estados del país, de los cuales Jalisco representa el 77% de producción total (SIAP, 2020; López-Bautista et al., 2020; Coria-Contreras et al., 2019). Acorde a datos del CRT, en 2018 y 2019, la superficie plantada de agave aumentó aproximadamente 31% implicando un máximo histórico de 96 millones de hijuelos plantados (3,200 hijuelos ha-1), sin incluir hijuelos para restitución de hectáreas jimadas (CRT, 2020).
En la actualidad existe consenso empírico que el material propagativo de agave contribuye en la diseminación de plagas en general, entre las que se incluye Fusarium sp., agente de gran impacto productivo (SENASICA-DGSV, 2017; NOM-083-FITO-2003). Sin embargo, no existen estudios que demuestren en hijuelos de A. tequilana la asociación de Fusarium spp. ni la carga de inóculo que pueden diseminar y constituir un factor de riesgo para el establecimiento de nuevas plantaciones. Considerando la existencia de zonas con diferente nivel de inductividad y nivel de daño por el síndrome marchitez y pudrición seca del cogollo (SMAP) (López-Bautista et al., 2020), y que algunos predios se emplean como plantaciones madre, con limitada o nula regulación, p.e. la certificación sanitaria genérica se realiza en Guanajuato, pero no en otros estados productores de la DOT, se justifican estudios etiológicos y epidemiológicos a nivel de planta madre-hijuelo con el fin de fortalecer y justificar el establecimiento de plantaciones certificadas para producir y comercializar hijuelos de bajo riesgo sanitario. A nivel de plantaciones comerciales de plantas adultas, normalmente empleadas como plantas madre de hijuelos, López-Bautista y colaboradores realizaron un trabajo exhaustivo regional en Jalisco con énfasis en las especies de Fusarium (López-Bautista et al., 2020). En este trabajo se identificó a la marchitez y pudrición seca del cogollo del agave como un síndrome (SMAP) asociado con un complejo de especies de Fusarium. Éstos investigadores reportaron un total de 16 especies binomiales y filogenéticas, y otras seis no identificadas aisladas de suelo, raíz y tejido aéreo pertenecientes a cuatro complejos filogenéticos: Fusarium oxysporum [FOSC], F. solani [FSSC], F. fujikuroi [FFSC] y F. incarnatum-equiseti [FIESC]. Al menos dos especies binomiales ya se habían reportado previamente: F. oxysporum y F. solani (Vega-Ramos et al., 2013; Ramírez-Ramírez et al., 2017).
La implicación de la sanidad de planta madre y la inductividad parasítica del suelo en la salud del hijuelo es importante para determinar estrategias de certificación y manejo de riesgos productivos regionales. La extensiva asociación de complejos de especies de Fusarium SMAP en plantaciones comerciales de Agave tequilana (López-Bautista et al., 2020), permite postular como base racional del presente trabajo que la asociación diferencial cuantitativa y composicional de Fusarium, tanto en condición externa no parasítica, como en forma internalizada en tejidos de hijuelos de agave azul, está en función del tiempo de crecimiento del hijuelo y del nivel de inductividad epidémica regional en la cual estén establecidas las plantación madre. En este contexto, este trabajo se propuso con el objetivo de desarrollar y aplicar una metodología que permitiera establecer la asociación parasítica de Fusarium spp. con hijuelos de A. tequilana y estimar la carga de inóculo en función de regiones epidémicas inductivas SMAP en Jalisco y al estado de desarrollo del hijuelo al momento del corte con fines comerciales.
MATERIALES Y MÉTODOS
Establecimiento del sitio experimental en campo. La colecta de muestras a partir de hijuelos para uso comercial se realizó en 2018 y 2019 con nueve y 12 plantaciones comerciales de A. tequilana variedad azul entre 3-4 años de edad, respectivamente. Las muestras se obtuvieron de 14 municipios, distribuidas en las regiones agaveras de Los Altos, Valles y Sur de Jalisco. Las plantaciones se seleccionaron con base al nivel de inductividad regional representado por plantas enfermas o sintomáticas a marchitez del agave en el ciclo epidémico 2017. Se utilizaron datos de la campaña contra plagas reglamentadas del agave de SENASICA y del Sistema Integral de Protección y Vigilancia Epidemiológica del Agave (SIVEA) (Cuadro 1).
Características de plantaciones madre. Las plantaciones madre se caracterizaron por edad de 3-4 años en periodo de arranque comercial de hijuelos según los criterios regionales aplicados por los productores, apariencia asintomática y manejo agronómico estándar consistente en aplicación de herbicidas (junio-julio), fertilización, “barbeo” (despunte de las hojas laterales para permitir el paso al surco) previo al corte de hijuelos, aporques en los primeros dos años y desquiote en plantaciones que lo presentaron.
Diseño experimental. El diseño experimental seleccionado para análisis de varianza fue un parcelas subdivididas en factorial 3x3x3 correspondiente a Altos, Valles y Sur, el factor región en parcela grande; inductividad alta, moderada y baja, del factor Intensidad epidémica de marchitez y pudrición seca, en parcela mediana; y tres calibres de hijuelos en parcela chica. Por región, las parcelas se seleccionaron con registros programados de arranque de hijuelos de empresas y productores cooperantes, y con base en su distribución regional para contar con dos sitios/inductividad/región. Cada parcela se dividió en tres bloques separados por tres surcos (3 m de distancia), con representatividad aproximada de una hectárea. La muestra de hijuelos por tipo de calibre para toma de muestra se realizó de los sitios de acopio “temporal” parcelario donde se acomodan después arrancados. En cada parcela se colectaron muestras de los tres tamaños de calibre de hijuelos: Lima, Naranja y Toronja (8-10, 10-12 y 12-15 cm de diámetro de piña, respectivamente). La muestra total de 270 hijuelos parcela-1 estuvo constituida de 15 hijuelos por calibre en dos repeticiones por bloque. En 2018, se seleccionaron tres muestras compuestas por calibre/bloque y en 2019 únicamente dos muestras principalmente en la región Los Altos y Sur para ampliar el muestreo de internalización. Por parcela, en tejido externo del ciclo productivo 2018 se obtuvieron 27 muestras/parcela para un total de 243 muestras compuestas totales; y en 2019, 18 muestras/parcela para un total de 216 muestras. En tejido interno en 2018, se colectaron 30 hijuelos de una parcela de alta inductividad en Los Altos, y en 2019 se colectaron 140 hijuelos (20 por predio), 120 de Los Altos y 20 de una parcela de baja inductividad en la región Sur.
Cuadro 1. Localización y caracterización tecnológica de 21 plantaciones comerciales de Agave tequilana seleccionadas en 2018 y 2019 para estudios etiológicos y carga de inóculo de hijuelos asociado con el síndrome de marchitez y pudrición seca del cogollo de planta madre en Jalisco.
| Año | Región | Inductividad | Municipio | Latitud | Longitud | Altitud (msnm) | Tecnifi- cación | Manejo | ID Plantación | |
|---|---|---|---|---|---|---|---|---|---|---|
| 2018 | Altos | Alta | Atotonilco | 20.51509 | -102.6127 | 1556 | Medio | Inorgánico | A-ATO-P4 | |
| Moderada | Jesús María | 20.59527 | -102.15688 | 2180 | Alto | Inorgánico | A-JM-M2 | |||
| Baja | Jesús María | 20.76863 | -102.14421 | 2279 | Medio | Inorgánico | A-JM-M1 | |||
| Sur | Baja | Juchitlán | 20.08979 | -104.08275 | 1245 | Alto | Inorgánico | S-JUC-PM6 | ||
| Juchitlán | 20.09765 | -104.07422 | 1199 | Alto | Inorgánico | S-JUC-PM7 | ||||
| Juchitlán | 20.05530 | -104.06809 | 1324 | Alto | Inorgánico | S-JUC-PM8 | ||||
| Valles | Moderada | Amatitán | 20.83527 | -103.66876 | 1224 | Medio | Inorgánico | V-AMA-P9 | ||
| El Arenal | 20.78533 | -103.71006 | 1387 | Medio | Inorgánico | V-ARE-PM4 | ||||
| Baja | Amatitán | 20.87292 | -103.76204 | 1229 | Medio | Inorgánico | V-AMA-PM5 | |||
| 2019 | Altos | Alta | Zapotlanejo | 20.5677961 | -102.891988 | 1856 | Alto | Inorgánico | AZAP-A01 | |
| Arandas | 20.6467737 | -102.273707 | 2078 | Alto | Inorgánico | AARA-A02 | ||||
| Moderada | Tepatitlán | 20.8714019 | -102.685529 | 1979 | Medio | Inorgánico | ATEP-M01 | |||
| Jesús María | 20.5994848 | -102.15713 | 2186 | Alto | Inorgánico | AJM-M02 | ||||
| Baja | Ixtlahuacan del río | 21.0554448 | -103.192341 | 1674 | Alto | Inorgánico | AIXT-B01 | |||
| Cañadas de Obregón | 21.1631611 | -102.675379 | 1829 | Bajo | Orgánico | ACDO-B02 | ||||
| Sur | Alta | Pihuamo | 19.1997579 | -103.426473 | 707 | Medio | Inorgánico | SPIH-A01 | ||
| Pihuamo | 19.2114215 | -103.481563 | 655 | Medio | Inorgánico | SPIH-A02 | ||||
| Moderada | Juchitlan | 20.1064934 | -104.061595 | 1190 | Medio | Inorgánico | SJUC-M01 | |||
| Pihuamo | 19.2475873 | -103.430513 | 681 | Medio | Inorgánico | SPIH-M02 | ||||
| Baja | Tecolotlán | 20.1694819 | -104.042434 | 1177 | Medio | Orgánico | STEC-B01 | |||
| Tuxcacuesco | 19.7303572 | -103.906454 | 927 | Alto | Inorgánico | STUX-B02 | ||||
Método CIFUSAG para obtención de lavados basales. Para seleccionar los hijuelos con base a su tamaño correcto de calibre se usaron aros metálicos con diámetros correspondientes a cada calibre; Lima 10 cm, Naranja 12 cm y Toronja 14 cm. Se realizó un lavado del cuello y base de las hojas de todos los hijuelos de la muestra compuesta. El lavado se realizó en una cubeta plástica de 15 L, con 1 L de agua desmineralizada estéril. Los hijuelos se sumergieron parcialmente y se tallaron con un cepillo plástico para desprender la mayor cantidad de suelo adherido. Una vez obtenido el lavado éste se agitó con un taladro modificado para homogenizar la muestra y con una malla plástica (abertura 2x2 mm) se filtró a otro recipiente de 2 L. El filtrado se dejó reposar durante 10-15 min para eliminar el excedente de agua y recuperar el suelo en tubos Falcon estériles de 50 mL (Figura 1 A1-A8). Las muestras se transportaron a laboratorio en hieleras con geles refrigerantes para conservación de temperatura y realizar su secado inmediato. La Figura 1 explica la metodología CIFUSAG. La descripción de literales y numerales (A1-E5) se indica a continuación: (A1) Distribución de hijuelos en campo. (A2) Muestra compuesta de 15 hijuelos para calibre Lima, Naranja y Toronja. (A3) 1L de agua desmineralizada estéril. (A4) Lavado basal del hijuelo. (A5) Taladro modificado. (A6) Lavado en reposo 10-15min. (A7) Eliminación de agua excedente y recolección de material sólido. (A8) Muestra de tejido externo basal en tubo Falcon estéril de 50mL. (B1) Muestra de 20 hijuelos calibre Naranja. (B2) Corte de hojas del cogollo alto. (B3) Lavado individual con jabón y agua del grifo para eliminación de residuos. (B4) Secado del hijuelo. (B5) Eliminación de tejido externo. (B6) Corte individual de hijuelos. (C1) Esquematización de tipos de tejido interno en hijuelo. (C2) Selección de tejido para siembras directas. (D1) Tejido restante del hijuelo en proceso de desinfestación. (D2) Macerado de tejido a 3000 rpm. durante 30s. (D3) Tejido de hijuelo macerado. (D4) Filtrado de bagazo con malla plástica. (D5) Muestra homogénea de 50ml en Tubo Falcon estéril. (E1) Siembra de tejido externo en medio Komada. (E2) Siembra de tejido interno. (E3) Cepa en purificación en agua-agar. (E4) Monospórico y (E5) Caracterización en medio Sabouraud.

Figura 1 Método CIFUSAG para el procesamiento de toma de muestras de hijuelos de plantas madre de Agave tequilana para tejido externo basal (lavado) (A), tejido interno (B y C), tejido macerado (B y D) y metodología de laboratorio (E). La explicación de literales y numerales (A1-E5) se indica en la sección Método CIFUSAG para obtención de lavados basales (Páginas 7 y 9).
Selección de hijuelos para estudios de internalización y carga de inóculo interno (CII). En adición a las muestras de tejido externo, en 2018 se colectaron 30 hijuelos distribuidos en calibre Lima, Naranja y Toronja de un predio de alta inductividad para estudios de internalización y en 2019 se seleccionaron hijuelos para disección individual y obtención de aislamientos de tejido interno. De las 12 parcelas totales, se seleccionaron seis de Los Altos, dos por cada nivel de inductividad (alta, moderada y baja inductividad) y una de Sur (baja inductividad). Por parcela, se seleccionaron 20 hijuelos de tamaño Naranja distribuidos en los tres bloques del diseño experimental (Figura 1 B1). En total se colectaron y procesaron 140 hijuelos los cuales se utilizaron para obtener diferente tejido interno (cuello, piña, base de las hojas y base del cogollo), el tejido restante, se maceró para evaluar carga de inóculo interno total.
Evaluación de plantas madre. Con la finalidad de registrar el estatus fitosanitario de plantaciones comerciales en la parcela de muestreo y colecta de hijuelos se evaluó la condición fitosanitaria de plantas madre mediante la escala diagramática propuesta por Jiménez-González y colaboradores (2017) (Figura 1B-C) con el sistema de muestreo (<3 ha) propuesto por SIVEA.
La evaluación in situ se realizó con App-SIVEA v4.1 (Guzmán-Hernández et al., 2017). El muestreo comenzó a partir de la tercera planta de cada surco para evitar efecto orilla. En 2018 se evaluaron 63 plantas/parcela, divididos en tres surcos, uno por bloque, con 21 plantas cada uno. En 2019 se evaluaron 10 cuadrantes distribuidos en los tres bloques del experimento, con 20 plantas continuas por cada uno, dando un total de 200 plantas evaluadas por plantación para marchitez del agave y pudrición seca del cogollo (Figura 1A). Los datos se enviaron en tiempo-real a la plataforma www.sivea.org.mx desde los módulos respectivos de App-SIVEA, posteriormente se realizó la descarga de la matriz epidemiológica para análisis.
Procesamiento en Laboratorio. Secado de muestras de tejido externo. Las muestras colocadas en tubos Falcon tuvieron un periodo de 8-48 h para su traslado al laboratorio debido a las distancias de los predios para toma de muestra. Durante este tiempo se mantuvieron en hieleras con geles refrigerantes. Una vez en laboratorio se mantuvieron en refrigeración a 4 °C por 6-8 h para dejar precipitar la muestra y eliminar el exceso de agua. Posteriormente, las muestras se colocaron sobre toallas interdobladas (Sanitas®) estériles por 12 h en una cámara de flujo laminar para su secado (Figura 1 B2-B4).
Siembra de tejido externo. Con la muestra seca, se realizó una dilución madre utilizando 1 g en 9 mL de agua desmineralizada estéril (proporción 1:9) en tubos Falcon de 15 mL. Después de un reposo de 15 min, la mezcla se homogenizó por 1 min de manera manual y se realizó una dilución 1x100.5, donde se utilizó 1 mL de la dilución madre y 1 mL de agua estéril, a fin de optimizar el conteo de colonias. Mediante una espátula Drigalsky se distribuyó una alícuota de 0.1 mL en cajas de Petri con medio Komada (Leslie y Summerell, 2006) (Figura 1 E1). Las muestras crecieron durante siete días para realizar los conteos de colonias de Fusarium spp. y hongos totales.
Aislamiento de tejido interno y macerado para CII. Los 140 hijuelos tamaño Naranja colectados se lavaron en laboratorio para eliminar la mayor cantidad de suelo del exterior. Con un machete rambo desinfestado con hipoclorito de sodio (3%) y alcohol (70%) se eliminó el exterior del hijuelo hasta dejar solo tejido interno (piña blanca) (Figura 1 B5). El tejido interno se dividió en trozos con la finalidad de separar muestras de cuello, piña, base de hoja y base de cogollo (Figura 1 B6). De cada tipo de tejido se cortaron 25 trozos de 0.5x0.5 cm para siembras directas. Estos, se desinfestaron en la campana de flujo laminar con hipoclorito (3%) seguido de alcohol (70%) por dos minutos cada uno, finalmente se realizaron dos enjuagues de dos minutos con agua desmineralizada estéril (Figura 1 C2). Los trozos de tejido se colocaron sobre toallas interdobladas durante 24 h para su secado con la finalidad de reducir crecimiento bacteriano. El resto de tejido interno se desinfestó en vasos de precipitado bajo el procedimiento previo para posteriormente macerarlo. Este proceso se realizó por cada hijuelo trabajado.
El macerado se realizó en una licuadora industrial (Blendtec®, modelo TB-621-26) a 3 mil revoluciones durante 30 s. El macerado se vertió en un vaso de precipitado a través de una malla plástica (abertura 0.5 x 0.5 cm) con la finalidad de eliminar el bagazo, se homogenizó y se tomó una muestra de 50 mL en tubos Falcon estériles. Las muestras reposaron durante 2-3 h aproximadamente, para obtener el sobrenadante (Figura 1 D1-D5). Este último se eligió debido a que presentó el mayor crecimiento de colonias en pruebas preliminares, en las cuales también se probó bagazo y precipitado de la muestra homogénea.
En diferentes cajas de Petri con medio de cultivo Komada, se sembraron cinco trozos de cada tipo de tejido (cuello, piña, base de las hojas y base del cogollo) (Leslie y Summerell, 2006). Similarmente, 100 µL del sobrenadante resultado del macerado, se distribuyeron en caja de Petri con medio Komada. En total se obtuvieron cinco cajas de Petri por hijuelo (cuatro de tejido y uno de sobrenadante) (Halfeld-Vieria y Nechet, 2005). Las siembras se incubaron a temperatura ambiente por siete días y posteriormente se realizó el conteo de Unidades Formadoras de Colonias (UFC) y se calculó el indice de Fusarium (López-Bautista et al., 2020).
Extracción de ADN, PCR y análisis filogenético. Se empleó el gen EF-1a, previamente identificados por su consistencia con especies de Fusarium en agave azul y otros sistemas (O´Donnell et al., 2015; López-Bautista et al., 2020). La extracción se realizó con el protocolo AP modificado (SDS 1%) (Green y Sambrook, 2012). Se cuantificó y determinó la calidad del ADN por espectrofotometría con Nano Drop 2000 (Thermo Fisher Scientific, USA), posteriormente se ajustó a 40 ng µL-1. Para PCR el volumen final del mix de reacción fue de 25 µL [1X de buffer de PCR (10X), 1.6 mM de MgCl2, 0.16 mM de desoxinucleótidos trifosfato (dNTP’s), 200 nM de cada iniciador, EF1* (5’-ATG GGT AAG GAR GAV AAG AC) / EF2* (5’-GGA DGT ACC AGT RAT CAT G), 0.5 U de Platinum® Taq DNA polimerasa (Invitrogen) y 2.5 µl de ADN (40 ng µL-1). Se utilizó el termociclador T-100 de BioRad. El programa de termociclaje consistió en: desnaturalización inicial a 94 °C por 5 min y 30 ciclos con desnaturalización a 94 °C por 30 s, alineamiento a 58 °C por 40 s, extensión a 72 °C por 55 s y una extensión final de 72 °C por 7 min. Los fragmentos amplificados se analizaron por electroforesis en gel de agarosa al 1.5% y TBE 1X. Cada depósito del gel se cargó con 4 µL del producto de PCR y 4 µL de buffer de carga (PROMEGA). Se usó el marcador de peso molecular (MMP) 1KB plus de Invitrogen con 1.5 µL+4 µL buffer. Las bandas de 760 pb se visualizaron con bromuro de etidio y luz UV. El producto de PCR respectivo se secuenció con el servicio comercial de Macrogen Inc., Korea.
Las secuencias de los aislados se editaron en el programa SeqAssem (v07/2008) y se blastearon en GenBank para una identificación previa y la obtención de secuencias de referencia para análisis filogenético. En el programa MEGA X (v10.1.8) se realizaron los alineamientos utilizando el algoritmo ClustalW. Se construyó la relación filogenética con el modelo de máxima vesosimilitud del General Time Reversible Model (GTR) + Gama Distributed With Invariant (G+I) con 1000 repeticiones Bootstrap.
RESULTADOS
Validación del método de muestreo. El método CIFUSAG se validó con diferentes herramientas y métodos en 2018 para estandarización del proceso descrito en la Figura 2. La revisión exhaustiva sugiere que en la actualidad, no existen trabajos reportados en agave o cultivos similares que permita la cuantificación de Fusarium spp. en estructuras propagativas como hijuelos, cormos, bulbos u otros mediante métodos análogos. En lavado externo en campo el uso de cepillos permitió mayor desprendimiento del suelo y tejido adherido a la base del hijuelo conformado por el cuello y base de las hojas, así como el taladro modificado con un mezclador de pintura, resultaron un método útil para zonas con suelos arenosos donde la muestra obtenida es solamente de 5-15 g de suelo, contrastante con predios arcillosos donde alcanzó los 30 g. Las UFC de éstas muestras alcanzaron un promedio de 129 (Min=3, Máx=422) colonias de hongos totales por siembra y Fusarium en seis colonias (Min=0, Máx=269) promedio.
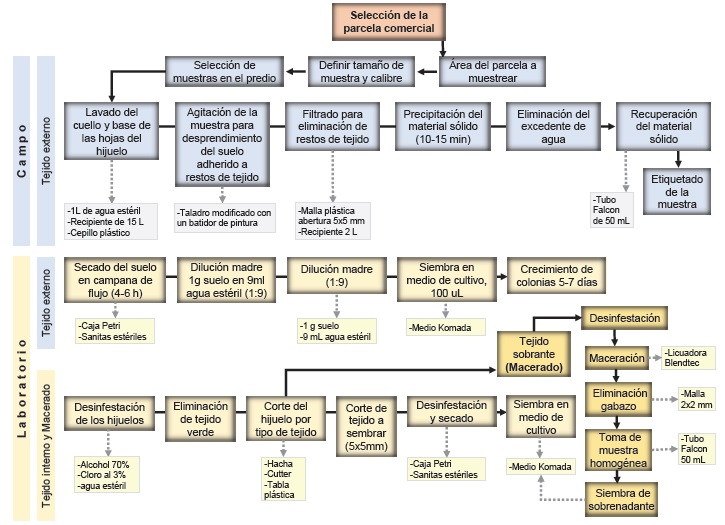
Figura 2 Esquematización del método CIFUSAG desarrollado para estimar carga de inóculo de Fusarium spp. a partir de hijuelos de A. tequilana con fases de campo y laboratorio. Las muestras incluyeron lavado basal, secciones de tejido interno y macerado total del hijuelo.
En tejido interno y macerado en laboratorio el lavado y eliminación del tejido verde externo de la piña del hijuelo evita contaminaciones y asegura la siembra de únicamente organismos internalizados. Además, la maceración y siembra de dilución madre para la obtención de CII aseguró un alto número de UFC de HT (4 617) de los cuales el 22.5% (1 038) perteneció a colonias de Fusarium spp. Conclusivamente el método CIFUSAG asegura altos crecimientos de HT y UFC de Fsp, permitiendo realizar análisis para el manejo y control adecuado de éste u otros organismos patógenos presente en el cultivo.
Comportamiento de unidades formadoras de colonias por región en tejido externo. El análisis de parcelas subdivididas no mostró efectos en la interacción de parcela grande, mediana y chica (Tukey p>0.05), por lo que se analizaron de forma independiente. En general el índice de Fusarium [(IF) = (∑Fsp) / (∑HT)] presentó diferencia por región y año. A nivel regional en 2018-2019 Sur reporta nivel de inductividad más bajo con respecto a otras regiones, sin embargo, el IF fue estadísticamente mayor (0.5-0.7) respecto a Los Altos (0.3-0.4) y Valles (0.2) (Tukey p<0.05) (Figura 3A).
En tejido externo, UFC Fusarium fue estadísticamente diferente (p<0.05) inter-regiones para 2018, pero no así en 2019 a pesar que contabilizó el doble de UFC para las dos regiones (Figura 3B). Las plantas enfermas en 2018 reportaron menos de cinco plantas enfermas promedio por parcela comercial y 2019 entre 15-20 plantas con marchitez (Figura 3C). Por su parte, el porcentaje de severidad en planta de 2018 fue de 4.0-19.32% y estadísticamente diferente principalmente en Altos respecto a Sur y Valles (p<0.05); mientras que en 2019 con severidad de 29-31% Altos y Sur no fueron diferentes (Figura 3D).
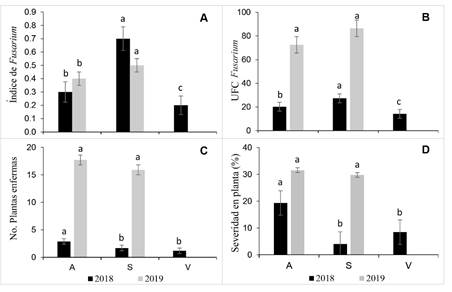
Figura 3 Carga de inóculo de Fusarium spp. en tejido externo (lavado) de hijuelos, número de plantas enfermas y severidad de planta madre con síndrome de marchitez y pudrición seca del cogollo en Los Altos (A), Sur (S) y Valles (V) de Jalisco en 2018 y 2019. A) índice de Fusarium spp., B) Unidades formadoras de colonias de Fusarium spp. C) Plantas enfermas, D) Porcentaje de severidad en planta. Al menos una letra en común por año son estadísticamente iguales (Tukey p<0.05).
En general los análisis varianza no mostraron efecto de interacción calibre+región en 2018 y 2019 para UFC e índice de Fusarium (p>0.05) (Figura 4B, C y D), pero si presentó diferencias en UFC de otros hongos (p<0.05) principalmente para muestras de hijuelo de 2019, siendo calibre Toronja el tamaño con promedio mayor UFC de otros hongos (107.1) (Figura 4A).
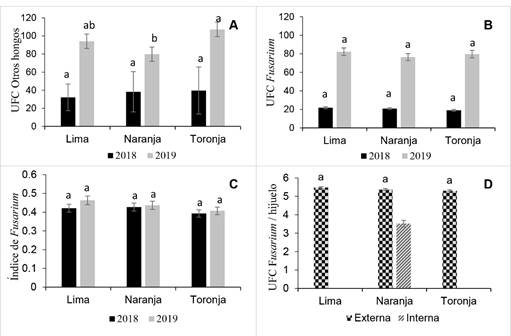
Figura 4 Carga de inóculo por calibre Lima, Naranja y Toronja de hijuelos de agave en experimentos 2018 y 2019. A) Unidades formadoras de colonia (UFC) de otros hongos, B) UFC Fusarium spp., C) Índice de Fusarium spp. y D) UFC de Fusarium/hijuelo por tipo de tejido externo o interno y calibre de hijuelos. Lima y Toronja sin datos. Al menos una letra en común por año (A-C) o entre tejido externo (D) son estadísticamente iguales (Tukey p<0.05).
Esto sugiere diversidad significativa en la cantidad de hongos por región y calibre. En Fusarium a pesar de no conocer la capacidad patogénica por inductividad regional, a través de los análisis se infiere un riesgo mayor en la movilización de hijuelos.
Unidades formadoras de colonias por región en tejido interno y macerado. En tejido macerado se realizaron pruebas preliminares iniciales. Los resultados mostraron que el sobrenadante, a partir de una muestra homogénea, presentó la mayor cantidad de hongos totales y Fusarium, principalmente en el medio de cultivo selectivo, con un 62% de crecimientos totales. Las UFC fueron mayor en la parcela de moderada inductividad de Tepatitlán con valor total de 378 (min=0, máx= 42, std=59.5), seguido de Zapotlanejo con 206 (min=0, máx= 32, std=31.2). El predio de baja inductividad de la región sur, correspondiente a Tuxcacuesco, obtuvo el tercer lugar en UFC de Fusarium con 188 (min=0, máx= 37, std=61.8). El predio de baja inductividad de Cañadas de obregón no presentó crecimientos de Fusarium, esto podría atribuirse a las condiciones climáticas de la temporada invernal, donde reportaron heladas (comunicación personal). El peso del hijuelo también podría respaldar el efecto de éste estrés, encontrándose en un promedio de 158 g, el más bajo de todos los predios de la región altos.
La carga de inóculo en tejido interno respecto al externo, en calibre Naranja y a nivel de hijuelos independientes fue menor (3.52 UFC). La carga de inóculo en tejido externo fue similar entre calibres, siendo en Naranja el tamaño que obtuvo un crecimiento promedio de 5.37 UFC. Estos resultados sugieren un mayor riesgo de dispersión de Fusarium por tejido externo. Sin embargo, las UFC encontradas de manera interna no son tan distantes del anterior, por lo que se sugieren un control sistémico y de contacto que ayude a reducir las cargas de inóculo presentes en los hijuelos (Figura 4D).
En tejido interno los crecimientos de Fusarium se comportaron significativamente diferente. En la base de las hojas se encontró el 75% de las cepas totales, con una mínima, por parcela, de 18 y máxima de 51. Le siguió el tejido de la base del cogollo (15%), piña (8%), y finalmente cuello (2%). Esto sugiere una posible especialización en tejidos a nivel de hijuelo, como lo reportado por López-Bautista et al. (2020), donde se reportan cepas diferentes de Fusarium en tejido aéreo y raíces y suelo. Así mismo estos datos sugieren que no existe un movimiento ascendente de cuello a tejido aéreo expuesto como las hojas, sino que existen múltiples vías de entrada.
Identificación molecular y filogenia. De los 30 hijuelos utilizados para aislamientos de Fusarium en tejido interno y externo se obtuvieron 23 cepas, 16 y siete respectivamente. En Ti de la Base de hojas se obtuvo el 56% del total, seguido de tejido de cuello (19%), Cogollo (12.5%) y Piña (12.5%). El análisis filogenético de las secuencias con el gen EF-1a determinó la presencia de tres especies binomiales de Fusarium pertenecientes a complejos diferentes; F. oxysporum (FOSC), F. verticillioides (FFSC), F. solani (FSSC), dos especies filogenéticas asociadas a planta madre; FIESC 9, FIESC 12 y una sin identificar; Fusarium 2-Agave, reportado por López-Bautista et al., 2020 (Cuadro 2).
Los complejos de Fusarium FOSC y FFSC se encontraron en ambos tejidos (interno y externo), mientras que FSSC sólo se aisló de tejido interno y FIESC de tejido externo. En Ti, Bh mostró la mayor diversidad y cantidad de especies; F. verticillioides (cinco), F. oxysporum (dos) y F. solani (dos). En Cogollo sólo se encontró a F. oxysporum (uno) y F. solani (uno), mientras que Cuello fue específico a F. oxysporum (tres). Sin embargo, en tejido de Piña las dos secuencias se alinearon con un máximo de 97% de identidad a especies de Fusarium sp. del GenBank, pero de 99.7-100% con la especie sin identificar Fusarium 2-agave, de planta adulta de A. tequilana. En tejido externo se encontró a F. verticillioides y F. oxysporum. El análisis filogenético con el gen EF-1a mostró la agrupación por complejo con un soporte estadístico mayor a 96% y por especie a 80%. También se observó la variabilidad entre clados, principalmente en los complejos FIESC y FSSC, donde se encuentran las especies filogenéticas y sin identificar de Fusarium spp. (Figura 5).
DISCUSION
El síndrome marchitez y pudrición seca del cogollo (SMAP) en A. tequilana representa uno de los principales retos en la producción de agave azul en la DOT. Los trabajos de investigación con esta enfermedad, causada por un complejo de especies de Fusarium, son limitados y enfocados principalmente a plantaciones comerciales con plantas adultas que exhiben el síndrome por predisposición del estrés productivo (Vega-Ramos et al., 2013; Ramírez-Ramírez et al., 2017; López-Bautista et al., 2020). Comúnmente este tipo de plantaciones, entre 3-4 años de edad, pueden ser empleadas como proveedoras de hijuelos para establecer nuevas plantaciones, lo cual impone interrogantes fitosanitarios por la estrecha relación planta madre-hijuelo-suelo. Con este marco racional, este trabajo aporta tres líneas de conocimiento: 1). Desarrollo y validación de una metodología de campo y laboratorio, denominado CIFUSAG (acrónimo de Carga de Inóculo Fusarium en Agave), para estimar la carga de inóculo de Fusarium spp. externo e internalizado en hijuelos; 2). Demuestra la existencia de carga de inóculo diferencial con fuerte efecto regional; y 3). Aporta bases etiológicas presentando evidencias asociativas de un complejo de especies de Fusarium con hijuelos tanto a nivel externo como a nivel de tejido interno.
Cuadro 2. Identificación molecular PCR de 23 aislados de Fusarium obtenidos de 30 hijuelos en 2018 por fuente de aislamiento utilizando el gen EF-1a.
| Fuente de aislamiento | Especie/Complejo | ID aislado | %Identidad | Secuencia Referencia | |
|---|---|---|---|---|---|
| Base de la hoja | F. verticillioides | [FOSC] | NF2bh | 100 | MH582325 |
| NF3bh | 99.70 | MH582331 | |||
| NF4bh | 99.85 | MH582331 | |||
| PF1bh | 99.41 | JF740737 | |||
| PF8bh | 100 | MH582325 | |||
| F. oxysporum | [FOSC] | LF6bh | 99.23 | AF008497 | |
| PF7bh | 99.39 | AF008497 | |||
| F. solani | [FSSC] | LF5bh | 99.85 | JF740774 | |
| NF21bh | 99.86 | JF740846 | |||
| Cuello | F. oxysporum | [FOSC] | LF9b | 99.23 | AF008497 |
| NF10b | 100 | AF246837 | |||
| PF11b | 99.85 | JF740855 | |||
| Cogollo | F. oxysporum | [FOSC] | NF12cb | 99.85 | AF008497 |
| F. solani | [FSSC] | NF22ca | 99.86 | JF740846 | |
| Piña | Fusarium | sp. [FSSC] | PF23d | - | - |
| Fusarium | sp. [FSSC] | PF24d | - | - | |
| Tejido externo | F. verticillioides | [FOSC] | PF17s | 99.85 | MH582325 |
| PF19s | 100 | MH582325 | |||
| F. oxysporum | [FOSC] | NF13s | 99.54 | AF008497 | |
| PF20s | 99.85 | AF008497 | |||
| Fusarium | sp. [FIESC] | LF14s | 97.92 | MH582434 | |
| NF16s | - | - | |||
| NF18s | 97.73 | MH582433 | |||
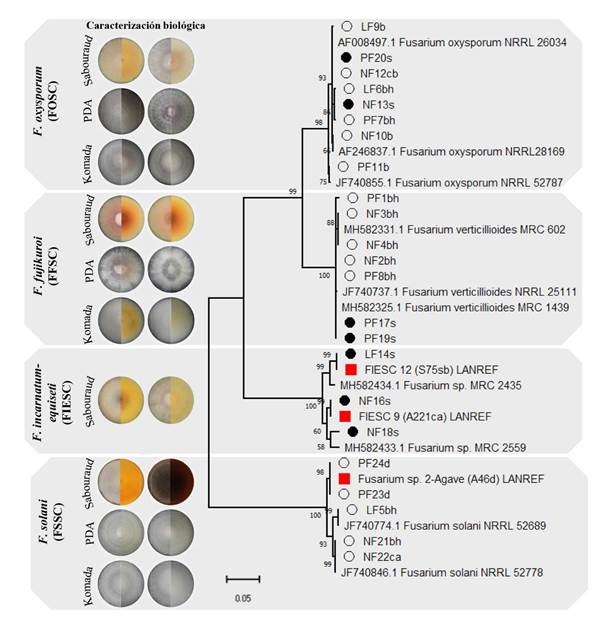
Figura 5 Filogenia de 23 cepas de Fusarium spp. asociadas a tejido externo (lavado) e interno de hijuelos de Agave tequilana basada en el gen EF-1a, máxima verosimilitud y general time reversible model (GTR) + gama distributed with invariant (G+I), con 1000 repeticiones bootstrap. Viñeta negra indica cepas de suelo, viñeta blanca cepas de tejido interno, en rojo especies filogenéticas y sin identificar de planta adulta de A. tequilana reportada por López-Bautista et al., 2020. El resto, sin marcas, son secuencia de referencia del GenBank.
La cobertura regional de 14 municipios de Jalisco y dos años de investigación con un total 7055 hijuelos y 46 656 colonias fungosas proporcionan buen soporte a los resultados de carga de inóculo y prueban la aplicabilidad de la metodología CIFUSAG. En contraste, la caracterización molecular se limitó a la población de Fusarium obtenida de 30 hijuelos de un predio de alta inductividad de Los Altos. Interesantemente, la composición y diversidad del complejo de especies encontrado fue análogo al encontrado por López-Bautista y colaboradores (López-Bautista et al., 2020). Sin embargo, es necesario ampliar los estudios de caracterización molecular con mayor cobertura regional y con otros genes adicionales al factor de elongación empleado en este trabajo. De particular interés son las especies de Fusarium con capacidad de internalización ya que pueden ser diseminadas con mayor eficiencia y representar un mayor reto de control. Sistemas productivos similares a agave, respecto al uso de material propagativo asociado con Fusarium spp. se ha reportado en cultivos como Musa paradisiaca (Bermúdez, 2014), Tulipa sp. (Bergman and Bekker, 1978) y Aloe vera (Avasthi et al., 2018). Sin embargo, en general se reporta la asociación cualitativa de Fusarium sin estimar cargas de inóculo que permitan establecer criterios de accionabilidad con propósitos preventivos. Similarmente, estudios de diversidad taxonómica están generalmente acotados a la identificación de la especie o raza de interés.
Con más de 96 millones de hijuelos de A. tequilana plantados entre 2018 y 2019, este es el principal medio de propagación y por tanto de movilización potencial de Fusarium spp. y posiblemente de otras plagas, debido a restricciones operativas, agronómicas y/o fitosanitarias del empleo de semilla botánica o del cultivo in vitro. En este contexto, los resultados de esta investigación obligan a profundizar en la comprensión del rol del hijuelo en la sostenibilidad productiva de una región con denominación de origen y limitado margen de expansión territorial. Está ampliamente documentado que Fusarium exhibe diversidad de estrategias adaptativas que garantizan su establecimiento y éxito parasítico una vez introducido en un nuevo nicho agroecológico. Un ejemplo reciente lo representa F. oxysporum f. sp. cubence Raza 4 Tropical (FOCR4T) con efectiva movilización y adaptación a suelos bananeros del mundo (Bermúdez, 2014). Similarmente se ha postulado, con base en estudios poblacionales filogenéticos y estructurales que Fusarium puede presentar procesos evolutivos divergentes-convergentes en A. tequilana y otros cultivos (Liew et al., 2016; López-Bautista et al., 2020). El síndrome SMAP en planta adulta es justamente una evidencia de la capacidad parasítica adaptativa de Fusarium spp. en la cual el hijuelo puede tener una implicación importante al movilizar haplotipos de diferentes especies del hongo propiciando cambios dinámicos en la estructura de prevalencia regional.
La experiencia mundial en el manejo de Fusarium evidencia que la prevención es la estrategia más rentable y biológicamente viable bajo un esquema impositivo regulatorio o voluntario, pero de adopción generalizada entre sectores productivos. Australia logró confinar un brote regional de FOCR4T por más de 20 años con fuertes medidas preventivas con restricción del movimiento de hijuelos para siembra como estrategia principal (M. Dita. 2017. Comunicación Personal). Sin embargo, estudios regionales en la región DOT de Jalisco sugiere la amplia distribución de haplotipos de diferentes especies de Fusarium por lo que el concepto de área libre como base de establecimiento de plantas madre y restricción en movilidad de hijuelos podría tener poca viabilidad (Vega-Ramos et al., 2013; Ramírez-Ramírez et al., 2017; López-Bautista et al., 2020). La alternativa sería optimizar el principio de baja prevalencia con el conocimiento patogénico a nivel de haplotipos y sus niveles de prevalencia regional. Así mismo, implica el profundo conocimiento de los mecanismos físico-químicos y biológicos de supresividad de suelos para operar sobre la salud de suelo como estrategia de mitigación (Fang et al., 2012; Huang et al., 2019). Por ejemplo, pH neutros-alcalinos y materia orgánica superiores a 2.5 no favorece altos índices de Fusarium spp. (IF) en suelos agaveros de Jalisco siendo tipificados con inductividad baja (López-Bautista et al., 2020). Si bien el hijuelo mantiene su conexión fisiológica con la planta madre hasta su corte con fines comerciales existe también una interacción con el suelo que debe ser entendida integralmente. En este trabajo, el calibre del hijuelo, definido por el tamaño de su base ‘bulbar’, pretendía demostrar que a más joven (Lima) menor exposición microbiológica del suelo y mayor vigor conferido por factores maternos, y por tanto menor presencia de Fusarium justificando su uso en nuevas plantaciones. Los resultados demostraron que calibre no tuvo efecto sobre carga de inóculo ni sobre la composición de especies. La condición infectiva o endofítica, sin embargo, aun requiere ser dilucidado. Por el contrario, la inductividad epidémica SMAP si tuvo un efecto en la carga de inóculo de hijuelos. Sorpresivamente, la región considerada como moderada (Sur, 6.83±4.22) superó marginalmente a la más inductiva (Los Altos, 5.58±2.42) en la cantidad de UFC/hijuelo. La región menos inductiva (Valles, 3.3±3) tuvo 59 y 48% menos carga de inóculo. No obstante, la menor variabilidad de UFC en Los Altos sugiere mayor prevalencia y endemicidad de Fusarium spp. En esta región, la selección de plantaciones madre a partir de plantaciones comerciales podría representar un mayor reto de mitigación y restitución de la salud de suelo.
Considerando la importancia de la industria del agave y los antecedentes epidémicos de SMAP se han implementado campañas fitosanitarias oficiales y se han propuesto iniciativas regulatorias con fines preventivos (SENASICA-DGSV, 2017). En 2003 se propuso la NOM-083-FITO-2003, un proyecto de la Norma Oficial Mexicana que tiene como fin delimitar los requisitos fitosanitarios para la producción y movilización de material propagativo de Agave tequilana Weber variedad azul en la región DOT. Éste proyecto de norma no se ha publicado y su aprobación es incierta. La NOM-083 tiene como objetivo: ‘Establecer los requisitos fitosanitarios para la producción y movilización de material propagativo de Agave tequilana Weber variedad Azul, con la finalidad de proteger su condición fitosanitaria y evitar la dispersión de plagas de importancia económica que lo afectan’. En este contexto plaga tiene una acepción amplia e implica principalmente a Cercospora agavicola, Fusarium spp. y Scyphophorus acupunctatus (Coleoptera: Curculionidae). La propuesta normativa tiene como eje rector la certificación de plantaciones madre, la cual se define como: ‘Condición temporal de un sitio de producción cultivado con Agave tequilana variedad azul, ubicada dentro de la zona con Denominación de Origen Tequila de la cual se pueden extraer hijuelos o donación de tejido para la producción in vitro de agave’. Este marco regulatorio podría ser una opción fundamental para la gestión fitosanitaria sustentable de la DOT si se incorpora la comprensión científica del riesgo que representa el hijuelo y la integración de plantaciones madre en un programa de vigilancia epidemiológica para optimizar el monitoreo, umbrales de prevalencia y criterios de accionabilidad fitosanitaria. Este trabajo e investigaciones previas desarrolladas en la red regional de vigilancia SIVEA (SENASICA-DGSV, 2017), la cual actualmente es operada únicamente por el estado de Guanajuato, proporcionan criterios biológicos y epidemiológicas para la identificación de zonas de riesgo y baja prevalencia como línea base para el establecimiento de plantaciones madre (Coria-Contreras et al., 2019; López-Bautista et al., 2020). El carácter mundial emergente de Fusarium spp., su complejidad taxonómica y plasticidad adaptativa obliga a buscar estrategias efectivas de exclusión y mitigación con base en sólidos criterios etiológicos, epidemiológicos y agroecológicos. Un visión holística y sistémica es obligada en la región DOT para garantizar su sustentabilidad y resiliencia.
CONCLUSIONES
Este es el primer trabajo que demuestra la asociación de cuatro complejos de especies de Fusarium spp. con hijuelos comerciales de Agave tequilana. Se desarrolló y validó el método CIFUSAG para estimar la carga de inóculo en hijuelo el cual puede ser aplicable a estudios de prevalencia microbiológica, manejo de riesgos, control y certificación con énfasis en Fusarium spp. La inductividad epidémica al síndrome de marchitez y pudrición seca del agave (SMAP) tuvo una tendencia proporcional con carga de inóculo de Fusarium spp., mientras que el calibre de hijuelo no tuvo un efecto diferencial. El estudio de factores físico-químicos y biológicos del suelo requieren integrarse para comprender los riesgos asociados a la carga de inóculo en hijuelo. Se recomiendan pruebas de patogenicidad selectivas para establecer la especie(s) de Fusarium que representan mayor sobrevivencia, infectividad y colonización en hijuelos comerciales. Esta investigación justifica el análisis profundo a nivel científico, técnico y regulatorio de plantaciones madre con propósito comercial y el movimiento de hijuelos con fines propagativos que permita en forma efectiva manejar el riesgo de dispersión, establecimiento y/o intensidad de daño potencial de al menos cuatro especies de Fusarium asociadas a hijuelos de A. tequilana. Es importante establecer estrategias biológicas y químicas de manejo de hijuelos con fines preventivos que permitan una efectiva gestión sanitaria de la región Denominación de Origen del Tequila (DOT).











 text in
text in 


