Las abejas colectan productos de plantas que emplean para su crecimiento y desarrollo, siendo los más importantes el néctar, polen, resinas y, en algunos casos, aromas de flores requeridos en cortejo y apareamiento (Borkraâ y Sulaiman, 2010; Dötterl y Vereecken, 2010; Villanueva-Gutiérrez et al., 2015). Esta interacción planta y abeja genera a su vez productos con diferentes características físicoquímicas, sensoriales y capacidades bioactivas, los cuales dependen de la especie vegetal, condición nutricional, origen geográfico y de los grupos taxonómicos de especies de abejas. Entre las más estudiadas se encuentran Apis mellifera (Apidae:Apinae) y los meliponinos (Apidae: Meliponini), abejas sin aguijón de trópicos y subtrópicos (Ayala et al. 2013; Komosinska et al., 2015; Da Silva et al., 2016).
Desde épocas ancestrales, los productos de colmena de diversas especies de abejas se han empleado como material de intercambio y ofrendarios divinos, así como en el tratamiento de diversas enfermedades (Borkraâ y Sulaiman, 2010). Actualmente, sus productos tienen diversos usos médicos, incluyendo tratamiento de pie diabético y heridas, antioxidante, antiinflamatorio y actividad antimicrobiana (Molan y Bets, 2004; Basim et al., 2006; Vit et al. 2008; Grajales-Conesa et al., 2018). Por otra parte, estudios recientes con productos de abejas sin aguijón, han demostrado que estos promueven mayor tasa de epitelización en heridas y efecto antiinflamatorio y antimicrobiano que la abeja europea o melífera (Rao et al., 2016). La actividad antimicrobiana se ha evaluado in vitro contra distintas bacterias de importancia médica: Listeria monocytogenes, Escherichia coli, Salmonella enterica, Pseudomonas aeruginosa, Streptococcus pyogenes, Proteus mirabilis, Staphylococcus aureus y diferentes especies fungosas del género Candida (Cabrera y Montenegro 2013; Zainol et al., 2013; Vit et al., 2016). Extractos metanólicos y etanólicos de polen, así como mieles de A. mellifera y de diversas especies de abejas sin aguijón han tenido efectiva actividad antimicrobiana contra hongos de interés médico y agrícola: Alternaria alternata, Botrytis cinerea, Fusarium oxysporum y C. gloeosporioides (Cabrera y Montenegro 2013; Albores-Flores et al., 2018). De los productos de colmena, el polen está compuesto por subproductos del gametangio masculino floral que colectan las abejas y cuenta con un alto contenido nutrimental, constituido por carbohidratos (13 y 55%), proteínas (10 y 40%), lípidos (1-10%) y fibra cruda (0.3 y 20%), además de minerales, oligoelementos, vitaminas, carotenoides, compuestos fenólicos, flavonoides, esteroles y terpenos (Bogdanov, 2004). Además de ser fuente alimenticia para las abejas, el agregado de polen es importante en la alimentación humana (Pascoal et al., 2014).
En el Soconusco, Chiapas, la meliponicultura se realiza en zonas aledañas a cultivos de la región, siendo café (Coffea spp.), mango (Mangifera indica), rambután (Nephelium lappaceum) y banano (Musa spp.) los principales. Se han desarrollado diversos estudios para caracterizar los productos de colmena de especies de abejas sin aguijón mayormente cultivadas en esta región, tales como: Melipona beecheii, M. solani, Scaptotrigona mexicana y Tetragonisca angustula (Grajales-Conesa et al., 2018; Espinoza-Toledo et al., 2018; Albores-Flores et al., 2018).
Por otro lado, Colletotrichum gloeosporioides es la especie fungosa más frecuente que causa antracnosis a nivel de campo y postcosecha en frutales y hortalizas (Beltrán y García, 2006; Chacini et al., 2013). A pesar de prácticas de manejo específicas para evitar la incidencia de esta enfermedad, incluyendo aplicación de fungicidas de contacto y sistémicos, no se ha logrado disminuir pérdidas de cosecha y postcosecha superiores al 40 y 60%, respectivamente (Huerta et al., 2009; Trinidad-Ángel, 2017). Por la condición tropical y subtropical del Soconusco, la incidencia de este hongo es frecuente en cultivos de la región, principalmente frutícolas (Huerta et al., 2009).
Por lo anterior, es necesario desarrollar estudios de eficacia biológica de nuevos productos con potencial para el control de C. gloeosporioides y que además representen una alternativa para los sistemas de producción orgánica. Este trabajo complementa estudios previos del efecto antifúngico a partir de extractos de miel producidas por las especies de abejas sin aguijón M. beecheii, M. solani y S. mexicana del Soconusco (Albores-Flores et al., 2018). Esta investigación se enfocó en caracterizar extractos de agregados de polen a nivel fisicoquímico e identificar potenciales compuestos bioactivos con efecto antifúngico contra C. gloeosporioides a partir de material colectado de colmenas comerciales de M. beecheii, S. mexicana y Tetragonisca angustula, una especie no estudiada previamente respecto al hongo.
MATERIALES Y MÉTODOS
Muestras de agregados de polen de abeja sin aguijón. Las muestras de agregados de polen de colmenas comerciales de tres especies de abejas sin aguijón M. beecheii, S. mexicana y T. angustula se colectaron de febrero 2017 a febrero de 2018. La identificación de especies se basó en trabajos previos regionales y con información taxonómica de la subfamilia (Espinoza-Toledo et al., 2018; Ayala et al. 2013). La localización de colmenas, número de muestras por especie y fechas de colecta se indican en el Cuadro 1. Las muestras de agregados de polen se colectaron con pinzas estériles de cajas racionales (cajas de abejas) y después se colocaron en frascos de plástico estériles previamente etiquetados con la información correspondiente. Las muestras se concentraron y almacenaron a -4 ºC en el Instituto de Biociencias de la Universidad Autónoma de Chiapas, Tapachula.
Cuadro 1 Especie de abeja melipona, número y ubicación de meliponarios comerciales y la composición vegetal pre dominante en el área de las colmenas muestreadas en Chiapas, México.
| Especie (número meliponarios) | Clave de Muestra | Establecimiento de la colmena | Fecha de colecta de polen | Tipo agroecológico (predominante) |
|---|---|---|---|---|
| Tetragonisca angustula | TA1 | Mazatán | Febrero 2017 | Frutales (mango) |
| TA2 | Rancho San Juan, Mazatán | Abril 2017 | ||
| (n=3) | TA3 | Rancho San Juan, Mazatán | Junio 2017 | |
| Scaptotrigona mexicana | SM1 | Cacahoatán | Mayo 2017 | Frutales (rambután) |
| SM2 | Tapachula | Mayo 2017 | ||
| (n=6) | SM3-SM6 | Mazatán | Agosto 2017 | |
| Melipona beecheii | MB1-MB3 | Estancia Agroecológica “Ayol” | Enero-Febrero 2018 | Agrícola (temporal) |
| (n=3) |
Análisis fisicoquímico. Se determinaron por triplicado usando métodos descritos por la AOAC (2003) con los siguientes parámetros: humedad (método 969.38), cenizas (945.38), pH (método 962.19) y acidez libre (método 962.19). La determinación de acidez libre se realizó según Bogdanov (2002) y AOAC (2003) mediante la valoración potenciométrica con un buffer alcalino hasta pH 8.5.
Extracción de fenoles totales. Se utilizó el protocolo modificado de Carpes et al. (2007). La preparación de solución de agregado de polen se realizó colocando 1g de agregado en 5 mL de metanol:agua (1:1) a pH 2. Para flavonoides se utilizó etanol al 80% dejando en reposo por 24 h.
Análisis del contenido de fenoles. Se determinó por el método de Restrepo et al. (2009) con el reactivo Folin Ciocalteu. A partir del extracto de agregado de polen se tomó 1 mL para preparar concentraciones a 25, 50, 75 y 100 %. Cada concentración se mezcló con 500 μL del reactivo de Folin-Ciocalteu diluido 1/10 con agua y se añadió 400 μL de Na2CO3. La mezcla se mantuvo en oscuridad total durante 15 min para propiciar la reacción. Posteriormente, se registró la absorbancia a 765 nm. Una mezcla de metanol:agua (1:1) se empleó como blanco (testigo). Se realizó la curva de calibración para estimar el contenido de polifenoles con una solución de ácido gálico a las concentraciones 0, 50, 100, 150, 200, 250 mg L-1 en una solución de metanol:agua (1:1). Los resultados del contenido total de polifenoles se expresaron en mg equivalentes de ácido gálico por cada 1 g de agregado de polen.
Análisis del contenido de flavonoides. Se determinó por la técnica de Restrepo et al. (2009). Para esto se empleó dihidrato de quercetina como estándar (1 mg mL-1). Se realizó una curva de calibración con una solución de quercitina/metanol a diferentes concentraciones: 0, 0.002, 0.004, 0.006, 0.008, 0.01 mg mL-1. Posteriormente se añadió acetato de potasio y tricloruro de aluminio y se dejó en oscuridad total durante 30 min. La absorbancia se registró a 415 nm.
Capacidad antioxidante. La cuantificación de la actividad antioxidante se realizó mediante la decoloración del radical 2.2´-azino-bis (3-etilbenzotiazolin-6-ácido sulfónico) con la metodología ABTS (Overveld et al., 2000). Los extractos resultantes de los agregados de polen, a concentraciones 25, 50, 75 y 100 %, se adicionaron con 20 mL de ABTS (2 mM) y 80 μL de persulfato de potasio 70 mM. Se dejaron en reposo y oscuridad a 25 ºC durante 16 h para producir el radical ABTS+. La absorbancia (ʎ = 734 nm) de la solución se ajustó a 0.800 ± 0.03 unidades de absorbancia en un espectrofotómetro (Thermo Scientific Modelo 4001/4) con ayuda de una solución reguladora de fosfatos 0.01 M (Na2PHO4+KH2PO4+NaCl+KCl en 1000 mL de agua destilada; pH 7.4 ajustado con NaOH). Para la construcción de la curva de calibración se agregaron 990 μL de la solución diluida de ABTS+ y se adicionaron 10 μL de solución Trolox (6-hidroxi-2, 5, 7, 8-tetrametilcromo-2-ácido carboxílico) a diferentes concentraciones (0-400 µM en metanol al 80 % v/v). Después de 6 min de reposo, la absorbancia se leyó a 734 nm empleando metanol al 80% v/v como blanco. Los resultados se expresaron como la capacidad antioxidante equivalente a Trolox por g de extracto de polen.
Actividad antifúngica. La cepa de C. gloeosporioides, perteneciente a la colección del Instituto de Biociencias, aislada de frutos de Carica papaya e identificada morfológicamente por Víctor Albores (Datos no publicados), se reactivó en medio nutritivo papa dextrosa agar (PDA). La actividad antifúngica se evaluó mezclando extractos metanólicos de agregados de polen colectados de cada especie de abeja con PDA in vitro. Los tratamientos, por triplicado, consistieron en mezclas de 100 μL de extractos a 25, 50, 75 y 100 % con 20 mL de PDA previamente preparado. Posterior a la siembra de la cepa, consistente en discos coloniales de 0.5 cm colocadas al centro de cajas Petri de 52 mm, se incubó a 32 °C en una estufa durante 12 días. El crecimiento micelial se midió cada 24 h con un Vernier con capacidad de 0-150 mm durante nueve días. Como testigo absoluto se empleó el crecimiento de una colonia de C. gloeosporioides en PDA bajo las mismas condiciones experimentales. Los testigos relativos de inhibición, por triplicado, fueron: 1) solución de metanol/agua, 2) clorotalonil a 21 mg mL-1 y 3) clorotalonil a 56 mg mL-1, estos dos últimos acordes a dosis comerciales aplicadas al cultivo de C. papaya por la Asociación de fruticultores del Soconusco, Chiapas.
La velocidad de crecimiento absoluto. Se determinó mediante la siguiente ecuación: μ = (Db-Da) / (tb - ta). Dónde: μ es velocidad de crecimiento de colonia (mm día-1); Db es el diámetro de la colonia (mm) en el tiempo b; Da, corresponde al diámetro de la colonia en el tiempo a, y, tb y ta es el tiempo de crecimiento absoluto entre dos evaluaciones. Para el cálculo comparativo del crecimiento de C. gloeosporioides de los cuatro extractos (1-4) respecto a los testigos relativos (1-3) se utilizó la siguiente ecuación: DFC = [(D testigo relativo1-3 - D extracto1-4) / (D testigo relativo1-3)] x 100. Donde, DFC es la diferencia en el diámetro (mm) de la colonia entre el D testigo relativo1-3 y el D extracto del agregado de polen1-4 expresado en porcentaje.
Análisis de datos. Los datos de todas las variables fisicoquímicas se analizaron por análisis de varianza multivariado (AMOVA) considerando cada especie-colecta como un tratamiento. La comparación de medias se realizó por la prueba Hotelling (α=0.05). Para determinar la separación o agrupación de colectas y especies se utilizó un análisis discriminante (ADL). Se realizó un análisis de componentes principales (ACP) para explicar el peso relativo de las variables fisicoquímicas en la composición de los agregados de polen dentro y entre especies. La relación del crecimiento micelial con fenoles, flavonoides, Trolox y actividad antioxidante se estimó con r-Spearman. Se realizó un análisis ANOVA por especie de abeja y fecha de evaluación del crecimiento para comparar el efecto de las cuatro concentraciones de extractos de agregados de polen con los testigos relativos. Todos los análisis de realizaron en INFOSTAT.
RESULTADOS
El resultado del análisis fisicoquímico de agregados de polen colectado por M. beecheii, S. mexicana y T. angustula se observa en el Cuadro 2. De manera general, los valores de humedad fueron de 12.2 a 31.4%, cenizas de 0.9 a 5.9%, pH estuvo en rango de 2.2 a 3.5, acidez libre de 117 a 233.4 meq Kg-1, fenoles de 1.2 a 2.6 mg EAG g-1, flavonoides de 0.9 a 3.1 µg EQ g-1, trolox de 4.3 a 8.1 mg Trolox g-1 y en concentración de glucosa de 0.01 a 0.3 mg L-1. En el análisis multivariado se encontró significancia de la especie de abeja-colecta en el contenido fisicoquímico (p=0.0001). Todas las combinaciones especie-colecta fueron estadísticamente diferentes (p=0.05), observándose que los valores multivariados fueron mayores en M. beecheii y menores para T. angustula. La cantidad de fenoles y flavonoides estuvieron relacionadas positivamente con la actividad antifúngica (p≤0.02), mientras que la capacidad antioxidante (Trolox) tuvo una r-Spearman negativa (-0.41 a -0.61) (Cuadro 3). En la mayoría de los extractos asociados a la especie S. mexicana y M. beecheii, la actividad antioxidante presentó correlación negativa con la actividad antifúngica.
Cuadro 2 Valores físicoquímicos del polen colectado por Melipona beecheii (Mb), Scaptotrigona mexicana (Sm) y Tetragonis ca angustula (Tar) en diferentes regiones del Soconusco, Chiapas.
| Variables fisicoquímicas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Clave de muestra | pH | Humedad (%) | Cenizas (%) | Acidez Libre (meq kg-1) | Trolox (mg g-1) | Fenoles (mg EAG g-1) | Flavonoides (mg EQ g-1) | Glucosa (mg L-1) | Prueba hotelling |
| MB1 | 2.2 | 31.4 | 0.9 | 127.1 | 6.8 | 2.2 | 1.8 | 0.04 | C |
| MB2 | 2.6 | 19.6 | 1.1 | 233.3 | 5.8 | 2.6 | 2.9 | 0.1 | B |
| MB3 | 2.5 | 12.2 | 3.4 | 206.2 | 6.4 | 2.5 | 3.1 | 0.01 | A |
| TA1 | 3.3 | 21.1 | 2.5 | 126.6 | 7.9 | 1.9 | 1.3 | 0.2 | J |
| TA2 | 3.4 | 24.7 | 4.1 | 146.4 | 7.4 | 1.8 | 1.7 | 0.2 | K |
| TA3 | 3.3 | 26.2 | 3.9 | 133.2 | 8.0 | 2.2 | 1.6 | 0.3 | L |
| SM1 | 3.3 | 30.6 | 1.8 | 142.8 | 7.4 | 1.2 | 1.5 | 0.1 | F |
| SM2 | 3.3 | 27.0 | 2.1 | 159.9 | 6.8 | 1.5 | 1.2 | 0.01 | E |
| SM3 | 3.5 | 12.2 | 2.4 | 146.4 | 8.1 | 1.4 | 1.3 | 0.02 | D |
| SM4 | 3.3 | 23.7 | 2.8 | 117.9 | 4.3 | 1.3 | 1.0 | 0.3 | I |
| SM5 | 3.5 | 27.5 | 5.9 | 183.1 | 5.3 | 2.1 | 1.1 | 0.06 | H |
| SM6 | 3.5 | 24.3 | 3.4 | 129.9 | 5.5 | 2.0 | 0.9 | 0.03 | G |
xLa información de referencia de cada muestra de extracto de polen se describe en el Cuadro1.
Con el análisis discriminante se explicó el 91.1% de varianza en los primeros dos componentes, CAN 1 (80%) y CAN 2 (11.1%). El mayor peso en CAN 1 lo aportaron fenoles, flavonoides y acidez libre. La conformación de grupos incluyó claramente las tres repeticiones por cada especie-colecta, pero mostró amplia variación entre colectas intra- e inter-especie. En concordancia con MANOVA, las colectas correspondientes a colmenas de M. beecheii se separaron del resto distribuyéndose en la dimensión positiva de CAN 1. En CAN 2, con un mayor peso de pH, cenizas y glucosa, se distribuyeron las otras dos especies-colectas, siendo S. mexicana la que tuvo mayor dispersión (Figura 1A).
Con el análisis de componentes principales, los primeros dos componentes explicaron el 58% de la varianza multivariada (CP1=43.5; CP2=14.8%). CP1 fue explicado principalmente por flavonoides, pH y acidez libre, mientras que CP2 estuvo determinado por cenizas y glucosa. Fenoles tuvo similar peso en ambos componentes (Figura 1B). La proyección de las colectas en este espacio multivariado desmarcó muestras de M. beecheii de colmenas establecidas en una estancia agroecológica con predominancia de cultivos anuales agrícolas (MB3 y MB2). El resto de colectas tuvieron poca dispersión en torno a valores bajos de CP1 y CP2.
Cuadro 3 Valores del coeficiente de correlación entre la concentración de fenoles, flavonoides y Trolox con la actividad antifúngica de los extractos de polen de cada especie de abeja.
| Clave de Muestra | Fenoles | Flavonoides | Trolox | |||
|---|---|---|---|---|---|---|
| Spearman | Valor p | Spearman | Valor p | Spearman | Valor p | |
| MB1 | 0.82 | <0.0001 | 0.77 | 0.0018 | -0.51 | 0.0154 |
| MB2 | 0.86 | <0.0001 | 0.81 | 0.0001 | -0.46 | 0.0525 |
| MB3 | 0.86 | <0.0001 | 0.80 | 0.0001 | -0.51 | 0.0154 |
| TA1 | 0.74 | 0.0012 | 0.76 | 0.0018 | -0.44 | 0.0722 |
| TA2 | 0.74 | 0.0012 | 0.72 | 0.0032 | -0.42 | 0.0915 |
| TA3 | 0.78 | 0.0001 | 0.70 | 0.0040 | -0.41 | 0.1458 |
| SM1 | 0.80 | <0.0001 | 0.70 | 0.0040 | -0.44 | 0.0722 |
| SM2 | 0.80 | <0.0001 | 0.70 | 0.0040 | -0.51 | 0.0154 |
| SM3 | 0.81 | <0.0001 | 0.66 | 0.0051 | -0.42 | 0.0915 |
| SM4 | 0.88 | <0.0001 | 0.62 | 0.0073 | -0.61 | 0.0003 |
| SM5 | 0.91 | <0.0001 | 0.62 | 0.0073 | -0.55 | 0.0083 |
| SM6 | 0.88 | <0.0001 | 0.58 | 0.0241 | -0.56 | 0.0083 |
yLa información de referencia de cada muestra de extracto de polen se describe en el Cuadro1.
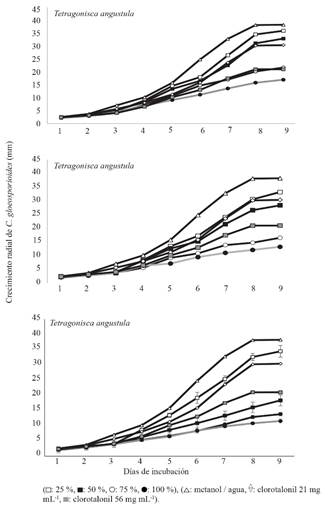
Actividad antifúngica. En las tres especies de abejas y cuatro concentraciones evaluadas de extractos metanólicos se detectó inhibición de C. gloeosporioides respecto a los testigos. A partir del tercer día de incubación y hasta su término a los nueve días, se observaron diferencias estadísticas en el crecimiento micelial del hongo respecto al testigo metanol/agua (p<0.0001) (Cuadro 4). Al cuarto día en adelante, las concentraciones 25, 50, 75 y 100% comenzaron a diferenciarse del mismo testigo. Las diferencias estuvieron en el rango 20-64% dependiendo del tiempo de crecimiento más que de la especie (Figura 2). Desde el quinto o sexto día, las concentraciones 75 y 100% superaron o igualaron el efecto inhibitorio del clorotalonil en su concentración más alta (56 mg mL-1). Extractos de S. mexicana a 50% fueron los únicos que también superaron la inhibición causada por el fungicida a esa concentración. Los extractos de T. angustula fueron los que tuvieron el menor efecto respecto a clorotalonil ya que únicamente la concentración 100% superó la dosis alta (Figura 2). Se detectó un efecto colecta-especie en la capacidad inhibitoria del hongo. Por ejemplo, la colecta MB1 de M. beecheii tuvo mayor efecto que MB1 y MB2 (Figura 3). Al comparar el crecimiento micelial final de los testigos relativos con el testigo absoluto (5.1 cm) se encontró que metanol/agua (3.8 cm) redujo el crecimiento del hongo en 25.4% y el clorotalonil en 35.3 % (3.3 cm, 21 mg mL-1) y 58.8 % (2.1cm, 56 mg mL-1). En general, la velocidad de crecimiento micelial de C. gloeosporioides estuvo en el rango de 0.027-0.041, 0.022-0.037, 0.012-0.025, y 0.009-0.013 mm h-1 en las concentraciones 25, 50, 75 y 100%, respectivamente.
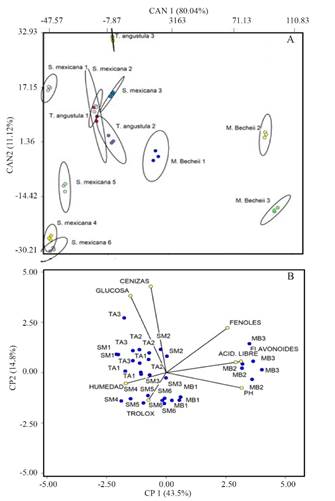
Figura 1 Análisis discriminante canónico para las tres especies de abeja colectoras de polen (A) y análisis de componentes principales de la actividad antimicrobiana de los extractos metanólicos de polen (B). La información de referencia de cada muestra de extracto de polen se describe en el Cuadro1.
Cuadro 4 Valores de diferencia en diámetro de colonia (DFC) de Colletotrichum gloeosporioides (expresados en valores de porcentaje) entre los extractos de polen colectados por las abejas y los tratamientos testigo (cloratalonil=Clor). (Se colocan únicamente en las concentraciones donde los extractos de polen de cada especie de abeja son menores en tamaño de colonia a la mayoría de los tratamientos testigo, los valores positivos indican que el diámetro de colonia con los extractos fue menor al testigo).
| Clave de muestra | Extracto | Metanol/agua (E-a) | Clor (21 mg mL-1)(E-b) | Clor(56 mg mL-1 (E-c) | Clave de muestra | Extracto | Metanol/agua (E-a) | Clor (21 mg mL-1) (E-b) | Clor (56 mg mL-1) (E-c) |
|---|---|---|---|---|---|---|---|---|---|
| MB1 | 75 | 51.9 | 40.4 | 14.4 | SM1 | 75 | 48.1 | 35.7 | 7.6 |
| 100 | 65.5 | 56.5 | 37.5 | 100 | 57.0 | 45.8 | 22.1 | ||
| MB2 | 75 | 60.9 | 51.5 | 30.3 | SM2 | 75 | 46.1 | 33.3 | 4.0 |
| 100 | 65.6 | 56.6 | 37.6 | 100 | 57.7 | 46.6 | 23.3 | ||
| MB3 | 75 | 58.2 | 48.2 | 25.6 | SM3 | 75 | 49.4 | 37.3 | 9.8 |
| 100 | 64.2 | 54.9 | 35.1 | 100 | 60.3 | 49.9 | 28.1 | ||
| TA1 | 75 | 42.8 | 29.1 | -1.9 | SM4 | 75 | 53.3 | 42.1 | 16.8 |
| 100 | 54.7 | 42.9 | 17.9 | 100 | 62.4 | 52.7 | 32.0 | ||
| TA2 | 75 | 43.5 | 29.9 | -0.7 | SM5 | 75 | 54.2 | 43.2 | 18.4 |
| 100 | 53.1 | 40.8 | 14.9 | 100 | 62.8 | 53.1 | 32.6 | ||
| TA3 | 75 | 39.7 | 25.2 | -7.5 | SM6 | 75 | 56.2 | 45.7 | 22.0 |
| 100 | 53.1 | 40.8 | 14.9 | 100 | 61.8 | 51.8 | 30.7 |
zLa información de referencia de cada muestra de extracto de polen se describe en el Cuadro1
DISCUSIÓN
La composición fisicoquímica de los agregados de polen colectados de colmenas comerciales de abeja sin aguijón fue heterogénea a nivel intra- e inter-especie debido a la capacidad de exploración territorial de las abejas y a la recolección de polen de diferentes especies vegetales (Cuadro 1). Sin embargo, se pudieron clasificar las especies en grupos, observándose que M. beecheii se segregó del resto de las especies. El efecto de especie puede estar asociado a nichos de explotación vegetal con el fin de evitar competencia interespecífica más que a algún efecto metabólico. Previamente se reportó que esta especie es monofloral con preferencia en fabáceas 45%, en contraste a M. solani y S. mexicana (Espinoza-Toledo et al., 2018). La composición fisicoquímica a nivel de agregados de polen tiene implicación en su calidad y valor nutrimental, terapéutico, antioxidante y antimicrobiano (Mărgăoan et al., 2010; Saavedra et al., 2013). La heterogeneidad fisicoquímica también se ha reportado en estudios de miel producida por meliponinos en el Soconusco (Espinoza-Toledo et al., 2018), y se ha reconocido el valor de estos atributos con fines ecológicos (Vit, 2008).

Figura 3 Crecimiento in vitro de Colletotrichum gloeosporoides en presencia de extracto metanólico de agregado de polen de Melipona beecheii (MB100) (100%), así como los controles metanol/agua (M-A) y cloratolonil 56 mg mL-1 (Cl56).
La correlación obtenida de las variables fisicoquímicas con la capacidad antioxidante de los extractos de agregados de polen sugiere que los fenoles, flavonoides y acidez libre ejercen mayor acción inhibitoria en el crecimiento micelial de C. gloesporioides (Cuadro 3) (Mărgăoan et al., 2010). Lo anterior podría estar relacionado con el tipo de compuestos fenólicos extraídos de los agregados de polen, que no tengan la propiedad de ser donadores de electrones y sean ácidos, evitando reaccionar con el radical oxidado ABTS. Este compuesto actúa sobre polifenoles donadores de átomos de hidrógeno mientras que el complejo férrico en FRAP actúa sobre los polifenoles capaces de donar electrones (Schaich et al., 2015). No se pudo atribuir que la capacidad oxidante observada en las muestras de extracto de agregado de polen de abeja sin guijón se deba a un componente en particular. La capacidad antioxidante es el resultado de la interacción entre moléculas que componen cada muestra (Paulino-Zunini et al., 2010). Por lo anterior, la baja relación obtenida con la actividad antifúngica estaría definida por diversos factores como la composición química de la muestra, región geográfica y fuente vegetal del polen (Bertrams et al., 2013; Duran et al., 2011).
La menor relación entre la capacidad antioxidante y la antifúngica en extractos de agregado de polen de T. angustula puede deberse a la composición de la muestra (Mărghitaş et al., 2009). Por otra parte, también puede haber un efecto metodológico ya que de acuerdo al solvente se puede determinar la molécula extraída (Muñoz et al., 2015). El efecto inhibitorio de extractos de agregados de polen es consistente con otros reportes donde se reconoce que el tipo de biomolécula y su bioactividad puede ser variable permitiendo diferenciar regiones y taxas pero implicando el efecto de la muestra (Pellati et al., 2011; Li et al., 2011; Ruíz-Montañez et al., 2014).
Los extractos de agregados de polen mostraron un claro efecto inhibitorio en C. gloeosporioides comparados con el fungicida comercial clorotalonil. La acción inhibitoria observada en cada extracto de agregado de polen estuvo asociada con la acción extractora del solvente y a la composición química de las muestras de polen. La concentración relativamente alta de compuestos fenólicos, en los cuales pueden estar incluidos terpenoides, fenilpropanoides, estilbenos y saponinas (Soto y Rosales, 2016), pueden estar implicados en la actividad antifúngica. Los extractos hidrofílicos de células vegetales están fuertemente relacionados con la inhibición del crecimiento celular y la germinación de conidios de Alternaria alternata y Fusarium oxysporum y, además pueden ser tóxicos en procesos de respiración microbiana (Rodríguez-Maturino et al., 2015). El 60% de extractos hidrofílicos presentan alta cantidad de flavonoides y fenoles (Pietarinen et al., 2006; Okwu y Nnamdi, 2008).
La propiedad antifúngica de agregados de polen colectadas por A. mellifera se ha reportado hasta en 70% de inhibición micelial en Aspergillus niger y 99.9% en A. fumigatus (Kacaniova et al., 2012). Similares efectos se han reportado en Alternaria, Botrytis y Fusarium (Cabrera y Montenegro, 2013). Respecto a las propiedades antifúngicas de agregados de polen asociados a abeja sin aguijón, se tienen reportes con T. angustula e inhibición del 26% en Candida albicans (Rojas, 2015). En el Soconusco, estudios previos con mieles de meliponinos demostraron un efecto 40% mayor que el fungicida cloratolonil en C. gloesporioides (Albores-Flores et al., 2018). En contraste, estos resultados con extractos de agregados de polen colectados por las mismas especies (M. beecheii, S. mexicana) mostraron un efecto superior hasta del 50% en comparación con el fungicida en dosis comercial alta (56 mg mL-1) dependiendo de la concentración del extracto. Este trabajo constituye el primer reporte sobre propiedades antifúngicas de agregados de polen de meliponinos. En particular, en el Soconusco, Chiapas, las abejas sin aguijón son una alternativa para la polinización de diversos cultivos de importancia económica, además de que la miel, los agregados de polen y propóleos son alternativas médicas para el tratamiento de úlceras diabéticas, así como en manejo en pre y postcosecha frutícola (Espinoza-Toledo et al., 2018; Albores-Flores et al., 2018, Grajales-Conesa et al., 2018).
CONCLUSIONES
En las muestras de agregados de polen, los valores observados de cada propiedad fisicoquímica estudiada oscilaron como sigue: pH: 2.2 a 3.5, humedad: 2 a 31%, cenizas: 0.9 a 5.9%, acidez libre: 117 a 133 meq kg-1, fenoles: 1.4 a 2.6 mg EAG g-1, flavonoides: 0.9 a 3.1 mg EQ g-1, glucosa: 0.01 a 0.3 mg L-1 y Trolox: 4.3 a 8.0 mg g-1. Los mayores valores de pH, cenizas, glucosa y Trolox, correspondieron a las especies de S. mexicana y T. angustula. Las que presentaron valores mayores de acidez libre, fenoles y flavonoides fueron las de M. beecheii.
Los compuestos bioactivos de los agregados de polen involucrados en la acción antifúngica fueron acidez libre, fenoles y flavonoides. La especie M. beecheii alcanzó valores de 38 a 66 % más inhibición de C. gloeosporioides comparado con el clorotalonil.











 texto en
texto en