Burkholderia, sensu lato, comprende, bacterias Gram negativas, incluidas en la subdivisión β proteobacteria (Sousa et al., 2011). Originalmente, se encontraba agrupada dentro del género Pseudomonas, pero con base en el análisis de secuencia 16S rARN, homología ADN-ADN, composición de ácidos grasos y características fenotípicas se reagrupó como género Burkholderia (Yabuuchi et al., 1992).
Burkholderia es un género bifuncional debido a que algunas de sus especies establecen relaciones simbiótico-mutualistas con las plantas, mientras que otras establecen asociaciones simbiótico-patogénicas con plantas, animales y humanos (Espinosa-Victoria et al., 2020). Burkholderia gladioli se aisló por primera vez de bulbos de gladiolo (Gladiolus sp.), y posteriormente de iris (Iris sp.), copo de nieve (Leucojum aestivum), azafrán (Crocus sativus), maíz (Zea mays) y arroz (Oryza sativa) (Mirghasempour et al., 2018). Recientemente, fue aislada de especies de orquídeas de los géneros Dendrobium, Oncidium y Miltonia (Keith y Thammakijjawat, 2019), por lo que puede considerarse como un patógeno reemergente.
B. gladioli se encuentra subdividida en cuatro patovares: B. gladioli pv. agaricicola, agente causal de la pudrición del champiñón; B. gladioli pv. alliicola, que ocasiona la pudrición del bulbo de cebolla; B. gladioli pv. gladioli, agente causal de la pudrición del gladiolo; y B. gladioli pv. cocovenenans, que genera intoxicación alimentaria severa como resultado de la ingestión de productos de soya y coco infectados con esta bacteria (Lee et al., 2016).
Actualmente, se conoce muy poco de la ocurrencia de B. gladioli en México, y de las características fisiológicas y bioquímicas de este fitopatógeno. Solo existe una nota científica (Félix-Gastélum et al., 2017) en la que se reporta a B. gladioli como agente causal de pudrición en cebolla en Sinaloa, México.
Por otra parte, México se encuentra dentro de los principales productores de cebolla (Allium cepa). A nivel mundial, ocupa el treceavo lugar con 1,620,318 t (FAOSTAT, 2017). A nivel nacional, Chihuahua (334,309.89 t), Zacatecas (18,758.38 t) y Guanajuato (176,700.99 t), son los estados con mayor producción de cebolla (SIAP, 2018). Sin embargo, este cultivo presenta diversos problemas fitosanitarios postcosecha, destacando la pudrición del bulbo, asociada generalmente a B. cepacia, B. gladioli, B. ambifaria, B. pirrocynia, Pectobacterium carotovorum, Serratia plymuthica, Pseudomonas marginalis, P. syringae, P. viridiflava, Pantoea ananatis y Enterobacter cloacae (Kowalska et al., 2015).
El objetivo del presente estudio fue caracterizar con un enfoque polifásico a B. gladioli, el agente causal de la pudrición blanda del bulbo de la cebolla blanca, así como determinar su potencial como agente patogénico de otras especies vegetales. Dado que B. gladioli es capaz de colonizar diferentes nichos ecológicos y presentar múltiples factores de virulencia, se hipotetizó que esta bacteria, además de ser el agente causal de la pudrición blanda en bulbo de la cebolla blanca, es también un patógeno potencial de diferentes especies vegetales.
MATERIALES Y MÉTODOS
La investigación se realizó en tres fases: La primera consistió en el aislamiento, caracterización morfológica, pruebas fisiológicas, bioquímicas y moleculares para la identificación del aislamiento bacteriano; la segunda y la tercera consistieron en la inoculación de diferentes estructuras vegetales y plantas de frijol (Phaseolus vulgaris) bajo condiciones controladas, para determinar su potencial infectivo.
Material biológico. Se analizaron bulbos de cebolla blanca (Allium cepa) variedad Carta blanca, con síntomas de pudrición blanda, procedentes de la comunidad de San Vicente Chicoloapan, Estado de México, localizada en las coordenadas Latitud N 19° 24’ 49” y longitud W 98° 53’ 8.29”.
Se utilizaron también bulbos de cebolla morada (A. cepa), tallos de puerro (A. ampeloprasum), cladodios de nopal (Opuntia indica), raíces de zanahoria (Daucus carota), rizomas de jengibre (Zingiber officinale), inflorescencias de brócoli (Brassica oleracea), esporocarpos de champiñón (Agaricus bisporus) y semillas de frijol (Phaseolus vulgaris) para evaluar la capacidad de colonización y patogenicidad del aislamiento bacteriano.
Aislamiento y caracterización morfológica del fitopatógeno. Las catáfilas externas de bulbos de cebolla con síntomas de pudrición blanda, se cortaron longitudinalmente. Posteriormente, se observó el flujo bacteriano del tejido con agua destilada estéril en microscopio óptico a 10X. Se tomó una asada, se sembró en medio B de King y se incubó a 28 °C por 48 h. La colonia bacteriana se caracterizó morfológicamente al microscopio estereoscópico. Posteriormente, se realizaron las pruebas de reacción de hipersensibilidad en plantas de tabaco (Nicotiana tabacum “xanthi”) de cuatro meses de edad y pudrición en tubérculos de papa (Solanum tuberosum) (Goszczynska et al., 2000).
Postulados de Koch. La cepa aislada, se inoculó en tejido sano de cebolla blanca variedad Carta blanca, mediante la aplicación de 0.5 mL de una suspensión acuosa con 3X108 UFC mL-1, ajustándola mediante la escala de McFarland (McFarland, 1907). Como testigos, se inocularon cuatro rodajas de cebolla blanca sana con 0.5 mL de agua destilada estéril, y se colocaron en cámara húmeda a 28 °C. La pudrición de las catáfilas se evaluó 48 h después de la inoculación. Una muestra del exudado del tejido con pudrición se sembró en medio B de King por 48 h. Posteriormente, se observó el crecimiento bacteriano en el microscopio estereoscópico, se seleccionó una colonia desarrollada aisladamente, la cual se transfirió en los medios de cultivo de B de King, MacConkey y Rojo Congo (Rodríguez, 1982).
Caracterización fisiológica y bioquímica. Se realizaron las siguientes pruebas fisiológicas y bioquímicas: tinción de Gram, oxidasa, catalasa, reacción KOH, reducción de nitratos, metabolismo oxidativo-fermentativo, licuefacción de gelatina, hidrólisis de arginina, producción de levana, hidrólisis del almidón y utilización de fuentes de carbono siguiendo la metodología descrita por Shaad (2001). Se registró el crecimiento de la bacteria a pH de 4 a 10 (Estrada de los Santos et al., 2013) y a temperaturas de 30 a 43 °C (Kowalska et al., 2015).
Extracción de ADN y reacción en cadena de la polimerasa (PCR). Se realizó la extracción de ADN bacteriano utilizando el método de CTAB citado por Doyle y Doyle (1990), con la modificación de lavado con acetato sodio 3 M. La calidad y cantidad del ADN se evaluó por espectrofotometría en Nanodrop 126 (ND-1000, Nanodrop Technologies).
Para la amplificación del gen 16S rARN se utilizaron los iniciadores universales 8 F (5´AGAGTTTGATCCTGGCTCAG-3´) y 1492 R (5´GGTTACCTTGTTACGACTT-3´) (Galkiewicz y Kellogg, 2008). La amplificación del fragmento del gen 16S rRNA se llevó a cabo bajo las siguientes condiciones, en un volumen final de reacción de 25 µL: se realizó una desnaturalización inicial del ADN a 95 °C por 5 min, en seguida 30 ciclos a 94 °C por 1 min, 54 °C por 45 s, 72 °C por 1 min y una extensión final a 72 °C por 8 min. El fragmento amplificado se separó por electroforesis en gel de agarosa al 2%, con bromuro de etidio, a 85 volts durante 60 min. El fragmento resultante se observó con luz ultravioleta en un fotodocumentador Biologing Systems modelo Epi Chemi II Darkroom. Posteriormente, el producto fue secuenciado por la empresa Macrogen en Korea.
Árbol filogenético. Para confirmar la identidad de la bacteria se realizó el ensamble de las secuencias foward y reverse mediante el software MEGA X (Kumar et al., 2018). La secuencia consenso se comparó con las secuencias registradas en el Basic Local Alignment Search Tools (BLAST) del National Center for Biotechnology Information (NCBI). Para realizar el árbol filogenético se descargaron del GenBank las secuencias parciales del gen 16S rARN de B. gladioli (MN559413), B. cepacia (AF097530), B. ambifaria (AF043302), B. plantarii (AB183679) y B. glumae (NR_029211), Paraburkholderia graminis (NR_029213), Pseudomonas viridiflava (NR_117825), P. fluorescens (NR_113647) y P. aeruginosa (NR_113599), utilizando como especie fuera de grupo a Agrobacterium tumefaciens (NR_115516). El alineamiento múltiple de secuencias se efectuó con la opción MUSCLE. El árbol filogenético se obtuvo mediante el método de Maximum Likelihood (ML) con 500 repeticiones de bootstrap, basado en el modelo de Tamura-Nei (TN93+G). El modelo utilizado se obtuvo mediante una prueba de modelos y de acuerdo con el criterio de información bayesiana (BIC), se eligió el que mejor describió el patrón de sustitución de bases.
Microscopía electrónica de barrido. Se utilizó una colonia del aislamiento bacteriano, con 72 h de crecimiento en medio B de King a 28 °C, para la observación de la morfología colonial en microscopia electrónica de barrido. Se tomó una pequeña muestra bacteriana y se fijó en glutaraldehído al 3%. Posteriormente, se enjuagó con el amortiguador de fosfato sorense (0.1 M), a pH de 7.2 durante 10 min. Transcurridas 24 h, se repitió este procedimiento dos veces más. A continuación, se deshidrató con alcohol a las siguientes concentraciones: 30, 40, 50, 60, 70, 80, 90 y 100%. Se dejó reposar en cada concentración durante 30 min. El proceso se repitió únicamente con la concentración al 100%. Posteriormente, se realizó el secado de la muestra hasta alcanzar el punto crítico, utilizando el desecador Samdri-780A® (USA, 2007). En seguida, el espécimen se colocó en un porta-muestra, con ayuda de un pincel, bajo el microscopio estereoscópico. Después, la muestra se cubrió con oro en el equipo FINE COAT (Ion sputter JFC-1100). Por último, se observó la morfología bacteriana con ayuda del software de Microanalisis AXS para microscopio electrónico de barrido (Oxford instruments INCA x-act 2009).
Inoculación del aislamiento bacteriano en estructuras vegetales bajo condiciones de laboratorio. Bulbos de cebolla morada (A. cepa), tallos de puerro (A. ampeloprasum), cladodios de nopal (O. indica), raíces de zanahoria (D. carota), rizomas de jengibre (Z. officinale), inflorescencias de brócoli (B. oleracea var. italica) y esporocarpos de champiñón (A. bisporus), se desinfestaron con hipoclorito de sodio (NaClO) al 2% por 2 min, enseguida con etanol al 70% durante 1 min, luego se realizaron tres lavados con agua destilada estéril. Finalmente, se secaron sobre papel absorbente estéril durante 10 min. Posteriormente, se inyectaron con 0.5 mL de inoculo bacteriano, a una densidad de 3.0 X108 UFC, ajustada mediante la escala de McFarland. En los testigos, el inoculo bacteriano se sustituyó con agua destilada estéril. En seguida, las estructuras vegetales fueron colocadas en cámaras húmedas y se evaluó el daño a las 48 h. Para determinar la severidad, se elaboró una escala del 0 al 5 de acuerdo con el grado de maceración 0, 20, 40, 60, 80 y 100%, respectivamente (Liao et al., 1986). Se utilizó un diseño completamente al azar con cuatro repeticiones por tratamiento. Con los datos obtenidos se realizó un ANDEVA, y después se compararon las medias de los tratamientos con la prueba de Tukey (p≤0.05). Se usó el programa SAS, Versión 9.0 (SAS Institute, 2002).
Inoculación del frijol con el aislamiento bacteriano bajo condiciones de invernadero. Se germinó cada semilla de frijol, en un contenedor de 1 L con Peat Moss y Agrolita (75:25). Se inoculó una suspensión bacteriana del patógeno a una concentración de 3.0 X109 UFC en cuatro plantas a los 10 días después de la germinación, asimismo, se dejaron cuatro plantas como testigo negativo (Falcao et al., 2004). Se utilizó un diseño completamente al azar con cuatro repeticiones por tratamiento. Con los datos obtenidos se realizó un ANDEVA, comparando las medias de los tratamientos con la prueba de Tukey (p≤0.05). Se usó el programa SAS, Versión 9.0 (SAS Institute, 2002).
Sensibilidad in vitro a productos químicos y biológicos. Se realizó una prueba de sensibilidad del aislamiento bacteriano por el método de difusión en agar (Matuschek et al., 2014), a los siguientes productos químicos: cuprimicin agrícola (200 g/ 100 L), serenade polvo (1 Kg/200 L), bactrol 2X (60 g/100 L), bactriomicin agrícola (400 g/100 L), fungifree biológico (2.5 Kg/200 L), cuprimicin 500 (625 g/100 L), phyton (1.5 mL/1 L), oxicloruro de cobre (400 g/100 L), kasumin (2L/200 L), final bacter (1.6 Kg/200 L), quatz (400 g/100 L), bacterbest biológico (1L/200 L) y biotermin biológico (3L/200 L). Como control se empleó agua destilada estéril. Se colocaron 200 µL de una suspensión acuosa del aislamiento bacteriano con 3.0 X108 UFC en cajas Petri cuadradas (120 X 120 mm) con medio agar nutritivo. El inóculo se distribuyó de manera uniforme con un asa Driglasky sobre la superficie del medio. Se usaron discos de papel filtro estériles (13 mm de diámetro), los cuales se sumergieron por tres segundos en cada uno de los productos y se colocaron en las placas de medio. Finalmente, las placas se incubaron a 28 °C durante 48 h para observar la presencia o ausencia de zonas de inhibición (Bauer et al., 1966).
RESULTADOS Y DISCUSIÓN
Caracterización morfológica. La morfología de las colonias observadas en medio B de King, después de 48 h de incubación a 28 °C, correspondió a colonias amarillas, lisas, convexas, mucoides y con producción de pigmento difusible en el medio (Figura 1A). Estas características coincidieron con las reportadas por Lamovsek et al. (2016) para B. gladioli pv. allicola. No obstante, las colonias no emitieron fluorescencia en medio B de King, como lo reportaron Kowalska et al. (2015).

Figura 1 Crecimiento del aislamiento bacteriano de Burkholderia gladioli en medios de cultivo B de King (A), Agar MacConkey (B) y Rojo Congo (C) después de 48 h de incubación.
Las colonias fueron de color púrpura en el medio agar MacConkey (Figura 1B), lo que confirmó que esta bacteria es capaz de fermentar la lactosa, diferenciándose de Pseudomonas aeruginosa (Callicó et al., 2004) que carece de la lactasa (Ranjan et al., 2017). Por otro lado, el aislamiento bacteriano mostró crecimiento de colonias rojas en medio Rojo Congo (Figura 1C), lo que indicó que esta bacteria es capaz de asimilar el hierro que se encuentra en el medio de cultivo. Esta característica es fundamental para el proceso de colonización de los microorganismos fitopatógenos (Aguado et al., 2012).
Identificación molecular. La amplificación del gen 16S ARN ribosomal del aislamiento bacteriano mostró fragmentos de 1500 pares de bases (pb). Al comparar la secuencia consenso (Número de Accesión MT672591) en la base de datos del NCBI se obtuvo un 100% de similitud con B. gladioli.
Árbol filogenético. La secuencia consenso MT672591 se agrupó con B. gladioli (MN559413) con 100 % de similitud (Figura 2).
Patogenicidad. Las rodajas de cebolla mostraron pudrición blanda 24 h después de la inoculación. Al microscopio estereoscópico se observó abundante flujo bacteriano 48 h después de la inoculación a 28 °C. Burkholderia gladioli (MT672591) fue positiva a la reacción de hipersensibilidad en tabaco y pudrición de papa. Las rodajas testigo no presentaron síntomas de pudrición blanda.
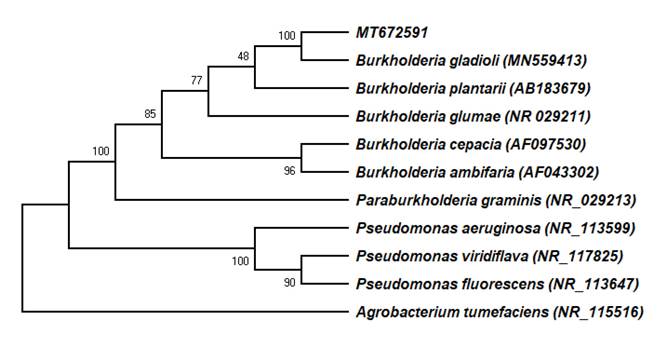
Figura 2 Árbol filogenético basado en la comparación de las secuencias del gen de la subunidad 16S del ARN ribosomal de especies del género Burkholderia y Pseudomonas. Entre paréntesis se indican los números de acceso de las secuencias en la base de datos NCBI.
Microscopía electrónica de barrido. Los resultados de microscopía electrónica de barrido concuerdan con lo reportado por el Programa de Investigación en Salud Ocupacional de la Universidad de Boston (2019), que indican que los miembros del género Burkholderia presentan forma bacilar de 1.6 a 3.2 µm, con uno o varios flagelos polares, importantes en la patogenicidad (Tomich et al., 2002). En el presente estudio no fue posible visualizar los flagelos, debido a que la observación de estas estructuras se realiza mediante la tinción negativa con microscopía electrónica de transmisión (Jurado y Petruccelli, 2005).
Los bacilos de B. gladioli (MT672591) formaron biopelículas y fueron observadas también en estado planctónico (Figura 3). La formación de biopelículas es otra característica importante de este género, ya que a través de estos detectan moléculas de señalización, que les permite la sincronización en la expresión de genes (Federle et al.,
Caracterización fisiológica y bioquímica. Burkholderia gladioli (MT672591) fue positiva a la prueba de reacción de hipersensibilidad en tabaco y pudrición de papa, lo que confirma la presencia de los sistemas de secreción I, II y III (Seo et al., 2015).
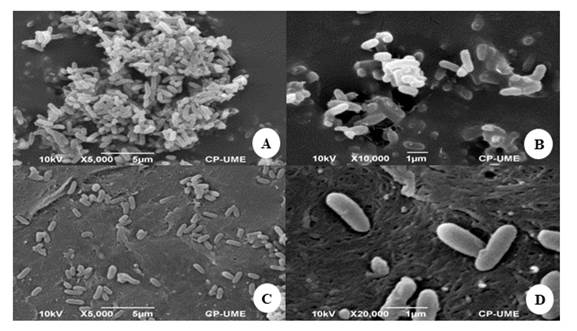
Figura 3 Micrografía de B. gladioli (MT672591) observada con microscopia electrónica de barrido. A y B corresponden a biopelículas (5,000 X y 10,000 X, respectivamente); C y D a la bacteria en estado planctónico (5,000 y 20,000 X, respectivamente).
En las bacterias fitopatógenas, el Sistema de Secreción III está codificado por los genes hrp (por sus siglas en inglés: hypersensitive response and pathogenicity), estos son necesarios para que las bacterias causen enfermedades en plantas susceptibles y provoquen la respuesta de hipersensibilidad en plantas resistentes (Lindgren et al., 1986; Büttner y He, 2009).
Estos sistemas de secreción habilitan a la bacteria a colonizar diferentes nichos ecológicos, como frutos postcosecha y tejido vegetal in vivo con los hospedantes con los cuales establece una relación compatible. Burkholderia gladioli (MT672591) fue estrictamente aeróbica y utilizó como fuente de carbono, glucosa, sacarosa, arginina y lactosa, coincidiendo con lo reportado por Kowalska et al. (2015). La bacteria (MT672591) creció a pH de 4, lo que le da ventaja competitiva en suelos ácidos. Esto contrasta con lo reportado por Estrada de los Santos et al. (2013), quienes mencionan que ninguna de las 59 cepas evaluadas, pertenecientes a 43 especies del género Burkholderia, creció a pH de 4. Se observó crecimiento de B. gladioli (MT672591) a 42 °C, concordando con lo reportado por Kowalska et al. (2015). En el Cuadro 1, se observan las similitudes y diferencias entre la cepa aislada en este estudio y las reportadas en Sinaloa, México y en Polonia.
Inoculación de B. gladioli en estructuras vegetales bajo condiciones controladas. Se registraron diferencias significativas en el grado de maceración (Cuadro 2). Se observó mayor grado de maceración en el bulbo de la cebolla morada y en el tallo de puerro. El tejido de ambas estructuras vegetales se maceró completamente 48 h después a la inoculación, y mostró el síntoma típico de pudrición blanda, causado por B. gladioli (MT672591) (Figuras 4 A y B). La cebolla morada y el puerro presentaron una interacción similar con la bacteria, debido probablemente a que ambas pertenecen a la familia Alliaceae.
Cuadro 1. Comparación fisiológica y bioquímica de cepas de B. gladioli procedentes del Estado de México (presente estudio), Sinaloa, México y Polonia.
| Característica | B. gladioli | B. gladioli | B. gladioli pv. alliicola |
|---|---|---|---|
| (MT672591) del Edo. de México, México | de Sinaloa, México (Félix-Gastélum et al., 2017) | de Polonia(Kowaslka et al., 2015) | |
| Hipersensibilidad en tabaco | + | + | + |
| Pudrición de papa | + | NR | NR |
| Tinción de Gram | - | - | - |
| Reacción KOH | + | NR | - |
| Crecimiento anaeróbico | - | NR | - |
| Oxidasa | + retardada | + | + |
| Catalasa | + | NR | NR |
| Fluorescencia en medio B de King | - | - | - |
| Colonia mucoide | + | - | - |
| Color crema en medio AN | + | + | + |
| Fermentación/oxidación | Oxidativo | NR | Oxidativo |
| Hidrólisis de gelatina | + | NR | + |
| Arginina dehidrolasa | - | - | - |
| Hidrolisis de Almidón | - | - | NR |
| Crecimiento: | |||
| 40 °C | + | NR | + |
| 42 °C | + | NR | NR |
| 43 °C | + | NR | NR |
| Levana | - | NR | NR |
| Motilidad | + | NR | NR |
| Reducción de nitratos | + | - | NR |
| Tolerancia: | |||
| pH 4 | + | NR | + |
| pH 8 | + | NR | + |
| pH 9 | + | NR | - |
| Utilización de: | |||
| Lactosa | + | + | + |
| Glucosa | + | + | NR |
| Celobiosa | + | + | + |
| Maltosa | - | NR | NR |
| Trehalosa | - | NR | NR |
| Inositol | - | NR | NR |
| Sorbitol | - | + | + |
| Dulcitol | + | NR | NR |
+Positivo, - Negativo, NR No reportado.
En los cladodios de nopal (Opuntia spp.), los primeros síntomas de pudrición blanda se observaron 24 h después a la inoculación. Primero, aparecieron puntos de color café obscuro, que fueron creciendo con aspecto húmedo y un halo alrededor de las manchas a las 48 h después de la inoculación (Figura 4C). Se observó pudrición completa del cladodio seis días después de la inoculación, coincidiendo con los síntomas que ocasiona Pectobacterium spp. (Torres et al., 2016). Ambos fitopatógenos se caracterizan por tener gran actividad enzimática. Hasta el momento, no existen reportes del género Burkholderia como patógeno del nopal en forma natural; sin embargo, debido a la agresividad de colonización que se observó bajo condiciones controladas, merece estudios posteriores.
Igualmente, se registró pudrición blanda y degradación del esporocarpo del champiñón (Figura 4D). Chowdhury y Heinemann (2006), reportaron que el Sistema de Secreción tipo II se encuentra involucrado en la enfermedad causada por B. gladioli pv. agaricola en champiñón. Estos investigadores mencionan que mutantes avirulentos fueron incapaces de degradar el tejido de champiñón, debido a la reducción de la capacidad de secretar quitinasas y proteasas, así como la reducción en el número de flagelos. B. gladioli pv. agaricola es considerada un patógeno potencial del champiñón, que podría ocasionar pérdidas importantes en la industria de este hongo (Gill y Tsuneda, 1997).
Cuadro 2 Grado de maceración inducido por B. gladioli en diferentes estructuras vegetales.
| Estructura vegetal | Maceración (%) |
|---|---|
| Bulbo de cebolla morada | 4.87 a |
| Tallo de puerro | 4.72 a |
| Cladodio de nopal | 4.22 ab |
| Esporocarpo de champiñón | 3.97 bc |
| Raíz de zanahoria | 3.62 b |
| Inflorescencia de brócoli | 3.50 c |
| Rizoma de jengibre | 0.00 d |
Medias con letras distintas son estadísticamente diferentes (p≤0.05); n=4 repeticiones por tratamiento.

Figura 4 Síntomas de pudrición inducidos por B. gladioli (MT672591) en diferentes estructuras vegetales bajo condiciones controladas: A) bulbos de cebolla morada, B) tallos de puerro, C) cladodios de nopal, D) esporocarpos de champiñón, E) raíces de zanahoria y F) inflorescencias de brócoli.
En la zanahoria se produjeron áreas café oscuras cerca de los puntos donde se inoculó la bacteria, tres días después de la inoculación (Figura 4E). Hasta el momento no existen reportes de B. gladioli causando daños en zanahoria, pero se ha reportado que Pseudomonas viridiflava promueve síntomas similares en las raíces de la zanahoria (Almeida et al., 2013). Esta similitud probablemente se deba a la cercanía del género Burkholderia, que originalmente se encontraba agrupado dentro del género Pseudomonas (Yabuuchi et al., 1992). En el caso de las inflorescencias de brócoli, el tejido se tornó acuoso con mal olor, y se observó maceración del tejido tres días posteriores a la inoculación (Figura 4F), síntomas similares a los que ocasiona Pseudomonas flourescens en este cultivo (Li et al., 2009). En el caso del jengibre, no se observó ningún síntoma, lo que evidencia una relación incompatible.
Inoculación del frijol con B. gladioli en invernadero. Se observaron lesiones necróticas en hojas y tallos del frijol (Figura 5). Se registró 100% de incidencia, sin embargo, no se registró diferencia estadística significativa con respecto al testigo en número de botones florales y altura (Cuadro 3). Estudios recientes indican que algunas cepas del género Burkholderia viven de forma endófita en maíz silvestre, sin causarle enfermedad (Johnston y Raizada, 2011). Compant et al. (2008), mencionan que en ecosistemas naturales y artificiales, Burkholderia spp. puede colonizar la filósfera y tejidos internos de las plantas, siendo probablemente la bacteria que más fácilmente se adapta al ambiente y las plantas. Por otra parte, B. gladioli produce toxoflavina que es altamente tóxica para plantas, hongos y animales (Anwar et al., 2017). Así mismo, Lee et al. (2016), indican que el quorum sensing está relacionado en la producción de toxoflavina.
Burkholderia gladioli posee un genoma constituido por 9.05 Mb, por dos cromosomas y cuatro plásmidos, lo que sugiere que el tamaño de su genoma está relacionado con su capacidad de colonizar diferentes nichos ecológicos (Mannaa et al., 2018). Además, Burkholderia, sensu lato, posee diversos factores de virulencia, como son: los sistemas de secreción tipo I, II, III, IV y V, adhesinas, pilis, sideróforos, proteasas extracelulares, varios polisacáridos y moléculas de quorum sensing (Ferreira et al., 2019).
Debido a que B. gladioli tiene la capacidad de sobrevivir en agua, y que gran parte de las aguas residuales se utilizan con fines agrícolas, esto podría traer consecuencias ecológicas negativas, como una fuente de diseminación a largas distancias (Escobedo y Pardo, 2017). Al realizar los reaislamientos en los tejidos vegetales utilizados en este estudio, en todos los casos, se observó motilidad bajo el microscopio óptico a 40X, coincidiendo con lo descrito por Chung et al. (2003). Esta es una característica importante en la patogenicidad de esta bacteria, ya que, al poseer un flagelo polar, le brinda ventaja para desplazarse en el tejido de su hospedante.

Figura 5 Síntomas inducidos por Burkholderia gladioli (MT672591) en plantas de frijol (Phaseolus vulgaris). A) Inicio de la lesión; B) Avance de la lesión.
Cuadro 3. Número de botones florales, altura y tamaño de lesiones en tallo de plantas de frijol inoculadas con Burkholderia gladioli (MT672591).
| Plantas de frijol | Número de botones florales | Altura (cm) | Lesión en tallo (cm) |
|---|---|---|---|
| Inoculado | 3.125 a | 27.2625 a | 0.8625 a |
| No inoculado | 2.25 a | 22.2625 a | 0 b |
Medias con letras distintas son estadísticamente diferentes (p≤0.05); n=4 repeticiones por tratamiento.
Sensibilidad in vitro a productos químicos y biológicos. Ningún de los productos ensayados tuvo efecto inhibitorio sobre B. gladioli (MT672591). Esta bacteria se caracteriza por su resistencia natural a antibióticos, debido a la capacidad de formar biopelículas y cambiar su envoltura celular para reducir la permeabilidad de membrana impidiendo así la entrada del antibiótico (Sousa et al., 2011; Torbeck et al., 2011). Los mecanismos que le brindan resistencia incluyen producción de ß-lactanasas y otras enzimas, así como la modificación de los puntos objetivo de los antibióticos (Ranjan et al., 2017).
CONCLUSIONES
Se identificó morfológica, fisiológica, bioquímica y molecularmente a Burkholderia gladioli (MT672591) como agente causal de pudrición blanda del bulbo de la cebolla blanca.
B. gladioli colonizó e indujo daño en bulbos de cebolla morada, cladodios de nopal, esporocarpos de champiñón, tallos de puerro, raíces de zanahoria y rizomas de jengibre en condiciones de laboratorio. Igualmente, promovió lesiones en plantas de frijol de condiciones de invernadero. Además, mostró resistencia natural a cuprimicin agrícola, serenade polvo, bactrol, bactriomicin agrícola, fungifree biológic, cuprimicin 500, phyton, oxicloruro de cobre, kasumin, final bacter, quatz y bacterbest biológico. Este estudio reporta por primera vez la caracterización polifásica de B. gladioli en México. Esta especie bacteriana tiene la capacidad de crecer a pH 4.0 y 42 oC, lo que podría conferirle habilidad competitiva en suelos ácidos y condiciones semiáridas. Se demuestra que tiene un amplio rango de hospederos en condiciones postcosecha, además de ser resistente a algunos productos usados en campo para el control de fitopatógenos.











 text in
text in 


