La vainilla (Vanilla planifolia) es una planta hemiepífita de la familia Orchidaceae originaria de Mesoamerica, cuyo centro de domesticación y diversificación se encuentra en el centro-norte del estado de Veracruz, México. Esta orquídea se desarrolla en climas cálidos a temperaturas de entre 20 y 30 °C, bajo condiciones específicas de luz y sombra, y requiere de un “tutor” es decir una planta o construcción artificial que le da sostén. La vainilla requiere de dos años de crecimiento vegetativo, y es hasta el tercer año de vida cuando desarrollan los primeros frutos. En México existen 874.50 ha sembradas con plantas de vainilla, las cuales producen 494.69 toneladas anuales de frutos procesados o “Beneficiados”. Los estados con mayor producción son Veracruz, Oaxaca, Puebla y San Luis Potosí; en este último, la región vainillera se localiza en la Huasteca Potosina Sur que comprende los municipios de Axtla de Terrazas, Tamazunchale, Aquismón, Matlapa, Coxcatlán, Huehuetlán y Xilitla (Figura 1).
Se conoce que las plantas de vainilla pueden ser susceptibles a la infección causada por el hongo Fusarium oxysporum, el cual produce clorosis en hojas y pudrición de la raíz y el tallo, llegando a ocasionar la pérdida total de la planta (Adame-García et al., 2015). Desde hace varias décadas, se ha cultivado vainilla (V. planifolia Jacks. ex Andrews) bajo sistemas tradicionales en la Huasteca Sur de S.L.P., produciendo frutos de calidad y sin síntomas aparentes de infección. Sin embargo, en verano del 2018 un grupo de productores vainilleros de esta región observaron marchitez y clorosis, síntomas característicos de las infecciones causadas por hongos, en varias plantas de vainilla en edad de producción. Con el objetivo de identificar los posibles hongos asociados a dichas plantas, durante los meses de septiembre y octubre del mismo año se realizaron tres muestreos independientes de plantas cultivadas en dos parcelas de aproximadamente 1.5 ha, ubicadas en las coordenadas 21.316651,-98.831236 en la comunidad de Cuichiapa, Matlapa, S.L.P., México. En estas parcelas se cultiva vainilla a campo abierto y bajo el sistema llamado “casa malla”. Para los muestreos cada parcela fue divida en cuatro cuadrantes, y se colectaron muestras de hojas, tallos y frutos de cinco plantas con síntomas en cada cuadrante. Las muestras fueron transportadas inmediatamente al laboratorio en cámaras húmedas a 4 °C para ser procesadas. Los tejidos de vainilla fueron lavados con hipoclorito de sodio al 10%, se enjuagaron con abundante agua destilada estéril, y se secaron con toallas de papel estériles. Se realizaron cortes transversales y longitudinales de los tejidos vegetales, después se colocaron pequeños segmentos de aproximadamente 1 cm2 de tejido sobre agar papa dextrosa (PDA) adicionado con carbenicilina (100 µg mL-1) para evitar la contaminación por bacterias. Se colocaron tres segmentos de tejido por cada caja de Petri con medio de cultivo y todas las muestras fueron sembradas por triplicado, incubadas a 28 °C y en oscuridad. Los cultivos fueron observados diariamente durante ocho días, hasta observar el crecimiento de colonias fúngicas en los sitios de contacto de la muestra de tejido y el medio de cultivo. De las cajas de Petri donde se observó el desarrollo de hongos, se tomaron muestras del micelio y se colocaron en nuevas cajas de Petri con medio PDA para obtener cultivos con una misma morfología colonial y a partir de los cuales se obtuvieron cultivos monospóricos que posteriormente fueron usados para identificación morfológica y molecular de los hongos. Para la obtención de cultivos monospóricos, se colectaron las esporas del hongo con una solución estéril de Tween 80 al 0.1%, se preparó una suspensión de 100 esporas mL-1, y con una espátula Drigalsky se sembraron 100 µL de dicha suspensión en medio PDA. Las cajas de Petri fueron incubadas como se describió anteriormente hasta observar el inicio del crecimiento de colonias fúngicas, las cuales fueron transferidas a nuevas cajas de Petri con medio de cultivo. Tres de estas colonias provenientes de tres aislados diferentes de hongos con características morfológicas (macroscópicas y microscópicas) similares fueron posteriormente utilizadas para la extracción de ADN, la amplificación de los ITS, y secuenciación de los mismos.
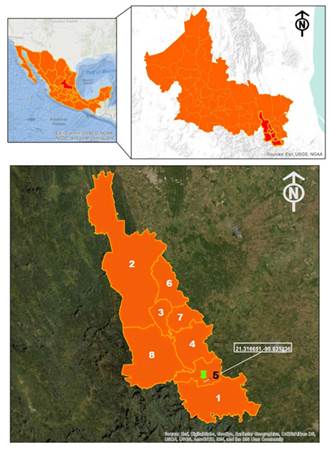
Figura 1. Localización de los municipios productores de vainilla de la Huasteca Potosina Sur, y sitio de estudio. 1) Tamazunchale, 2) Aquismón, 3) Huehuetlán, 4) Axtla de Terrazas, 5) Matlapa, 6) Tancanhuitz de Santos, 7) Coxcatlán, 8) Xilitla. El número cinco en color negro indica el municipio donde se encuentra localizado el sitio de estudio de este trabajo.
La identificación microscópica de los aislados fúngicos se realizó mediante la técnica de microcultivo. Las hifas y estructuras de los hongos fueron teñidas con azul algodón lactofenol (Sigma-Aldrich, 113741) y observadas directamente en un microscopio de campo claro (Carl Zeiss, Oberkochen). Para determinar sus características morfológicas, se siguieron las claves taxonómicas descritas por Leslie y Summerell (2006). También se colectó y congeló con nitrógeno líquido, el micelio de tres diferentes aislados fúngicos a los seis días de crecimiento en medio sólido PDA. El micelio se pulverizó con la ayuda de un mortero, y se usaron 100 mg para la extracción de ADN genómico. El ADN se extrajo con fenol-cloroformo, se lavó con etanol al 70%, y se resuspendió en agua desionizada estéril. La integridad del ADN se observó mediante electroforesis en gel al 1% de agarosa ultrapura (Sigma, MA), y su concentración se determinó en un espectrofotómetro NanoDrop Thermo Scientific (Waltham, MA). Posteriormente, se realizó la amplificación por PCR de la región de Espaciadores Internos Transcritos (ITS) de las muestras de ADN genómico. Para ello se usó la Taq DNA polimerase Platinum High Fidelity (Invitrogen, MA), los oligonucleótidos ITS1 CTTGGTCATTTAGAGGAAGTAA e ITS2 GCTGCGTTCTTCATCGATGC (Bellemain et al. 2010), y 100 ng de DNA genómico de cada hongo. Las condiciones usadas en la PCR fueron las siguientes: temperatura inicial de desnaturalización a 94 °C durante 2 min; 35 ciclos con una desnaturalización a 94 °C por 15 s, alineamiento a 55 °C por 30 s, extensión a 68 °C por 20 s; y una extensión final a 72 °C durante 1 min. Los productos de PCR se visualizaron en gel al 1% de agarosa ultrapura (Thermo Fischer Scientific), se purificaron mediante el kit D4033 de Zymo Research (Irvine, CA), y se cuantificó su concentración en espectrofotómetro NanoDrop Thermo Scientific (Waltham, MA). Los productos de PCR fueron secuenciados usando el oligonucleótido ITS1, y utilizando la plataforma de Sanger (ABI 3730 XL, Applied Biosystem) en el Laboratorio de Servicios Genómicos de la UGA-CINVESTAV, en Irapuato Guanajuato, México. Las secuencias fueron editadas en el software BioEdit 7.2.5, y posteriormente analizadas mediante BLAST en el sitio en línea del National Center for Biotechnology (NCBI) (https://blast.ncbi.nlm.nih.gov/Blast.cgi). Finalmente, esporas de los tres aislados puros fueron criopreservadas en tubos con glicerol al 25% y a -80°C en el cepario del laboratorio de desarrollo y diferenciación de hongos, del Cinvestav Unidad Irapuato.
Considerando los lineamientos para determinación de daño en cultivos agrícolas descritos por Gabriel et al. (2017), se observó que aproximadamente un 70% de las plantas de vainilla con síntomas, presentaban marchitamiento general. Además, algunas de sus hojas y frutos presentaban zonas clorosis y puntos de necrosis o pudrición (Figura 2A y 2B). Interesantemente, las hojas y frutos con síntomas fueron fácilmente desprendidas del tallo, en los diferentes momentos de muestreo. A los cinco días post-siembra de los segmentos de tejido en medio PDA, se observó el crecimiento de colonias fúngicas filamentosas en las zonas de contacto entre los tejidos de planta y el medio de cultivo. Después de obtener aislados fúngicos con características macroscópicas similares, se obtuvieron aproximadamente 15 aislados fúngicos por muestreo, los cuales fueron usados para la obtención de cultivos monospóricos. Las colonias fúngicas puras mostraron desarrollo de micelio filamentoso, esparcido y abundante, con ligera acumulación de macroconidios y microconidios en el centro de la colonia. Se observó la producción de pigmentos color violeta por el anverso de la colonia y mostró una coloración amarillo-marrón por el reverso del medio de cultivo (Figura 2E). Bajo el microscopio se observó abundante micelio septado, hialino y después de una semana de crecimiento se observó el desarrollo de clamidosporas de aproximadamente 8 µm de diámetro (Figura 2F). Además, se observaron microconidios con forma arriñonada, u ovalada de aproximadamente 7 µm de largo (Figura 2G).
Las secuencias de ITS de los tres aislados fueron depositadas en GenBank de NCBI con los números de acceso MT573368, MT573369, y MT573370. Dichas secuencias presentaron una longitud de aproximadamente 230 nucleótidos y una cobertura del 100% y una similitud del 99.55% con el complejo de especies Fusarium oxysporum, en particular con el aislado O309 reportado en NCBI con la clave MT032690.1, el cual fue aislado de raíces, hojas y tallos de plantas de calabaza. Estos resultados comprueban que los tres aislados fúngicos secuenciados corresponden a una misma especie del género Fusarium, aunque estudios moleculares y filogenéticos más robustos permitirían confirmar la especie y la forma specialis (f. sp.) del hongo, es decir el grupo taxonómico dentro de la especie F. oxysporum a la cual pertenece el hongo aislado considerando su rango de plantas huéspedes.

Figura 2. Síntomas de infección observados en las plantas de vainilla cultivada en la Huasteca Potosina Sur, e imágenes de la morfología del hongo Fusarium aislado. A, Hoja de vainilla con clorosis y puntos de necrosis (flecha roja). B, Frutos de vainilla con clorosis e importantes zonas de necrosis (flecha roja). C y D, Hojas y frutos de plantas de vainillas sin síntomas de infección. E, Crecimiento de Fusarium en medio PDA y en oscuridad. F, Micelio y clamidosporas de Fusarium. G, Microconidios de Fusarium.
Fusarium oxysporum es un grupo con más de 100 formae speciales (ff. spp.) de hongos fitopatógenos altamente virulentos, con la capacidad de sobrevivir saprofíticamente por largos periodos de tiempo en la materia orgánica del suelo en espera de plantas u hospederos débiles. Muchos de estos hongos son agentes patógenos de especies de plantas económicamente importantes en todo el mundo. En México, diferentes especies del género Fusarium han sido reportadas en cultivos de importancia económica con síntomas de infección, por ejemplo, en naranjos var. Valencia y en plantas de mango. Incluso, previamente ha sido reportada la infección por F. oxysporum en plantas de vainilla cultivadas en los estados de Veracruz (Adame-García et al., 2015) y Nayarit (Casillas-Isiordia et al., 2017), donde las plantas directamente inoculadas con aislados del hongo, mostraban importantes zonas de clorosis y necrosis o putrefacción; síntomas que también se observaron en las plantas utilizadas en este trabajo. En este trabajo se reporta por primera vez el aislamiento e identificación de Fusarium asociados a plantas de vainilla cultivadas en la región Huasteca del estado de San Luis Potosí. Por lo tanto, como perspectivas de este trabajo se plantea la infección de plantas de vainilla sanas con el aislado de Fusarium reportado, tanto en condiciones in vitro como in vivo. Así como la realización de experimentos moleculares más robustos que permitan definir la forma specialis del hongo.











 texto en
texto en 


