El cultivo de fresa (Fragaria × ananassa) está ampliamente distribuido en el mundo debido a su diversidad genotípica, naturaleza altamente heterocigótica y amplia gama de adaptaciones ambientales (Vikas-Kumar y Anil, 2019). En México, los estados de Jalisco, Tlaxcala, Michoacán, Baja California (Norte y Sur) y Guanajuato son los principales productores, pues aportan el 99% de la producción nacional. El estado de Puebla se posiciona en el noveno lugar de producción de fresa (SIAP, 2019). A pesar de su importancia, el cultivo presenta problemas fitosanitarios causados en su mayoría por hongos. Por mencionar algunos, se resaltan a Fusarium solani (Baiswar y Ngachan, 2018), Pestalotiopsis sp. (Morales-Mora et al., 2019), Curvularia inaequalis, C. spicifera (Ayoubi et al., 2017), Colletotrichum fragariae, C. acutatum (Chung et al., 2019), Rhizopus stolonifer (Oliveira et al., 2019) y Aspergillus niger (Chiotta et al., 2009). Estos fitopatógenos solos o en conjunto originan pérdidas del 70% de la producción ocasionado mermas económicas (Lafuente-Rincón et al., 2016). Los productos de síntesis química se han empleado por décadas para el control de estas enfermedades (Gan y Wickings, 2017). Sin embargo, el uso de éstos está relacionado con la generación de resistencia, daños al ambiente y la salud humana (Andrade-Hoyos et al., 2019). Bajo esta premisa, el control biológico se considera una de las prácticas eficientes y ecológicamente viables para el desarrollo de una agricultura sostenible (Pérez-Torres et al., 2018).
El género Trichoderma contiene a las especies antagonistas más relevantes, capaces de controlar un amplio número de hongos que afectan a las plantas de interés agrícola (Romero-Arenas et al., 2017). El éxito y su uso en la agricultura se debe a sus mecanismos de acción como la competencia por espacio, micoparasitismo, antibiosis y la producción de compuestos volátiles (Nawrocka et al., 2018; Hernández-Melchor et al., 2019). En consecuencia, los objetivos de este trabajo fueron: 1) identificar y caracterizar morfológicamente a nivel género aislados fúngicos asociados a un cultivo de fresa de la variedad Camino Real en Atlixco Puebla, México y 2) determinar la capacidad antagónica y el porcentaje de inhibición del crecimiento radial in vitro de la cepa T-H4 de Trichoderma harzianum contra los hongos aislados del cultivo de fresa.
Zona del aislamiento. Se tomaron muestras de tejido vegetal del cultivo de fresa variedad “Camino Real” en una parcela de 2,000 m2, de la comunidad de Xalpatlaco, Atlixco, Puebla (18° 56’ 9.26” N y 98° 26’ 16.56” O; 2,350 msnm), con antecedentes de alta incidencia de enfermedades fúngicas durante la producción primavera-verano 2018 y 2019. El muestreo fue dirigido, colectando muestras con síntomas sospechosos de hongos; todas las muestras se mantuvieron en bolsas de plástico dentro de una hielera hasta su traslado al laboratorio.
Aislamiento de hongos de tejidos vegetales. Las muestras se cortaron en secciones de 0.5 cm2 de tejido vivo y muerto, se desinfestaron con hipoclorito de sodio al 1.5% y se lavaron tres veces con agua destilada, se secaron con papel estéril y finalmente se sembraron en cajas Petri con medio de cultivo Papa Dextrosa Agar (PDA) a una temperatura de 25 ± 2 °C con luz ambiental por tres días. Las colonias desarrolladas fueron aisladas y purificadas mediante cultivos monospóricos o transferencia de puntas de hifa y se conservaron en una solución de glicerol al 20% a -84 °C.
Caracterización morfológica y crecimiento micelial. La identificación a nivel género de los hongos se realizó comparando las características morfológicas de la colonia (textura, tipo de micelio, color, tipo de hifas) y se tomaron medidas de forma y tamaño de estructuras anamórficas, las cuales se compararon con claves taxonómicas de identificación de Barnett y Hunter (1998) en un sistema de micro cultivo utilizando un microscopio óptico (Carl Zeiss, Jena, Alemania) a 1000x magnificaciones (Samson et al., 2014). Para la evaluación de la tasa de desarrollo micelial, se colocaron fragmentos de 0.25 cm2 de agar con micelio de 10 días de crecimiento de cada hongo caracterizado en cajas Petri con PDA, se incubaron bajo oscuridad a 27 °C por 10 días y se midió el diámetro micelial cada 12 h para estimar la velocidad de crecimiento (cm), la cual se calculó con la función de crecimiento lineal y=mx + b (donde ‘y’ es la distancia, ‘x’ es el tiempo y ‘b’ el factor constante) y se expresó en centímetros por día (cm d-1) (Zeravakis et al., 2001). El diámetro fue medido con un vernier digital (CD-6 Mitutoyo), manteniendo siempre en la misma dirección por triplicado, la cual fue establecida al azar para cada repetición, se usó solo el promedio para calcular la tasa de desarrollo y la velocidad de crecimiento micelial por día.
Antagonismo de T. harzianum ante hongos aislados del cultivo de fresa. La evaluación del antagonismo se realizó con la cepa T-H4 de T. harzianum, aislada de la raíz de Persea americana, cuya secuencia se incluyó en la base de datos del National Center for Biological Information (NCBI) con el número de acceso MK779064.1, mismo que está depositado en el laboratorio de Eco-Campus Valsequillo, del Instituto de Ciencias, Benemérita Universidad Autónoma de Puebla (BUAP). La técnica de cultivo dual se utilizó de acuerdo con Andrade-Hoyos et al. (2019) por triplicado para determinar el porcentaje de inhibición de crecimiento radial aplicando la fórmula PICR= [(R1-R2/R1) x 100] para cada ensayo evaluado por un lapso de siete a 10 días. Para complementar las evidencias del antagonismo, se comparó y clasificó cada ensayo con la escala establecida por Bell et al. (1982); I) Crecimiento de Trichoderma sp. cubrió toda la superficie del medio y redujo la colonia del patógeno, II) Crecimiento de Trichoderma sp. cubrió al menos 2/3 partes del medio, III) Trichoderma sp. y fitopatógeno crecieron ambos a la mitad de la superficie del medio, no se sobrepuso uno del otro, IV) Hongo patógeno creció al menos 2/3 partes del medio y resistió a la invasión de Trichoderma sp. y V) Crecimiento del patógeno cubrió toda la superficie del medio.
Análisis estadísticos. Los datos se analizaron con ANOVA (de dos vías) en el paquete estadístico IBM SPSS Statistics versión 25. La velocidad de crecimiento, tasa de desarrollo y PICR fueron las variables de respuestas con tres repeticiones en un diseño estadístico completamente al azar. El experimento se repitió dos veces para su validación. Se realizó una comparación de medias por el método de Tukey-Kramer con un nivel de probabilidad de p≤0.05.
Se obtuvieron 30 muestras de tejidos vegetales: 10 muestras de raíz, 10 muestras de hojas y 10 muestras de tallos con presencia de micelio, así como 20 frutos maduros de fresa con síntomas de enfermedad, de los cuales se identificaron dos hongos asociados a la raíz; tres hongos asociados a hojas y tallos; así como tres hongos asociados al fruto de fresa.
Fusarium sp. Se aisló de la corona de la planta y se asoció a síntomas de marchitez. Las colonias fúngicas desarrollaron micelio aéreo abundante, de textura algodonosa y de color blanco. En el reverso, la colonia fue de color rosado y tiñó el agar de tonos entre púrpura y violeta (Rentería-Martínez et al., 2018). En cuanto a las características microscópicas se observaron macroconidios (Figura 1A) ligeramente curvos de uno a cinco septos (Gordon, 2017) y microconidios en forma ovoide, yacientes de monofiálides laterales (Figura 1B), pueden formar masas (simulan cabezas) pero nunca cadenas. Las colonias crecieron a una velocidad de 0.83 ± 0.03 cm d-1 (Cuadro 1), rango que concuerda con el estudio de Groenewald et al. (2006).
Rhizoctonia sp. El hongo se asoció a síntomas de marchitez y pudrición de raíz. La colonia en medio de cultivo PDA, se observó de color blanco al inicio y posteriormente de color marrón y café arena en su periferia, con textura aterciopelada y cerosa, con escaso micelio aéreo, y con una tasa de desarrollo de 1.05 cm por día (Cuadro 1). Se observaron hifas hialinas y septadas, algunas de tonalidades más oscuras, con formación de un ángulo recto en algunos sitios de entrecruzamiento de las hifas (Figuras 1 C y D), criterio para ubicar al hongo dentro del género Rhizoctonia (González et al., 2006).
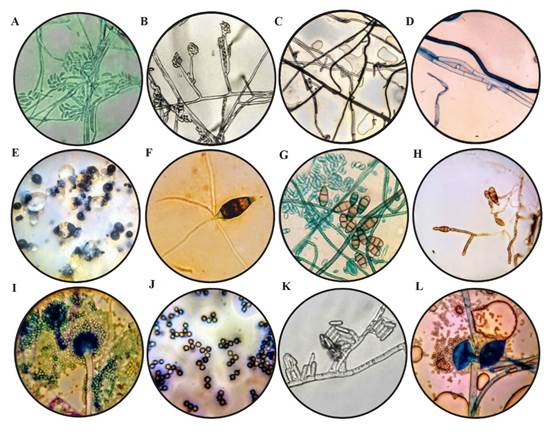
Figura 1 Características morfológicas, (A) Macroconidios septados (40 X) de Fusarium sp. teñidos con verde de malaquita; (B) Microconidios aglomerados en cabezas falsas sobre monofiálides con presencia de septos (100 X) característicos de Fusarium sp.; C) Micelio con ramificación y constricción en ángulo recto (40 X) de Rhizoctonia sp.; (D) Hifas septadas, con hifa naciente en un ángulo recto (100 X), de Rhizoctonia sp. teñidas con azul de metileno; (E) Conidiomas de color negro de Pestalotiopsis sp. en la superficie de la colonia; (F) Conidio (100 X) de Pestalotiopsis sp.; (G) Microconidios teñidos con verde de malaquita y presencia de conidios maduros (100 X) de Curvularia sp.; (H) Conidios ovoides a oblongos con celdillas (100 X) y sostenidos por hifas septadas de Alternaria sp.; (I) Conidióforo teñido con azul de metileno y métula hialina de Aspergillus niger (40 X); (J) Conidios globosos con crestas en su contorno (100 X) característicos de Aspergillus niger; (K) Conidios (100 X) de Colletotrichum sp.; (L) Esporangio maduro teñidos con azul de metileno de Rhizopus stolonifer (100 X).
Cuadro 1. Clase de antagonismo de acuerdo a Bell et al. (1982), porcentaje de inhibición de crecimiento radial y tasa de desarrollo de diferentes hongos asociados al cultivo de fresa en Atlixco, Puebla.
| Nombre | Tasa de desarrollo (mm/h) * | Velocidad de crecimiento ( cm d-1 ) * | PICR* | Clase Antagonismo |
|---|---|---|---|---|
| Colletotrichum sp. | 0.28 ± 0.007 c | 0.75 ± 0.01 e | 87.56 ± 1.60 a | II |
| Pestalotiopsis sp. | 0.28 ± 0.027 c | 0.94 ± 0.08 d | 71.11 ± 1.18 d | II |
| Alternaria sp. | 0.18 ± 0.006 d | 0.47 ± 0.01 f | 81.33 ± 0.77 c | II |
| Rhizoctonia sp. | 0.46 ± 0.052 b | 0.47 ± 0.02 f | 70.22 ± 5.46 de | III |
| A. niger | 0.51 ± 0.067 b | 1.33 ± 0.07 c | 43.56 ± 6.73 f | III |
| R. stolonifer | 0.56 ± 0.017 b | 2.08 ± 0.28 a | 28 ± 12.72 f | IV |
| Curvularia sp. | 0.31 ± 0.027 c | 1.52 ± 0.10 b | 84 ± 0.77 b | II |
| Fusarium sp. | 0.16 ± 0.013 d | 0.83 ± 0.03 d | 63.65 ± 1.50 e | III |
| T. harzianum | 1.67 ± 0.01 a | 1.86± 0.22 a | ||
*Letras diferentes significa diferencia significativa entre tratamientos de acuerdo con Tukey-Kramer para p≤0.05.
Pestalotiopsis sp. El hongo se aisló de áreas con necrosis principalmente en hojas y tallos; en las hojas se observaron acérvulos, principalmente en las zonas necróticas y se caracterizó al género de Pestalotiopsis (Morales-Mora et al., 2019). Las colonias mostraron crecimiento arrosetado y micelio aéreo escaso, una coloración entre tonos blanco y crema, en su interior y en la superficie del medio de cultivo se desarrollaron acérvulos de color negro brillante (Figura 1E). Se observaron conidios característicos del género Pestalotiopsis similares a lo reportado por Maharachchikumbura et al. (2014), oscuros, ligeramente curvados, con seis células con la basal y la terminal hialina y, esta última puntiaguda con tres a cinco apéndices apicales hialinos, también elipsoidal (Figura 1F). Además, se observaron conidióforos hialinos, irregularmente ramificados, septados, lisos y cortos. Las colonias mostraron una tasa de desarrollo micelial promedio de 0.28 ± 0.027 mm h-1 (Cuadro 1).
Curvularia sp. El hongo se aisló de hojas con manchas ovaladas con tonos castaño claro hasta oscuros, con márgenes amarillentos. Algunas especies de Curvularia son conocidas por causar tizón en la hoja y podredumbre de la fresa (Ayoubi et al., 2017). La colonia del hongo mostró abundante micelio aéreo, de color verde-negro y micelio vegetativo radial y expansivo de color café-obscuro y blanco grisáceo hacia la periferia de la parte reversa de la colonia. Hifas septadas, hialinas a marrón claro y ramificadas de 1.5-4 µm de ancho. Conidios de forma simpodial, fusiformes y ovalados en los extremos, con tres o cuatro divisiones, de color café-dorado a café-pálido, con divisiones de los extremos ligeramente hialinas y de tamaño entre 10-25 μm de largo y 7-10 μm de ancho. Células conidiógenas hialinas de 7-12 μm de largo por 5-10 μm de ancho, proliferando de forma simpodial con desprendimiento de microconidios (Figura 1G). Esta caracterización concuerda con algunas especies de Curvularia descritas por Madrid et al. (2014). La velocidad de crecimiento promedio fue de 1.52 ± 0.10 cm d-1 resultados similares a los reportados por Almaguer et al. (2013).
Alternaria sp. El hongo se aisló de hojas con manchas foliares de forma irregular y de color café obscuro, con un contorno amarillento tenue; estos síntomas se asocian con infecciones de Alternaria. La colonia presentó una textura algodonosa, abundante y densa, de tonalidades entre blanco-gris y, posteriormente gris oscuro, como lo reportaron Mehmood et al. (2018) en el cultivo de fresa. En el anverso y reverso de la caja Petri, el agar se tiño de un tono entre verde y negro. La cepa presentó hifas septadas, hialinas y conidios de forma ovoides a oblongos, septados transversal y longitudinalmente (Figura 1H), con tres hasta cinco divisiones en los conidios. Este hongo presentó una tasa de desarrollo micelial de 0.18 ± 0.006 mm h-1 (Cuadro 1).
Aspergillus niger. El hongo se aisló de frutos con signos de “podredumbre de la frutilla” y se caracterizó como A. niger (Chiotta et al., 2009). La colonia presentó micelio con crecimiento disperso de color negro oscuro, con textura granular y densa. Dentro de las características microscópicas se observaron cabezas conidiales biseriadas y radiales procedentes de hifas aéreas de 5-7 µm de diámetro, de paredes gruesas, lisas, hialinas y de color marrón pálido, vesícula casi esférica de 10 µm de diámetro de donde se desarrollaron métulas, ocupando toda la superficie. Sus conidios globosos de color marrón (Figura 1 I-J), normalmente rugosos con crestas irregulares y protuberancias (Krijgsheld et al., 2013). La velocidad de crecimiento fue de 1.33 ± 0.07 cm d-1 (Cuadro 1). Jørgensen et al. (2011) reportan un crecimiento vegetativo de A. niger N402 en medio maltosa de 0.22 a 0.24 mm h-1.
Colletotrichum sp. El hongo se aisló de frutos que presentaron lesiones necróticas, hundidas, en forma de anillos concéntricos. Los principales hongos asociados a estos síntomas de enfermedad pertenecen al género Colletotrichum (C. acutatum, C. gloeosporioides y C. fragariae) (Howard et al., 1992). Las colonias presentaron micelio de tonos naranja-pálido a naranja-salmón; así mismo desarrolló un micelio aéreo con tonos blancos hasta rosados. Además, se observó la formación de aglomeraciones sobre la superficie de la colonia, estas eran de un color naranja brillante y en su interior se observó el desarrollo de conidios. Dichas estructuras se describen como conidiomas de tipo acérvulo (Dai et al., 2006). Específicamente, la colonia aislada desarrolló acérvulos epidermales, conidios de forma cilíndrica con extremos redondeados, los cuales se generaron directamente de las monofiálides provenientes de las hifas septadas (Figura 1K) (Freeman y Katan, 1997). Las colonias crecieron a velocidad de 0.75 ± 0.01 cm d-1 (Cuadro 1), rango que concuerda con Gutiérrez-Alonso et al. (2001), quienes evaluaron distintos aislamientos de C. gloeosporioides.
Rhizopus stolonifer. El hongo se aisló de frutos en descomposición. La colonia presentó colonias blancas y posteriormente gris, algodonosas con crecimiento rápido y con micelio aéreo. La velocidad de crecimiento fue de 2.08 ± 0.28 cm d-1 (Cuadro 1); Hernández-Lauzardo et al. (2005) reportaron una tasa de crecimiento superior (2.3 mm h-1) de R. stolonifer durante el período de incubación de cuatro días, resultados superiores a los reportados en esta investigación. Se observó el desarrollo de esporangióforos de color pardo oscuro que nacen de un nudo de rizoides, zigosporas esféricas de pared gruesa y desnuda. Este hongo se reconoce fácilmente por sus espolones hialinos o parduzcos, sus rizoides numerosos y pardos y sus esporangios negros y lustrosos (Figura 1L) (Farrera et al., 2007).
Antagonismo de T. harzianum ante hongos aislados del cultivo de fresa. Se presentaron zonas de interacción entre T. harzianum y los hongos evaluados, donde se observó un parasitismo para todos los casos. La reducción en la tasa de crecimiento de los hongos en cultivos duales es un indicador de la capacidad antagónica de Trichoderma (Guigón-López et al., 2010). El porcentaje de inhibición de crecimiento radial (PICR) varió en un rango de 28 a 87.6%, con diferencias significativas (p<0.05). Los porcentajes de inhibición más altos se registraron en los confrontamientos con las cepas de Colletotrichum sp., Alternaria sp. y Curvularia sp. (Cuadro 1). En el confrontamiento con Alternaria sp. se observó nulo crecimiento al momento del contacto con el antagonista. Este efecto se reportó contra A. porri, al confrontarse con T. harzianum en pruebas in vitro; que también mostró fuerte actividad micoparasítica y alta capacidad competitiva por espacio y nutrientes (Mazrou et al., 2020).
En un estudio realizado por Gaviria-Hernández et al. (2013), al estudiar T. harzianum, obtuvieron valores de antagonismo de 65% para C. gloeosporioides y 79% para C. acutatum, resultados inferiores a los reportados en la presente investigación. Por otro lado, Benhamou y Chet (1993) indicaron que existe gran agresividad por parte del antagonista T. harzianum y susceptibilidad de R. solani desde el segundo día después de la inoculación. Estos resultados concuerdan con los obtenidos por Hernández-Lauzardo et al. (2005), quienes en condiciones similares obtuvieron un PICR de 58% cuando evaluaron a T. harzianum A-34 contra R. solani, resultados menores a los reportados en la presente investigación; sin embargo, Andrade-Hoyos et al. (2019), encontraron un PICR de 87.9% para R. solani utilizando T. harzianum.
En otra investigación Guédez et al. (2009), compararon el crecimiento miceliar de T. harzianum con R. stolonifer (3.22 cm), R. solani (3.1 cm) y A. niger (1.72 cm) obteniendo diferencias significativas (p<0.01), resultados similares a la presente investigación. Michel-Aceves et al. (2005) encontraron que al evaluar el efecto antagónico de aislados nativos de Trichoderma spp., sobre el crecimiento de F. oxysporum y F. subglutinans fueron de 47.6% y 73%, respectivamente, resultados similares a los del presente estudio. Por otro lado, en una investigación reciente de Andrade-Hoyos et al. (2019), mencionan que T. harzianum inhibe el crecimiento de micelio en F. oxysporum hasta 35%. La actividad antagónica de T. harzianum fue menor con A. niger y R. stolonifer, donde los porcentajes de inhibición fueron de 43.56 ± 6.73% y 28 ± 12.72%, respectivamente, valores que se clasifican en las clases III y IV (Figura 2) de acuerdo con la escala establecida por Bell et al. (1982). Corrêa et al. (2007), observaron un efecto antagónico nulo de cepas de T. harzianum y T. aureoviride frente a Sclerotium rolfsii. Esto podría indicar que los aislamientos de S. rolfsii son capaces de liberar sustancias al medio de cultivo al entrar en contacto con el antagonista, que impiden el avance de este y/o desintoxican los metabolitos secretados por Trichoderma, como lo menciona Duarte-Leal et al. (2017), por lo que estos aspectos se deben continuar investigando para otros hongos, como es el caso de A. niger y R. stolonifer.
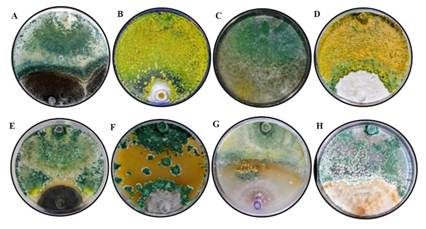
Figura 2. Antagonismo de la cepa T-H4 de T. harzianum en escala de Bell et al. (1982), (A) Aspergillus niger, (B) Colletotrichum sp., (C) Rhizopus stolonifer, (D) Pestalotiopsis sp., (E) Curvularia sp., (F) Alternaria sp., (G) Fusarium sp. y (H) Rhizoctonia sp.
Reyes et al. (2008) notificaron que una de las características significativas de Trichoderma es su elevada velocidad de crecimiento. García-Espejo et al. (2016) mencionan que la forma en que T. harzianum probablemente inhibe el crecimiento del patógeno, es debido a la producción de compuestos inhibitorios que se difunden al medio de cultivo; antibiosis por producción de metabolitos volátiles y no volátiles entre los cuales se encuentran, pirones, isocianatos, pépticos y trichocinas; además, la producción de enzimas extracelulares difundibles tales como pectinasas, cutinasas, glucanasas y quitinasas. En este sentido, se logra observar que que Alternaria sp., Colletotrichum sp. y Curvularia sp., son más susceptibles al hongo antagonista.
Las pruebas de antagonismo reflejan la capacidad y variabilidad genética del antagonista y del fitopatógeno para resistir el antagonismo, permitiendo la selección preliminar para ser evaluados en condiciones de campo, así como para complementar y determinar su capacidad biocontroladora (Fraire-Cordero et al., 2003). En esta área de estudio se abren perspectivas potenciales, debido a que los microorganismos antagonistas se han utilizado durante años como agentes de biocontrol para diversas enfermedades en fruta fresca y para cultivos con buenos resultados (Elad et al., 1983).
En la presente investigación se logró identificar a Colletotrichum sp., A. niger y R. stolonifer asociados al fruto de fresa, Pestalotiopsis sp., Curvularia sp. y Alternaria sp., presentes en hojas y tallos y a Rhizoctonia sp. y Fusarium sp., asociados a la raíz del cultivo de fresa, variedad Camino Real. La cepa de Trichoderma harzianum (T-H4) mostró capacidad antagónica in vitro frente a Colletotrichum sp., Pestalotiopsis sp., Alternaria sp., Rhizoctonia sp. y Curvularia sp., pero no consiguió inhibir el desarrollo de R. stolonifer.











 text in
text in 


