Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de fitopatología
versión On-line ISSN 2007-8080versión impresa ISSN 0185-3309
Rev. mex. fitopatol vol.38 no.3 Texcoco sep. 2020 Epub 27-Nov-2020
https://doi.org/10.18781/r.mex.fit.2005-6
Artículos de Revisión
Lisozimas: características, mecanismo de acción y aplicaciones tecnológicas en el control de microorganismos patógenos
1 Laboratory of Microbiology and Mycotoxins, Department of Food Research and Postgraduate, Universidad de Sonora, Bulevard Luis Encinas y Rosales S/N, Colonia Centro, C.P. 83000, Hermosillo, Sonora, México;
2 Centro de Desarrollo de Productos Bióticos, Instituto Politécnico Nacional, Carretera Yautepec-Jojutla, Km 6, CEPROBI 8, C.P. 62731, San Isidro Yautepec, Morelos, México.
Dentro de las enzimas antimicrobianas reportadas, las lisozimas y las enzimas tipo lisozimas procedentes de diversas fuentes naturales han mostrado actividad antibacteriana y antifúngica, haciéndolas atractivas como nuevas alternativas para controlar los microorganismos patógenos. Aunque las enzimas antimicrobianas se han propuesto ampliamente en la industria alimentaria y en la protección de cultivos, su uso implica algunas desventajas, como la inactivación por inhibidores o productos químicos o condiciones de procesamiento, los altos costos de producción y purificación, y problemas de solubilidad e inestabilidad. La tecnología de inmovilización enzimática es una herramienta prometedora capaz de reducir estos inconvenientes, particularmente cuando está destinada a trabajar en medios sólidos. Esta revisión muestra el estado del arte sobre la actividad de la lisozima contra bacterias y hongos, centrándose en los mecanismos de acción involucrados. Además, también se discuten los aspectos y características más importantes de las lisozimas y su posible aplicación tecnológica, incluida la aplicación de matrices poliméricas a base de quitosano para la inmovilización de las enzimas antimicrobianas.
Palabras clave: Enzimas antimicrobianas; nanomateriales; matrices poliméricas; quitosano
Since lysozymes and enzymes-like lysozymes have antibacterial and antifungal activity, they are becoming attractive as new alternatives for controlling pathogenic microorganisms. Although the antimicrobial enzymes have been proposed in the food industry and crop protection, their use involves some disadvantages. These include the inactivation by inhibitors, chemicals, or processing conditions, the high production and purification costs, and problems of solubility and instability. Enzyme immobilization is a promising tool capable of reducing some inconveniences, mainly when it is intended to work in solid media. This review shows state of the art on the lysozyme activity against bacteria and fungi, focusing on its mechanisms of action. The most important aspects and characteristics of the antimicrobial lysozymes and their possible technological application, including the application of chitosan-based polymeric matrices for the immobilization of the antimicrobial enzymes, are also discussed.
Key words: Antimicrobial enzymes; nanomaterials; polymeric matrices; chitosan
Las enzimas pertenecen a una gran diversidad de moléculas de origen natural y, como parte de sus atributos, algunas poseen actividad antimicrobiana (Oh y Park, 2018). Las enzimas presentan características particulares que las convierten en excelentes catalizadores biológicos y aceleran la velocidad a la que se llevan a cabo las reacciones biológicas específicas para formar o degradar un nuevo producto (Sheng et al., 2016). En los microorganismos, como en otros tipos de organismos vivos, las enzimas tienen un papel primordial en sus funciones biológicas, como la división y el desarrollo celular, la defensa y la adaptación a condiciones desfavorables en un ambiente dado (Gow et al., 2017). Por otro lado, la capacidad que tienen los organismos de colonizar hábitats específicos ha dado como resultado el surgimiento de varios problemas económicos y sanitarios en todo el mundo (Gálvez-Iriqui et al., 2019). Sin embargo, las plantas y los organismos no están indefensos ante el ataque microbiano, ya que las enzimas tienen una amplia participación en los procesos de defensa.
Hasta ahora, las enzimas antimicrobianas que han sido estudiadas son, entre otras, las proteolíticas, las oxidativas y las que tienen la capacidad de hidrolizar polisacáridos, incluidas las amilasas, las liasas, Dispersin B y las lisozimas (Thallinger et al., 2013). En particular, se ha reportado ampliamente la actividad de las lisozimas contra varios microorganismos debido a su capacidad de hidrolizar los polímeros presentes en la pared celular de las bacterias, específicamente aquellas que pertenecen al grupo Gram (+) (Phillips, 1967). En estudios recientes se ha reportado también la capacidad que tiene esta enzima de hidrolizar la pared celular de hongos y levaduras (Manikandan et al., 2015; Zhou et al., 2017; Hernández-Téllez et al., 2018). Asimismo se ha reportado su efectividad como agente antibacterial y antifúngico cuando se combina con otros compuestos activos (Hernández-Téllez et al., 2018; Wu et al., 2018a). Las moléculas biopoliméricas como el quitosano se han utilizado en la preparación de materiales funcionales o de compuestos formulados a base de lisozimas. El quitosano es un biopolímero policatiónico capaz de retardar o inhibir el desarrollo de bacterias y hongos al interactuar con los componentes celulares presentes en la membrana y la pared celular (Bautista-Baños et al., 2016).
La combinación de lisozimas y quitosano se ha utilizado en la fabricación de materiales en forma de soluciones, películas, fibras, hidrogeles y micro- y nanopartículas, cuyo uso se ha propuesto para el control de microorganismos en los ámbitos de la salud humana, la agricultura y la industria de transformación y preservación de alimentos (Wu et al., 2018a). Por tanto, es posible suponer que las lisozimas, solas o combinadas con el quitosano, pueden actuar en los diferentes biopolímeros y péptidos presentes en las células de los hongos y la levadura induciendo la muerte de la célula o anormalidades durante el crecimiento. Por tanto, el objetivo de la siguiente revisión es presentar los aspectos y las características más importantes de las lisozimas y sus aplicaciones tecnológicas como enzimas antimicrobianas.
Información general sobre la lisozima. La lisozima o muramidasa forma parte del grupo de las hidrolasas glucosídicas y cataliza la hidrólisis del enlace β (1-4) entre la N-acetilglucosamina y el ácido N-acetilmurámico de las paredes celulares de las bacterias (Jana et al., 2017). Su estructura primaria está formada por una cadena polipeptídica simple cuyo número de residuos de aminoácidos varía: 130 en la lisozima humana (hLyz) y 129 en la lisozima de pollo (cLyz) (Cao et al., 2015). Sin embargo, ambas tienen una estructura muy similar. La cLyz es una enzima con 14.6 kDa y un alto punto isoeléctrico de 11.16 (Yu et al., 2018), en tanto que la hLyz tiene 14.7 kDa y un punto isoeléctrico de 9.28; sin embargo, el aspartato-52 y el glutamato-35 son los aminoácidos esenciales en la actividad enzimática (Cao et al., 2015). Además, la estructura terciaria de la enzima de ambas lisozimas es similar, pero difiere en una región beta. En la Figura 1 se muestran los cuatro hélices alfa, las cuatro bobinas aleatorias y una doble hoja beta plegada y antiparalela de la lisozima humana y una hoja beta plegada trenzada y antiparalela de la lisozima de pollo (Strader, 2018). En general, la lisozima se pliega en una estructura terciaria compacta y globular con una larga hendidura en su superficie (Sheng et al., 2016; Jana et al., 2017; Strader, 2018). La estructura de la enzima tiene seis triptófanos (Trp-28, Trp-62, Trp-63, Trp-108, Trp-111 y Trp-123) y tres tirosinas (Tyr-20, Tyr-23 y Tyr-53), de los cuales tres residuos de Trp se localizan en el sitio de unión del sustrato, dos en la parte hidrofóbica y uno en el borde de la lisozima. Dentro de estos aminoácidos, Trp-62 y Trp-108 se encuentran en el sitio de unión del sustrato y desempeñan una función esencial en la unión del sustrato y la estabilización de la estructura de la enzima (Figura 2) (Sheng et al., 2016; Wu et al., 2019).

Figura 1 Estructura terciaria de la lisozima humana (rojo) y de la lisozima de clara de huevo (pollo, azul) (Strader, 2018).
Sustrato de la lisozima. El peptidoglucano es un componente básico de la pared celular de las procariotas fuera de la membrana citoplásmica (Jana et al., 2017; Monteiro et al., 2018). Esta estructura polimérica es fundamental para las células de las bacterias, ya que lleva a cabo el mantenimiento de su morfología, sirve como andamio para fijar otros componentes en la envoltura celular, como las proteínas, se ocupa del estrés mecánico y permite que los nutrientes lleguen a la membrana plásmica que contiene los transportadores (e.d., proteínas, porinas, permeasas, entre otros) necesarios para su translocación en el citosol, procesos todos estos necesarios para la supervivencia de las bacterias (Jana et al., 2017).
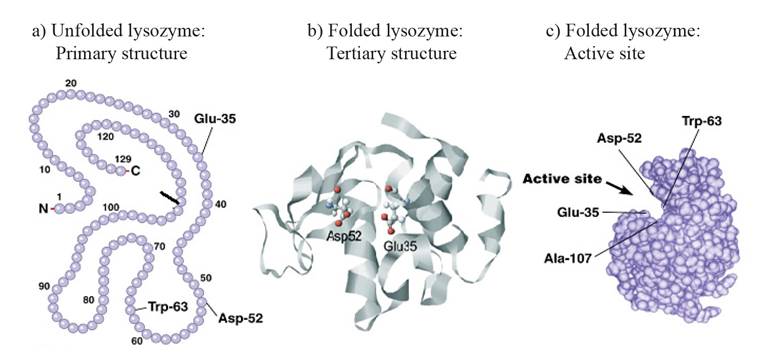
Figura 2. Estructuras primaria (a) y terciaria (b) de la lisozima de pollo. Sitio activo con los aminoácidos responsables de la actividad de la lisozima (c). (Held y Van Smaalen, 2014; Hardin et al., 2016).
El peptidoglucano o mureína es un biopolímero formado por cadenas lineales de glucanos, entrecruzadas por péptidos cortos con diferentes composiciones, dependiendo del tipo de bacteria. Están ensambladas por residuos de N-acetilglucosamina (GlcNAc) y el N-acetil ácido murámico (MurNAc) unidos por enlaces β (1-4) (Jana et al., 2017; Monteiro et al., 2018). Las bacterias patogénicas han generado resistencia a la actividad bacteriolítica del hospedante que secreta la lisozima durante la infección; el mecanismo primario es la modificación de la cadena de su peptidoglucano glucano (Sukhithasri et al., 2013) (Figura 3).
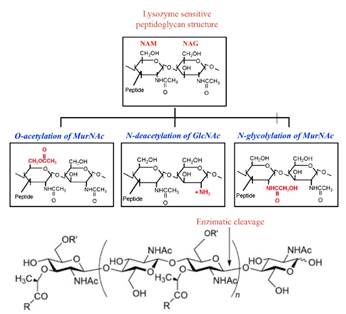
Figura 3. Estructura de un peptidoglucano sensible y uno resistente a la lisozima (a) y escisión enzimática de lisozima; (b) Bacteria patogénica que modifica esta estructura por O-acetilación de AAM en la posición C-6, N-deacetilación de NAG en la posición C-2 y N-glicosilación de ácido murámico en la posición C-2 (Sukhithasri et al., 2013; Taylor et al., 2019).
Recientemente, se ha reportado la síntesis de los monosacáridos y disacáridos del ácido acetilmurámico (AAM), así como la posibilidad de que estos compuestos puedan unirse al sitio activo de la lisozima, para producir su hidrólisis (Jana et al., 2017). La disposición en el espacio de los grupos funcionales de estos compuestos pueden impedir o promover la unión al sitio activo de la enzima, en este caso, los grupos metoxilo (-OCH3), acetilo (-COCH3) y metilo (-CH3). Este estudio sugiere que los sustratos relacionados con el peptidoglucano, que puedan adoptar la conformación necesaria para interactuar con el sitio activo, serán hidrolizados en los enlaces o-glicosídicos por la lisozima.
De aquí surge la pregunta sobre cómo pueden interactuar la lisozima y otros polisacáridos distintos al peptidoglucano, sobre todo aquellos que están presentes en la pared celular de los hongos o la levadura, como la quitina y el quitosano, que están estructuralmente relacionados, o incluso otros polisacáridos como los β-glucanos. Sin embargo, es de destacar que estos microorganismos no tienen peptidoglucano. Es importante señalar que aún no se ha reportado la manera en que estos polisacáridos interactúan a nivel molecular (Sowa-Jasiłek et al., 2016; Zhou et al., 2017; Hernández-Téllez et al., 2018;). Es posible que la quitina (un polímero de cadena larga de N-acetilglucosamina) o el quitosano (compuesto de residuos de D-glucosamina y N-acetil-D-glucosamina unidos a β-(1→4)) tengan una función importante en la interacción entre la lisozima y la pared celular fúngica (Han et al., 2012).
Mecanismo de catálisis. El mecanismo catalítico de la lisozima fue el primero que se estudió del grupo de las glicosidasas. Éste cataliza la escisión de los enlaces β-1,4-glicosídicos entre el ácido N-acetilmurámico y la N-acetil glucosamina en el peptidoglucano (Yu et al., 2018). La lisozima tiene dos residuos de ácido carboxílico, aspartato-52 y glutamato-35, que se encuentran estratégicamente situados en el enlace glicosídico y catalizan la escisión en dos pasos (Figuras 3, 4 y 5).

Figura 4. Complejo enzima-sustrato de la lisozima de pollo donde se pueden apreciar los residuos catalíticos Glu-35 y Asp-52 en el sitio activo. Figura editada de Hardin et al., 2016.
En general, el proceso catalítico comienza con un fragmento de seis residuos del polisacárido (subsitios A-F); este fragmento se une al sitio activo de la enzima, donde todos los monómeros del fragmento son fácilmente incrustados, excepto uno (D). El monómero D produce una conformación de media silla, la cual cambia para entrar en un punto específico del sitio activo de la enzima. Este sitio contiene dos aminoácidos iónicos, ácidos glutámico (Glu-35) y aspartato (Asp-52). Estos dos residuos desempeñan funciones muy diferentes; el Glu-35 actúa como residuo ácido-base y el Asp-52 como un nucleófilo enzimático (Jana et al., 2017).
En su trabajo, Phillips (1967) estableció la distancia entre los residuos glicosídicos D y E que unen el oxígeno. El oxígeno más cercano de Glu 35 es de casi 3 Å; el más cercano de Asp 52 es de aproximadamente 3 Å desde el átomo C(1) del residuo D de azúcar, y de aproximadamente la misma distancia desde el átomo de oxígeno del anillo de ese residuo.
En el primer paso (glicosilación), D se tensa en una conformación similar a la del estado de transición. El residuo ácido-base Glu-35 actúa como donador de un protón al oxígeno, que participa en la unión glicosídica de los residuos D y E; por tanto, la reducción del oxígeno induce la escisión del enlace C-O. Glu-35 tiene ahora un oxígeno de carga negativa y D es un ión inestable con carga positiva. Al mismo tiempo, el carboxilato desprotonado de Asp-52 realiza un ataque nucleofílico al carbón anomérico y, mediante resonancia, estabiliza el carbón con carga positiva. En el segundo paso (deglicosilación), el Glu-35 desprotonado actúa como base general donde acepta un protón (desprotonado). Este protón proviene de una molécula de agua directamente posicionada y lleva a cabo una sustitución nucleofílica en la enzima glicosil. El hidróxido resultante se puede unir con el residuo D neutralizando la carga y permitiendo su liberación de la hendidura. A continuación, el nucleófilo se regenera en el sitio activo (Figura 5) (Stick et al., 2009; Jana et al., 2017; Strader, 2018; Wu et al., 2019).
Diferencias catalíticas entre los tipos de lisozimas. La lisozima y las enzimas tipo lisozima (poca actividad de la muramidasa) han sido aisladas y purificadas a partir de fuentes y organismos naturales. Estas enzimas pueden inducir cambios en la estructura de la célula y causar la muerte de los microorganismos (Chen et al., 2016). En los animales, existen cuatro principales tipos de lisozimas, que se clasifican dependiendo de la fuente: tipo-c (de pollo o convencional), type-g (ganso), tipo-i (invertebrado) y tipo-ch (chalaropsis) (Zhou et al., 2017). Los tipos -c y -g se encuentran en todos los vertebrados, en tanto que los invertebrados típicamente producen el tipo-i. Los diferentes tipos de lisozima se han reportado en algunos invertebrados, por ejemplo, lisozimas tipo c en artrópodos, de tipo g en moluscos y de tipo-ch en nematodos (Zhou et al., 2017; Yu et al., 2019).
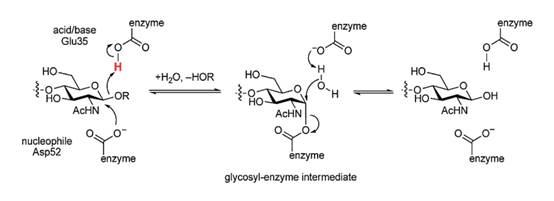
Figure 5 Mecanismo catalítico de la lisozima mediado por los aminoácidos Glu-35 y Asp-52 (Stick et al., 2009).
En el Cuadro 1 se resumen los diversos tipos de lisozimas y enzimas tipo lisozimas de animales, plantas y los que se obtienen por recombinación genética. Tanto en los vertebrados como en los invertebrados, las lisozimas y las enzimas tipo lisozimas son enzimas multifuncionales que sirven como moléculas de inmunidad innata inespecífica responsables de la defensa antibacterial (patógenos y no patógenos) y/o de la digestión (Zhou et al., 2017; Wu et al., 2019). No obstante, pocos estudios han reportado estimulación previa con una infección bacteriana o fúngica en los organismos hospedantes para inducir la expresión de las lisozimas y las enzimas tipo lisozimas (Zhou et al., 2017; Yu et al., 2019); después de que fueron aislados, la actividad de la lisozima en algunos de ellos fue poca o nula, pero la actividad de la peptidasa aumentó o fue sobreexpresada en el tracto digestivo. Este comportamiento sugiere que ciertas lisozimas de organismos vivos o enzimas tipo lisozimas tienen una función primaria relacionada con las funciones digestivas y la nutrición (Zhou et al., 2017; Yu et al., 2019).
Las diferencias catalíticas entre los diversos tipos de lisozima sugieren que la ausencia de actividad de la muramidasa de las lisozimas tipo-i con respecto a las de tipo-c podrían deberse a diferencias en la secuencia del aminoácido. Zhou et al. (2017) obtuvieron y purificaron una lisozima recombinante de tipo-i de cangrejo de manglar (Scylla paramamosain), que tenía 54% de similitud con la lisozima tipo-i aislada de camarón (Litopenaeus vannamei); ésta fue altamente expresada tanto en el tracto digestivo como en los hemocitos. El análisis de la secuencia del aminoácido reveló que esta enzima carecía de los dos aminoácidos responsables de la actividad de la muramidasa, los ácidos aspártico y glutámico. Pese a esto, los homólogos tipo-i de la lisozima en invertebrados, la enzima Splys-i, mostraron actividad antimicrobiana contra bacterias tanto Gram (+) como Gram (-), así como en células fúngicas, cuando los cangrejos fueron previamente expuestos a éstas. Los autores sugieren que el mecanismo de acción contra estos microorganismos no está relacionada con la actividad de la muramidasa sino con la actividad de la isopeptidasa y los fenómenos de aglutinación de las proteínas en la superficie microbiana, haciendo posible la unión con los componentes de la célula como los peptidoglucanos y los lipopolisacáridos.
Cuadro 1 Propiedades de algunas lisozimas purificadas obtenidas de animales, plantas y recombinación genética.
| Source of lysozyme | Characteristic | pH | Molecular Weight | Biological activity | Reference |
|---|---|---|---|---|---|
| Pupae(Cameraria ohridella) | Crude extract with lysozyme activity | Experimental conditions: 6.4 | 15 & 28 kDa | Antibacterial activity against Micrococcus luteus, Saccharomyces cerevisiae, Bacillus megaterium | Fiołka et al., 2005 |
| Mung bean (Phaseolus mungo) | SLA = 355 U mg-1 at 30 °C pI: 9.7 Optimum temperature of 55 °C | Optimum at 5.5 | 14.4 kDa | Antifungal activity against Fusarium oxysporum, F. solani, Sclerotium rolfsii, Pythium aphanidermatum, B. cinerea | Wang et al., 2005 |
| Clam (Ruditapes philippinarum) | SLA = 3.76×105 U mg-1 | 5.5 | 13.4 kDa | N/D | Kim et al., 2012 |
| Cauliflower (Brassica oleracea) | EA = 133.0 μg Optimum temperature of 40 °C | 3.0-9.0 Optimum at 8 | 22.0 kDa | Antimicrobial activity against Pseudomonas syringae, Xanthomonas campestris, E. carotovora, F. solani, Leptosphaeria maculans, B. cinerea, Cheilomenes lunata, Rhizoctonia solani, A. alternata | Manikandan et al., 2015 |
| Lyz-i2 recombinant from white shrimp (Litopenaeus vannamei) | Physicochemical parameters = N/D | Experimental condition: 6.2 | 16.9 kDa | Antibacterial activity against E. coli, Micrococcus lysodeikticus, Vibrio vulnificus, V. harveyi, V. alginolyticus, V. parahaemolyticus | Chen et al., 2016 |
| Lyz type-c from silkworm (Galleria mellonella) | Physicochemical parameters = N/D | Experimental condition: 6.4-7.4 | N/D | Activity against Candida albicans | Sowa-Jasiłek et al., 2016 |
| Lyz type-i recombinant from mud crab (Scylla paramamosain) | Lys with a 54% identity to Lys of L. vannamei Physicochemical parameters = N/D | Optimum at 8 | 16 kDa | Low muramidase activity, moderate antimicrobial activity against Gram (+) and Gram (-) bacteria and C. albicans | Zhou et al., 2017 |
| Lyz recombinant from whitefly (Bemisia tabaci) | Type-c: Btlysc, Type-I: Btlysi1-Btlysi2 | Optimum at 6 | 15 kDa | Antibacterial activity against Bacillus subtilis and Staphylococcus aureus | Wang et al., 2018 |
| Lyz type-i from earthworm (Eisenia andrei) | Isopeptidase activity. Chain of 226 amino acid residues | N/D | 22.2 kDa | Important for the digestive system | Yu et al., 2019 |
wEA = actividad enzimática; xSLA = actividad específica de la lisozima, ypI = punto isoeléctrico, zN/D = no determinado.
La lisozima tipo-i obtenida de lombriz de tierra Eisenia andrei mostró una secuencia del polipéptido de 226 residuos de aminoácidos, con 14 residuos de cisteína (Cys). La teoría de los autores es que posiblemente los residuos de Cys tienen que ver con el alto número de puentes de azufre que distinguen el tipo-i de otras lisozimas (Yu et al., 2019). Un aspecto importante de esta secuencia enzimática (Ea-iLys) es que contiene tres residuos de ácidos aspártico y glutámico, y serina, que promueven la actividad de la muramidasa, la alanina y la isopeptidasa mediada por la histidina. Los 14 residuos de Cys forman siete puentes de disulfuro, que bloquean los pocos sitios de escisión de la tripsina (< 10), posiblemente haciendo que esta enzima sea resistente a las proteinasas digestivas que secretan las glándulas intestinales. Estas diferencias sugieren que la actividad de esta enzima se concentra principalmente en las funciones digestivas y que no es parte de los efectores del sistema inmunológico (Yu et al., 2019). Por último, Wang et al. (2018) obtuvieron tres lisozimas recombinantes de tres genes de mosquita blanca (Bemisia tabaci), una de tipo-c (Btlysc) y dos de tipo-i (Btlysi1 y Btlysi2). Estas enzimas mostraron variaciones en el número de aminoácidos en sus secuencias, 146 en las de tipo-c y 156 y 160 en las dos de tipo-i, respectivamente. Las de tipo-c contenían ocho residuos de cisteína consevados, en tanto que Btlysi1 y Btlysi2 tenían 12 residuos de cisteína conservados con la capacidad de formar seis puentes de disulfuro.
Estos resultados coinciden con los que obtuvieron Yu et al. (2019) y Zhou et al. (2017). Estos autores sugieren que las lisozimas de tipo-i contienen numerosos puentes de disulfuro debido a su relación con la función digestiva de E. andrei y S. paramamosain. Además, la expresión de la lisozima de tipo-c ocurrió antes y después de que la mosquita blanca fuera infectada con el hongo entomopatógeno Beauveria bassiana, sin cambiar su patrón de comportamiento; esto sugiere que la lisozima tipo-c desempeña la función de un efector del sistema inmunológico. Las dos enzimas de tipo-i cambiaron su patrón de expresión cuando la alimentación de las mosquitas varió y no contrajeron ningún tipo de infección con microorganismos patogénicos, lo cual indica que estas enzimas están muy relacionadas con los procesos digestivos.
Efecto del pH y la temperatura en la actividad enzimática. Los aminoácidos responsables de la escisión del polisacárido son susceptibles a variaciones en la acidez del medio. El pH y la temperatura afectan la actividad catalítica de la enzima y, en consecuencia, la velocidad de la reacción, que lleva a cabo el mecanismo de acción. Dependiendo de la fuente de aislamiento y purificación, la lisozima puede tener pequeñas variaciones en su pH y temperatura óptimos (Cuadro 1). La mayoría de los estudios indican que las escalas óptimas de pH van desde ligeramente ácido (5.5-6.7) para el tipo-c (Fiołka et al., 2005; Kim et al., 2012; Chen et al., 2016; Wang et al., 2018) hasta alcalino (7.4-8) para el tipo-i (Manikandan et al., 2015; Zhou et al., 2017; Yu et al., 2019;). La temperatura óptima de las lisozimas varía según la fuente, pero la mayoría de los estudios indican que es de aproximadamente 40 °C para insectos y animales.
Actividad antibacterial y antifúngica de la lisozima. La actividad biológica de la lisozima causa una interferencia en el crecimiento bacterial, sobre todo en las Gram (+). Además, el descubrimiento de la estructura de la lisozima promovió más estudios de investigación sobre su posible aplicación. En general, la actividad de la lisozima se determina utilizando cepas de Micrococcus sp., que sirven como sustrato para visualizar la actividad por medio de turbidimetría. Actualmente, el ensayo de Micrococcus sp. es considerado el estándar de referencia para medir la actividad de la lisozima (Fiołka et al., 2005; Kim et al., 2012).
Fiołka et al. (2005) aislaron y purificaron una lisozima de la pupa de Cameraria ohridella capaz de lisar las células de Bacillus megaterium, ocasionando una disminución en la densidad óptica del crecimiento bacterial comparada con la del control de la lisozima. Según los autores, es posible que las lisozimas tengan dos funciones, una forma digestiva que descompone las bacterias ingeridas en el intestino y una respuesta de defensa contra patógenos que se introducen en el hemocele. Wang et al. (2005) obtuvieron resultados similares con una lisozima purificada de frijoles mungo (Phaseolus mungo), que mostraron actividad antibacterial y antifúngica. Al parecer, la lisozima de frijol mungo es más eficaz para inhibir Fusarium solani y Botrytis cinerea. Además, pudo interrumpir en el crecimiento radial de F. solani e indujo anormalidades en su estructura celular, como desprendimiento de la membrana celular y la pared celular de la hifa, así como fugas de su citoplasma, lo cual sugiere la función vital de la lisozima en los mecanismos constitutivos de defensa del hospedante contra patógenos microbianos (Wang et al., 2005). Una lisozima aislada y purificada del tejido de una planta de coliflor afectó el crecimiento de hongos fitopatógenos y bacterias como F. solani y Erwinia carotovora, que normalmente infectan este cultivo (Manikandan et al., 2015).
Con respecto a la actividad contra hongos fitopatógenos, Acremonium obclavatum mostró una mayor sensibilidad a la enzima, seguida de Leptosphaeria maculans y Alternaria alternata (Manikandan et al., 2015). Todos estos estudios sugieren que las lisozimas de tejido vegetal y de insectos inhiben el desarrollo de bacterias y hongos. Sin embargo, en algunos casos, la actividad antibacterial de la lisozima de huevo de gallina sigue siendo más eficaz que la de otros tipos de lisozima previamente reportadas. Aunque ya se ha esclarecido el mecanismo de acción asociado a la actividad antibacteriana de la lisozima, a la fecha existe poca información acerca del mecanismo exacto de acción que las lisozimas siguen para dañar la superficie de la célula fúngica (Hernández-Téllez et al., 2018; Wu et al., 2017).
Una lisozima aislada de semillas de Pithecellobium dulce ejerció actividad antifúngica contra Macrophomina phaseolina, con una alta estabilidad térmica de hasta 80 °C por 15 min y pH=8.0 (Sawasdipuksa et al., 2011). También se ha reportado la actividad de la lisozima de clara de huevo de pollo en el crecimiento de hongos dimórficos como Paracoccidioides brasiliensis (Lopera et al., 2008) y el efecto antibiopelícula en Candida albicans (Sebaa et al., 2017). Cuando se expusieron células de levadura de P. brasiliensis a la lisozima, la capacidad de gemación múltiple disminuyó. Asimismo, se observaron cambios ultraestructurales como la fusión de vacuolas lípidas, estructuras laminares, degradación subcelular e interrupción de las capas fibrilares en los conidios después de su exposición a la enzima. Por tanto, la lisozima parece ejercer una doble función como parte de los mecanismos de defensa antifúngicos (Lopera et al., 2008). La lisozima humana mostró >80% de actividad antifúngica contra Aspergillus fumigatus, Penicillium sp., Acremonium sp., Candida parasilopsis y C. albicans, que comúnmente se identifican en pacientes con rinosinusitis crónica (Woods et al., 2011).
Se ha sugerido que la lisozima puede hidrolizar los enlaces (β-1,4)-glicosídicos entre los monómeros N-acetilglucosamina que integran la quitina, afectando la función de la pared celular (Sowa-Jasiłek et al., 2016; Hernández-Téllez et al., 2018). Sowa-Jasiłek et al. (2016) indicaron que la lisozima afectó el crecimiento de Candida albicans, ya que entra en un estado apoptótico, causado por una pérdida de la potencial membrana en la mitocondria; sin embargo, no describieron el mecanismo. También se observaron varios efectos nivel del núcleo de la célula, como la condensación de la cromatina y la fragmentación ADN. Hernández-Téllez et al. (2017, 2018) reportaron que las nanopartículas de quitosano-lisozima y sus componentes por separado pudieron interrumpir la primera etapa del crecimiento de Aspergillus parasiticus. Los autores encontraron bajos porcentajes de viabilidad celular en concentraciones de partículas de 200 a 300 μg mL-1. La germinación y el diámetro de las esporas, la producción de azúcares reductores y la integridad de la membrana también fueron afectadas.
Hasta ahora, los datos acerca de cómo el mecanismo de acción de la lisozima afecta el desarrollo fúngico siguen siendo insuficientes. Las afectaciones estructurales pueden estar relacionadas con la producción de β-1,3-glucanasa, lo cual coincide con la baja producción de azúcares reductores detectada en Aspergillus parasiticus después de su exposición a nanopartículas de quitosano-lisozima (Hernández-Téllez et al., 2017). Cabe señalar que en la realización de estos estudios se han utilizando enzimas puras, sin combinarlas con otros agentes antimicrobianos y que, por tanto, es necesario, en primerer lugar, establecer cómo trabaja la enzima en los hongos y la levadura, con el fin de llevar a cabo su aplicación tecnológica en las industrias farmacéutica, alimentaria y agrícola.
Inmovilización de la lisozima en nanomateriales antimicrobianos a base de quitosano. La aplicación industrial de las enzimas se recomienda debido a su selectividad y especifidad en condiciones moderadas (Figura 6).
Además, las enzimas pueden mejorar un gran número de procesos industriales de manera sostenible e inocua para el medio ambiente, ya que su comportamiento podría reducir el uso de compuestos químicos, así como la toxicidad inherente que éstos generan durante las reacciones (Bilal e Iqbal, 2019; Wang y Jiang, 2019). Sin embargo, todavía existen algunas desventajas para su aplicación en la industria, como los altos costos (dependiendo del proceso), la poca estabilidad operacional, la desactivación por algunos solventes y la falta de recuperación o reciclabilidad, entre otras.
Respecto a su origen biológico, las enzimas son solubles y podrían ser inhibidas por los sustratos y los productos de reacción, los metabolitos y otros compuestos en los medios (Bilal e Iqbal, 2019). Una estrategia que se propone es la inmovilización de las enzimas en matrices poliméricas diseñadas para aumentar su actividad antibacterial y prolongar su actividad y eficacia. A la fecha, este procedimiento se ha realizado con diferentes soportes sólidos y esto ha permitido resolver con buenos resultados los problemas antes mencionados, pero a menor escala (Huang et al., 2012; Wang y Jiang, 2019). La inmovilización puede mejorar el control de la reacción, evitar que la enzima contamine el producto, un factor que es particularmente relevante en la industria alimentaria, permitiendo el uso de diferentes reactores. La tecnología de inmovilización de las enzimas puede promover y mejorar la estabilidad de la enzima.
Asimismo, esto supone la reutilización de las enzimas inmovilizadas. La técnica de inmovilización puede utilizarse incluso en el aislamiento y purificación de enzimas. Adicionalmente, este proceso suele ser necesario cuando se quiere lograr un comportamiento óptimo en medios no acuosos (Bilal e Iqbal, 2019). A la fecha, la estrategia más utilizada para inmovilizar enzimas es el uso de materiales sólidos preexistentes. Por tanto, se han recomendado muchos polímeros y sus derivados, incluidos el alginato, la celulosa, el dextrano, la agarosa, el agar-agar, la carragenina, la gelatina, la goma guar, la pectina, el quitosano y otros (Bautista-Baños et al., 2016; Bilal e Iqbal, 2019).
Los métodos de síntesis que más se mencionan para la inmovilización de enzimas se pueden clasificar como físicos y químicos. En los métodos físicos, las enzimas se unen al soporte con enlaces de hidrógeno o por atrapamiento en la matriz del polímero, en tanto que en los métodos químicos las enzimas están estrechamente unidas en el soporte por enlaces covalentes (Bilal e Iqbal, 2019). Cuando se utilizan estos métodos, la inmovilización de la enzima se lleva a cabo por medio de absorción en materiales insolubles, atrapamiento en redes de gel de polímeros, encapsulamiento, entrecruzamiento utilizando agentes bifuncionales, unión covalente a un vehículo insoluble y formación de agregados de enzimas por medio de entrecruzamiento. Por lo general, la inmovilización de la enzima proporciona una mejor accesibilidad y estabilidad adicional en los procesos de desnaturalización. Las enzimas inmovilizadas han mostrado mayor estabilidad térmica y operacional al pH, las condiciones de temperatura extremas y los solventes orgánicos (Bilal e Iqbal, 2019). Sin embargo, existen todavía problemas prácticos que tienen que resolverse durante la inmovilización de la enzima, como la poca capacidad de carga en soportes sólidos, la baja tasa de recuperación y la pérdida de actividad enzimática causada por los inhibidores (Wang y Jiang, 2019).
Es fundamental conocer la técnica correcta de inmovilización para, posteriormente, seleccionar la matriz de soporte y lograr la óptima inmovilización de la enzima. Es necesario verificar que la matriz de soporte de la enzima sea robusta y biocompatible con las características recuperables (Bilal e Iqbal, 2019). Con este propósito, se han hecho extensos estudios sobre las matrices poliméricas naturales debido a sus características deseables, como no toxicidad, biocompatibilidad, biodegrabilidad, flexibilidad, sustentabilidad y el número de sitios reactivos disponibles (Bilal e Iqbal, 2019; Wang y Jiang, 2019).
El quitosano es un polímero ampliamente utilizado, que cumple con todas estas características que lo hacen atractivo para la industria alimentaria, productos farmacéuticos, electroquímicos, biosensores, textiles y recubrimientos (Hernández-Téllez et al., 2018; Wu et al., 2018b). Se han preparado varios materiales a base de lisozimas y quitosano, a macro- y nano escala, cuyo uso se ha propuesto para inhibir o retardar el crecimiento microbiano. Entre estos materiales, se han estudiado mezclas de soluciones, hidrogeles, fibras y nanofibras, y nano- y micropartículas (Hernández-Téllez et al., 2018; Wu et al., 2018b; Yu et al., 2018). La matriz que más se ha reportado por lograr la inmovilización de la enzima es el quitosano; la inmovilización se realizado por medio de la interacción electrostática entre las cargas positivas del quitosano y la carga negativa del tripolifosfato (TPP) (Yu et al., 2018). Sin embargo, la incorporación de otros contraiones, como el alginato de sodio, el carragenano y el glutaraldehído, ha permitido la síntesis de estos materiales, sin que pierdan su actividad biológica (Hernández-Téllez et al., 2018; Wu et al., 2018c).
Cuadro 2 Aplicaciones tecnológicas y actividad biológica de la lisozima.
| Source of lysozyme | Immobilization | Characteristics | Technological application and biological activity | References |
|---|---|---|---|---|
| Commercial from chicken egg white | CS-TPP nanoparticles by ionic complexation | 20000 U mg-1, D: 50-280 nm, EE (%): 47.3, PIEA (%): 85 | Possible antimicrobial material, evaluation not reported | Deng et al., 2006 |
| Commercial from chicken egg white | Nanofibers by electrospinning: deposition of the components by layers | 25,000 U mg-1 Z: +26.4 mV | Evaluated as antimicrobial packaging. S. aureus and E. coli were inhibited 60-80% | Huang et al., 2012 |
| Commercial from chicken egg white | CS-TPP nanoparticles by ionic complexation | ~100,000 U mg-1, D: 159 ± 24 nm, Z: +41.6 ± 1.1 mV, EE (%):10 ± 0.2 | Antimicrobial agent or possible drug. Evaluated against S. epidermidis | Piras et al., 2014 |
| Purified from egg white | CS beads crosslinked with glutaraldehyde | N/D | Control Oenococcus oeni during the winemaking process | Liburdi et al., 2016 |
| Commercial from chicken egg white | CS-TPP nanoparticles by ionic complexation | D:297.9 nm, Z: + 39 mV, EE (%): 29.1 | Activity against Bacillus subtilis, M. luteus, Serratia marcescens and E. coli | Matouskova et al., 2016 |
| Commercial from chicken egg white | CS-TPP nanoparticles by ionic complexation | D: 488.8 ± 10.22 nm, Z: +21.10±0.84 mVPDI: 0.71 ± 0.17, EE (%): 80% | Antibacterial material against S. aureus and E. coli | Wu et al., 2017 |
| Commercial from chicken egg white | CS and sodium alginate hydrogels | 5000 U mg-1, spherical shape, Z: -55 a -30 mV, SI: 45.66 ± 7.62, RRC(%): 87.72 ± 3.96 | Controlled release material to control foodborne microorganisms. Complete inhibition of E. coli and S. aureus | Wu et al., 2018b |
| Commercial from chicken egg white | CS-carrageenan-lysozyme nanoparticles by ionic complexation | 40000 U mg-1, D: 250 ± 8.1 nm, Z: +21.6 ± 0.8 mV, EE (%):70 ± 1.7 | Antifungal activity against Aspergillus parasiticus | Hernández-Téllez et al., 2018 |
| Commercial from chicken egg white | CS nanoparticles by ionic complexation with sodium alginate and calcium ions | 4000 U mg-1, D: 901.8 ± 75.50 nm Z: +2.58 ± 0.87 mV, EE (%): 92.79 ± 0.53 | Antimicrobial material proposed for the food industry | Wu et al., 2018c |
qCS: Quitosano; rD: diámetro hidrodinámico (nm); sPIEA: actividad de la enzima después de la inmovilización; tZ: Z potencial/carga; uEE: eficiencia de encapsulación; vT: grosor de la película; wSI: Índice de dilatación; xRRC: capacidad relativa de liberación ; yTPP: tripolifosfato; zND: no determinado.
Otro aspecto que cabe destacar es que, debido a la complejidad del aislamiento y la purificación de las enzimas de fuentes naturales, estos materiales suelen ser sintetizados con lisozimas comerciales de clara de huevo de pollo, reduciendo su aplicación en la actividad biológica (Cuadro 2). Algunos reportes sugieren que las lisozimas aisladas de plantas, ya sea si son de tipoc o de tipo-i, pueden afectar una amplia diversidad de hongos, especialmente especies fitopatógenas, donde las enzimas fue aislada (Wang et al., 2005; Manikandan et al., 2015). Aunque en los últimos años se ha hecho mucho más investigación sobre el quitosano y la lisozima, hoy en día, los materiales funcionales generados a base de éstos han abierto una nueva línea de investigación en todo el mundo.
Conclusiones y perspectivas. Las lisozimas están presentes en una gran variedad de organismos vivientes y, de manera notable, desempeñan una función importante en el sistema inmunológico, la digestión y la nutrición. Hoy en día se sabe que las lisozimas y las enzimas tipo lisozima pueden inhibir el crecimiento bacterial y afectar el desarrollo de hongos y levaduras. Los mecanismos de acción para inhibir el desarrollo de hongos y bacterias que se han reportado incluyen agregación en la superficie de la célula y, posteriormente, la actividad de la muramidasa y/o isopeptidasa, que afecta importantes proteínas y polisacáridos presentes en la pared celular. Sin embargo, todavía no se sabe muy bien de qué manera el mecanismo inhibe los polisacáridos de los hongos y la levadura. Aunque la lisozima de tipo-c es la que más se utiliza con propósitos antimicrobianos, otros tipos de lisozima manifiestan esta actividad. Por esta razón, es necesario estudiar cuidadosamente todos los tipos de lisozimas y las enzimas tipo lisozima, en particular las de plantas e insectos, ya que pueden afectar no solo a las bacterias sino también a los hongos patógenicos y a levaduras. Con base en una revisión de literatura, se ha propuesto la producción de micro- y nanomateriales formulados con estas enzimas antimocrobianas y matrices poliméricas, y estas últimas con polímeros policatiónicos como el quitosano. Dado que se espera que esta combinación pueda actuar de manera signérica en la preservación de alimentos, la protección de cultivos y formulaciones farmacéuticas, es además indispensable estudiar las implicaciones de su aplicación en el laboratorio y a niveles más altos, específicamente, en materiales destinados al control de hongos fitopatógenos.
Literature Cited
Bautista-Baños, S., Romanazzi, G. and Jiménez-Aparicio, A. 2016. Chitosan in the preservation of agricultural commodities. 1st Edition. Elsevier Academic Press. New York, USA. 384 pp. ISBN 9780128027356. https://doi.org/10.1016/C2014-0-03033-X [ Links ]
Bilal, M. and Iqbal, HMN. 2019. Naturally-derived biopolymers: potential platforms for enzyme immobilization. International Journal of Biological Macromolecules 130(1): 462-482. https://doi.org/10.1016/J.IJBIOMAC.2019.02.152 [ Links ]
Cao, D., Wu, H., Li, Q., Sun, Y., Liu, T., Fei, J., Zhao, Y., Wu, S., Hu, X. and Li, N. 2015. Expression of recombinant human lysozyme in egg whites of transgenic hens. PloS one 10(2): e0118626. https://doi.org/10.1371/journal.pone.0118626 [ Links ]
Chen, T., Ren, C., Wang, Y., Luo, P., Jiang, X., Huang, W. and Hu, C. 2016. Molecular cloning, inducible expression and antibacterial analysis of a novel i-type lysozyme (lyz-i2) in Pacific white shrimp, Litopenaeus vannamei. Fish & Shellfish Immunology 54(1): 197-203. https://doi.org/10.1016/J.FSI.2016.04.008 [ Links ]
Deng, Q., Zhou, C. and Luo, B. 2006. Preparation and characterization of chitosan nanoparticles containing lysozyme. Pharmaceutical Biology 44(5): 336-342. https://doi.org/10.1080/13880200600746246 [ Links ]
Fiołka, MJ., Ptaszyńska, AA. and Czarniawski, W. 2005. Antibacterial and antifungal lysozyme-type activity in Cameraria ohridella pupae. Journal of Invertebrate Pathology 90(1): 1-9. https://doi.org/10.1016/j.jip.2005.06.015 [ Links ]
Gálvez-Iriqui, AC., Cortez-Rocha, MO., Burgos-Hernández, A., Calderón-Santoyo, M., Argüelles-Monal, WM. and Plascencia-Jatomea, M. 2019. Synthesis of chitosan biocomposites loaded with pyrrole-2-carboxylic acid and assessment of their antifungal activity against Aspergillus niger. Applied Microbiology and Biotechnology 103:2985-3000. https://doi.org/10.1007/s00253-019-09670-w [ Links ]
Gow, NAR., Latge, JP. and Munro, CA. 2017. The Fungal Cell Wall: Structure, Biosynthesis, and Function. Pp: 267-291. In: Heitman, JGN., Howlett, B., Crous, P. and Stukenbrock, EJT. (Eds.). The Fungal Kingdom. Vol. 5. ASM Press. Washington, DC., USA. 1160p. https://doi.org/10.1128/microbiolspec.funk-0035-2016 [ Links ]
Han, T., New, N., Furuike, T., Tokura, S. and Tamura, H. 2012. Methods of N-acetylated chitosan scaffolds and its In-vitro biodegradation by lysozyme. Journal of Biomedical Science and Engineering 5(1): 15-23. https://doi.org/10.4236/jbise.2012.51003 [ Links ]
Hardin, J., Bertoni, GP. and Kleinsmith, LJ. 2016. Enzymes: The Catalysts of Life. Pp:142-146. In: Hardin, J. and Bertoni, G (Eds.). Becker’s World of the Cell. 9th ed. Pearson Higher Ed. USA. 920p. [ Links ]
Held, J. and van Smaalen, S. 2014. The active site of hen egg-white lysozyme: flexibility and chemical bonding. Acta Crystallographica Section D 70(4): 1136-1146. https://doi.org/https://doi.org/10.1107/S1399004714001928 [ Links ]
Hernández-Téllez, CN., Cortez-Rocha, MO., Burgos-Hernández, A., Rosas-Burgos, EC., Lizardi-Mendoza, J., Torres-Arreola, W. and Plascencia-Jatomea, M. 2018. Chitosan/ carrageenan/lysozyme particles: Synthesis, characterization and antifungal activity against Aspergillus parasiticus. Revista Mexicana de Ingeniería Química 17(3): 897-912. https://doi.org/10.24275/uam/izt/dcbi/revmexingquim/2018v17n3/Hernandez [ Links ]
Hernández-Téllez, CN., Rodríguez-Córdova, FJ., Rosas-Burgos, EC., Cortez-Rocha, MO., Burgos-Hernández, A., Lizardi-Mendoza, J. and Plascencia-Jatomea, M. 2017. Activity of chitosan-lysozyme nanoparticles on the growth, membrane integrity, and β-1,3-glucanase production by Aspergillus parasiticus. 3 Biotech 7(5): 279. https://doi.org/10.1007/s13205-017-0913-4 [ Links ]
Huang, W., Xu, H., Xue, Y., Huang, R., Deng, H. and Pan, S. 2012. Layer-by-layer immobilization of lysozyme-chitosan-organic rectorite composites on electrospun nanofibrous mats for pork preservation. Food Research International 48(2): 784-791. https://doi.org/10.1016/J.FOODRES.2012.06.026 [ Links ]
Jana, M., Ghosh, A., Santra, A., Kar, RK., Misra, AK. and Bhunia, A. 2017. Synthesis of novel muramic acid derivatives and their interaction with lysozyme: Action of lysozyme revisited. Journal of Colloid and Interface Science 498: 395-404. https://doi.org/10.1016/J.JCIS.2017.03.060 [ Links ]
Kim, M., Park, M. and Jeong, Y. 2012. Purification and characterization of lysozyme from filipino venus, Ruditapes philippinarum. Food Science and Biotechnology 21(5): 1463-1468. https://doi.org/10.1007/s10068-012-0193-z [ Links ]
Liburdi, K., Benucci, I., Palumbo, F. and Esti, M. 2016. Lysozyme immobilized on chitosan beads: Kinetic characterization and antimicrobial activity in white wines. Food Control 63: 46-52. https://doi.org/10.1016/j.foodcont.2015.11.015 [ Links ]
Lopera, D., Aristizabal, BH., Restrepo, A., Cano, LE. and González, A. 2008. Lysozyme plays a dual role against the dimorphic fungi fungus Paracoccidioides brasiliensis. Revista do Instituto de Medicina Tropical de Sao Paulo 50(3): 169-175. https://doi.org/10.1590/S0036-46652008000300008 [ Links ]
Manikandan, M., Balasubramaniam, R. and Chun, SC. 2015. A single-step purification of Cauliflower lysozyme and its dual role against bacterial and fungal plant pathogens. Applied Biochemistry and Biotechnology 177(2): 556-566. https://doi.org/10.1007/s12010-015-1747-3 [ Links ]
Matouskova, P., Marova, I., Bokrova, J. and Benesova, P. 2016. Effect of encapsulation on antimicrobial activity of herbal extracts with lysozyme. Food technology and biotechnology 54(3): 304. https://doi.org/10.17113/ftb.54.03.16.4413 [ Links ]
Monteiro, JM., Pereira, AR., Reichmann, NT., Saraiva, BM., Fernandes, PB., Veiga, H. and Pinho, M. G. 2018. Peptidoglycan synthesis drives an FtsZ-treadmilling-independent step of cytokinesis. Nature 554(7693): 528-532. https://doi.org/10.1038/nature25506 [ Links ]
Oh, YH. and Park, NG. 2018. Isolation of an invertebrate-type lysozyme from the body wall of spoon worm, Urechis unicinctus. Journal of Life Science 28(3): 300-306. https://doi.org/10.5352/JLS.2018.28.3.300 [ Links ]
Phillips, D. 1967. The Hen Egg-White Lysozyme Molecule. Pp: 483-495. In: Symposium on Three-Dimensional Structure of Macromolecules of Biological Origin on October 19, 1966. Vol. 57(3). National Academy of Sciences. Durham, North Carolina, USA. 550p. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC335535/?page=10 [ Links ]
Piras, AM., Maisetta, G., Sandreschi, S., Esin, S., Gazzarri, M., Batoni, G. and Chiellini, F. 2014. Preparation, physical-chemical and biological characterization of chitosan nanoparticles loaded with lysozyme. International Journal of Biological Macromolecules 67: 124-131. https://doi.org/10.1016/j.ijbiomac.2014.03.016 [ Links ]
Sheng, L., Wang, J., Huang, M., Xu, Q. and Ma, M. 2016. The changes of secondary structures and properties of lysozyme along with the egg storage. International Journal of Biological Macromolecules 92: 600-606. https://doi.org/10.1016/j.ijbiomac.2016.07.068 [ Links ]
Sawasdipuksa, N., Lei, Z., Sumner, LW., Niyomploy, P. and Sangvanich, P. 2011. A lysozyme with antifungal activity from Pithecellobium dulce seeds. Food Technology and Biotechnology 49(4): 489-494. https://hrcak.srce.hr/index.php?show=clanak&id_clanak_jezik=111619 [ Links ]
Sebaa, S., Hizette, N., Boucherit-Otmani, Z. and Courtois, P. 2017. Dose-dependent effect of lysozyme upon Candida albicans biofilm. Molecular Medicine Reports 15(3): 1135-1142. https://doi.org/10.3892/mmr.2017.6148 [ Links ]
Sowa-Jasiłek, A., Zdybicka-Barabas, A., Stączek, S., Wydrych, J., Skrzypiec, K., Mak, P. and Cytryńska, M. 2016. Galleria mellonella lysozyme induces apoptotic changes in Candida albicans cells. Microbiological Research 193: 121-131. https://doi.org/10.1016/j.micres.2016.10.003 [ Links ]
Stick, RV., Williams, SJ., Stick, RV. and Williams, SJ. 2009. Enzymatic cleavage of glycosides: mechanism, inhibition and synthetic applications. Pp: 253-284. In: Stick, RV. and Williams, S (Eds.). Carbohydrates: the essential molecules of life. Elsevier Science. 2nd Ed. 496pp. https://doi.org/10.1016/B978-0-240-52118-3.00007-7 [ Links ]
Strader, S. 2018. Human Lysozyme. University of Virginia. https://collab.its.virginia.edu/access/content/group/f85bed6c-45d2-4b18-b868-6a2353586804/2/Ch06_Strader_S_Lysozyme_(Human)-_-/index.html. (Consulta, 23 Julio 2020). [ Links ]
Sukhithasri, V., Nisha, N., Biswas, L., Kumar, VA. and Biswas, R. 2013. Innate immune recognition of microbial cell wall components and microbial strategies to evade such recognitions. Microbiological Research 168(7): 396-406. http://dx.doi.org/10.1016/j.micres.2013.02.005 [ Links ]
Taylor, EJ., Skjøt, M., Skov, LK., Klausen, M., De Maria, L., Gippert, GP., Turkenburg, JP., Davies, GJ. and Wilson, KS. 2019. The C-type lysozyme from the upper gastrointestinal tract of Opisthocomus hoatzin, the stinkbird. International Journal of Molecular Science 20(22): 5531. https://doi.org/10.3390/ijms20225531 [ Links ]
Thallinger, B., Prasetyo, EN., Nyanhongo, GS. and Guebitz, GM. 2013. Antimicrobial enzymes: An emerging strategy to fight microbes and microbial biofilms. Biotechnology Journal 8(1): 97-109. https://doi.org/10.1002/biot.201200313 [ Links ]
Wang, D. and Jiang, W. 2019. Preparation of chitosan-based nanoparticles for enzyme immobilization. International Journal of Biological Macromolecule 126: 1125-1132. https://doi.org/10.1016/J.IJBIOMAC.2018.12.243 [ Links ]
Wang, S., Ng, TB., Chen, T., Lin, D., Wu, J., Rao, P. and Ye, X. 2005. First report of a novel plant lysozyme with both antifungal and antibacterial activities. Biochemical and Biophysical Research Communications 327(3): 820-827. https://doi.org/10.1016/j.bbrc.2004.12.077 [ Links ]
Wang, ZZ., Zhan, LQ. and Chen, X. 2018. Two types of lysozymes from the whitefly Bemisia tabaci: Molecular characterization and functional diversification. Developmental and Comparative Immunology 81: 252-261. https://doi.org/10.1016/j.dci.2017.12.012 [ Links ]
Woods, CN., Hooper, DN., Ooi, EH., Tan, L-W. and Carney, AS. 2011. Human lysozyme has fungicidal activity against nasal fungi. American Journal of Rhinology & Allergy 25(4): 205-208. https://doi.org/10.2500/ajra.2011.25.3631 [ Links ]
Wu, T., Ge, Y., Li, Y., Xiang, Y., Jiang, Y. and Hu, Y. 2018a. Quality enhancement of large yellow croaker treated with edible coatings based on chitosan and lysozyme. International Journal of Biological Macromolecules 120: 1072-1079. https://doi.org/10.1016/J.IJBIOMAC.2018.08.188 [ Links ]
Wu, T., Huang, J., Jiang, Y., Hu, Y., Ye, X., Liu, D. and Chen, J. 2018b. Formation of hydrogels based on chitosan/alginate for the delivery of lysozyme and their antibacterial activity. Food Chemistry 240: 361-369. https://doi.org/10.1016/J.FOODCHEM.2017.07.052 [ Links ]
Wu, T., Jiang, Q., Wu, D., Hu, Y., Chen, S., Ding, T. and Chen, J. 2019. What is new in lysozyme research and its application in food industry? A review. Food Chemistry 274: 698-709. https://doi.org/10.1016/J.FOODCHEM.2018.09.017 [ Links ]
Wu, T., Li, Y., Shen, N., Yuan, C. and Hu, Y. 2018c. Preparation and characterization of calcium alginate-chitosan complexes loaded with lysozyme. Journal of Food Engineering 233: 109-116. https://doi.org/10.1016/J.JFOODENG.2018.03.020 [ Links ]
Wu, T., Wu, C., Fu, S., Wang, L., Yuan, C., Chen, S. and Hu, Y. 2017. Integration of lysozyme into chitosan nanoparticles for improving antibacterial activity. Carbohydrate Polymers 155: 192-200. https://doi.org/10.1016/J.CARBPOL.2016.08.076 [ Links ]
Yu, WZ., Zhang, Y., Liu, X., Xiang, Y., Li, Z. and Wu, S. 2018. Synergistic antibacterial activity of multi components in lysozyme/chitosan/silver/hydroxyapatite hybrid coating. Materials & Design 139: 351-362. https://doi.org/10.1016/J.MATDES.2017.11.018 [ Links ]
Yu, YS., Lee, JY., Woo, JW., Kim, JS., Bae, YH., Cho, SJ. and Park, SC. 2019. Identification and expression pattern of a new digestive invertebrate-type lysozyme from the earthworm. Genes & Genomics 41(3): 367-371. https://doi.org/10.1007/s13258-018-0776-z [ Links ]
Zhou, J., Zhao, S., Fang, WH., Zhou, JF., Zhang, JX., Ma, H. and Li, XC. 2017. Newly identified invertebrate-type lysozyme (Splys-i) in mud crab (Scylla paramamosain) exhibiting muramidase-deficient antimicrobial activity. Developmental & Comparative Immunology 74: 154-166. https://doi.org/10.1016/J.DCI.2017.04.017 [ Links ]
Recibido: 22 de Mayo de 2020; Aprobado: 29 de Julio de 2020











 texto en
texto en 



