La higuera (Ficus carica) llegó a México durante la conquista en el siglo XVI (Flaishman et al., 2008) y fueron las higueras comunes las que se adaptaron mejor, ya que no requerían de polinización para el desarrollo de siconos. Sin embargo, a través del tiempo las variedades originales experimentaron variaciones fenotípicas como el tamaño, color y consistencia. Una de estas nuevas variedades fue descrita y nombrada cultivar “Nezahualcóyotl” por García et al. (2013). Este material vegetativo es utilizado para la producción intensiva bajo cubierta, debido a su rápido crecimiento, fácil manejo y alta productividad que permite tener densidades de 12 500 plantas ha-1 con rendimientos superiores a 100 t ha-1 (Mendoza et al., 2017). La implementación de este sistema de producción requiere veinte veces más plantas que los sistemas convencionales, y que éstas se encuentren libres de plagas y enfermedades. La principal forma de propagar la higuera es mediante estacas de tallos leñosos podados después de la cosecha (Boliani et al., 2019). Las plantas producidas en vivero pueden presentar pudrición del tallo y raíces asociada a patógenos del complejo damping off (Fusarium, Rhizoctonia, Pythium y Phytophthora), que es favorecida por la humedad relativa de 80%, temperatura de 25 °C y altas densidades (García et al., 2008).
Para realizar un plan de control de la enfermedad, es primordial llevar a cabo la identificación de los agentes causales, así como elaborar guías que permitan conocer los síntomas y el avance de la enfermedad. Las escalas de severidad son útiles para estandarizar y cuantificar la enfermedad, lo que permitirá implementar planes de manejo (Hernández y Sandoval, 2015). El objetivo de este trabajo fue aislar e identificar los agentes causales de la pudrición del tallo de plantas de higuera, así como elaborar escalas para la evaluación de severidad de los agentes causales que sirvan como guías en futuros estudios epidemiológicos.
Para el aislamiento de los agentes causales, se emplearon 50 individuos distribuidos completamente al azar, de un lote de plantas propagadas por estacas de 20 días de edad, que mostraron lento crecimiento, clorosis, marchitamiento, caída de hojas y pudrición de tallo y raíces. Las plantas se tomaron del invernadero de propagación del Campo Experimental de Fitotecnia de la Universidad Autónoma Chapingo a 19° 29’ 30.8” Latitud Norte, 98° 52’ 22.0” Longitud Oeste y una altitud de 2266 m. Las plantas fueron lavadas con agua corriente y jabón. Posteriormente, se retiró la epidermis con un bisturí para dejar expuesta la corteza donde se notaban lesiones de color marrón-rojizo en los extremos de la estaca (Figura 1). Con ayuda de un bisturí se cortaron cuatro secciones de cada estaca en los bordes de las lesiones, de 0.3 x 0.3 cm de lado y 0.1 cm de grosor (Leslie y Summerell, 2006), 200 secciones en total. Se tomaron cuatro secciones por cada tallo, que fueron sumergidas en agitación constante en una solución de hipoclorito de sodio (NaClO) al 0.5% durante un minuto. Posteriormente, se enjuagaron tres veces con agua destilada estéril y se secaron sobre toallas de papel estériles dentro de una campana de flujo laminar. Bajo condiciones de asepsia, se colocaron las secciones de tejido de cada tallo en placas de medio Papa Dextrosa Agar, PDA (BD Bioxon®) y fueron incubadas a 28 °C durante cinco días. Se aislaron dos tipos de hongos y un oomiceto, que se purificaron mediante la técnica de punta de hifa y monoesporángios e identificaron morfológicamente mediante microcultivos de cada aislamiento en bloques de medio PDA, resembrado por punción e incubados a temperatura ambiente. Las muestras se tiñeron con azul de metileno y fueron observadas bajo microscopio óptico a 40X, e identificadas morfológicamente con las claves de Barnett y Hunter (1998).
Se reprodujeron los postulados de Koch empleando los aislamientos microbianos asociados a la pudrición del tallo. Se usaron estacas de higuera frescas de 8 cm de largo, con al menos una yema axilar, que fueron lavadas con agua corriente y desinfestadas en una solución de NaOCl al 1% durante dos minutos. En seguida, las estacas fueron enjuagadas con agua destilada estéril y posteriormente expuestas a alcohol etílico al 96% durante un minuto y enjuagadas nuevamente. Las estacas fueron secadas sobre toallas de papel estériles dentro de una campana de flujo laminar. Después, las estacas fueron colocadas en cámaras húmedas, inoculadas por triplicado con los microorganismos aislados, e incubadas a 28 °C. Al cabo de diez días se tomaron muestras de tejido para re-aislar al microorganismo inoculado y registrar la sintomatología de cada una de las estacas infectadas. La cámara húmeda consistió de un vaso de plástico de 240 mL transparente con tapa, dentro del cual se colocó una estaca de higo sostenida por una base de unicel. El inóculo consistió de tres discos de 0.5 cm de diámetro de siete días de crecimiento, para inoculaciones individuales, 1.5 discos de cada medio en inoculaciones dobles y un disco de cada medio en inoculaciones triples. Los discos fueron colocados sobre una toalla de papel húmeda de 5 x 5 cm y papel aluminio de 7 x 7 cm estériles, sujetos a la base de la estaca con Parafilm “M” ®. El fondo del vaso se cubrió con una toalla de papel húmeda de 10 x 10 cm y la tapa fue sellada con Parafilm “M” ®.
Para la identificación molecular, los aislamientos se incubaron a 27 °C durante siete días para después extraer el ADN. Mediante PCR, se amplificaron las regiones internas transcritas ITS1 e ITS4 de hongos y oomicetos, utilizando los iniciadores ITS1 (TCCGTAGGTGAACCTGCGG) e ITS4 (TCCTCCGCTTATTGATATGC). Para los hongos se empleó un ciclo inicial de 94 °C durante cinco minutos, seguidos de 35 ciclos (94 °C, 30 segundos; 56 °C, 45 segundos y 72 °C, dos minutos) y una elongación final a 72 °C durante cinco minutos. Para los oomicetos, se empleó un ciclo inicial de 95 °C durante cuatro minutos, 34 ciclos (95 °C, un minuto; 55 °C, un minuto y 72 °C, dos minutos) y un paso final de extensión a 72 °C durante 10 minutos (White et al., 1990). Los productos amplificados se separaron mediante electroforesis en geles de agarosa al 0.8%. Las secuencias se ensamblaron y editaron con el programa BioEdit y fueron comparadas contra las secuencias contenidas en la base de datos del GeneBank del National Center of Biotechnology Information (NCBI) mediante la herramienta BLAST para determinar las posibles especies de cada aislamiento.
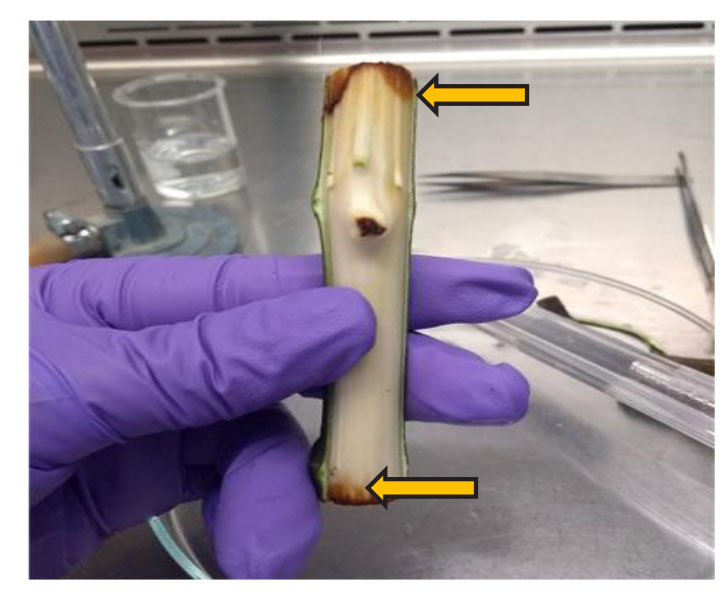
Figura 1. Lesiones color marrón-rojizo en la corteza (flechas) de una estaca de F. carica inoculadas con F. solani, A. alternata y P. ultimum.
Por otro lado, Se colocaron estacas frescas de aproximadamente ocho centímetros de largo en cámaras húmedas de forma individual, igual que en las pruebas de patogenicidad. Las estacas fueron inoculadas individualmente con los patógenos aislados, así como con todas las combinaciones, estableciéndose quince repeticiones por tratamiento, lo cual resultó en un total de 120 unidades experimentales. Se incubaron a 28 °C y se seleccionaron al azar tres estacas o repeticiones de cada tratamiento a través del tiempo, para determinar los niveles de severidad (escala de severidad).
Finalmente, se evaluó el porcentaje de pudrición, el cual se calculó midiendo el área de pudrición de la estaca tanto de la corteza como de la epidermis, así como el área total de la corteza y de la epidermis, obteniendo su relación con la siguiente fórmula: (A2 x 100)/A1, donde A2 es el área total de la epidermis o de la corteza de la estaca y A1 es el área de la epidermis o de la corteza con pudrición. Las mediciones se hicieron por triplicado, se determinó el promedio y se propuso un rango de porcentaje de daño para cada nivel de severidad con cada tratamiento. Las mediciones se hicieron con ayuda del software de procesamiento de imágenes IMAGE J versión 1.50i desarrollado por el National Institute of Health (Rasband, 2018).
Los aislamientos resultaron altamente emparentados con F. solani (99% de similitud) con 95% de frecuencia en estacas enfermas, A. alternata (99% de similitud) con 72% de frecuencia y P. ultimum (100% de similitud) con 80% de frecuencia. Los postulados de Koch confirmaron que F. solani, A. alternata y P. ultimum fueron los agentes causales en la pudrición de las estacas de la higuera, ya que se observaron síntomas similares a los encontrados en el campo. El re-aislamiento de los dos hongos y el oomiceto correspondieron a los que se inocularon inicialmente en un 95%.
El Cuadro 1, corresponde a la escala de severidad donde se muestra el porcentaje de daño ocasionado por F. solani, A. alternata, y P. ultimum individualmente, así como el daño inducido por sus combinaciones a través del tiempo en la corteza y epidermis de la estaca. En general, se establecieron cinco niveles de daño visualmente diferentes entre sí. Sin embargo, para P. ultimum se establecieron solamente tres, debido a que solo se detectó avance de la enfermedad hasta los 32 días después de la inoculación (DDI). A la fecha, no hay reportes de la presencia de estos tres patógenos en estacas de higuera, aunque éstos se encuentran presentes en otros cultivos con sintomatología similar bajo condiciones de invernadero.

zDías después de la inoculación.
Cuadro 1. Escala de severidad en el que se observa el porcentaje de daño en estacas de Ficus carica inducido por Fusarium solani, Alternaria alternata y Pythium ultimum inoculados individualmente y en combinación.
Fusarium solani ataca plantaciones adultas de mango, mostrando síntomas de marchitez de puntas de tallos y necrosis en tejidos vasculares (Khanzada et al., 2004). Igualmente, en manzanos causa tizón y caída de hojas (Wang et al., 2010). Este hongo, produce enzimas como cutinasas, celulasas, quitosanasas, pectinasas y otras que degradan fitoalexinas (Leslie y Summerell, 2006). Debido a este mecanismo, F. solani puede afectar fácilmente los tejidos blandos y lignificados, como los tallos de higuera, que manifestaron los primeros síntomas de pudrición a los cinco días después de la inoculación (DDI). Los síntomas de las especies patogénicas del género Fusarium, son marchitamiento vascular y pudrición de tallos y raíces (Torres, 2000). En el presente trabajo, los más altos porcentajes de pudrición de epidermis y corteza, la presencia de micelio en el exterior de la estaca, así como el desprendimiento de la epidermis ocurrieron en el nivel 5 de la escala de severidad, mostrando de 57-70 y 51-100 % de daño en epidermis y corteza, respectivamente, entre los 21 y 25 DDI.
Por otra parte, la especie más importante del género Alternaria es A. alternata que puede manifestarse como patógeno, oportunista o saprofito (Logrieco et al., 2009). En plantas adultas de higuera se han reportado daños causados por especies de Alternaria, sin embargo, siempre se asocian a daños en hojas y siconos, así como en frutos de manzano, cítricos, olivos y tomates (López et al., 2016). Todas las especies patogénicas de Alternaria producen fitotoxinas específicas y no específicas para sus hospederos, entre las toxinas no específicas se encuentra el zinniol que induce necrosis (Lou et al., 2013). El más alto porcentaje de necrosis de la corteza en las estacas de higuera, promovida por A. alternata se presentó en el nivel 5 de la escala de severidad, con 51-100% de daño, entre los 22-25 DDI. Sin embargo, la epidermis presentó solo 8% pudrición hasta el nivel 5. Se observó también presencia de micelio de color gris oscuro en el exterior de la estaca. La inoculación por separado con F. solani y A. alternata indujo 100% de daño de la corteza entre 22-25 DDI.
Para el caso del oomiceto P. ultimum es miembro del complejo damping off, causante de la muerte de plántulas de muchas especies de importancia agrícola. Este oomiceto es de las especies más agresivas dentro de su género (Mavrodi et al., 2012). Pythium ultimum se asocia a la pudrición de raíces de plantas adultas, portainjertos y plántulas de manzano (Mazzola et al., 2002; Zhu et al., 2016). En este trabajo, P. ultimum promovió de 21-30% del daño de la corteza entre los 19-32 DDI. También se observó presencia de micelio en la parte superior de la estaca, que al ser tocado se desprendió con facilidad. La epidermis no presentó pudrición ni desprendimiento.
Los porcentajes más altos de daño se presentaron en un rango de menor tiempo (de 17-20 DDI) cuando se hicieron inoculaciones mixtas de F. solani + A. alternata y F. solani + P. ultimum. La manifestación drástica más temprana de la necrosis de epidermis (61-85%) y corteza (61-80%) ocurrió entre los 11-13 DDI, cuando se inocularon conjuntamente F. solani, A. alternata y P. ultimum. Lo anterior podría explicarse por el efecto sinérgico de las enzimas que cada patógeno sintetiza, lo que facilita el progreso de la enfermedad. Las estacas testigo, mostraron daño ligero debido a la oxidación por el corte. En campo, la necrosis del tallo de la higuera está asociado a la diseminación de esporas y micelio a través del agua, viento o herramientas. No obstante, en vivero, la alta densidad podría favorecer la diseminación de propágulos e infestación, ya que las plántulas se encuentran próximas en los procesos de propagación, climatización y transporte.
Este es el primer trabajo en el que se reporta a F. solani, A. alternata y P. ultimum como agentes causales de la pudrición de las estacas de la higuera. Los síntomas encontrados en las estacas evaluadas in vitro fueron similares a los presentados en plántulas en invernadero de propagación, confirmándose así los Postulados de Koch. La escala de severidad propuesta permitirá identificar el grado de daño causado por F. solani, A. alternata y P. ultimum, de forma individual o combinada, en los sistemas de producción intensivos de higo. De esta investigación se deriva la necesidad de validar las escalas de severidad en el sistema de propagación de higo en invernadero. Así, al verificarse su precisión y exactitud, podrán emplearse exitosamente en la evaluación de los daños en esta especie. Por otro lado, la identificación de los patógenos F. solani, A. alternata y P. ultimum permitirá realizar un control fitosanitario adecuado, y ofrecer plantas de mejor calidad que permitan el establecimiento óptimo de sistemas intensivos.











 texto en
texto en 


