La semilla es el vehículo (sexual y asexual), por excelencia, para la propagación de cultivos; lo anterior, como portadoras de características genéticas y morfológicas destacadas para la producción agropecuaria; sin embargo, pueden transportar organismos patógenos, lo que afecta la eficiencia productiva (Arriagada, 2012; Lamichhane et al., 2020). El efecto negativo de la asociación patógeno-semilla puede limitar la densidad de plantas, materia prima, alimentos y afectar seriamente tanto la salud humana y animal (Afzal et al., 2019). La inspección y análisis de semilla permite la detección oportuna de los patógenos asociados y con ello, la oportunidad de tomar medidas de manejo. Entre los patógenos asociados a semillas forrajeras, los hongos poseen mayor importancia; lo anterior, dado que, además de afectar la densidad vegetal al establecimiento, rendimiento por enfermedades, también provocan alteraciones en parámetros de calidad de la cosecha: lignificación de tallos, disminución de digestibilidad, contenido de aminoácidos libres en raíz y hojas de plantas afectadas, micotoxinas causantes de enfermedades en el ganado, entre otros problemas (Pirelli et al., 2016). La fitosanidad junto con otras variables (viabilidad, germinación, pureza y vigor) determinan la calidad de un lote de semilla. La mayor parte de la literatura especializada indica que géneros de hongos como: Alternaria, Aspergillus, Botrytis, Cladosporium, Curvularia, Doratomyces, Fusarium, Helminthosporium, Macrophomina, Nigrospora, Penicillium, Chaetomium, Pestalotia y Rhizopus, incluyen especies asociadas a la semilla, en campo y almacén (Lezcano et al., 2007). Los beneficios de una semilla con buen control sanitario contra patógenos aéreos y del suelo incluyen mejor emergencia, altura y vigor de planta; además, mayor biomasa aérea y radical de esta (Lamichhane et al., 2020).
En México, cerca del 90% de las semillas forrajeras son importadas (Quero et al., 2017). La necesidad de recursos genéticos forrajeros nacionales que garanticen calidad, alta persistencia y adaptación a condiciones regionales especificas (Quero et al., 2007) hace necesarios estudios de calidad de semilla producida en el país; lo anterior, con el fin de otorgarle calidad sanitaria en conjunto con la calidad genética y comercial y promover la recuperación del mercado nacional con semilla de la mejor calidad. El establecimiento de praderas de alto riesgo en temporal semiárido implica su manejo con elevada incertidumbre inherente al clima y donde la calidad biológica y sanitaria de semilla es, las más de las veces, el único componente que se puede manejar con certidumbre (Quero-Carrillo et al., 2014). Pasto Banderita Bouteloua curtipendula es una especie nativa de México árido y semiárido, con buena apetencia para el ganado, alta calidad nutricional y ampliamente demandado en resiembras de praderas y pastizales de zonas áridas y semiáridas (Morales et al., 2009). Por consiguiente, objetivo del presente trabajo fue identificar hongos patógenos asociados a las semillas del pasto Banderita producida comercialmente en el Valle del Mezquital, Hidalgo.
Materiales Y Métodos
Material genético. Las muestras evaluadas pertenecen a cinco materiales genéticos apomícticos de pasto Banderita, registrados por el Colegio de Postgraduados, durante 2017 y 2018, disponibles para investigación en el área de Forrajes del Programa de Ganadería. Se evaluaron las variedades noveles, de las cuales, se carece de información sobre su calidad sanitaria: 1) “NdeM-La Zarca”, 2) “NdeM-303”, 3) “NdeM-5”, 4) “NdeM-Zenith” y 5) “NdeM-La Resolana”. La semilla se cosechó al centro de praderas exclusivas para producción comercial de semilla, regadas con aguas del río Tula, libres de pastoreo, en áreas con, al menos, un año de establecidas y con superficies de una (NdeM-5, NdeM-Zenith; NdeM-La Resolana) y 10 ha (NdeM-La Zarca, NdeM-303), localizadas en el Valle del Mezquital, Hidalgo y cosechada manualmente en otoño de 2017. Este valle se localiza a 2000 msnm delimitado por sierras al norte y noreste, que impiden el paso de masas de aire húmedo provenientes del Golfo de México. El clima es seco con lluvias en verano clasificado como tipo BSkwg y BShwg. Precipitación anual entre 500 y 600 mm. Temperaturas mínima de -10 °C en invierno y máxima de 39.5 °C, en verano (CONAGUA, 2018).
Aislamiento y purificación de hongos. El trabajo fue realizado en el Departamento de Fitosanidad-Fitopatología del Colegio de Postgraduados, Campus Montecillo-Texcoco, Estado de México, durante el 2018. Las semillas de cada variedad se separaron en tres tipos de muestra o propágulo: M1-espiguillas (brácteas accesorias + cariópsides), M2-cariópsides con lemas y M3-cariópsides limpios (sin brácteas accesorias). Se sembraron 60 cajas Petri de cada tipo de propágulo (M1, M2 y M3) y variedad. Los aislamientos se obtuvieron: M1, sin desinfestar por el método de papel secante y congelación (Warham et al., 1998). En el caso de M2 y M3, fueron desinfestados con solución de hipoclorito de sodio a 1.5% por dos min, se enjuagaron tres veces con agua destilada estéril, se secaron con papel absorbente estéril y se sembraron cinco propágulos por caja Petri en medio de cultivo PDA (papa-dextrosa-agar; Crous et al., 2009) marca Bioxon®. Las cajas se incubaron a 24 ± 2 °C por ocho días o hasta el desarrollo de estructuras. Posteriormente, se realizaron los sub-cultivos necesarios en medio de cultivo PDA, con el fin de iniciar el proceso de purificación con la técnica de punta de hifa y monospóricos (Gilchrist et al., 2005). Para calcular la frecuencia de aislamiento por género y tipo de muestra se utilizó la siguiente ecuación: Frecuencia (%) = (No. de aislados del género identificado / total de aislados analizados por tipo de muestra) *100 (Mariscal et al., 2017).
Caracterización morfológica. De los aislamientos obtenidos, posteriormente se sembraron en medios selectivos de cultivo, de acuerdo a los posibles géneros obtenidos de las siembras. Los aislamientos del género Alternaria se sembraron en cajas Petri con medio de cultivo PDA, V8 (Agar-jugo de verduras®) y PCA (Papa-Zanahoria-Agar); los del género Fusarium en medio PDA, CLA (Agar-clavel) y SNA (Spezieller Nährstoffarmer-Agar); y finalmente, los del género Bipolaris solo en medio PDA. Las cajas se incubaron a temperatura de 24 ± 2 °C con 12 horas luz/oscuridad, durante 14 días. Para la identificación morfológica se realizó con base a color de colonia, forma y tamaño de conidióforos y conidios; para Fusarium y Bipolaris, se llevaron a cabo preparaciones semipermanentes en glicerol al 50%. El tamaño de muestra para las mediciones fue de 50 ejemplares por cada género (Crous et al., 2009), documentadas con ayuda de microscopio compuesto con cámara Motic Images Plus 2.0, (Software Motic 580 ver.5.0.) y microscopio Carl Zeiss® Imager D2 con cámara (Axioncam 503 color). La identificación se realizó con base a claves taxonómicas (Warham et al., 1998; Barnett y Hunter, 1972; Gilchrist et al., 2005; Leslie y Summerell, 2006; Manamgoda et al., 2014).
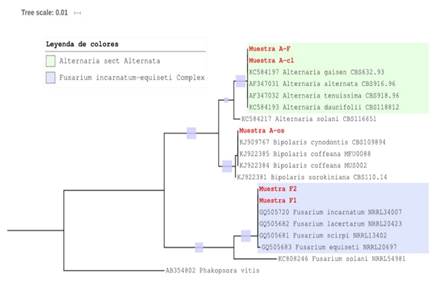
Identificación molecular, alineamiento de secuencias y análisis filogenético. Para confirmar molecularmente las especies de hongos se realizó la extracción de ADN genómico por el método de Fosfatasa Alcalina (AP) (Sambrook y Russell, 2001) y se corroboró su calidad por medio del Nanodrop; posteriormente, se enviaron a Macrogen® Inc., Korea para la purificación y amplificación del ADN mediante la reacción en cadena de la polimerasa (PCR). Para ello, se amplificó la región ITS del ADN ribosomal ITS4 con la utilización del iniciador: 5´-TCCTCCGCTTATTGATATGC-3´, para Alternaria spp. y Bipolaris spp., cuyo fragmento de amplificación es de 550 bp (White et al., 1990); mientras que para Fusarium spp., se realizó en el ADN ribosomal ITS4 con el iniciador EF1-983F (5´- GCYCCYGGHCAYCGTGAYTTYAT-3´; Kidd et al., 2019), con un producto de 900 a 1, 200 bp. Ambos iniciadores se consideran universales de dominio público. Las secuencias se editaron y alinearon manualmente mediante el Software BioEdit 7.2.5 (Hall, 1999) y se compararon individualmente en la base de datos del Banco de Genes del National Center for Biotecnology (NCBI) USA, mediante el programa Basic Local Alignment Search Tool (BLAST) con los parámetros preestablecidos. Para el análisis filogenético de las secuencias múltiples se utilizó el software Molecular Evolutionary Genetics Analysis (MEGA 7) y las secuencias de referencia reportadas por Woudenberg et al. (2013), para el género Alternaria; de O´Donnell et al. (2009), para Fusarium y para Bipolaris, de Manamgoda et al. (2014). Todas las secuencias fueron alineadas con el algoritmo CLUSTAL-W y se analizaron con el método Neighbor-joining (NJ) (Saitou y Nei, 1987). Se utilizaron 1000 réplicas de valores soporte (Bootstrap) para obtener un árbol consenso con una regla de mayoría del 70% (Tamura et al., 2004). Se utilizó al basidiomiceto Phakopsora vitis como nodo raíz, externo al grupo.
Resultados Y Discusión
Entre las 900 siembras que se realizaron para cada variedad (300 por tipo de propágulo), los géneros Alternaria, Bipolaris y Fusarium, fueron los principales hongos aislados en propágulos de pasto Banderita, con incidencia variable, dependiendo del tipo de propágulo y variedad. El género Alternaria con 67% fue el que se identificó con mayor frecuencia entre las cinco variedades y los tres tipos de propágulo; lo anterior, con excepción de M3 (cariópside limpio) de la variedad NdeM-5, donde no se aisló este género como resultado de la protección física que las brácteas accesorias proporcionan en esta especie, retrasando o evitando la entrada del patógeno. En alguna parte del desarrollo de semilla, las brácteas (glumas, lema y palea) son suficientemente sólidas o impermeables para evitar la llegada del patógeno al cariópside. Este hongo posee amplia distribución y presencia en el ambiente y puede infestar, desde el suelo, a semillas antes y después de la cosecha (Pavón et al., 2012); similarmente, por contacto con brácteas contaminadas y/o mal manejo de cosecha de semilla; lo anterior, es importante para la sobrevivencia de plántulas post-siembra y no necesariamente para la calidad de forraje en especies perennes como pasto Banderita.
El género Fusarium presentó una incidencia de 24% (número) y, estuvo presente en las cinco variedades con frecuencia variable entre variedades, siendo en M2 y M3 donde se aisló con mayor frecuencia; lo cual, es indicativo de que el beneficio al cariópside mejora la sanidad del propágulo. La presencia de Fusarium puede deberse a su ciclo biológico ya que, en zonas con baja humedad ambiental, como son las regiones áridas donde se desarrolla naturalmente pasto Banderita, la infección la causa casi de manera exclusiva el inóculo presente en suelo, invadiendo y penetrando la base de tallos y raíces, por lo que los agentes protectores químicos o biológicos adicionados a la semilla evitan la infestación de plántulas, ya sea desde las brácteas accesorias o desde el suelo (Cook, 2010), llegando infectar a toda la planta. Finalmente, el género Bipolaris, con 9% de incidencia, fue el de menor número de aislados en las cinco variedades, siendo en M3 de NdeM-La Zarca donde se presentó en mayor frecuencia (Figura 1). Los géneros Alternaria, Bipolaris y Fusarium están asociados a enfermedades de hoja, tallo y raíz en gramíneas, así como con la producción de micotoxinas con efectos negativos en la salud animal (Sainz et al., 2012). Enfermedades como “Damping-off” y punta negra del grano, pueden ser causadas por el complejo Alternaria spp., Fusarium spp. y Bipolaris spp. (Rodríguez et al., 2009).
Identificación morfológica. Aunque no se observaron síntomas en la semilla, la presencia de hongos que afecten el desarrollo de plántulas, es importante a la siembra, ya que definirá la capacidad competitiva de estas ante un ambiente naturalmente desafiante, así como su densidad en la pradera. Se obtuvieron 51 aislamientos de los tres tipos de muestra (M1, M2, M3); entre los cuales, se identificaron cinco morfoespecies: Alternaria F y Alternaria-cl, Bipolaris-os, Fusarium 1 y Fusarium 2. De acuerdo con las claves taxonómicas para cada género, se identificaron las siguientes especies: Alternaria-cl: colonia de coloración gris en medio de cultivo PCA, conidios con ornamentación rugosa-punteada, obclavados, muriformes, septación transversal de 1-6 y longitudinal de 0-3 septas, tamaño de conidios de 15-34 x 6.3-13.5 µm, conidióforos primarios de 12-46 x 3.8-5.4 µm. La catenulación puede poseer de 5-15 conidios, presenta ramificación secundaria, correspondiendo estas características a A. tenuissima de acuerdo a las claves de Simmons (1995) (Figura 2A-2C). Alternaria F: colonia grisáceo-olivo en medio PCA, conidios obclavados, muriformes con ornamentación rugosa-punteada, septación transversal de 1-6 y longitudinal de 0-3, tamaño variable de conidios de 10.5-42 x 6.4-12.7 µm, conidióforos primarios de 34.1- 44.8 x 3.1- 4.6 µm. La catenulación puede poseer de 5-10 conidios, presenta abundante ramificación secundaria, correspondiendo estas características a A. alternata (Simmons, 1995) (Figura 2D-2F); en esta especie, las esporas sobreviven sobre la semilla o el micelio dentro de esta, la alta humedad y temperaturas de 20-25 °C favorecen su desarrollo. El hongo A. alternata ha sido aislada de semillas de trigo (Bautista et al., 2011) y Leucaena (Lezcano et al., 2010), en avena causa tizón foliar (García et al., 2013), pudriciones en frutales (Mariscal et al., 2017; Ruiz et al, 2017) y hortalizas (Fraire et al., 2010). El efecto de muchos hongos en pastos perennes puede ser patogénico (Kononenko et al., 2015; Masi et al., 2017) y/o potencializar su resistencia a diversidad de presiones ambientales (Ali et al., 2017); por su parte, A. tenuissinna está presente en cultivos de trigo (Perello et al., 2015). Estas especies producen micotoxinas que pueden estar presentes en productos como harinas, concentrados y alimentos procesados, afectando seriamente la salud humana y animal (Pavón et al., 2012).
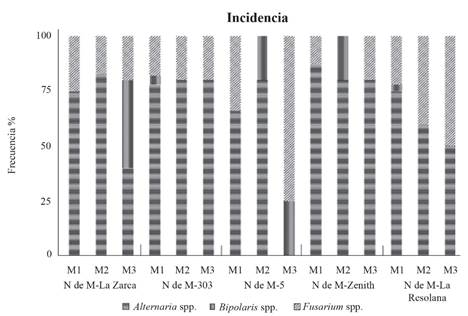
Figura 1. Frecuencia de los géneros Alternaria, Bipolaris y Fusarium aislados de cinco variedades comerciales del pasto Banderita (Bouteloua curtipendula) a partir de espiguillas, cariópsides con lemas y cariópsides limpios. M1: espiguilla completa; M2: cariópside con lema; M3: cariópside limpio.
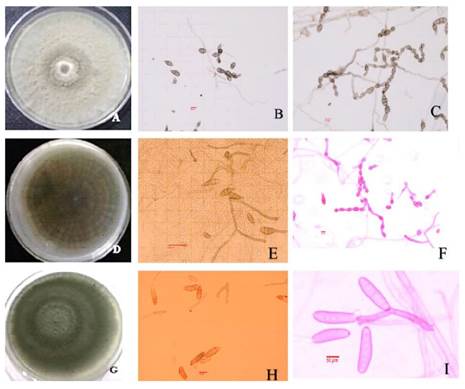
Figura 2. Características culturales y morfológicas de hongos asociados a semilla de pasto Banderita procedente del Valle del Mezquital, Hidalgo. Morfología de los hongos. A-C) Alternaria tenuissima, A) Colonia en PCA, B) Conidios, C) Cadena de conidios. D-F) Alternaria alternata , D) Colonia en PCA, E) Conidios, F) Cadena de conidios. G-I) Bipolaris cyndontis, G) Colonia en PDA, H) Conidios, I) Conidióforo.
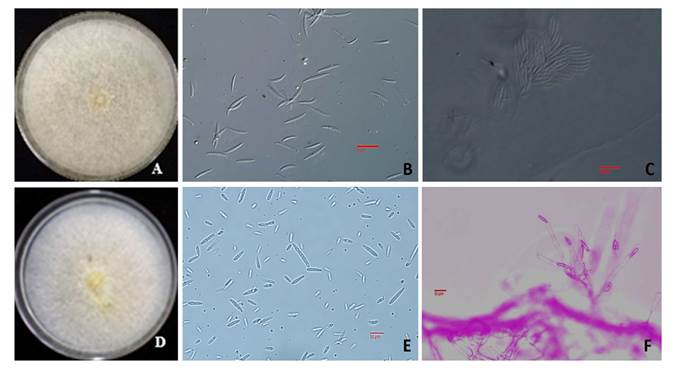
Figura 3. Características culturales y morfológicas de hongos asociados a semilla de pasto Banderita procedente del Valle del Mezquital, Hidalgo. A-C) Fusarium scirpi, A) Colonia en PDA, B) Macroconidios, C) Esporodoquio. D-F) Fusarium incarnatum, D) Colonia en PDA, E) Micro y Mesoconidios, F) Fiálides.
Para el género Fusarium 1: la colonia presentó una coloración beige con micelio blanco que se tornó marrón al envejecer en medio de cultivo PDA y con formación de masas de esporas. Los esporodoquios se observaron de color salmón-naranja con macroconidios delgados y curva dorsiventral de 26-38.5 x 3-4.9 µm, con 5-6 septos, célula apical ahusada, célula basal en forma de pie. Microconidios elipsoidales de 8.9-17.5 x 2.5-4.2 µm, con 0-3 septos y polifialides cortas, características correspondientes a F. scirpi, (Leslie y Summerell, 2006) (Figura 3A-3C). Esta especie es común en regiones templadas, áridas y semiáridas (Summerell, 2019), pastizales y tierras de cultivo. Se considera patógeno secundario, pero puede causar pudriciones en raíz de leguminosas. Fusarium 2: presentó coloración naranja pálido a salmón, en medio de cultivo PDA, abundante micelio algodonoso; macroconidios semirectos y ligeramente curvados de 27-36 x 3-4.5 µm con 3-5 septos, célula basal en forma de pie, célula apical afilada y curva; similarmente, presenta abundantes mesoconidios, con 1-3 septos. Estas características coinciden con F. incarnatun (Leslie y Summerell, 2006) (Figura 3D-3F). Este hongo está presente en suelo y amplia gama de ambientes tropical-desérticos considerados de baja importancia económica y asociado a semilla de mijo perla (Pennisetun americanum) (Wilson, 2002), soya (Chiotta et al., 2015) y sorgo; similarmente, es ampliamente reconocida la presencia de micotoxinas en forrajes que se usan con alto contenido de humedad mal manejados: henos, silo y heno-silo. La presencia de gran cantidad de metabolitos fúngicos (más de cien; entre micotoxinas, antibióticos y otros de acción desconocida) han sido reportadas en especies forrajeras cultivadas (Ramírez et al., 2014) y del pastizal; sin embargo, se desconocen muchos de sus efectos sobre el ganado en pastoreo (Nichea et al., 2015). Especies pertenecientes al complejo F. incarnatum-equiseti se han asociado a enfermedades en gramíneas y producción de micotoxinas (Salvat et al., 2013).
Finalmente, el género Bipolaris B-os: presentó en medio de cultivo PDA, colonias de coloración olivo-oscura con micelio aéreo, conidióforos individuales sin ramificación de 43-160 x 4-6 µm, septado y geniculado en la parte superior, de color marrón; conidios de 21.5-49 x 10.5-15.8 µm lisos o ligeramente curvados, cilíndricos, de color marrón, con 2-6 septos, características que corresponden a B. cynodontisManamgoda et al. (2014) (Figura 2G-2I). Este hongo fue reportado por primera vez en Cynodon dactylon en 1909 y se considera como patógeno saprofito secundario y puede invadir amplia gama de hospedantes dentro de las gramíneas (Poaceae). Es considerado de baja importancia económica, reportado como patógeno en varias especies de pastos (González et al., 2006). Por ejemplo, en Chloris gayana y C. dactylon induce manchas foliares (Hagan, 2005; Rodríguez, 2011).
Identificación y filogenia molecular. Basados en la identificación morfológica se enviaron por triplicado muestras de ADN de los géneros a Macrogen® Inc., Korea. Las secuencias de ADN obtenidas de los aislamientos tuvieron porcentaje de cobertura e identidad ≥ 99% para distintas especies de cada género de Alternaria, Bipolaris y Fusarium; lo cual, confirmó la identificación previa de los géneros basada en caracteres morfológicos. Para determinar la identidad de cada aislamiento, se realizó filogenia molecular (Figura 4). Las secuencias correspondientes al género Alternaria, se agruparon en el clado que comprende a diez especies que conforman el complejo A. alternata (Woudenberg et al., 2013). Existe escasa variación molecular y para determinar los morfotipos específicos, es necesario secuenciar tres o más genes (Woudenberg et al., 2015). Sin embargo, por la morfología presentada (Simmons, 1995), se corroboró que Alternaria F fue A. alternata y Alternaria-cl fue A. tenuissima. La secuenciación de Bipolaris-os se alineó con el clado que comprende a B. coffeana y B. cynodontis (Manamgoda et al., 2014), ambas especies relacionadas filogenéticamente. Acorde a la morfología observada y lo descrito por (Manamgoda et al., 2014) corresponde a B. cynodontis. Las secuencias de Fusarium, se alinearon dentro del complejo incarnatum-equiseti, que incluye a cuatro especies: F. incarnatum, F. equiseti, F. lacertarum y F. scirpi. La región ITS del rADN y EF1 no presentó suficiente polimorfismo para separar entre estas cuatro especies filogenéticamente relacionadas; lo cual, concuerda con lo reportado por O´Donnell et al. (2009). De acuerdo con la morfología presentada se identificó a F1 como F. scirpi y F2 como F. incarnatum.
Conclusiones
Las semillas evaluadas presentaron baja calidad fitosanitaria, ya que se encontraron a Alternaria spp. (67%), Fusarium spp. (24%) y Bipolaris spp. con 9% de incidencia en las cinco variedades y los tres tipos de propágulo. Las especies A. alternata, A. tenuissinna, F. incarnatum, F. scirpi y B. cynodontis fueron identificadas por caracterización morfológica, molecular y filogenia, como los principales hongos asociados en semilla comercial del pasto Banderita (Bouteloua curtipendula) proveniente del Valle del Mezquital, Hidalgo. No existen en México estudios previos sobre la presencia de hongos en semilla de esta gramínea nativa de enorme importancia para recuperar pastizales. A partir de esta información, se recomienda realizar futuros estudios para determinar la patogenicidad de los hongos aislados en la semilla, así como estudios epidemiológicos en condiciones de campo con el fin de poder desarrollar estrategias asertivas para promover mayor calidad sanitaria de semilla y mejorar la probabilidad de establecimiento de praderas de alto riesgo, en condiciones de temporal semiárido.











 texto em
texto em