México ostenta la Denominación de Origen del Tequila (DOT) desde 1997, conformada por 181 municipios distribuidos en los estados de Nayarit (8), Guanajuato (7), Tamaulipas (11), Michoacán (30) y Jalisco con 125 municipios, de los cuales 21 se encuentran en la región de Los Altos (CRT, 2017). En 2018, la producción primaria de agave azul (Agave tequilana var. azul) como materia prima para elaboración de tequila implicó 64,582.76 ha equivalente a 206.6 millones de plantas, concentrándose en Los Altos el 57% de la producción (SIAP, 2018).
En los últimos 20 años, la producción de agave azul ha sido afectada primariamente por marchitez y pudrición seca del cogollo (Rubio, 2007; Gómez-Ortiz et al., 2011). La marchitez vascular inicia con enrollamiento de punta de hojas por obstrucción y taponamiento de haces vasculares que provocan deshidratación y muerte progresiva de tejidos, seguido de cambio de coloración de azul turquesa a verde opaco; en etapa avanzada de enfermedad, las plantas muestran enrollamiento foliar firme, y eventualmente coriáceo, mayor al 50% del área foliar; en la mayoría de casos se pierde anclaje por reducción o destrucción total del sistema raíz (Jiménez-González et al., 2017). Etiológicamente se ha reportado la asociación de diversos organismos entre ellos, F. oxysporum y F. solani (Rubio, 2007; Vega-Ramos et al., 2013; Ramírez-Ramírez et al., 2017). En contraparte, plantas con pudrición seca del cogollo se caracterizan por lesiones corrugadas de color negro y amarillo-pálido que descienden desde la punta a base del cogollo. Inicialmente, la pudrición se restringe al ápice interno del cogollo. A diferencia de mancha gris por Cercospora (Coria-Contreras et al., 2019) o pudrición blanda, el cogollo mantiene su textura rígida, sin colapso, y no presenta olor fétido. El agente causal de pudrición seca también se ha asociado a Fusarium sp. (Gómez-Ortiz et al., 2011), mientras que en pudrición blanda se ha reportado a Pectobacterium spp. y Erwinia sp. (Jiménez-Hidalgo et al., 2004; Rincón-Enríquez et al., 2014). De los tres tipos de pudrición de cogollo, la seca tiene mayor ocurrencia aunque menor a marchitez (www.sivea.org.mx). En algunas subregiones y predios con alta intensidad de marchitez, la pudrición seca puede concurrir en la misma planta. Aunque en 2013 se estableció la campaña oficial fitosanitaria del agave, recurrentemente estas enfermedades comprometen inventarios productivos debido a la ausencia de métodos efectivos de manejo y por abandono de plantaciones comerciales infestadas durante periodos cíclicos de bajo precio.
Aunque la caracterización morfológica clásica es importante para identificar Fusarium spp. (Leslie y Summerell, 2006; Ceja-Torres et al., 2008), el incremento de enfermedades y epidemias causadas por este género y su complejidad taxonómica justifica el empleo de técnicas moleculares para identificación de especies, estructura poblacional y filogenia (Liew et al., 2016; Herrera-Parra et al., 2017; Parra-Cota et al., 2018; Almaraz-Sánchez et al., 2018). Convencionalmente, la región espaciadora interna transcrita (ITS) del ADN ribosómico nuclear se ha empleado en Fusarium y hongos en general (O’Donnell et al., 2015). Sin embargo, es consenso actual que Fusarium se debe analizar con genes asociados al factor de elongación (EF-1a), a la subunidad mayor de ARN polimerasa I (RPB1), y segunda subunidad más grande de ARN polimerasa II (RPB2) (O’Donnell et al., 2015). La presente investigación tuvo como objetivo identificar las especies de Fusarium obtenidas de raíz y suelo de plantaciones comerciales de agave azul asociadas a marchitez y pudrición seca del cogollo en Los Altos, Jalisco, mediante técnicas morfológicas, epidemiológicas y moleculares con la finalidad de conocer la diversidad y prevalencia regional que coadyuve al establecimiento de estrategias metodológicas, operativas y de manejo que sustenten el Sistema Integral de Vigilancia Epidemiológica Fitosanitaria del agave (SIVEA), base de la campaña fitosanitaria del agave.
Materiales Y Métodos
Área de estudio. La colecta de muestras se realizó en 40 plantaciones comerciales de 3-4 años distribuidas en 13 municipios de Los Altos, Jalisco (Cuadro 1). Las plantaciones se seleccionaron mediante criterios de inductividad epidémica integrados en la metodología REG-N (Acevedo-Sánchez et al., 2017; Coria-Contreras et al., 2019). Adicionalmente se consideró la sintomatología y condición fitosanitaria predominante de plantación: marchitez (M), pudrición seca de cogollo (P), aparentemente sano (AS) e improductivos (IP). Las parcelas IP fueron elegidas por antecedentes de incidencia alta, causando su abandono para producción comercial de agave.
Método de muestreo. En plantaciones con M y P, el muestreo se realizó en torno a focos iniciales con 1-4 plantas contiguas con severidad 3-4 de marchitez (M) y/o 3-5 de pudrición seca (P) según clases de escala diagramática propuesta por Jiménez-González y colaboradores (2017). Se integraron cinco submuestras, dos intra-foco y tres de perifoco, para conformar una muestra compuesta de 500 g de suelo y raíces. La submuestra se tomó con una pala cilíndrica metálica diseñada para estandarizar el volumen de colecta a 10 cm del cuello de planta y a 35 cm de profundidad. Para AS se aplicó misma metodología en una sección interna de plantación en torno a plantas aparentemente sanas. En parcelas IP, la muestra compuesta consistió únicamente de suelo colectado en el tercio medio del predio. Cada muestra compuesta se dividió para análisis microbiológico y fisicoquímico. Este último se realizó en el laboratorio de fertilidad de suelos del Colegio de Postgraduados, Campus Montecillo.
Cuadro 1. Condición fitosanitaria, identificación y localización de 40 plantaciones comerciales de Agave tequilana de 3-4 años de edad, seleccionadas por criterios de inductividad epidémica para estudio etiológico regional de marchitez y pudrición seca del cogollo del agave en Los Altos, Jalisco. Verano 2016.
| Condición Fitosanitaria | Municipio | Latitud | Longitud | Altitud (msnm) | ID Plantación |
|---|---|---|---|---|---|
| Marchitez de planta | Arandas | 20.695398 | -102.326988 | 2082 | A-ARA-M09 |
| 20.850716 | -102.158635 | 1954 | A-ARA-M10 | ||
| Atotonilco A. | 20.580920 | -102.516410 | 1940 | A-ATO-M04 | |
| 20.515050 | -102.612560 | 1624 | A-ATO-M03 | ||
| 20.56022 | -102.53321 | 1911 | A-ATO-M15 | ||
| Jesús María | 20.630650 | -102.213000 | 2132 | A-JM-M11 | |
| 20.613504 | -102.266203 | 2026 | A-JM-M12 | ||
| 20.707930 | -102.122470 | 2235 | A-JM-M14 | ||
| 20.595730 | -102.156940 | 2172 | A-JM-M13 | ||
| Ayotlán | 20.606100 | -102.378590 | 1946 | A-AYO-M06 | |
| 20.601070 | -102.402080 | 1901 | A-AYO-M05 | ||
| San Ignacio C. G. | 20.674480 | -102.505280 | 1949 | A-SICG-M08 | |
| 20.724880 | -102.467340 | 2014 | A-SICG-M07 | ||
| Poncitlán | 20.367180 | -102.836960 | 1533 | A-PON-M01 | |
| Zapotlanejo | 20.575610 | -102.889340 | 1556 | A-ZAP-M02 | |
| Pudrición seca del cogollo | Arandas | 20.683519 | -102.264241 | 2003 | A-ARA-P11 |
| 20.745702 | -102.324358 | 2222 | A-ARA-P05 | ||
| 20.694717 | -102.324106 | 2243 | A-ARA-P10 | ||
| 20.631250 | -102.272260 | 2053 | A-ARA-P12 | ||
| Jesús María | 20.723180 | -102.127880 | 2271 | A-JM-P14 | |
| 20.708100 | -102.122040 | 2238 | A-JM-P13 | ||
| 20.692854 | -102.065208 | 2250 | A-JM-P15 | ||
| Atotonilco A. | 20.588600 | -102.513800 | 1826 | A-ATO-P06 | |
| 20.634495 | -102.435671 | 1957 | A-ATO-P07 | ||
| Ayotlán | 20.581670 | -102.370740 | 1944 | A-AYO-P08 | |
| Poncitlán | 20.36105 | -102.96944 | 1618 | A-PON-P03 | |
| San Ignacio C. G. | 20.723920 | -102.493020 | 2018 | A-SICG-P09 | |
| Tepatitlán M. | 20.649600 | -102.632200 | 1915 | A-TEP-P02 | |
| Yahualica G. G. | 21.113520 | -102.866870 | 1824 | A-YAH-P01 | |
| Zapotlanejo | 20.576420 | -102.889370 | 1869 | A-ZAP-P04 | |
| Improductivos | Cuquío | 21.016096 | -103.006563 | 1810 | A-CUQ-IP01 |
| 20.98254 | -103.02026 | 1860 | A-CUQ-IP02 | ||
| Degollado | 20.42574 | -102.13187 | 1723 | A-DEG-IP07 | |
| 20.46372 | -102.21277 | 1748 | A-DEG-IP08 | ||
| Tepatitlán M. | 20.63825 | -102.90195 | 1751 | A-TEP-IP05 | |
| 20.63964 | -102.638365 | 1904 | A-TEP-IP04 | ||
| San Miguel A. | 20.89801 | -102.40221 | 2049 | A-SMA-IP06 | |
| Acatic | 20.783383 | -102.887821 | 1685 | A-ACA-IP03 | |
| Aparentemente sanos | Jesús María | 20.594201 | -102.156956 | 2176 | A-JM-AS01 |
| Atotonilco A. | 20.662899 | -102.472285 | 1840 | A-ATO-AS02 | |
Aislados y caracterización morfológica. Aislados de Fusarium se obtuvieron a partir de muestras de suelo mediante diluciones de solución madre (SM), para la cual se colocaron 5 g de suelo, debidamente homogeneizado y triturado, en tubos Falcon con 45 mL de agua destilada estéril (1:9/p:v). La mezcla se homogeneizó mediante agitación en Vortex por 5 min. Se seleccionó una dilución 1x100.5, obtenida con 1 mL de SM en 1 mL de agua destilada estéril, para optimizar el conteo de colonias. Mediante espátula Drigalsky se distribuyó una alícuota de 0.1 mL en medio Komada modificado, con tres cajas Petri como repeticiones. El PCNB en Komada se adicionó previo a la esterilización para reducir su efectividad fungicida y permitir el crecimiento controlado de otros hongos además de Fusarium. El tejido de raíz (<0.5cm) se desinfestó por 1 min con hipoclorito al 2%, seguido de 1 min en alcohol 70% y tres lavados con agua destilada estéril. Cuatro trozos de 1 cm se sembraron por caja Petri; cada trozo de tejido se tomó como una repetición. Las siembras se incubaron a 28 °C durante 5-7 días. Posteriormente, putativas colonias de Fusarium se transfirieron a medio SNA-Agar modificado (Leslie y Summerell, 2006). Se incubaron durante cinco días y se obtuvieron 1-2 cultivos monospóricos por aislado usando una dilución de conidios de 1x106.
La caracterización de aislados se realizó con crecimientos en medios Komada, SNA, CLA, PDA y Sabouraud según el atributo de interés (Leslie y Summerell, 2006). Los caracteres analizados fueron: coloración micelial; presencia o ausencia de monofiálides, polifiálides, clamidosporas, células conidiogénicas; y tipo, forma, septos y tamaño de conidios (Leslie y Summerell, 2006; Gogoi et al., 2017). Las observaciones se realizaron en un microscopio Carl Zeiss modelo Axio Imager A1 con sistema de análisis de imagen AxioCam ICc1 y el programa digital AxioVision.
Extracción de ADN, PCR y secuenciación. Para la identificación molecular, de un total de 109 aislados se seleccionaron por representatividad 13 aislados monospóricos obtenidos de suelo y 12 de raíz, con base a características culturales in vitro, morfología, fuente de aislamiento, prevalencia e inductividad regional de enfermedad. El ADN genómico se extrajo por el método Sambrook y Russell. La concentración y calidad del ADN se verificó con NanoDrop 2000 (Thermo Fisher Scientific, USA) y se homogeneizó a 40 ng µL-1 para la reacción en cadena de polimerasa (PCR). Se amplificó la región ITS del ADN ribosomal usando los parámetros publicados (White et al., 1990) y el gen factor de elongación (EF-1a) con los iniciadores EF1* (5’ - ATG GGT AAG GAR GAV AAG AC) / EF2* (5’- GGA DGT ACC AGT RAT CAT G). Cada reacción PCR para EF-1a consistió en una mezcla de 0.8 X de solución buffer de PCR, 1.6 mM de MgCl2 (50mM), 0.2 µM de desoxinucleótidos trifosfato (dNTP’s), 0.2 pmol de cada iniciador, 0.5 unidades de Platinum® Taq DNA polimerasa (Invitrogen) y 2.5 µL de ADN (40 ng µL-1) a un volumen final de 25 µL. Las condiciones PCR en termociclador (T-100, BioRad) consistieron de un ciclo inicial de desnaturalización a 94 °C por 5 min, seguido por 30 ciclos a 94 °C por 30 s, a 58 °C por 40 s y a 72 °C por 55 s y una extensión final a 72 °C por 7 min. Los productos de ambas amplificaciones fueron analizados en gel agarosa 1.5% a 90 Volts por 90 min, se tiñó con bromuro de etidio y se reveló con luz UV en fotodocumentador (UVP, BioImaging Systems, Epi Chemi II Darkroom). Los fragmentos amplificados de 550 y 750 pb aproximadamente se secuenciaron en Macrogen Inc., Korea.
Alineamiento de secuencias y análisis filogenético. Las secuencias se editaron con el programa SeqAssem y se compararon mediante BLASTn con bases de datos Fusarium-ID, Fusarium-MLST y GenBank para determinar identidad de taxones con base en similitud comparativa de secuencias, expresado en porcentaje de identidad. Para determinar relaciones filogenéticas y confirmar la identificación, las secuencias obtenidas se alinearon con secuencias de referencia del GenBank, utilizando el algoritmo MUSCLE y se analizaron con Máxima verosimilitud (ML) en MEGA7 con 1000 replicaciones Bootstrap. El modelo seleccionado para ML fue Kimura-2 parámetros +G. Se integró a F. dimerum (NRRL 36140) como grupo externo. Secuencias representativas de Fusarium sp. fueron registradas en Genbank. con número de accesión MH172303 para el complejo FOSC y MH179126 para el complejo FSSC.
Cálculo del Índice de Fusarium . Únicamente de muestras de suelo, el número de unidades formadoras de colonia (n) de Fusarium spp. y de hongos totales se contabilizó en medio de cultivo Komada a siete días de incubación. Cada muestra tuvo tres repeticiones consistentes en igual número de cajas Petri 90x15 mm. El Índice de Fusarium (IF) se generó como IF = (n - colonias Fusarium spp) / (n - hongos totales), donde IF ≈ 1.0 indica mayor carga de Fusarium spp. en la muestra de suelo.
Análisis del índice de Fusarium con pH y Materia orgánica. Se analizó la dependencia univariada del Índice de Fusarium (IF) con pH y materia orgánica (MO) por medio de adaptaciones a los modelos exponencial negativo [ln (y) =a - b(x)] y Gregory [ln (y) =a- bln (x)]; donde y representa el Índice de Fusarium, x valores de pH y MO, a y b son parámetros de ajuste y tasa, respectivamente. Un total de 28 parcelas comerciales con análisis de pH y MO fueron incluidas en este análisis.
Resultados
Caracterización morfológica y cultural. Un total de 109 aislados de Fusarium se obtuvieron a partir de 248 siembras in vitro provenientes de 40 muestras de suelo (57 aislados) y 32 de raíz (52). El medio Komada, por su especificidad a Fusarium, fue adecuado para aislar al hongo tanto de suelo como de raíz y para evaluar textura y coloración micelial. CLA y SNA fueron óptimos para inducir esporulación y evaluar tipo de esporas y septación. Estos medios fueron complementarios por respuesta diferencial entre cepas (Cuadro 2). En CLA y SNA, predominaron macroconidios de forma recta a ligeramente curva y falcada, de tres a seis células, agrupándose en dos grupos: grupo A incluyó cepas con macroconidios de longitud media de 26.01 µm (rango: 17.12-57.62 µm), y grupo B con media de 33.19 µm (27.16-48.8 µm). Una cepa presentó macroconidios con longitud de 76.45 µm (Figura 1 A-D). Microconidios elipsoidales, sin septos y dispuestos en falsas cabezas en monofiálides caracterizaron al grupo A, mientras que en el grupo B presentaron un septo. En general, los microconidios tuvieron una longitud media de 10 µm y rango de 3.7-12.4 µm (Figura 1 E-F). El tamaño de fiálides fue determinante para diferenciar entre cepas del grupo A y B. En el primer caso se observaron fiálides cortas con longitud media de 23.43 µm (Figura 1 G-H) contra fiálides largos de 147.91 µm en promedio del grupo B (Figura 1I-J). Las clamidosporas fueron escasas en la mayoría de cepas; sin embargo, algunos aislados de ambos grupos, las formaron individualmente o en cadena (Figura 1K). Las características morfológicas encontradas y su variabilidad concordaron con la descripción taxonómica del género Fusarium (Leslie y Summerell, 2006). Las 109 cepas se entregaron en resguardo a SENASICA-DGSV-CNRF. Aislados seleccionados para registro en el banco de genes de NCBI fueron: A115a=MH172303; A129a=MH179126.
Cuadro 2 Medios de cultivo seleccionados para aislamiento, purificación, caracterización cultural y morfológica de Fusarium spp. a partir de 248 siembras, provenientes de 40 plantaciones comerciales y 72 muestras de suelo y raíz de agave azul. Verano, 2016. Los Altos, Jalisco.
| Medio de cultivo x | Objetivo | Características observadas y | |||
|---|---|---|---|---|---|
| Coloración | Esporulación | Esporas | Septación | ||
| Komada | Aislamiento | + | - | - | - |
| SNA | Inducción de esporulación y purificación | - | + | - | - |
| CLA | Caracterización morfológica de esporas | - | + | + | + |
| PDA | Caracterización cultural de colonias | + | - | - | - |
| Sabouraud | Purificación y obtención de cultivos monospóricos | + | - | - | - |
xSNA= Spezieller Nährstoffarmer Agar; CLA= agar hojas de clavel; PDA= agar papa dextrosa.
yColoración= evaluación del color de 109 colonias con 7-10 días de crecimiento; Esporulación= cuantificación cualitativa de la producción de esporas (alta, media y baja); Esporas= presencia o ausencia y tamaño de macro y microconidios; tipo de clamidospora; Septación= cuantificación del número de septos en macro y microconidios.
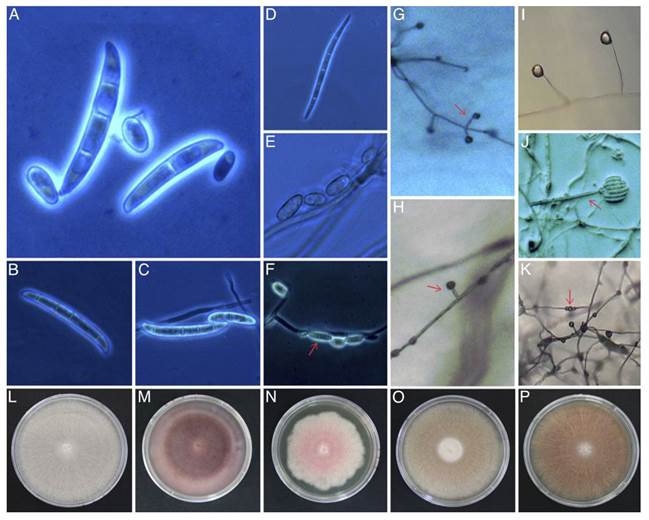
Figura 1. Ejemplo de características morfológicas y culturales empleadas en la caracterización de 109 cepas de Fusarium aisladas a partir de 248 siembras provenientes de 40 plantaciones comerciales y 72 muestras de suelo y raíz de agave azul. Macroconidios (A-D): A-B, Rectos ligeramente curvos (48.8 y 44.62 µm), de 3 a 6 septos, célula apical redondeada y célula basal con apenas muescas. C, Largo con una ligera curvatura dorso ventral (76.45 µm), de 6 septas, célula apical afilada y célula basal apenas con muescas. D, Curvado con tres septas (32.68 µm), célula apical corta, célula basal con muescas distintivas. Microconidios (E-F): E, Ovalados sin septas. F, Ovalados con una septa. Monofiálides (G-J): G-H, Cortas (23.43 µm). I-J, Largas (147.91 µm). Clamidosporas (K): En cadena. Coloración micelial en Komada (L-P): L, Blanco. M, Morado. N, Rosa. O, Melón P, Salmón.
En Komada, las cepas mostraron diferencias en textura micelial con predominancia lisa y algodonosa. Por colorimetría se diferenciaron diez colores sobresaliendo blanco, morado, rosáceo, salmón y melón (Figura 1L-P). En 57 aislados de raíz, provenientes de ocho municipios, se determinaron seis colores con mayor frecuencia de micelio blanco en 19/57 aislados (33.3%), principalmente en plantaciones con marchitez (Figura 2 A), seguido de aislados rosáceos. En 52 aislados de suelo de 11 municipios se tuvo toda la gama de colores con dominancia del morado en 14/52 aislados (26.92%) en las cuatro condiciones fitosanitarias (Figura 2 C; Cuadro 1 y 3), pero asociado principalmente a plantaciones con pudrición seca del cogollo (Figura 2B). El blanco fue el segundo color observado (Figura 1L-P; Figura 2C). En Arandas se obtuvo la mayor diversidad de color micelial para aislados de suelo y raíz seguido de Jesús María con abundancia de salmón, morado y blanco. En Tepatitlán sobresalió la combinación morado-rosácea para aislados de suelo en plantaciones improductivas y con pudrición seca. En Jesús María, aislados de suelo en plantaciones aparentemente sanas se distinguieron por micelio blanco y morado (Figura 2C).

Figura 2. Plantas enfermas de focos seleccionados para muestreo. A) Planta con síntomas de marchitez severidad clase 4. Costado izquierdo, hoja con enrollamiento y deshidratación severa. B) Planta con síntomas de pudrición seca del cogollo severidad clase 5. Cogollo completo con secamiento avanzado (flecha). Costado derecho, cogollo con pudrición descendente y textura seca rígida. C) Diversidad de color micelial de 109 cepas de Fusarium spp. caracterizados en medio Komada, provenientes de 72 muestras de suelo y raíz de 40 plantaciones comerciales y 13 municipios de Los Altos, Jalisco. Verano 2016.
Identificación molecular y filogenia. A partir de 25 cepas seleccionadas para análisis molecular se obtuvieron fragmentos óptimos de 550 pb ITS y 760 pb EF-1a (Figura 3). El uso de ITS permitió la identificación de cepas a nivel género, pero no a especie, debido a que la alineación de secuencias entre miembros de un complejo de especies o entre especies estrechamente relacionadas no fue confiable. El análisis de secuencias parciales del gen EF-1a, aunado a la caracterización morfológica, determinó cinco especies de Fusarium, dos sin identificar, asociadas a marchitez y pudrición seca del cogollo, aislados de raíz y suelo, que correspondieron a tres complejos de especies de Fusarium: F. oxysporum del complejo de especies Fusarium oxysporum (FOSC), con 9 haplotipos, representó al grupo morfológico A; F. solani, F. falciforme y Fusarium sp. del complejo de especies Fusarium solani (FSSC), con 2, 2 y 1 haplotipo, respectivamente, del grupo morfológico B; y Fusarium sp. del complejo Fusarium fujikuroi (FFSC) con un haplotipo. El porcentaje de cobertura e identidad para identificación de especies fue de 98-100%, con un E-value = 0. Secuencias representativas de los dos complejos principales, FOSC y FSSC, fueron registradas en Genbank con número de accesión MH172303 y MH179126, respectivamente (Cuadro 3). El análisis filogenético con base en el gen EF-1a confirmó la identificación taxonómica de cepas y mostró claramente el nivel de variabilidad y agrupación por complejos de especies con soporte estadístico de 73-100%. Las cepas de FSSC, a excepción del A185s, se agruparon con secuencias de referencia. En FOSC, únicamente 3/14, aislados se agruparon con secuencias de referencia, el resto se agrupó en clados distintos y asociados a valores de confiabilidad bajos (Figura 3), lo cual sugiere mayor variación genética y adaptación de F. oxysporum a la diversidad regional del sistema productivo agave. El único aislado del FFSC, tanto en GenBank como filogenéticamente, se agrupó próximo a F. andiyazi pero sin corresponder a esta especie (Figura 3).

Figura 3. Imagen superior: Ejemplo de amplificación de productos PCR con gen EF-1a (760 pb). Carriles 1-21: ADN deFusariumspp. 21:F. oxysporum(control), 23: Blanco con H2O. MM: Marcador de peso molecular 1kb plus Invitrogen. Inferior: Filogenia de 25 cepas de Fusarium spp. de suelo y raíz de A. tequilana (marcados con ●) basada en el gen EF-1a, mediante Máxima verosimilitud (ML) y Kimura-2 parámetros +G con 1000 repeticiones Bootstrap. Claves texto y numeral son secuencias de referencia del GenBank.
Cuadro 3. Fuente de asilamiento e identificación molecular, con base en la secuencia parcial del gen EF-1a, de 25 cepas de Fusarium spp. seleccionadas de un acervo de 109 cepas aisladas de suelo y raíz en cuatro condiciones fitosanitarias y previamente caracterizadas morfológica y culturalmente.
| Fuente de Aislamiento | Especie/Complejox | Condición Fitosanitaria | ID aislado | Coberturay % | Identidady % | Secuencia Referencia |
|---|---|---|---|---|---|---|
| Suelo | F. oxysporum [FOSC] | Marchitez | A173s | 100 | 99 | KP964900 |
| A157s | 100 | 99 | JF740855 | |||
| A164s | 100 | 99 | JF740837 | |||
| A57s | 100 | 98 | JF740855 | |||
| Pudrición | A180s | 100 | 100 | JF740853 | ||
| A212s | 100 | 99 | JF740855 | |||
| F. solani [FSSC] | Pudrición | A174s | 100 | 99 | JF740846 | |
| Fusarium sp. [FSSC] | Pudrición | A185s | 100 | 100 | - | |
| F. falciforme [FSSC] | Improductivo | A38s | 100 | 99 | GU170631 | |
| A84s | 100 | 99 | GU170631 | |||
| Marchitez | A169s | 100 | 99 | GU170631 | ||
| A168s | 100 | 99 | GU170631 | |||
| Pudrición | A204s | 100 | 99 | GU170631 | ||
| Raíz | F. oxysporum [FOSC] | A. sano | A132a | 100 | 99 | JF740855 |
| Marchitez | A114a | 100 | 99 | JF740855 | ||
| A84a | 100 | 98 | JF740855 | |||
| A115aZ | 100 | 99 | JF740837 | |||
| A131a | 100 | 98 | JF740855 | |||
| A140a | 100 | 99 | JF740855 | |||
| A62a | 100 | 98 | JF740855 | |||
| Pudrición | A146a | 100 | 98 | JF740855 | ||
| F. solani [FSSC] | Marchitez | A103a | 100 | 98 | JF740846 | |
| A85a | 100 | 99 | EF452941 | |||
| Pudrición | A129aZ | 100 | 99 | EF452945 | ||
| Fusarium sp. [FFSC] | Marchitez | A125a | 100 | 100 | - | |
xIdentificación taxonómica de aislados de suelo y raíz a nivel de género, especie y complejo mediante caracterización morfológica y molecular con EF-1ª.
yCobertura % = Valor de cobertura en porcentaje determinado por nBLAST de NCBI usado en la identificación de cada aislado; Identidad % = Valor de identidad en porcentaje determinado por nBLAST de NCBI.
zAislados seleccionados para registró en el banco de genes de NCBI: A115a=MH172303; A129a=MH179126.

Figura 4. Frecuencia de especies/complejo en 25 cepas de Fusarium spp. seleccionadas de un acervo de 109 cepas aisladas de suelo y raíz en cuatro condiciones fitosanitarias y previamente caracterizadas morfológica y culturalmente. Verano, 2016. Los Altos, Jalisco.

Figura 5. A) Unidades Formadoras de Colonias (UFC) e Índice de Fusarium obtenidas de 28 plantaciones comerciales de agave azul en cuatro condiciones fitosanitarias de 11 municipios de Los Altos, Jalisco. Barras de error indican desviación estándar. Ausencia de barras indican una muestra por municipio (Cuadro 1). Condición sanitaria: AS= Aparentemente sano, IP = Improductivo, M = Marchitez y P = Pudrición. B-C) Ajuste de nivel máximo de índice de Fusarium a modelos Exponencial Negativo y Gregory con respecto a pH del suelo (B) y Materia orgánica (C). Verano 2016. Los Altos, Jalisco.
Prevalencia y asociación sintomatológica. El complejo F. oxysporum (FOSC) fue el más prevalente con 6/13 (46.15%) cepas de suelo y 8/12 (66.66%) de raíz, principalmente asociado con marchitez. El complejo Fusarium solani (FSSC) fue el segundo en importancia regional con F. falciforme 5/13 (38.46%) cepas aisladas únicamente de suelo, F. solani en 1/13 (7.9%) y 3/12 (25%) cepas de suelo y raíz, respectivamente, y con una cepa denotada como Fusarium sp. aislada de raíz 1/12 (8.33%). Las cepas de este complejo se encontraron asociadas en la misma proporción en plantaciones con marchitez y pudrición seca del cogollo. Dos cepas se asociaron a sitios improductivos. Del complejo Fusarium fujikuroi (FFSC), Fusarium sp. aislado de raíz, se asoció con síntomas de marchitez (Figura 4). A nivel de haplotipos por especie, i.e. variantes de secuencia intraespecíficos, F. oxysporum tuvo seis haplotipos asociados únicamente a marchitez, dos a pudrición seca y uno común a ambos tipos de síntomas; F. solani tuvo uno exclusivo a marchitez y otro común. F. falciforme, aunque tuvo un haplotipo específico a marchitez, otro haplotipo fue común y además se encontró en suelos improductivos. Las dos especies de Fusarium no identificadas a nivel de especie se asociaron con síntomas específicos de marchitez o pudrición seca. F. oxysporum tuvo en total cinco haplotipos repetidos. Cuatro asociados a diferentes municipios y síntomas lo cual fortalece la mayor condición prevalente de esta especie.
Análisis regional del Índice de Fusarium . El IF fue mayor en Atotonilco y Poncitlán con valores de 0.95 y 0.91, respectivamente, asociados a plantaciones con pudrición seca. Para marchitez, los municipios con mayor IF fueron San Ignacio C. G. y Ayotlán con valores de 0.48 y 0.45, respectivamente. Los IF más bajos (<0.25) se obtuvieron en Ayotlán, Arandas y Zapotlanejo asociados a pudrición seca, y en J. María, Poncitlán y Atotonilco para marchitez (Figura 5 A). En plantaciones con agaves aparentemente asintomáticos, IF fue 0.49 y 0.42 para Atotonilco y J. María, respectivamente; mientras que en parcelas improductivas de Cuquío, Degollado y Tepatitlán, IF estuvo en el rango 0.37-0.58. Estos resultados muestran la amplia distribución de Fusarium y el riesgo epidémico que representa. Entre los hongos totales contabilizados en muestras de suelo se encontraron géneros con capacidad antagónica y supresiva como Trichoderma spp., Penicillium spp., Bionectria spp. y Aspergillus spp.
IF tuvo una relación inversamente proporcional con pH de suelo y MO (p≤0.02). La tasa decremental de IF respecto al aumento de PH se estimó adecuadamente con el modelo exponencial negativo (b=0.83, r 2=0.71, p<.0001) y Gregory (b=4.91, r 2=0.72, p=0.0098). Con estos modelos se estimó que pH≤5.5 es inductivo a Fusarium (IF≥0.33). El Índice de Fusarium más alto (0.92) se tuvo a un pH de 4.6 y el menor (0.1) en suelos neutro-alcalinos (6.9-7.7) (Figura 5B). Con respecto a MO, la tasa estimada fue ligeramente mejor con el modelo exponencial negativo (b=0.64, r 2 =0.68, p<.0001) que con Gregory (b=1.98, r 2 =0.63, p=0.0238). Similarmente, se estimó que MO≤2.5 es inductivo a Fusarium (IF≥0.30). Así, los valores más bajos de IF≤0.2 se asociaron con MO 3.3 - 5.4 (Figura 5C). Comparando municipios contrastantes, en Atotonilco, una plantación con IF=0.95 estuvo asociada a pudrición seca con pH=6.18 y MO=3.16; mientras otra plantación asociada a marchitez tuvo IF=0.21 con pH=6.95 y MO=5.36. En J. María, una plantación asociada a pudrición seca con IF=0.51 estuvo relacionada con pH=5.57 y MO=2.34, y otra asociada a marchitez con IF=0.11 pH=6.57 y MO=2.48. Lo anterior sugiere que, aunque IF puede estar determinado por otros factores edáfico-biológicos, es posible establecer umbrales pH:MO supresivos a Fusarium (Figura 6).
Discusión
La marchitez y pudrición seca del cogollo constituyen problemas fitosanitarios de alto riesgo productivo del agave azul (Agave tequilana) en la región DOT. El manejo fitosanitario de estas enfermedades actualmente es limitado en gran parte por restricciones etiológicas y epidemiológicas (Rubio, 2007; Ramírez-Ramírez et al., 2017). En trabajos previos, la metodología etiológica ha sido regionalmente delimitada o se han enfatizado métodos morfológicos y moleculares clásicos basados en ITS con parciales resultados (Ávila-Miranda et al., 2010; Vega-Ramos et al., 2013; Ramírez-Ramírez et al., 2017). Este es el primer trabajo exhaustivo regional que involucra el enfoque de inductividad epidemiológica en la selección de 40 plantaciones comerciales en edades de estrés productivo de 3-4 años. La investigación incluyó 13 municipios de Los Altos, principal región agavera de Jalisco, con antecedentes históricos de alta intensidad epidémica a estas enfermedades (Acevedo-Sánchez et al., 2017). Adicionalmente, este trabajo diferenció muestras de suelo y raíz obtenidas a nivel de foco y perifoco provenientes de cuatro condiciones fitosanitarias predominantes: marchitez, pudrición seca del cogollo, plantaciones aparentemente sanas y parcelas improductivas. El objetivo fue maximizar y minimizar la variabilidad regional e intraparcelaria, respectivamente, en la caracterización morfológica, cultural y molecular de Fusarium spp. asociados al agave. La concepción de este enfoque considera evidencias previas de la implicación de F. oxysporum y F. solani en marchitez (Ávila-Miranda et al., 2010; Vega-Ramos et al., 2013; Ramírez-Ramírez et al., 2017) y de Fusarium sp. en pudrición seca (Gómez-Ortiz et al., 2011) y se planteó asumiendo la asociación de un complejo de Fusarium spp. con adaptabilidad parasítica interespecífica, regional y sintomatológica, contrastante. Este trabajo demostró la asociación de cinco especies con síntomas de marchitez y/o pudrición seca ubicadas en tres complejos filogenéticos: F. oxysporum del complejo de especies Fusarium oxysporum (FOSC) con 56% de representatividad regional (46.2% suelo y 66.7% raíz); F. solani, F. falciforme y Fusarium sp. del complejo Fusarium solani (FSSC) (40%); y Fusarium sp. del complejo Fusarium fujikuroi (FFSC) (4%). Por primera vez se reporta la asociación de F. falciforme, única especie vinculada a plantaciones con marchitez, pudrición seca e improductivas, y dos especies aún sin identificar, una de ellas perteneciente a un complejo sin especies previamente reportadas en agave (FFSC).

Figura 6. Relación de pH y MO en función al Índice de Fusarium. El recuadro muestra potencial umbral pH:MO asociado a bajos niveles de IF. El tamaño del círculo es proporcional al valor de IF. Verano 2016. Los Altos, Jalisco.
Aislamientos de raíz y suelo permitieron analizar la consistencia de resultados al asociar al hongo directamente con tejido del hospedante. F. falciforme y Fusarium sp. (FSSC) fueron los únicos que se aislaron exclusivamente de suelo. Sin embargo, el primero se ha encontrado en tejido aéreo de agave en otras regiones de Jalisco (CP-LANREF. Datos no publicados). El análisis de secuencias y filogenia confirmó la variabilidad intra e interespecífica de Fusarium y la asociación de haplotipos, referidos aquí como variantes de secuencia intraespecíficos con base en el gen EF-1a, con síntomas específicos. Claramente, marchitez se asoció con más haplotipos específicos a este síntoma pertenecientes a F.solani, F. falciforme y F. oxysporum. Este último fue la especie más diversa e incluyó el único haplotipo asociado exclusivamente a pudrición seca y el único encontrado en plantaciones aparentemente sanas. La existencia de un haplotipo, por complejo de especies, asociado únicamente con pudrición seca o con la capacidad de causar los dos tipos de síntomas sugiere un proceso interespecífico de evolución divergente con adaptación a síntomas aéreos, siendo marchitez la condición parasítica asociada a la especie(s) ancestral. La ocurrencia de dos especies no identificadas puede implicar procesos avanzados de especiación o la existencia, menos probable, de procesos de evolución convergente. La viabilidad de estos procesos genéticos poblacionales es posible considerando la continuada y confinada cultivación del agave por más de 200 años en región DOT y la condición semiperenne del cultivo con propagación vegetativa. Estos mecanismos adaptativos se han sugerido en cultivos como el mango (Mangifera indica) ante la creciente variabilidad y ocurrencia de nuevas especies de Fusarium (Liew et al., 2016). Con este contexto, se concluye que la marchitez y la pudrición seca del cogollo del agave son expresiones sintomatológicas de un síndrome causado por diferentes especies de Fusarium con adaptabilidad parasítica diferencial a nivel intra e interespecie. La marchitez y pudrición seca puede ser causada por un mismo aislado (haplotipo) de F. oxysporum, F. solani y F. falciforme pero no son los más prevalentes, lo que explica la baja incidencia de ambos síntomas en la misma planta. Estas mismas especies tienen en conjunto un mayor número de aislados (haplotipos) especializados únicamente en marchitez siendo congruente con su alta intensidad epidémica regional. Esta conclusión requiere posteriores estudios de patogenicidad y epidemiología especializados, ampliar otras regiones agaveras DOT, muestreo de tejido aéreo, incluir mayor acervo de secuencias, y el empleo de otros genes como los asociados a RPB1 y RPB2 (O’Donnell et al., 2015). Sin embargo, estos resultados coadyuvan a mejorar estrategias de control y monitoreo regional al clarificar la etiología de los tres tipos de pudrición del cogollo (Gómez-Ortiz et al., 2011; Jiménez-Hidalgo et al., 2004; Rincón-Enríquez et al., 2014; Coria-Contreras et al., 2019). Al respecto, en este trabajo y el realizado con mancha gris a nivel estatal (Coria-Contreras et al., 2019), la pudrición bacteriana no fue detectada lo que supone su extremada baja prevalencia u ocurrencia en condiciones agronómicas y climáticas muy específicas (Jiménez-Hidalgo et al., 2004; Rincón-Enríquez et al., 2014).
Estudios etiológicos regionales, además de un enfoque epidemiológico (Ceja-Torres et al., 2008), requieren de estrategias metodológicas que permitan optimizar tiempo, recursos económicos y aporten a un marco racional de análisis. Este trabajo mostró la importancia de combinar estrategias morfológicas y culturales clásicas con el enfoque molecular actual (Leslie y Summerell, 2006; O’Donnell et al., 2015; Gogoi et al., 2017). La caracterización de un total de 109 aislados regionales de Fusarium, en cinco medios de cultivo, permitió categorizar por grupos y finalmente seleccionar el acervo de cepas representativas para identificación molecular (Burgess et al., 1991; Leslie y Summerell, 2006). La colorimetría micelial, importante atributo discriminante para Fusarium en PDA (Gogoi et al., 2017), resultó fundamental como fase inicial debido al gran acervo de siembras iniciales en Komada (248). Por otro lado, debido a la complejidad del problema etiológico de este trabajo, la región ITS no fue funcional para la identificación de Fusarium.Vetrovsky y colaboradores (2016) indican que esta región no es adecuada por su alta variabilidad, su naturaleza multicopia y su longitud tan variable. Adicionalmente, ITS es una región altamente conservada para resolver límites interespecíficos de Fusarium. Por lo anterior, se estima que 50% de secuencias Fusarium o más, están incorrectamente identificadas en NCBI (O’Donnell et al., 2015). Estos aspectos son fundamentales desde le perspectiva etiológica y genética poblacional debido a la relevancia actual de Fusarium. En México, recientes estudios demuestran la importancia de este género en cultivos como Jatropha curcas, Capsicum pubescens y Citrus sinensis (Herrera-Parra et al., 2017; Almaraz-Sánchez et al., 2019; Parra-Cota et al., 2019).
Aunque el Índice Fusarium (IF) fue altamente variable entre municipios y condición fitosanitaria de plantación, IF se propone como indicador para relacionar riqueza de hongos respecto a Fusarium spp. para estimar la condición supresiva del suelo bajo la premisa que el manejo sustentable de Fusarium, hongo con alta capacidad saprobiótica-parasítica, se debe basar en la prevención promoviendo la salud del suelo. La variabilidad IF puede explicarse por su determinante multifactorial como lo evidenció la relación inversamente proporcional con pH y MO (r 2 = 0.72 - 0.68). El efecto inductivo de poblaciones de Fusarium con pH ácido se ha reportado en Fusarium oxysporum f. sp. cubense (Huang et al., 2019) y Fusarium oxysporum f. sp. fragariae. En este caso, pH menor a 5.2 fue más inductivo (Fang et al., 2012). Similarmente, un suelo rico en MO (i.e. mayor a 3%) es una condición ampliamente aceptada de suelos supresivos que favorece poblaciones de microorganismos que compiten o inhiben el desarrollo de Fusarium spp. (Orr y Nelson, 2018; Huang et al., 2019). En esta investigación, Trichoderma spp. y Bacillus spp. frecuentemente se asociaron a plantaciones con bajo IF (CP-LANREF. Datos no publicados) lo que demuestra la necesidad de estudios integrales regionales. La propuesta de umbrales pH:MO en este trabajo tiene potencial para estimar riesgos productivos por Fusarium spp. en agave.
La diversidad, complejidad y prevalencia de especies de Fusarium en plantaciones comerciales de Los Altos y los impactos productivos históricos causados por este hongo estimula investigar el síndrome marchitez y pudrición seca del cogollo desde una perspectiva sistémica, en la cual se considere el modelo planta-patógeno en relación a variables físico-químicos del suelo, riqueza biológica de antagonistas, factores climáticos y tipologías productivas. La comprensión sistémica permitirá desarrollar estrategias de manejo preventivas efectivas y sustentar la salud del suelo. Así mismo, coadyuvará a estimar y mitigar riesgos asociados a Fusarium spp. debido a la intensa movilización de hijuelos requerida por el incremento de superficie plantada ante la demanda de exportación de tequila, actualmente en quinto lugar en generación de divisas. El cultivo de agave azul constituye una cadena productiva que justifica inversión en investigación e innovación que garantice su rentabilidad y preservación socio-cultural y ambiental.
Conclusiones
Esta investigación aporta por primera vez información etiológica exhaustiva asociada a la marchitez y pudrición seca del cogollo de agave azul (A. tequilana) en 40 plantaciones comerciales de 13 municipios de Los Altos, Jalisco. La caracterización morfológica, cultural y molecular de aislados de Fusarium spp. asociados a estos síntomas permite unificarlos como expresiones de un síndrome causado por cinco especies de Fusarium pertenecientes a los complejos F. oxysporum (FOSC), F. solani (FSSC) y F. fujikuroi (FFSC). Se propone denominar marchitez y pudrición seca del cogollo del agave a esta enfermedad. La marchitez y pudrición seca puede ser causada por un mismo aislado (haplotipo) de F. oxysporum, F. solani y F. falciforme pero, contrario a los que causan únicamente marchitez, no fueron los más prevalentes. F. oxysporum fue el más variable y prevalente en suelo (46.2%) y raíz (66.7%) sugiriendo mayor adaptabilidad parasítica. F. falciforme y dos especies sin identificar de los complejos FSSC y FFSC se reportan por primera vez asociados al agave. Aunque, estos resultados requieren mayor precisión mediante estudios epidemiológicos y de patogenicidad, el carácter extensivo de este trabajo confiere claras tendencias etiológicas. El Índice Fusarium (IF) tiene potencial como indicador de riqueza de hongos respecto a Fusarium spp. para estimar la condición supresiva del suelo. IF tuvo una relación significativa inversamente proporcional con pH y MO, lo que permite proponer umbrales integrados para estimar riesgos productivos por Fusarium. Finalmente, considerando la campaña oficial contra plagas del agave, estos resultados justifican el empleo de escalas diagramáticas independientes para marchitez y pudrición seca del cogollo con fines de monitoreo. Sin embargo, se recomienda la inclusión de algoritmos en el sistema digital SIVEA para automatizar el análisis la incidencia regional del síndrome por tipología de síntoma con propósito de análisis de riesgo.











 texto en
texto en 


