México ocupa el segundo lugar y participa con el 21% de la producción en el mundo de limón mexicano (Citrus aurantifolia) y lima persa (Citrus latifolia), con una producción de 627.4 miles de t (FAOSFAT, 2018), donde el 70% del total se destina al mercado nacional y el resto al mercado de exportación, principalmente a los Estados Unidos de América. En el 2016 se tuvo una producción de 2’439,477 t de lima persa, destacando Veracruz (717,014 t), Michoacán (619,612 t) y Oaxaca (263,448 t); Morelos ocupa el doceavo lugar con una producción de 3,880 t y actualmente cuenta con 612 ha plantadas en 17 municipios, donde destaca el limón (32%) y la naranja Valencia (66%) de la superficie total establecida y, un rendimiento de 12.1 y 7.7 t ha-1 respectivamente (SIAP, 2018).
No obstante, los árboles de lima persa presentan enfermedades fungosas en raíces, tronco, follaje y frutos, que causan pérdidas al cultivo (Christensen, 2017). En Morelos se asumía que la muerte de árboles era ocasionada por la gomosis (Phytophthora parasitica), debido a que fue reportada en los estados de Colima y Tabasco, causando síntomas de secreción de goma y pudrición del pie, llegando a ocasionar la muerte de árboles de cítricos de pie franco e injertado, provocando la eliminación de huertas (Acosta-Pérez et al., 2012; Vidales 1982). No obstante, existen varios géneros de hongos de la familia Botryosphaeriaceae considerados como patógenos endófitos muy agresivos, que a menudo matan gran parte de su hospedante después del daño físico, generalmente cuando se encuentra en estrés, otros síntomas que causan son manchas foliares, pudriciones de frutas, muerte descendente, gomosis, cancros perennes y finalmente la muerte en especies económicamente importantes de cultivos perennes leñosas y plantas ornamentales, así como especies de árboles forestales nativas e introducidas (Mohali et al., 2007; Slippers and Wingfield, 2007).
Estudios recientes citan a especies del género Lasiodiplodia causando enfermedades en el trópico en cultivos importantes como cacao (Theobroma cacao), aguacate (Persea americana), papaya (Carica papaya), caucho (Hevea brasiliensis), chirimoya (Annona cherimola), durazno (Prunus persica), caña de azúcar (Saccharum officinarum), uvas (Vitis vinifera) y cítricos (Picos-Muñoz et al., 2015). Valle-De la Paz et al. (2019) reportan la presencia de al menos tres especies del género Lasiodiplodia (L. theobromae, L. citricola y L. pseudotheobromae), causando gomosis, muerte descendente de ramas y la muerte de árboles de lima persa en Morelos. Sin embargo, se desconoce la distribución e impacto de estos patógenos en huertas comerciales de lima persa en la entidad. Por lo tanto, el objetivo fue determinar la distribución, incidencia y severidad de la muerte descendente ocasionada por el complejo de especies de Lasiodiplodia spp., en plantaciones de lima persa en Morelos.
Se realizó un muestreo en 46 huertos de lima persa en el período de septiembre de 2014 a agosto del 2015 (Figura 1). Para la identificación de las especies por Valle-De la Paz et al. (2019) se tomaron 46 muestras de ramas primarias, secundarias y troncos con síntomas de la enfermedad, de los que se obtuvieron 15 aislamientos monospóricos, los cuales fueron resembrados en medio V8-Agar. La identificación morfológica a nivel de género se realizó con claves y descripciones taxonómicas de Phillips et al. (2013).
La identificación molecular se realizó a partir de ADN genómico (ADNg), obtenido de micelio por el método AP descrito por Sambrook y Russell (2012). Los cebadores empleados fueron ITS5 e ITS4 de los genes ribosomales (ADNr). El análisis de las muestras fue corroborado mediante PCR tradicional de acuerdo al protocolo descrito por Ahrens y Seemüller (1992), con modificaciones en los componentes según Sambrook y Russell (2012). La calidad se evaluó por electroforesis horizontal en gel de agarosa al 1% (Ultrapure, Gibco, USA) y las bandas se visualizaron en un transiluminador (Gel Doc 2000, BIO RAD®, USA). La concentración de ADN se cuantificó con un espectrofotómetro NanoDrop 2000 (Thermo Scientific®). Los fragmentos de ADN amplificados por PCR fueron purificados con el kit Wizard (Promega®, USA), siguiendo el protocolo del fabricante. El producto de PCR purificado fue secuenciado en ambas direcciones por Macrogen Inc. (Seoul, Korea del Sur). Las secuencias fueron ensambladas y editadas con la opción CAP (Contig Assembly Program) del Software BioEdit v7.0.9.1. Las secuencias de hongos fueron comparadas y depositadas en la base de datos del GenBank. Los árboles filogenéticos fueron construidos con los datos de las terminaciones de ITS5 e ITS4, además se analizaron con el software MEGA (Molecular Evolutionary Genetics Analisys) versión 7.0.14 (Tamura et al., 2007), alineadas con ClustalW 1.8.1 (Thompson et al., 1994) y comparados con las secuencias de genes homólogos depositados en la base de datos de la National Center for Biotechnology Information. Después de analizar la congruencia entre los conjuntos de datos, se hizo un análisis de máxima parsimonia (MP), se realizaron los análisis filogenéticos en PAUP (Phylogenetic Analysis Using Parsimony) versión 4.0b10 (Swofford, 2003). Los árboles filogenéticos se obtuvieron con la función de búsqueda heurística con 1,000 repeticiones de adición aleatoria, bisección y reconstrucción de árboles (TBR) como algoritmo de intercambio de ramas y los espacios o datos faltantes fueron considerados deleciones completas (Kimura, 1980; Hillis y Bull, 1993). La secuencia HQ231345 de Phoma tracheiphila de GenBank se utilizó como el taxón fuera de grupo.
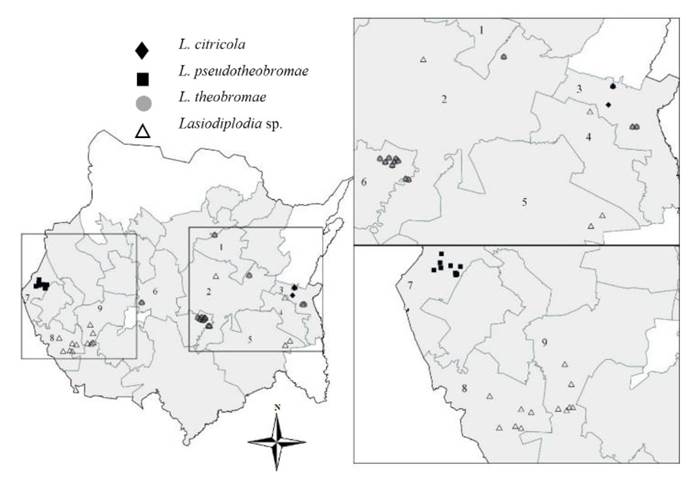
Figura 1 Distribución de especies de Lasiodiplodia en huertas de lima persa (Citrus latifolia) cultivadas en Morelos, México. Municipios muestreados= 1: Cuautla; 2: Ayala; 3: Jantetelco; 4: Jonacatepec; 5: Tepalcingo; 6: Tlaltizapán de Zapata; 7: Coatlán del Río; 8: Amacuzac; 9: Puente de Ixtla. Polígonos en blanco no registran superficie de cítricos.
La incidencia se evaluó con la metodología propuesta por Acosta-Pérez et al. (2012), seleccionando cinco hileras de cada huerto, 4 a 21 árboles por hilera y un total de 21 a 50 árboles por huerto. El porcentaje de incidencia se determinó dividiendo el número de plantas enfermas entre el total de plantas evaluadas y multiplicadas por 100. La severidad se evaluó mediante escala propuesta por Orozco-Santos (1995) y modificada por Valle-De la Paz, que consta de cuatro clases, donde 0= árbol sano, 1= presencia de exudaciones de goma en tronco principal o en ramas primarias y secundarias, 2= agrietamiento visible, exposición de tejidos internos, en tronco principal o en ramas primarias y secundarias y 3= presencia de cancro bien definido y muerte descendente de ramas (Figura 2). La severidad se transformó a porcentaje de infección (% PI) con la fórmula de Townsend y Heuberger (1943). A los datos se les aplicaron las pruebas de normalidad (Shapiro-Wilk) y homogeneidad de varianza (Levene y Bartlett) y como no se ajustaron a dichos principios, el análisis se realizó con estadística no paramétrica, utilizando la prueba de Kruskall Wallis y la comparación de medias con la prueba de Tukey (α=0.05) y p< 0.0001.
Los síntomas observados en árboles de lima persa en Morelos son rajaduras en tallo, exudaciones de goma (Figura 2 B), cancros en la base del tallo (Figura 2 E), agrietamiento visible con exposición de tejidos internos (Figura 2 C), amarillamiento del follaje, muerte descendente de ramas y necrosis descendente en ramas con presencia de puntos negros (Figura 2 D), que corresponden a los cuerpos fructíferos (picnidios) del patógeno (Figura 3 E y F). La enfermedad descendió a la base de la rama anual e invadió las ramas secundarias, lo cual coincide con Khanzada et al. (2004), quienes reportan que en plantas afectadas las ramas nuevas comienzan con una marchitez, posteriormente las hojas se tornan de color marrón y sus márgenes se doblan hacia arriba, se secan y caen. En condiciones severas las ramas se secan una tras otra en secuencia, resultando en la muerte de todo el árbol.

Figura 2 Síntomas y niveles de daño de muerte descendente en árboles de lima persa en Morelos. A) 0: Árbol sano; B) 1: Presencia de exudaciones de goma en tronco principal o en ramas primarias y secundarias; C) 2: Agrietamiento visible con exposición de tejidos internos; D y E) 3: Muerte descendente de ramas y cancro bien definido.
Algunos de estos síntomas son similares a los que ocasiona P. parasitica, particularmente la secreción de goma y formación de cancros (Acosta-Pérez et al., 2012; Vidales, 1982), mientras que Lasiodiplodia spp. causa muerte descendente de ramas y la formación de picnidios, adicionalmente los tejidos vasculares de ramas muertas se tornan de color marrón (Figura 2). Valle-De la Paz et al. (2019) con base a caracteres morfológicos identificaron el género Lasiodiplodia sp. El análisis molecular determinó agrupamiento de cuatro clados; uno con 11 aislamientos a género Lasiodiplodia sp. y tres clados a especies, un aislado alineó para Lasiodiplodia citricola, otro para L. pseudotheobromae y dos para L. theobromae (Figura 3).
En la Figura 1 se presenta la distribución de las especies de Lasiodiplodia, describiéndose por municipio muestreado: Cuautla (Lasiodiplodia sp., y L. theobromae), Tlaltizapán de Zapata (Lasiodiplodia sp. y L. theobromae) y Jantetelco (Lasiodiplodia sp., L. citricola y L. theobromae). Mientras que en Coatlán del Río sólo se encontró a L. pseudotheobromae; en Ayala, Jonacatepec, Tepalcingo, Amacuzac y Puente de Ixtla se identificó a Lasiodiplodia sp. La especie predominante fue L. theobromae con 28.57 %, seguido de L. pseudotheobromae con 16.07% y finalmente L. citricola con 3.57%. En el 51.78% de los huertos muestreados se encontró a Lasiodiplodia sp. lo cual indica la probable presencia de especies nuevas.
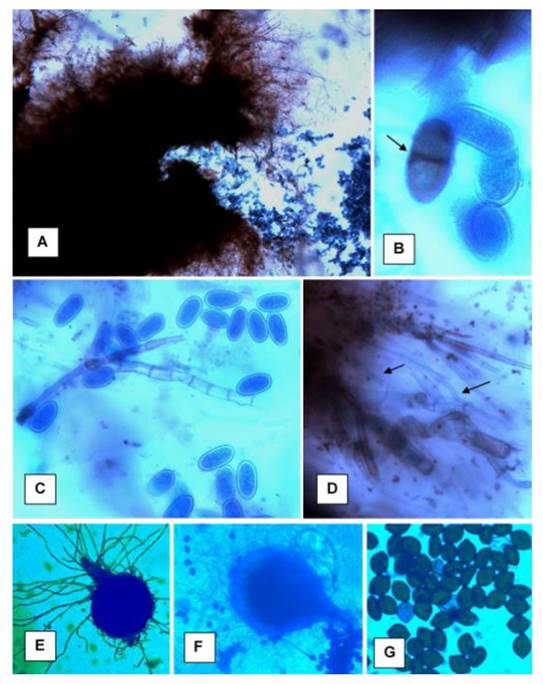
Figura 3 Estructuras de Lasiodiplodia theobromae, L. pseudotheobromae y L. citricola en medio PDA. A) Conidio de L. theobromae; B) didimospora madura y amerosporas inmaduras de L. theobromae; C) conidios inmaduras (amerosporas) de L. pseudotheobromae; D) paráfisos de L. pseudotheobromae; E y F) picnidios y conidios de L. citricola; G) conidios de L. citricola. Fotografías tomadas en Microscopio óptico (A, F y E) 10 X; B, C, D y G) 100 X.
Las pruebas de medias de la incidencia de la muerte descendente se separaron en 18 grupos, con diferencias estadísticas entre ellos. En el grupo A se ubicaron huertos con mayor porcentaje de incidencia, que fue de 96.7 a 100 %, estos se ubicaron en los municipios de Jonacatepec (1 huerto), Coatlán del Río (2), Tlaltizapán de Zapata (2) y Cuautla (1). En los siguientes 10 agruparon los huertos que presentaron una incidencia de media a alta, con porcentajes de 55.4 a 88.1%, ubicándose en los municipios de Jantetelco (2 huertos), Coatlán del Río (4), Amacuzac (3), Tlaltizapán de Zapata (3), Puente de Ixtla (4), Tepalcingo (3) y Ayala (1). En el grupo EDHIGCF se agruparon huertos donde la incidencia fue media de 48.1 a 49.2%, con ubicación en los municipios de Amacuzac (1), Puente de Ixtla (1 huerto) y Jantetelco (2). Seguido de cinco grupos donde la incidencia se presentó de media a baja de 44.3 a 23.8%, ubicándose en los municipios de Coatlán del Río (2), Jantetelco (1), Tlaltizapán de Zapata (3) y Ayala (1). Finalmente, en el grupo I se tuvieron los huertos que presentaron la menor incidencia de la enfermedad con 11.9 a 25.4% y se ubicaron en los municipios de Tlaltizapán de Zapata (3 huertos), Ayala (2), Amacuzac (3) y Coatlán del Río (1) (Figura 6).
La enfermedad presentó porcentajes de incidencia de 49 a 100%, en 37 de los 46 huertos evaluados, de los cuales el 78% de huertos presenta incidencias que oscilan del 31.8 al 100% (Figura 6), es decir que se observa en todas las áreas productoras de lima persa del estado de Morelos, donde se detectaron factores como la edad de la planta, manejo agronómico, podas, fertilización, etc., que predisponen su presencia; sin embargo es importante destacar que los municipios de Coatlán del Río y Tlaltizapán de Zapata están localizados en la parte sur-poniente del estado de Morelos, donde predomina un clima cálido, integrado por la prolongación de la zona de pie de monte. El centro de la entidad conjuntamente con la montaña sur constituye el 60% de la superficie estatal, donde se logran temperaturas medias anuales de 22 a 26°C, temperaturas máximas de 34°C y lluvias predominantes en los meses de verano e invierno hasta de 900 mm (INEGI, 2018).
El municipio con menor porcentaje de incidencia de la enfermedad fue Coatlán del Río (11.97 %) y se localiza al sur poniente del estado, colindando con Guerrero y el Estado de México, caracterizado por un clima subhúmedo con lluvias en verano y en invierno A (W) es el predominante. También se tienen microclimas como el subtropical húmedo y el caluroso tropical con invierno indefinido. La precipitación promedio es de 1,000 milímetros anuales, con temperaturas máximas de 34 °C, la media 24 °C y la mínima 14 °C. (Enciclopedias municipios y delegaciones de México, 2018). Estas condiciones meteorológicas influyen en la infección y desarrollo de la enfermedad. En este sentido, Picos-Muñoz et al. (2015) manifestaron que humedades relativas y temperaturas altas favorecen la aparición de este hongo. Además, plantearon que puede causar importantes pérdidas económicas sobre todo en frutales. Reportan que la fuente de infección son la presencia de plantas enfermas y restos de poda que quedan tirados en el campo, además, es favorecida por altas temperaturas, lluvias y humedad proporcionada por el riego, este factor favorece la expulsión de las esporas de los picnidios y se acumulen en la atmósfera que rodea el cultivo y suelo (Muhammad, 2009).
La muerte descendente de árboles frutales susceptibles a la enfermedad puede resultar de la interacción de este patógeno con estrés hídrico, suelos arcillosos, escasa materia orgánica, elevada cantidad de caliza activa, fertilización inadecuada, exceso de riego, alta humedad por sombra excesiva, quemadura de sol, presencia de heridas por causas naturales o por el uso de herramientas de corte en la cosecha, podas y suelos compactados alcalinos que complican el desarrollo radicular, nutrición y aireación (Agustí, 2003; Ko et al., 2004).
Las pruebas de medias de la severidad de la muerte descendente se separaron en 30 grupos, con diferencias estadísticas entre ellos (Figura 6). La severidad más alta (100%), se encontró en huertos ubicados en los municipios de Tlaltizapán de Zapata (1 huerto) y Coatlán del Río (1), los cuales fueron significativamente diferentes a todos los huertos, correspondiendo al grupo A. En los siguientes 14 grupos se agruparon los municipios con porcentajes que van de 55.5 a 95% en los siguientes municipios Tepalcingo (1 huerto), Puente de Ixtla (3), Ayala (1), Coatlán del Río (5), Tlaltizapán de Zapata (3), Amacuzac (3), Jonacatepec (1), Jantetelco (2) y Cuautla (1) (Figura 4). Enseguida se presenta el grupo KEJMIHLGN con una severidad medias de 50.5 con un huerto del municipio de Tepalcingo (1), en seguida con 13 grupos presentaron porcentajes de infección de 9.8 a 43.3% en municipios de Jantetelco (2 huertos), Puente de Ixtla (2), Coatlán del Río (2), Amacuzac (4), Tlaltizapán de Zapata (5) y Amayuca (1) (Figura 5). Por último, en el grupo Q se agruparon dos huertos del municipio de Tlaltizapán de Zapata, los cuales fueron significativamente diferentes con un porcentaje de severidad de 3.7 a 5.08 %. Las agrupaciones anteriores, indica que más del 71 % de los huertos evaluados, presentan severidades que van del 30.0 al 100% de porcentaje de infección de la enfermedad (Figura 6).
Rodríguez (2010) señala que la actividad del hongo se ve favorecida por temperaturas de 24 ±26 ºC. Mientras que Almaguer et al. (2015) coinciden en que especies de Lasiodiplodia son comunes en los trópicos y causan varias enfermedades en etapas de cultivo como en postcosecha, como L. theobromae que afecta a principalmente frutales, donde las lluvias y el viento son factores que determinan la dispersión de las esporas dentro de las áreas de cultivo.
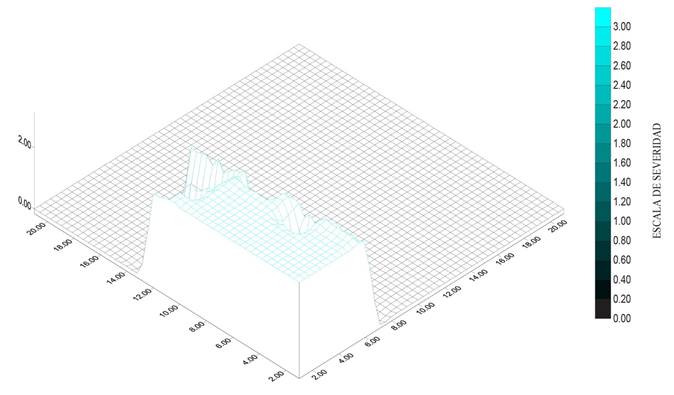
Figura 4 Severidad (2.4.) de muerte descendente en lima persa (Citrus latifolia) en un huerto de Coatlán del Río, Morelos.
Los resultados del estudio corroboran que la mayor severidad de daños producidos por Lasiodiplodia spp, ocurren en los municipios ubicados en el Sureste del estado (Figura 1), caracterizado por un clima semicálido, con precipitaciones de 800 mm y temperatura media anual de 24°C, donde los suelos tienen una gran afluencia de aguas subterráneas lo que puede ser determinante para la diseminación rápida de este patógeno, como ocurre con otros patógenos en suelos arcillosos. Previo a este estudio Acosta-Pérez et al. (2012) señalaron, que, en plantaciones de C. latifolia, existía una nueva enfermedad con síntomas externos similares a la gomosis y que los productores equivocadamente estaban manejando como tal. Esta enfermedad estuvo presente en el 44% de las plantaciones de C. latifolia con una incidencia promedio de 10.2% e intervalo de 1.7 a 25.0%. La disminución de la superficie de cítricos ha sido atribuida entre otros factores a los daños por Phythophthora (Acosta-Pérez et al., 2012; Sosa et al., 2015; Vidales, 1982). Sin embargo, estos resultados preliminares, exponen una afectación creciente, con daños hasta grado 3, con presencia de cancro y muerte descendente de ramas, atribuibles a varias especies de Lasiodiplodia. La muerte descendente se presenta con diferentes intensidades en el estado de Morelos y dentro de los mismos municipios, lo que demuestra que Morelos cuenta con las condiciones adecuadas tanto de temperatura y humedad, idóneas para el desarrollo de esta enfermedad, aunado al mal manejo por parte del productor, lo que desencadena el desarrollo y la propagación de la enfermedad.
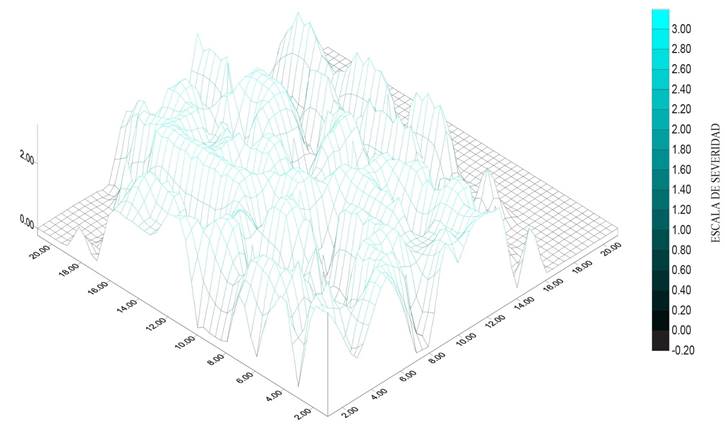
Figura 5 Severidad (1.6) de muerte descendente en lima persa (Citrus latifolia) en un huerto del municipio de Puente de Ixtla, Morelos.
Se concluye que la muerte descendente es una enfermedad que se encuentra asociada a varias especies de Lasiodiplodia tales como: Lasiodiplodia citricola, L. pseudotheobromae y L. theobromae, las cuales atacan seriamente a los árboles de lima persa, presentando incidencias y severidades altas en los huertos de cítricos del estado de Morelos, encontrándose presente en el 100% de las huertas evaluadas, lo cual refleja la importancia de esta enfermedad en la reducción de la rentabilidad del cultivo.











 texto en
texto en 



