El jitomate (Solanum lycopersicum L.) es una de las hortalizas de mayor relevancia económica y agroalimenticia (Blancard, 2012). México es el noveno productor a nivel mundial (FAOSTAT, 2017), sin embargo, la producción es comprometida por enfermedades inducidas por hongos, bacterias, virus y nematodos (Blancard, 2012). Los nematodos más problemáticos en el cultivo son los agalladores Meloidogyne spp. y Nacobbus aberrans sensu lato (Cristóbal-Alejo et al., 2006; Blancard, 2012). En México, N. aberrans s.l. afecta principalmente a cultivos de chile (Capsicum annuum L.), jitomate (S. lycopersicum L.) y frijol (Phaseolus vulgaris L.) (Manzanilla-López et al., 2002; Reid et al., 2003). El nematodo induce el agallamiento de raíces, dificultando la absorción de agua y nutrimentos, lo que deriva en la reducción del sistema radical, clorosis, enanismo y marchitez; y al igual que otros nematodos, su manejo comprende el uso de nematicidas sintéticos (Manzanilla-López et al., 2002; Hallmann y Meressa, 2018).
El estudio de alternativas ecológicas para el manejo de nematodos fitoparásitos es de interés para contribuir a la reducción del uso de nematicidas químicos y por ende de los efectos negativos que tienen en la salud humana y el entorno ambiental. Estas alternativas comprenden el uso de biocontroladores, enmiendas orgánicas, resistencia genética, entre otros (Manzanilla-López et al., 2002; Hallmann y Meressa, 2018). El aprovechamiento del fondo genético de parientes silvestres (PS) de cultivos en los sistemas agrícolas está bien documentado (Sánchez-Peña et al., 2006; Hajjar y Hodgkin, 2007). Los PS involucran a los progenitores de los cultivos y a especies más o menos relacionadas, los cuales por sus altos niveles de diversidad genética son promisorios como fuentes de resistencia a plagas y enfermedades (Hajjar y Hodgkin, 2007). Son varios los PS de jitomate que se han reportado como resistentes a fitopatógenos (Grandillo et al., 2011); por ejemplo, la resistencia a M. incognita, M. javanica y M. arenaria es principalmente conferida por los genes Mi, característica que fue transferida a jitomate desde su pariente silvestre S. peruvianum (L. peruvianum) (Yaghoobi et al., 1995). Se ha demostrado que los genes Mi no son efectivos contra N. aberrans s.l., y en estudios exploratorios no se han encontrado fuentes confiables de resistencia contra este nematodo en jitomate (Veremis et al., 1997; Cabrera et al., 2017). En México, el jitomate silvestre (S. lycopersicum var. cerasiforme) crece bajo condiciones inhóspitas y comúnmente es considerado como arvense en los cultivos. En Michoacán son localmente conocidos como “tinguaraques”, y algunas poblaciones son tolerantes al estrés hídrico y a ciertas plagas y enfermedades (Sánchez-Peña et al., 2006; Álvarez-Hernández et al., 2009). A la fecha, no existen estudios sobre el desarrollo de N. aberrans s.l. en estos genotipos michoacanos. Por tanto, el objetivo del presente trabajo fue conocer la respuesta de cinco poblaciones locales de JS y una variedad cultivada a la inoculación con juveniles de segundo estadio de este nematodo.
Las semillas de jitomate silvestre (JS) provinieron de frutos recolectados en los municipios de Jiquilpan (19° 59’ 5’’ N, 102° 42’ 2’’ W), y Villamar: Los negritos (20° 03’ 28’’ N, 102° 36’ 29’’ W), El platanal (20° 03’ 43’’ N, 102° 35’ 55’’ W), y Emiliano Zapata (19° 58’ 47’’ N, 102° 37’ 12’’ W) (ubicados en la Ciénega de Chapala “región Michoacán”), los frutos fueron de tamaño pequeño según la clasificación descrita por Álvarez-Hernández et al. (2009). Las poblaciones se denominaron como TGM-J, TGM-N, TGM-P, TGM-B y TGM-Z. Las semillas se desinfectaron superficialmente con NaClO al 1% y se germinaron a 25±1 °C. Como referencia de susceptibilidad a N. aberrans s.l. se incluyó al cv. Río grande (cvRG) como control. Las plántulas se trasplantaron en macetas conteniendo arena esterilizada y se mantuvieron en una cámara de crecimiento a 27±1 °C con un fotoperiodo de 14 h luz. El riego se realizó cada 24 h, y la fertilización quincenalmente con NitrofoskaTM 12-12-12 (3.1 g por litro de agua). Para la inoculación de las plantas con N. aberrans s.l., el inóculo se obtuvo de raíces agalladas de jitomate (cultivo monoxénico) (población del Colegio de Postgraduados Campus Montecillo, Estado de México, México) (Villar-Luna et al., 2017). La extracción de huevos se realizó según Hussey y Barker (1973), y la obtención de J2 fue con la técnica de Baermann usando placas de Petri e incubando los huevos en agua esteril a 25±1 °C. La inoculación con J2 se realizó cuando las plantas cumplieron 25 días de edad. Para contabilizar los nematodos en el interior de las raíces, éstas se tiñeron por el método hipoclorito de sodio-fucsina ácida (Byrd et al., 1983), se registró el número de nematodos por raíz (NNR) y los estadios juveniles y adultos bajo un microscopio óptico (10x) (Zeiss Primo Star, Germany). El índice de agallamiento se evaluó según una escala de 0-5: 0: raíces sin agallas; 1: 1-20 % de agallamiento; 2: 21-40%; 3: 41-60%; 4: 61-80%; y 5: 81-100% (Oka et al., 2009). Para determinar el número de huevos, de cada raíz se realizó la extracción según Hussey y Barker (1973), y se contabilizaron bajo un microscopio estereoscopio (Zeiss, Germany).
Se establecieron tres experimentos independientes y el diseño experimental fue completamente al azar. En los experimentos 1 y 2 se evaluaron los tratamientos: 1) JS (TGM-J), y 2) cvRG, ambos inoculados con N. aberrans s. l.. El primer experimento (E1) comprendió trece plantas de cada genotipo, las cuales fueron crecidas en macetas con 75 cm3 de arena e inoculadas (1000 J2/planta). A los 21 días posteriores a la inoculación (dpi) se evaluó el NNR (n=5 plantas), y a 45 dpi se registró el índice de agallamiento de raíces (n=8 plantas). El segundo experimento (E2) también comprendió trece plantas de cada genotipo, cada una de ellas se inoculó con 300 J2, y las evaluaciones se realizaron a 7 y 21 dpi (NNR) (n=4 plantas), y a 60 dpi (número de agallas y huevos) (n=5 plantas). En E2, las plantas fueron crecidas en macetas con 25 cm3 de arena y a 21 dpi fueron trasplantadas por segunda vez en macetas con 75 cm3 (para permitir un mejor desarrollo de raíces). En el experimento 3 (E3), los tratamientos consistieron de cinco genotipos: TGM-J, TGM-N, TGM-P, TGM-B, TGM-Z, y cvRG; las plantas se crecieron en macetas de 25 cm3, el nivel de inoculo fue de 500 J2 por planta, y a 60 dpi se evaluó el número de agallas por gramo de raíz (n=5 plantas). Los datos del número de nematodos, agallas y huevos fueron transformados a log10 (x + 1), se sometieron a un análisis de varianza (ANOVA), y de comparación de medias con el método de Tukey (p≤0.05) utilizando el programa SAS versión 9.0 (SAS Institute Inc., 2002).
En raíces de todos los genotipos de jitomate, los juveniles observados correspondieron a los estadios J2, J3 y J4 en los distintos tiempos de evaluación (Figura 1). En el E1, a 21 dpi, aun cuando numéricamente hubo diferencias, éstas no fueron estadísticamente significativas, a este tiempo fueron evidentes los estadios J3 y J4. En el E2, a 7 dpi predominaron J3, también se observaron escasos J2; a 14 dpi, los juveniles correspondieron a J3 y J4; y a 21 dpi, J4 fueron los predominantes. En el E1, a 21 dpi el porcentaje promedio de nematodos en el interior de las raíces fue de 5.6% en el JS (TGM-J) y de 6.7% en el cvRG. En el E2, a 7 dpi en TGM-J fue de 20% mientras que en cvJRG fue de 24.3%; y a 21 dpi fue de 4.7% y 13.2%, respectivamente (Cuadro 1). En el tercer experimento (E3), todas las poblaciones de jitomate silvestre mostraron agallas características de N. aberrans s. l. en sus raíces (agallamiento tipo rosario). Cabe destacar que, en algunas poblaciones silvestres, el nematodo indujo un mayor agallamiento con respecto al cvRG, no obstante, no fueron estadísticamente diferentes (Cuadro 2). En E2, el segundo trasplante promovió un mejor desarrollo de raíces, no obstante, el número de agallas no se incrementó a 60 dpi. (Figura 2).
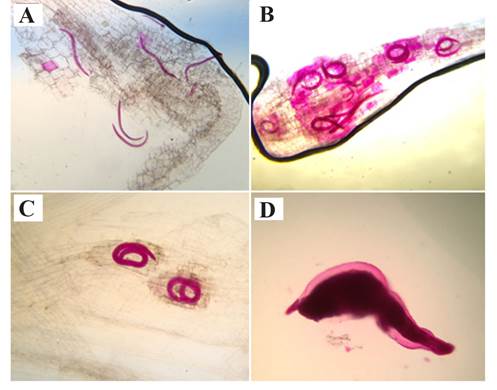
Figura 1 Estadios de Nacobbus aberrans sensu lato observados en raíces de Solanum lycopersicum var. cerasiforme y S. lycopersicum cv. Río grande. A: juveniles del segundo estadio (J2); B: juveniles del tercer estadio (J3); C: juveniles del cuarto estadio (J4); y D: hembra adulta. Fotos representativas de raíces teñidas por el método hipoclorito de sodio-fucsina-ácida.
Tanto en el JS TGM-J como en el cvRG fueron evidentes todos los estadios de N. aberrans s.l., y sus características fueron consistentes con lo descrito por Manzanilla-López et al. (2002); así, los J2 fueron de cuerpo alargado y delgado, los J3 y J4 fueron más largos y anchos (dispuestos en forma de “C” o enrollados, y la hembra adulta fue en forma de huso tendiendo a globosa (Fig. 1D). En cuanto al NNR, el reducido número a 7 dpi (E2) con respecto al inoculo inicial (300 J2), se asocia con el hábito migratorio de los juveniles, es posible que cierta proporción de individuos estuvieran fuera de la raíz al momento de realizar el registro, aunado al hecho de que no todos tienen éxito en invadir la raíz. N. aberrans s.l., previo a su etapa adulta, es generalmente migratorio (ingreso y egreso frecuente de la raíz), este comportamiento es común de los J2, J3, J4 y la hembra inmadura; mientras que la hembra adulta exhibe un hábito sésil parecido a Meloidogyne spp. (Manzanilla-López et al., 2002). Similarmente, Godínez-Vidal et al. (2013) reportaron que en la interacción compatible Capsicum annuum-N. aberrans, a 7 dpi solo el 12.3% de los J2 inoculados fueron observados dentro de las raíces. Al igual que en Meloidogyne spp., cierta proporción de individuos que ingresan a la raíz se diferencian en hembras y otros en machos, los machos son vermiformes y abandonan la raíz, mientras que las hembras se ensanchan y adoptan el estado sésil (Manzanilla-López et al., 2002). Lo anterior explica lo ocurrido en el E2, donde a 21 dpi hubo un decremento en el NNR con respecto a los 7 dpi. Con relación al agallamiento de raíces y producción de huevos, en los E2 y E3, todas las poblaciones de JS fueron susceptibles, debido a que el nematodo completó su ciclo de vida al igual que en el cvRG. En plantas resistentes ocurre lo opuesto, usualmente el ciclo de vida es interrumpido en cualquiera de los estadios juveniles del nematodo, este bloqueo es condicionado por una respuesta hipersensitiva, mecanismo que se caracteriza por una necrosis local en el sitio de infección, la cual confina y elimina al patógeno (Williamson y Kumar, 2006). La resistencia a nematodos agalladores se caracteriza por el fracaso de los individuos para formar un sitio especializado de alimentación, las hembras no completan su desarrollo, y la formación de agallas y huevos es mínima e incluso no observables (Williamson y Kumar, 2006). Los datos de agallamiento y huevos en este trabajo son similares a los reportados por Veremis et al. (1997), quienes confrontaron un genotipo de L. esculentum var. cerasiforme contra una población argentina de N. aberrans s.l.; aun cuando el número de huevos y de agallas fue inferior al del cv. Rutgers (susceptible), el genotipo fue considerado susceptible. Diferentes poblaciones de N. aberrans s. l. pueden inducir una respuesta distinta en sus hospedantes y viceversa. Por ejemplo, Toledo et al. (1993) revelaron la gran capacidad parasítica de N. aberrans s.l. sobre diez hospedantes jitomate, chile, verdolaga (Portulaca oleracea L.), remolacha (Beta vulgaris L.), acelga (Beta vulgaris var. cicla), papa (Solanum. tuberosum L.), pepino (Cucumis sativus L.), rábano (Raphanus sativus L.), calabacita (Cucurbita pepo L.), y frijol, seis de ellos fueron susceptibles a cuatro poblaciones del nematodo, lo anterior también sugirió la presencia de razas de N. aberrans s.l. en México.
Cuadro 1 Estadios juveniles, agallas y huevos en raíces de tinguaraque ( Solanum lycopersicum var. cerasiforme) inoculadas con Nacobbus aberrans sensu lato.
| Genotipo | Exp | Nematodosz | Agallamiento | Huevos | ||
|---|---|---|---|---|---|---|
| 7 | 21 | 45z | 60y | 60y | ||
| TGM-J | 1 | nd | 56.40±4.93 | 1.75±0.16a | nd | nd |
| (1.75±0.04a) | ||||||
| RG | nd | 66.80±6.30 | 2.25±0.31a | nd | nd | |
| (1.82±0.04a) | ||||||
| TGM-J | 2 | 60.00±12.68 | 14.00±5.12 | nd | 2.46±0.37 | 219.21±21.75 |
| (1.75±0.10a) | (1.09±0.16a) | (0.53±0.05a) | (2.33±0.04a) | |||
| RG | 73.00±7.12 | 39.75±11.74 | nd | 0.68±0.12 | 137.52±28.77 | |
| (1.86±0.04a) | (1.56±0.11a) | (0.22±0.03b) | (2.10±0.10a) | |||
TGM-J: jitomate silvestre; RG: cv. Río grande. 7, 21, 45 y 60: días post-inoculación con Nacobbus aberrans sensu lato. †Número de nematodos (diferentes estadios) por raíz. yNúmero de agallas y huevos por g de raíz. zÍndice de agallamiento evaluado según una escala de 0-5, donde 0: raíces sin agallas; 1: 1-20% de agallamiento; 2: 21-40%; 3: 41-60%; 4: 61-80%; y 5: 81-100% (Oka et al., 2009). nd: no determinado. Los valores representan la media ± error estándar. Medias con la misma letra no son significativamente diferentes (Tukey, p˂0.05). El ANOVA se realizó utilizando datos transformados [log10 (x + 1) ] y se muestran entre paréntesis.
Cuadro 2 Agallamiento inducido por Nacobbus aberrans sensu lato en raíces de Solanum lycopersicum var. cerasiforme (tinguaraque).
| Tratamiento | Agallas/g de raíz |
|---|---|
| TGM-J | 98.38±7.64 (1.99±0.03a) |
| TGM-N | 65.18±12.53 (1.79±0.08a) |
| TGM-P | 90.42±18.76 (1.92±0.10a) |
| TGM-B | 57.22±5.79 (1.76±0.04a) |
| TGM-Z | 59.77±4.27 (1.78±0.03a) |
| RG | 58.32±2.02 (1.77±0.01a) |
Los valores representan la media ± error estándar. Medias con la misma letra no son significativamente diferentes (Tukey, p˂0.05). RG: cv. Río grande. El ANOVA se realizó utilizando datos transformados [log10 (x + 1) ] y se muestran entre paréntesis.
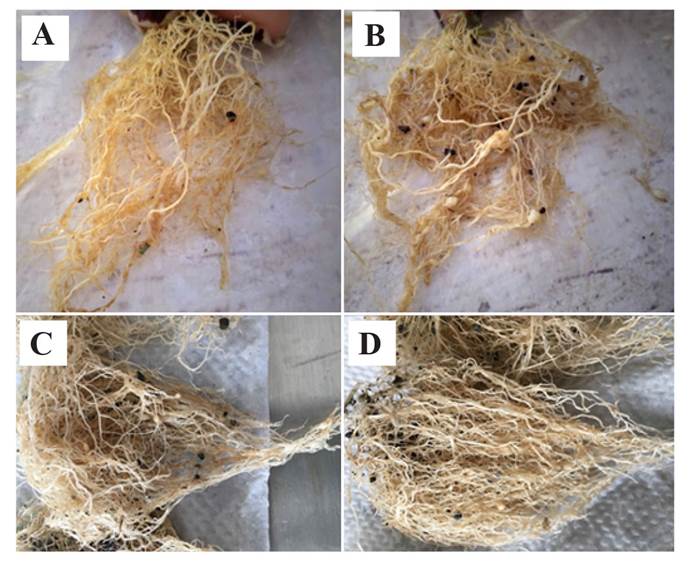
Figura 2 Raíces agalladas por Nacobbus aberrans sensu lato (población Montecillo) a 45 (A-B) y 60 (C-D) días post-inocula ción. A y C) Solanum lycopersicum var. cerasiforme; B y D) S. lycopersicum cv. Río grande.
La susceptibilidad de plantas silvestres a nematodos fitoparásitos no es inusual, por ejemplo, Veremis et al. (1997) encontraron que varias accesiones silvestres de L. chmielewskii, L. peruvianum, L. peruvianum var. glandulosum, L. hirsutum, y L. pimpinellifolium resultaron susceptibles a N. aberrans s.l. También, un trabajo desarrollado por Ruiz de Galarreta et al. (1998) quienes evaluaron 90 especies silvestres de Solanum (98 accesiones) contra Globodera pallida, reveló que solo doce accesiones resultaron resistentes; sin embargo, varias de aquellas que resultaron susceptibles, mostraron resistencia al oomiceto Phytophthora infestans y a cuatro virus fitopatógenos. En otro escenario, el pariente silvestre L. pimpinellifolium (=S. pimpinellifolium) fue susceptible a M. javanica, este genotipo presentó un índice de agallamiento similar al de líneas susceptibles de jitomate, no obstante, fue catalogado como tolerante debido a que su producción de frutos no fue alterada (Udo et al., 2008). Los resultados revelan la capacidad de las colectas locales de S. lycopersicum var. cerasiforme de ser hospedantes de la población de N. aberrans utilizada en este trabajo. N. aberrans s.l. invadió las raíces, y completó su desarrollo y reproducción. Lo anterior sugiere la necesidad de explorar otras solanáceas silvestres nativas como posibles fuentes de resistencia, información que a la fecha es escasa. No se recomienda la inclusión del tinguaraque en programas de manejo de N. aberrans s.l. (en la región donde se realizaron las colectas), por ejemplo, aquellos que involucren su uso como portainjertos en suelos infestados con este nematodo. Aunado al aprovechamiento fitosanitario del tinguaraque, este material constituye un recurso valorado por la población rural en el occidente de México, tiene usos alimenticios -como la elaboración de salsas- y medicinales para humanos y animales; por tanto, es crucial promover su conservación, sin embargo, al crecer como arvense en los cultivos, enfrenta riesgos por el uso de herbicidas y quemas de pastizales (Rodríguez-Guzmán et al., 2009).











 texto en
texto en 


