El CTV es subendémico en México con un reciente brote de raza severa en algunos municipios del Golfo de México. Es un organismo reglamentado por el área oficial desde los 80’s prevaleciendo en condición asintomática. Por el contrario, el huanglongbing (HLB) o dragón amarillo también llamado citrus greening o enverdecimiento de los cítricos se detectó en 2009 con rápida dispersión en el país. Esta es una enfermedad causada por una bacteria Gram-negativa Candidatus liberibacter (Gottwald, 2007). Se conocen tres especies: Candidatus Liberibacter asiaticus (CLas), Candidatus Liberibacter africanus (CLaf) y Candidatus Liberibacter americanus (CLam), siendo la primera la única reportada en México. CLas ataca a todos los cítricos, afecta la fisiología productiva de las plantas jóvenes y adultas con síntomas moderado a severos, incluyendo a los híbridos, y está distribuida en casi todos los países productores de cítricos (Bové, 2012; Hall et al., 2012). La bacteria sistémica se multiplica y transporta por el floema requiriendo de insectos vectores para su transmisión, siendo Diaphorina citri más importante (Hall et al., 2012; Ichinose et al., 2010).
Mora-Aguilera et al. (2014) reportan niveles de intensidad epidémica variable con incidencia del 26% en Brasil hasta 100% en China. Los mismos autores reportan el potencial de pérdidas productivas en 42% para naranja dulce, 62% en limón mexicano y 17.3% en limón persa bajo las condiciones citrícolas de México. Por el carácter epidémico de la enfermedad, el gobierno federal ha impulsado desde 2008 un programa nacional de control basado en la erradicación de plantas enfermas, control del vector y uso de material certificado, el cual ha permitido contener el impacto de la enfermedad, reconociéndose regiones endémicas y subendémicas como Colima, Michoacán y Nayarit. Actualmente no existen variedades resistentes por lo que el control del vector y un manejo agronómico eficiente con énfasis en la nutrición y riego permite mantener la rentabilidad de plantaciones comerciales (Mora-Aguilera, G. 2018. Datos no publicados; Fu et al., 2016). Existen a nivel experimental diversas alternativas físicas y químicas para el control de CLas (Zhang et al., 2014; Vazquez-Garcia et al., 2013; Zhang et al., 2012; Hoffman et al., 2012; Ding et al., 2008). Algunos de estos métodos no han tenido resultados consistentes, y otros, como el uso de antibióticos, no son viables ambiental y económicamente. El desarrollo de variedades transgénicas en cítricos, como una alternativa para el rápido desarrollo de resistencia, ha demostrado su viabilidad contra el CTV; sin embargo, el empleo de genes exógenos a la planta ha limitado su implementación comercial. Una alternativa es el empleo de CRISPR, técnica de edición de genes aun en desarrollo, y el uso de genes endógenos asociados a mecanismos de defensa en plantas.
La activación de estos mecanismos comienza con el reconocimiento de efectores como flagelina, quitinas, glucoproteínas y lipopolisacáridos que se denominan Patrones Moleculares Generales Asociados a Patógenos (PMGAP). Las proteínas que reconocen a estos efectores son llamadas Proteínas de Resistencia (R). Este mecanismo de respuesta específica se denomina resistencia gen por gen sensu Flor (Gao et al., 2015; Nishimura y Dangl 2010; Belkhadir et al., 2004). Al tipo de resistencia ejercida por proteínas R, únicamente en presencia de un patógeno, se denomina resistencia sistémica adquirida (RSA) (Gómez y Mejía, 2011).
Recientemente, el análisis del transcriptoma de cítricos en respuesta a la infección de CLas, CLam y CTV ha demostrado que varios genes se sobreexpresan en respuesta a la infección mientras que otros genes se reprimen (Hu et al., 2017; Rawat et al., 2017; Da Graca et al., 2016; Fu et al., 2016). Entre los múltiples genes consistentemente asociados con la RSA se incluyen CsNDR-1, AZI-1 y PR-1 expresados en respuesta a fitopatógenos de cítricos y otros cultivos (Hu et al., 2017; Da Graca et al., 2016; Lu et al., 2013; Pajerowska et al., 2013: Yu et al., 2013; Van Loon y Van Strien, 1999). La identificación de genes activados por la presencia de fitopatógenos permite postular la posibilidad de garantizar su expresión en la planta en forma continua y regular mediante ingeniería genética con el fin de anticipar procesos de infección. Este trabajo tuvo como propósito identificar y aislar los genes CsNDR-1, AZI-1 y PR-1 a través de ingeniería genética, clonarlos en vectores de transformación e introducirlos en dos cepas de Agrobacterium tumefaciens para su implementación futura en transformación genética de cítricos con genes endógenos para inducir la resistencia a CLas y CTV.
Material y métodos
Material biológico. Las plantas de Arabidopsis thaliana y de naranja dulce (Citrus sinensis) fueron crecidas en una mezcla de sustrato peat moss-perlita (60:40) en condiciones de invernadero a una temperatura de 27-30 °C y 2243 m.s.n.m. en Montecillo Texcoco, Estado de México.
Análisis bio-informático. Se utilizó el programa BLAST (Basic Local Alignment Search Tools) para buscar las secuencias consenso de la base de datos de Arabidopsis (Pajerowska M.K. et al., 2013; Yu et al., 2013) y de C. sinensis (Lu et al., 2013); se eligió la secuencia con mayor similaridad (Query). Para el análisis de alineamiento de las secuencias conservadas de los genes reportados se utilizó el programa Mega6. Los cebadores diseñados se analizaron con los programas Oligo Analyzer tool, Primer Questo Tool (IDT, Integrated DNA Technologies) y con NEBcutter (BioLabs) para analizar la posible formación de dímeros e identificar los sitios de restricción en los cebadores.
Extracción de ADN. La extracción de ADN para el aislamiento de los genes AZI-1 y PR-1, se llevó a cabo usando 0.1 gramos de hojas maduras de A. thaliana siguiendo el método de CTAB 2% (Doyle y Doyle, 1987). Mientras que para el aislamiento de CsNDR-1 se emplearon hojas jóvenes de C.sinensis usando el QIAGEN DNAeasy kit siguiendo las instrucciones del fabricante. La concentración de ADN se midió con 1 µL de la muestra en un nanodrop (Thermo SCIENTIFIC, NANODROP 2000).
Diseño de iniciadores. Se realizó la búsqueda de los genes en BLAST. Para el gen CsNDR-1 se ubicó la secuencia gi|568842565|ref|XM_006475151.1| PREDICTED: Citrus sinensis protein CsNDR-1-like (LOC102630232), mRNA. Con la secuencia encontrada se diseñó un iniciador ‘Forward’ y uno ‘Reverse’ ambos conteniendo una serie de 6 A/T seguida de la secuencia de la enzima de restricción elegida para la clonación más la secuencia Kozac ACC y finalmente la secuencia del iniciador.
Para el caso del gen AZI-1 se encontró el siguiente registro gi|30682133ǀrefǀNM_117317.4ǀ Arabidopsis thaliana azelaic acid induced 1 (AT4G12470), mRNA y para el PR-1 giǀ 17381133ǀAY064023ǀ Arabidopsis thaliana putative pathogenesis-related PR-1 protein (At2g14610), mRNA. Con las secuencias encontradas se diseñó un iniciador ‘Forward’ y ‘Reverse’ para cada gen.
Identificación y Amplificación de genes. La detección y amplificación de los genes por PCR punto final se realizó con cebadores específicos para cada gen incluyendo sitios de restricción para la clonación (Cuadro1).
En el diseño de los cebadores se incorporaron sitios de restricción de Apa1 (GGGCCC) y Spe1 (ACTAGT) además de varias adeninas seguidas a esos sitios de restricción. Se usó un volumen final de 25 µL conteniendo 5 µL de ADN, 2.5 µL de 10X PCR Buffer (Invitrogen), 1 µL de MgCl2 50 (Invitrogen), 0.5 µL de dNTPs 10 mM (Promega), 1 µL de cada cebador (10 pmol), H2O libre de ARNsa/ADNsa (Invitrogen) y 0.2 µL de Taq polimerasa (Invitrogen). Se usó un programa de amplificación de 35 ciclos para AZI-1 y PR-1: 95 °C por 30 s, 68 °C por 30 s y 68 °C por 30 s. Para CsNDR-1 35 ciclos: 95 °C por 30 s, 66 °C por 30 s y 68 °C por 40 s. Los tres genes tuvieron una primera etapa de predesnaturalización de 95 °C por 2 min y una etapa final de extensión de 68 °C durante 5 min.
Cuadro 1 Cebadores diseñados para aislar y clonar los genes AZI-1, PR-1 y CsNDR-1.
| Cebadorx | Secuenciay | Ampliconz |
|---|---|---|
| AZI1 F | 5´ AAA GGGCCCATGGCTTCAAAGAACTCAGCCTCTCTTG-3´ | 486pb |
| AZI1 R | 5´-AAA ACTAGTTCAAGCACATTGGAAACCAGATGGAAGC-3´ | |
| PR-1 F | 5´AAA GGGCCCATGAATTTTACTGGCTATTCTCGATTTTTAA-3´ | 486pb |
| PR-1 R | 5´-AAA ACTAGTTTAGTATGGCTTCTCGTTCACATAATTCC-3´ | |
| CsNDR1 F | 5´-AAA AAA GGGCCCACCATGTCAGAAAACGCCGGTGGGTGCTGC-3´ | 618pb |
| CsNDR1 R | 5´-AAAAAA ACTAGTTTAAGCAAAAATCAAGACAAAAAAATACAAC-3´ | |
x Nombre de los cebadores F:forward, R: reverse.
y Secuencia de cada cebador empleado.
z tamaño del amplicon a obtener para cada gen.
Los productos de PCR se analizaron en un gel de agarosa al 1%, con 5 µL de producto de PCR y 3 µL de Buffer de carga (Promega). El gel se corrió a 90 Volts, 400 Amperios, durante una hora, dejando teñir en bromuro de etidio por 5 min. Los productos de PCR que amplificaron del tamaño esperado se purificaron con QIAquick® PCR Purification Kit y fueron secuenciados para corroborar el aislamiento del gen en cuestión antes de continuar con la ingeniería.
Contrucción del vector. El vector pUC118-FMV-Poly-2-1 (Febres et al., 2003) fue crecido en tres mililitros de medio líquido 2xYT (extracto de levadura 10 g L, triptone 16 g L, NaCl 5 g L) conteniendo 100 µg mL-1 de ampicilina (amp) a 37 °C por 12 h para después aislar el plásmido con el QIAprep®Spin miniprep kit siguiendo las indicaciones del fabricante. Los genes AZI-1, PR-1 y CsNDR-1 purificados y el vector pUC118-FMV-Poly-2-1 aislado fueron digeridos con las enzimas de restricción Apa1 y Spe1 a la temperatura y tiempo recomendado para cada enzima. La doble digestión de los tres genes y del vector pUC118-FMV-Poly-2-1 producen un solo fragmento por lo que se purificaron con el QIAquick® PCR Purification Kit para posteriormente ser ligados durante 12 h a 4 °C. Los productos de la digestión fueron clonados en Escherichia coli DH5α (Invitrogen) con 80 a 100 ng µL-1 de ADN por electroporación bajo condiciones de un pulso a 1.8 kV (Bio-Rad, 165-2100). Las bacterias presuntamente transformadas fueron sembradas en medio sólido 2xYT conteniendo 100 µg mL-1 de amp probando tres alícuotas de células transformadas (10, 20 y 50µl) empleando una micropunta estéril y distribuyendo en la superficie del medio. Transcurridas 12 h a 37 °C varias colonias individuales crecidas fueron analizadas mediante PCR con los cebadores antes mencionados para corroborar la presencia de los genes. Los productos de PCR se corrieron en un gel con 0.8% de agarosa a 100 volts por 30 min.
Las colonias identificadas positivas se crecieron en tres ml de medio líquido 2xYT conteniendo 100 µg mL-1 de amp a 37 °C a 230 rpm durante 12 h. Con la mitad del cultivo bacteriano crecido (1.5 mL) se realizó la extracción del plásmido con el kit QIAprep Spin Miniprep Kit de QIAGEN y se mandó a secuenciar para verificar las secuencias de los tres genes. Con la otra mitad de los cultivos bacterianos se hicieron ‘stocks’ con glicerol y se almacenaron a -80 °C.
Para continuar con la inserción de los genes de interés ahora en plásmidos vectores de transformación pCAMBIA se procedió como sigue: las bacterias con los tres genes contenidos independientemente en pUC118-FMV-Poly-2-1 fueron crecidas en medio sólido 2xYT con 100µg mL-1 de ampicilina mientras que aquellas que contenían los plásmidos pCAMBIA2201 y pCAMBIA 2301 se crecieron en medio sólido 2xYT con 25 µg mL-1 de cloranfenicol (Cap) o 50 µg mL-1 de kanamicina (Kan) respectivamente por 12 h a 37 °C. Los plásmidos fueron extraídos con el QIAprep® Spin Miniprep Kit y fueron subsecuentemente digeridos con las enzimas de restricción BamH1 y SphI a la temperatura y tiempo recomendado para cada enzima. Los productos de la doble digestión de pUC118-FMV-Poly-2-1 fueron purificados usando el QIAgen gel purification kit en tanto que los productos de la doble digestión de los vectores pCAMBIA fueron purificados con el Qiaprep Miniprep Kit.enseguida. La ligación de los productos se realizó incubándolos durante 12 h a 4 °C. Los productos de la digestión fueron clonados en Escherichia coli DH5α (Invitrogen) con 80 a 100ng/µl de ADN por electroporación bajo condiciones de un pulso a 1.8 kV (Bio-Rad, 165-2100). Las bacterias presuntamente transformadas fueron sembradas en medio sólido 2xYT conteniendo 25 µg mL-1 de Cap para pCAMBIA2201 o 50µg mL-1 de Kan en el caso de pCAMBIA 2301 probando tres alícuotas de células transformadas (10, 20 y 50 µL) empleando una micropunta estéril y distribuyendo en la superficie del medio. Transcurridas 12 h a 37 °C varias colonias individuales crecidas fueron analizadas mediante PCR con los cebadores específicos para corroborar la presencia de cada uno de los tres genes.
Una vez más las colonias individuales que resultaron positivas se crecieron en medio líquido con los antibióticos respectivos para cada plásmido durante a 37 °C a 230 rpm por 12 h. De igual manera, una alícuota se mandó a secuenciar y con la otra alícuota de bacterias se hicieron ‘stocks’ para almacenar a -80 °C.
Transformación de A. tumefaciens. Los plásmidos pCAMBIA con las construcciones fueron crecidos en medio sólido 2xYT conteniendo 25 µg mL-1 de Cap para pCAMBIA2201 o 50 µg mL-1 de Kan en el caso de pCAMBIA 2301 a 37 °C por 12 h, transcurrido este tiempo los plásmidos se extrajeron con el Qiaprep Spin miniprep kit. Las cepas competentes de A. tumefaciens EHA 105 y AGL 1 (Kayim y Koc 2005; Almeida et al., 2003) se eligieron para ser transformadas mediante electroporación (Bio-Rad, 165-2100) bajo las condiciones de un pulso a 2.5 kV (Bio-Rad, 165-2100). Las células bacterianas presuntamente transformadas de la cepa EHA 105 fue crecidas en medio sólido YEP (bactopeptone 10 g L, NaCl 5 g L, extracto de levadura 10 g L) con rifampicina (Rif) (50 µg mL-1) y Kan (50 µg mL-1), mientras que las células de la cepa AGL 1 fueron crecidas en medio sólido YEP con Rif (50 µg mL-1), Kan (50 µg mL-1) y carbenicilina (Carb) (25 µg mL-1). Se probaron alícuotas de 50, 100 y 200 µL de las dos cepas de Agrobacterium y se incubaron durante dos a tres días a 27 °C. Las colonias individuales crecidas se analizaron por PCR punto final con los iniciadores y condiciones antes descritos por cada gen, las que resultaron positivas se mandaron a secuenciar. Aquellas colonias cuya transformación y construcción se verificaron mediante la secuenciación se crecieron en medio YEP líquido con los antibióticos respectivos antes de criopreservarlas a -80 °C.
Resultados y discusion
Identificación de los genes. La concentración de ADN de Arabidopsis fue de 478.2 ng µL-1 con un valor de unidades de densidad óptica (D.O.) de 2.04. La concentración de ADN de C. sinensis fue de 48.7 y su lectura D.O. fue de 1.7. Los productos de PCR corridos en el gel de agarosa mostraron las bandas del tamaño esperado, de 486 pb correspondiente al gen AZI-1 y PR-1 y para el gen CsNDR-1 se obtuvo una banda de 618 pb (Figura 1). La secuenciación de los productos mostró identidad del 99% al menos.
Clonación de los genes en el plásmido pUC118-FMV-Poly-2-1. Los genes purificados se insertaron en el vector pUC118-FMV-poly-2-1 (Febres et al., 2013). Las colonias individuales de E. coli que crecieron se analizaron por PCR para detectar las transformadas. Para el gen AZI-1 se analizaron 18 colonias con los iniciadores AZI-1 F/AZI-1 R, obteniendo tres colonias positivas (Figura 2A, carriles 2, 4 y 10). Para el gen PR-1 se analizaron de igual forma 18 colonias con los iniciadores PR-1 F/PR-1 R, obteniendo seis colonias positivas (Figura 2B, carriles 2, 9, 11 al 13 y 16). Para el gen CsNDR-1 se repitió la transformación dos veces y se analizaron un total de 35 colonias con los iniciadores CsNDR-1 F/CsNDR-1 R, se obtuvieron dos colonias positivas y se muestra una en el carril 12 de la Figura 2C. Se mandaron a secuenciar todas las colonias que resultaron positivas por PCR y la colonia de cada uno de los genes AZI-1, PR-1 y CsNDR-1 que mostró la mayor similitud con la secuencia reportada en la base de datos de GenBank de NCBI, se eligió para continuar con la clonación en el vector pUC118-FMV-poly-2-1. Para el caso del gen PR-1 la colonia tres mostró la mayor similaridad (99%), en el caso del gen AZI-1 la colonia uno mostró una similaridad del 99% y la colonia 14 fue la que mostró 99% de similaridad en el gen CsNDR-1. Se obtuvieron tres construcciones con las mejores colonias de cada uno de los genes insertadas entre el promotor FMV y señal de terminación 35S de pUC118-FMV-Poly-2-1 (Figura 3A, B y C).

Figura 1 Amplificación de los genes AZI-1, PR-1 y CsNDR-1. Geles de agarosa al 1.5 %, con 5 μl de producto de PCR (carriles 1-2 y 4-5) más 3 μl de buffer de carga. M; marcador de peso molecular (1 kb DNA ladder). A). Carril 1: amplificación del gen AZI-1 de Arabidopsis. Carril 2: control negativo del gen AZI-1. Carril 4: amplificación del gen PR-1 de Arabidopsis. Carril 5: control negativo del gen PR-1. B). Carril 1: control negativo de CsNDR-1. Carril 2 y 3: amplificación del gen CsNDR-1.

Figura 2 Confirmación mediante PCR de colonias DH5α transformadas con los genes AZI-1, PR-1 y CsNDR-1 contenidos en el plásmido pUC118-FMV-Poly-2-1. Fragmentos amplificados en gel de agarosa al 0.8%. M: marcador de peso molecular (1 kb DNA ladder). A). Carril 1: Control positivo del gen AZI-1. Carril 2, 4 y 10: Amplificación del gen esperado. Carril 19: control negativo del gen AZI-1 . B). carril 1: control positivo del gen PR-1. Carril 2, 9, 11, 12, 13 y 16; colonias positivas de la amplificación del gen PR-1. Carril 19: control negativo del gen PR-1 . C). Carril 1 al 15, colonias analizadas del gen CsNDR-1 . Carril 12: muestra positiva. Carril 16; control negativo.
Los genes aislados en esta investigación CsNDR-1, AZI-1, PR-1 han sido descritos consistentemente como posibles candidatos para generar resistencia a diversos patógenos (Lu et al., 2013). Dichos genes forman parte de los 633 genes que se ven alterados después de la inoculación con CLas de acuerdo con Mafra et al., (2013), los cuales están relacionados con la respuesta sistémica adquirida (RSA) de la planta. Varios autores han identificado también estos genes como parte de la respuesta de la planta ante el ataque por CLas y CTV (Hu et al., 2017; Rawat et al., 2017; Da Graca et al., 2016; Fu et al., 2016), por tal motivo, fueron elegidos para el desarrollo de estas construcciones.
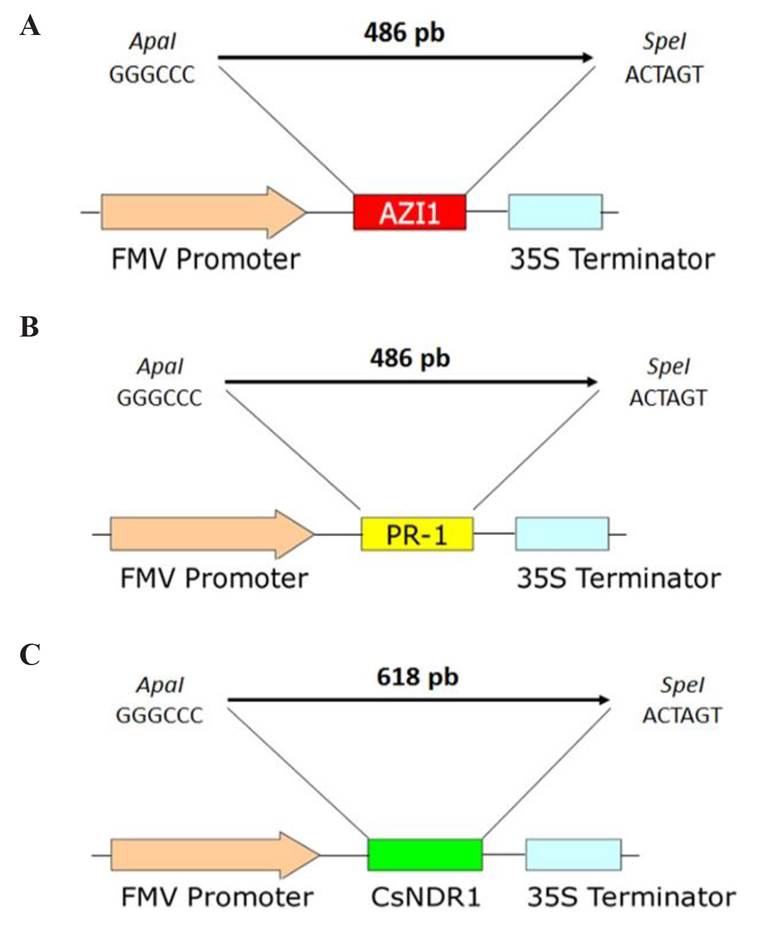
Figura 3 Representación esquemática de las construcciones de los genes insertadas en el plásmido pUC118-FMV-Poly-2-1. A). AZI-1, B). PR-1 y C). CsNDR-1. En la imagen se muestran los genes AZI-1 (rojo), PR-1 (amarillo) y CsNDR-1 (verde) clonados bajo el promotor FMV (anaranjado) y su señal de terminación 35S (azul). En la parte superior de cada construcción se indica el tamaño del amplicón y las enzimas de restricción utilizadas durante la clonación.
El plásmido pUC118-FMV-Poly-2-1 fue seleccionado por su tamaño pequeño, por generar un gran número de copias (500 a 700), su sitio múltiple de clonación que permite la fácil integración de los fragmentos de ADN dentro de este vector (Febres et al., 2013); además de ser compatible, para la subsecuente clonación dentro de los vectores pCAMBIA, incorporando los promotores y terminadores CaMV35S y/o NOS de pCAMBIA.
Clonación en plásmidos pCAMBIA. Las construcciones que contenían los genes de interés fueron insertadas en los vectores pCAMBIA 2201 y 2301. El proceso de clonación se repitió por duplicado, modificando las concentraciones de ADN en la reacción de ligación, al no encontrar colonias transformadas con los genes de interés. En cada experimento se analizaron 21 colonias, dando un total de 42 colonias analizadas por cada gen. Para el gen AZI-1 clonado en pCAMBIA 2201, se modificó la concentración de ADN-plásmido en la reacción de ligación de 31.8 ng µL-1 - 108 ng µL-1 a 63.6 ng µL-1 - 72 ng µL-1; las colonias crecidas se analizaron por PCR con los iniciadores AZI-1 F/AZI-1 R, obteniendo diez colonias positivas en la segunda repetición de clonación (Figura 4A). El gen AZI-1 clonado en pCAMBIA 2301 la modificación de la concentración de ADN en la ligación fue de 41.1 ng µL-1 - 100 ng µL-1 a 82.2 ng µL-1 - 86.4 ng µL-1; de igual forma se analizaron por PCR las colonias crecidas con los mismos iniciadores AZI-1 F/AZI-1 R, se obtuvieron cuatro colonias positivas en el segundo experimento (Figura 4B). En cuanto al gen PR-1 clonado en el vector pCAMBIA 2301, la concentración del ADN modificado en la ligación fue de 25.2 ng µL-1 - 86.4 ng µL-1 a 37.8 ng µL-1 - 72 ng µL-1, además de aumentar a dos horas el paso de incubación después del choque eléctrico, las colonias crecidas se analizaron con los iniciadores PR-1 F/PR-1 R, obteniendo tres colonias positivas en el último experimento (Figura 4C). Las construcciones amplificaron un producto de 486 pb lo cual fue lo esperado. Para el gen CsNDR-1 en pCAMBIA, se realizó un solo ensayo, se analizaron 32 colonias, obteniendo sólo dos colonias positivas (Figura 4D).

Figura 4 Confirmación mediante PCR de colonias DH5α con los genes AZI-1, PR-1 y CsNDR-1 insertados en los plásmidos pCAMBIA 2201 y 2301. Fragmentos amplificados en gel de agarosa al 0.8%. M: marcador de peso molecular (1 kb DNA ladder). A). AZI-1-pCAMBIA 2201. Carril 1; Control positivo del gen AZI-1. Carril; 4, 6, 7, 8, 11, 12, 14, 16-21; Amplificación del gen esperado. Carril 23; control negativo. B). AZI-1-pCAMBIA 2301. Carril 1; Control positivo. Carril; 3, 18, 21 y 22; Amplificación del gen esperado. Carril 23; control negativo. C). PR-1-pCAMBIA 2301. Carril 1; control positivo del gen PR-1. Carril; 6, 7 y 20; colonias positivas de la amplificación del gen PR- 1. Carril 23; control negativo. D). CsNDR-1 en pCAMBIA 2301. Carril 20 y 22; colonias positivas para el gen CsNDR-1. Carril 24; control negativo.
Todas las construcciones que contenían los genes AZI-1, PR-1 y CsNDR-1 bajo el promotor FMV y el terminador 35S, fueron clonadas entre el gen de selección neomicin fosfotransferasaII (ntptII) que confiere resistencia a Kanamicina y el gen reportero β-glucoronidasa (uidA) conocido como GUS de los plásmidos pCAMBIA 2201 y 2301. El gen de selección de transformación nptII quedó con el promotor y terminador 35S y el gen reportero GUS quedó con el promotor 35S y con el terminador NOS. Los genes AZI-1, PR-1 y CsNDR-1 clonados en pCAMBIA 2301 tienen como gen de selección de la bacteria al gen nptII (Figura 5A, C y D). El gen AZI-1 insertado en pCAMBIA 2201 se encuentra bajo el gen de selección en bacteria a cloranfenicol (Figura 5 B).
Las construcciones se mandaron secuenciar para corroborar la identidad y orientación de la inserción antes de continuar con la transformación en A. tumefaciens se eligieron aquellas que mostraron una homología de 99% al menos. En la Figura 6 se muestra el 100% de identidad de la colonia dos para el caso del gen AZI-1 insertado en pCAMBIA2301. Los plásmidos pCAMBIA se usan con éxito en transformación genética de diversas plantas incluyendo cítricos (De Oliveira et al., 2015; Hajeri et al., 2014; Pinheiro et al., 2014).
Transformación de A. tumefaciens. Se hizo transformación de las dos cepas A. tumefaciens con los tres genes clonados en pCAMBIA y se analizaron con PCR colonias individuales para confirmar la transformación. La construcción del gen PR-1 en pCAMBIA2301 en la cepa EHA105 produjo varias colonias individuales (Figura 7A); de igual manera la construcción del gen CsNDR-1 en pCAMBIA2301 en la cepa Agl1 (Figura 7B). Los resultados de PCR confirmaron colonias positivas para ambos genes sin embargo la verificación mediante secuenciación no mostró alta identidad para el caso de la construcción con el gen PR-1. La construcción del gen CsNDR-1 con el promotor FMV y el terminador 35S clonados en pCAMBIA 2301 logró ser insertada en las dos cepas de A. tumefaciens EHA 105 y AGL 1. Se analizaron 11colonias al azar por PCR con los cebadores CsNDR-1 F/CsNDR-1 R, obteniendo una colonia positiva en la cepa EHA105 (Figura 8A) mientras que para la cepa AGL1 se obtuvieron cuatro colonias positivas (Figura 8B). La baja eficiencia de transformación de Agrobacterium y de E.coli es algo común en experimentos de construcción y clonación de genes. Gelvin (2003) menciona que hay muchos factores que pudieran estar involucrados tales como la baja competencia de las células bacterianas, células estresadas, ADN de mala calidad, baja o alta concentración de ADN en la transformación, condiciones durante la ligación de fragmentos, condiciones de electroporación, la temperatura de incubación, concentraciones de antibióticos entre otros. La cepa de A. tumefaciens EHA 105 ha sido utilizada en transformación genética en cítricos, mostrando excelentes porcentajes de transformación, debido a la virulencia que posee (Hao et al., 2016; Dutt et al., 2015). La cepa AgL1 ha mostrado de igual forma alto grado de transformación de cítricos (Shi et al., 2016; Kayim y Koc 2005).

Figura 5 Representación esquemática de la construcción en pCAMBIA 2201 y 2301. Construcción FMV-AZI-1-35S insertada en los plásmidos A). pCAMBIA 2301, y B). pCAMBIA 2201. C). Construcción FMV-PR-1-35S, y D). Construcción FMV-CsNDR-1-35S insertadas en el plásmido pCAMBIA 2301. Los genes de interés, barras de color rojo, amarillo y verde, quedaron insertados entre el gen de selección ntptII que confiere resistencia a kanamicina con el promotor y terminador de CaMV (Cauliflower mosaic caulimovirus) y entre el gen reportero GUS bajo el promotor 35S del CaMV y terminador Nopalina sintasa (NOS).

Figura 6 Análisis en GenBank de la secuencia del gen AZI-1 clonado en pCAMBIA2301. La secuencia Query es el gen re portado de Arabidopsis thaliana y la secuencia Sbjct es la clonada en esta investigación con el 100% de similaridad.

Figura 7 A). Colonias transformadas de A. tumefaciens EHA 105 con el plásmido pCAMBIA 2301 con el gen PR-1 en el medio YEP con Rif (50 μl/ml). B). Colonias transformadas de A. tumefaciens Agl1 con el plásmido pCAMBIA 2301 con el gen CsNDR-1 en el medio YEP con Rif (50 μl/ml), Kan (50 μg/ml) y Carb (25 μg/ml). Los números indican las colonias elegidas al azar para confirmar la presencia del gen mediante PCR.

Figura 8 PCR de colonias de A. tumefaciens. M: Marcador molecular (1 kb DNA ladder). A). EHA 105 transformadas con el gen CsNDR-1. Carril 1: control positivo. Carril; 8 colonia positiva con el gen CsNDR-1. Carril 12: control ne gativo. B). AGL 1 transformada con el gen CsNDR-1. Carril 1: control positivo de CsNDR-1. Carril 2-5: colonias positivas con el gen CsNDR-1. Carril 6: control negativo.
Conclusiones
Se lograron aislar los genes AZI-1, PR-1 y CsNDR-1 mediante PCR con los iniciadores diseñados a partir del genoma de Arabidopsis thaliana y de Citrus sinensis con sitios de restricción específicos para su clonación. Las secuencias aisladas y clonadas de los genes AZI-1, PR-1 y CsNDR-1 mostraron el 99 % de similitud con respecto a los registros de las secuencias de A. thaliana y C. sinensis registrada en la base de datos de Genbank de NCBI.
Se incorporaron los tres genes entre el promotor FMV y el terminador 35S CaMV del vector de clonación pUC118-FMV-poly 2-1. La clonación de los genes en los vectores pCAMBIA2301 y pCAMBIA2201 permitió incorporar a las construcciones un gen de selección de transformación (35S-nptII-35S) y un gen reportero (35S-GUS-NOS). Los tres genes (AZI-1, PR-1 y CsNDR-1) se clonaron independiente en pCAMBIA2301 sin embargo sólo el gen AZI-1 logró clonarse en pCAMBIA2201.
El gen CsNDR-1 fue incorporado a las cepas A. tumefaciens EHA 105 y AgL1. Los genes AZI-1 y PR-1 no se lograron integrar a estas cepas de Agrobacterium. La identificación, aislamiento y clonación de los genes CsNDR-1, AZI-1 y PR-1 involucrados en los mecanismos de defensa de las plantas ante el ataque de un patógeno podrían ser sobreexpresados mediante ingeniería genética en cítricos y ser usados para inducir resistencia a varios patógenos incluyendo la bacteria Candidatus liberibacter causante de la enfermedad HLB y al Citrus tristeza virus.











 texto en
texto en 


