En México, el nogal pecanero Carya illinoinensis (Wangenh.) Koch es un cultivo establecido en 112,000 ha, cuyo valor fue de 330 millones de dólares en 2015 (Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco, 2018). La enfermedad más importante de las raíces del nogal es la pudrición de la raíz causada por el hongo Phymatotrichopsis omnivora (Duggar) Hennebert (Herrera-Perez y Samaniego-Gaxiola, 2002). Un método reciente para el control de patógenos de plantas en el suelo, es la desinfestación reductiva del suelo (RSD), donde se agrega una fuente de carbono (C) como melaza, paja de trigo o compuestos ricos en carbohidratos al suelo, luego se satura con agua y se cubre con un plástico (Momma et al., 2006).
En la RSD, los residuos agregados se descomponen en una condición anaeróbica, el pH de la solución del suelo se acidifica, el potencial oxidación-reducción ORP (Eh) alcanza valores negativos (reductores) y ácidos grasos volátiles (VFAs), compuestos orgánicos de azufre y iones metálicos Mn2+ y Fe2+ se generan, tóxicos para hongos, bacterias, nematodos y malezas (Hewavitharana et al., 2014; Momma, 2008; Momma et al., 2011; Shrestha et al., 2016). Los VFAs aumentan su toxicidad acidificando el medio (Samaniego-Gaxiola y Pedroza-Sandoval, 2013).
La supervivencia de los esclerocios de P. omnivora fue nula después de sumergirse en soluciones de FAVs, así como en suelo inundado con glucosa agregada (Samaniego-Gaxiola, 1994; Samaniego-Gaxiola y Balagurusamy, 2013). Sin embargo, no se ha registrado si el suelo infestado con P. omnivora, inundado y agregado con glucosa induce los cambios de la RSD, si los FAVs en la solución de este suelo solo o ajustando su pH pueden matar los esclerocios del hongo. Por otro lado, los esclerocios de P. omnivora son susceptibles de morir cuando se secan o permanecen en contacto con Trichoderma spp. (Samaniego-Gaxiola 2008; Samaniego-Gaxiola et al., 2010). El suelo seco o inoculado con Trichoderma harzianum Rifai, podría disminuir el inóculo de P. omnivora. Los métodos de control en el suelo: RSD, desecado e inoculando con T. harzianum, podrían combinarse y dar mejores resultados que individualmente, para proteger a al nogal pecanero contra la pudrición texana. Por lo tanto, los objetivos de este trabajo fueron: i) registrar el pH, ORP, producción de FAVs en el suelo agregado con glucosa e inundado permanentemente; ii) evaluar la supervivencia de los esclerocios de P. omnivora después de permanecer en el sobrenadante proveniente de este suelo, donde el pH se ajusta o no ~ 4; iii) evaluar la incidencia y muerte nogal pecanero sembrado en suelos tratados con RSD utilizando melaza (M), inoculado con T. harzianum (T), suelo desecado (DS) y sus combinaciones DS+T, DS+M y DS+T+M; y iv) registrar los cambios del pH y ORP en suelos tratados.
El suelo se extrajo de 0-5 cm de profundidad, del huerto Hormiguero ubicado en la carretera Torreón-San Pedro Km 16 (25° 41’ 16.3” N 103° 19’ 52.4” W). Ocho repeticiones (frascos de vidrio) de 1 l se agregaron 400 g de suelo, luego 80 ml de una solución de glucosa de 0.0, 0.5, 2.0 y 4.0 mg g-1, luego 250 ml de agua (inundación) y finalmente se incubaron los frascos, por cinco días a 28 °C. Desde el comienzo del período de incubación, se extrajeron diariamente 20 ml del sobrenadante de cada frasco. Esta muestra se dividió en dos grupos de viales (cada uno con 10 ml), en ambos grupos se midieron el pH y la ORP, con un multi-parámetro de marca HI 9828 de Hanna Instruments. A un grupo de viales no se ajustó el pH y el otro sí a pH ~ 4 al añadirle H2SO4; en este último caso, se cuantificó la cantidad de ácido utilizado para ajustar el pH. En ambos grupos de viales, se colocaron 25 esclerocios de P. omnivora (por vial) durante una hora, y luego se midió el pH y los esclerocios se extrajeron y germinaron. Los esclerocios fueron reproducidos, cosechados, manejados y germinados según lo indicado por Samaniego-Gaxiola (2008).
Desde el segundo hasta el quinto día de incubación de los frascos, se tomaron muestras compuestas del sobrenadante, para cada dosis de glucosa-suelo 0.0, 0.5, 2.0 y 4.0 mg g-1. Cada muestra compuesta de 10 ml se analizó para ácidos orgánicos, mediante cromatografía líquida de alta presión, en una columna Aminex HPX 87H, 300 x 7,8 mm, con fase móvil: H2SO4 5 mM, condiciones de flujo de 0,5 ml / min, 50 °C y análisis de detección por disposición de diodos a 210 nm. La cuantificación de la curva estándar se obtuvo por estándares de referencia. El perfil de cada ácido se verificó mediante el espectro de absorción y el tiempo de retención correspondiente.
En Hormiguero, en marzo de 2012, se establecieron un control y seis tratamientos aleatorios, cada tratamiento tuvo cuatro repeticiones. La repetición fue una microparcela de 3x2 m, donde se sembraron equidistantemente 12 semillas de nuez pecanera. Entre parcelas, hacia ambos extremos, de dejaron cuatro metros de tierra sin sembrar. El tratamiento control (C) consistió en la siembra en seco de la nuez y luego la aplicación de una lámina de irrigación de 15 cm, que fue similar para los tratamientos. En el tratamiento suelo desecado (DS) el suelo se extrajo hasta 60 cm y secó al sol para alcanzar una humedad inferior al 5%, luego se devolvió el suelo al pozo y se sembraron las nueces. La humedad de todos los tratamientos (suelos con o sin desecación) se determinó tomando dos muestras de 100 g para cada profundidad y repetición; Todas las muestras se pesaron antes y después de secar durante 48 horas con aire seco a 100 °C para determinar su contenido de humedad (W/W). La RSD se implementó utilizando melazas P/P (M) a una tasa de 33 kg (55 t ha-1), las melazas se disolvieron en 800 l de agua de riego y se vertieron en la parcela, y luego la superficie se cubrió durante 14 d con plástico negro Polietileno de 600 µm. El tercer día después de aplicar las melazas, se vertieron 100 l de una solución de H2SO4 (23 mmol L-1) en el suelo (retirando el plástico). La parcela se cubrió nuevamente con plástico durante 11 d, luego se destapó por dos semanas para permitir la aireación, y después se sembraron las nueces. Un aislado de T. harzianum (T) obtenido de la rizósfera de nogal pecanero se utilizó para hacer un inóculo agua, arena y paja de trigo, según lo descrito por Lewis y Papavizas (1984), se aplicó 3 kg de inóculo (peso seco) por parcela. Otros tres tratamientos combinados fueron DS + M, DS+T y DS+M+T, según el caso, primero se secó el suelo, luego se agregaron las melazas y finalmente se aplicó T. harzianum.
En cada parcela, el tercer día después de aplicar las melazas, ocho tubos de PVC se enterraron equidistantemente a 60 cm de profundidad. En el cuarto y séptimo día, la mitad de los tubos se extrajeron, respectivamente, se cortaron en segmentos de 0-20, 20-40 y 40-60 cm y congelaron hasta el análisis del suelo; mediante un extracto agua-suelo 2:1 donde se midieron el pH y el ORP.
De septiembre a octubre de cada año 2013-2015, se evaluó la incidencia de la pudrición texana y la mortalidad de los nogales. Cuando los nogales mostraban hojas marchitas se consideró enfermos; mientras que los árboles muertos, tenían seca la epidermis de ramas y tallos. Sin embargo, algunos nogales enfermos se marchitaron y defoliaron, pero su madera estaba viva y se recuperaron al siguiente año; Al principio, uno de estos árboles se consideró muerto, pero sus raíces estaban invadidas al mismo tiempo por P. omnivora y Trichoderma sp. Por lo tanto, el resto de los nogales marchitos con su epidermis viva, no fueron removidos y sus raíces tampoco fueron inspeccionadas.
A los datos de pH y ORP del experimento de laboratorio, se aplicó un análisis de varianza de dos vías (efectos del tratamiento) para mediciones repetidas o tiempo de muestreo (rmANOVA) SAS (1999). En el experimento de campo, el análisis de pH y ORP fue un ANOVA para cada tiempo de muestreo, porque provenía de diferentes muestras. La incidencia y la mortalidad de los árboles de pacana se analizaron cada año por separado mediante un ANOVA. Cuando los análisis estadísticos fueron significativos (P<0,001), la comparación de medias entre tratamientos se realizó con la prueba de rango múltiple de medias de Duncan (P=0,05).
El pH alcanzó hasta 6.2 y se mantuvo en el suelo adicionado con 4.0 mg g-1 de glucosa, las dosis más bajas de glucosa no permitieron un pH tan bajo o solo hasta el segundo día; el suelo sin glucosa mantuvo un pH alrededor de 8. El error estándar de los valores de pH del sobrenadante después de colocar esclerocios de P. omnivora aumentó con respecto al sobrenadante sin los esclerocios (Figura 1).
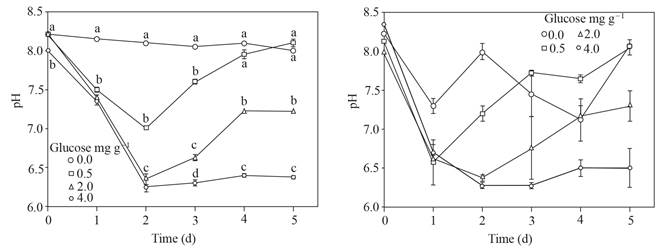
Figura 1 Izquierda, pH del sobrenadante obtenido del suelo con glucosa agregada e inundada hasta 5 d. Derecha, pH del sobrenadante después de colocar 25 esclerocios de P. omnivora durante una hora. Barra de error estándar n=8, las mismas letras sobre la barra no son significativamente diferentes según la prueba de separación de medios de Duncan (P>0.05).
El ORP descendió solo en el suelo con glucosa a medida que pasaba el tiempo, hasta alcanzar valores de -50 a - 250 mV, y permaneció alrededor de 50 mV en el suelo sin glucosa (Figura 2).
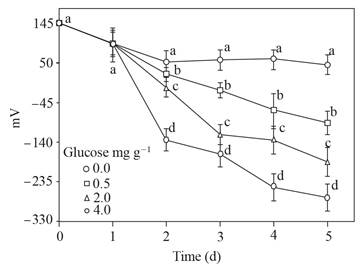
Figura 2 Potencial oxidación-reducción (mV) del sobrenadante obtenido del suelo con glucosa agregada e inundado hasta 5 d. Barra de error estándar n=8, las mismas letras sobre la barra no son significativamente diferentes, según la prueba de separación de medios de Duncan (P>0.05).
Los ácidos orgánicos detectados en los sobrenadantes entre los días dos y cinco de los suelos adicionados con glucosa se indican en la Cuadro 1. El total de VAFs detectados desde el tercer día de incubación fue casi dos veces (20 contra 11 mmol L-1) en 4.0 versus 2,0 mg g-1 de glucosa agregada en el suelo; y solo <0.2 mmol L-1 fue detectado de otros ácidos orgánicos.
Las cantidades de ácido sulfúrico para ajustar a ~ 4 el pH del sobrenadante se muestran en la Figura 3; solo los sobrenadantes obtenidos de los suelos con 2.0 y 4.0 mg g-1 de glucosa agregada excedieron los 60 μL y alcanzaron cerca de 180 μL de ácido sulfúrico.
Los valores de pH de los sobrenadantes ajustados a pH ~ 4 y los alcanzados en los sobrenadantes donde permanecieron esclerocios de P. omnivora se muestran en la Figura 4; el pH de estos últimos oscilaron alrededor de 4.5 a 2.5, en contraste con el pH de los sobrenadantes sin esclerocios fluctuaron de 4.2 a 3.9.
Cuadro 1 Ácidos grasos volátiles y otros ácidos orgánicos, detectados en sobrenadantes obtenidos del suelo con dosis agregadas de glucosa-suelo de 0.0, 2.0 y 4.0 mg g-1 e inundadas hasta cinco días.
| Dose | Day | Acidsz in mmol L-1 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Volatile fatty acids | Other organic acids | Total mmol L-1 | |||||||
| mg g-1 | AA | AB | AF | AC | AL | AS | Volatile | Other | |
| 0 | 5 | Nd | Nd | Nd | Nd | Nd | Nd | Nd | Nd |
| 2 | 2 | 4.85 | Nd | 0.93 | 0.01 | 0.02 | Nd | 5.78 | 0.03 |
| 3 | 9.71 | Nd | Nd | Nd | 0.01 | Nd | 9.82 | 0.01 | |
| 4 | 9.68 | 0.14 | Nd | 0.01 | Nd | Nd | 11.00 | Nd | |
| 5 | 11.15 | 0.08 | Nd | Nd | 0.01 | Nd | 11.23 | 0.01 | |
| 4 | 2 | 6.23 | 0.07 | 1.37 | 0.02 | 0.09 | 0.01 | 7.67 | 0.11 |
| 3 | 18.23 | Nd | 0.09 | Nd | Nd | 0.015 | 18.31 | 0.01 | |
| 4 | 20.06 | Nd | 0.07 | 0.01 | 0.04 | 0.051 | 20.12 | 0.10 | |
| 5 | 22.02 | Nd | 0.09 | 0.01 | 0.02 | 0.038 | 22.10 | 0.07 | |
z Ácidos, AA = acético; AB = butírico; AF = fórmico; AC = cítrico; AL = láctico; AS = succínico / z Acids, AA = acetic; AB = butyric; AF = formic; AC = citric; AL = lactic; AS = succinic.
Nd = No detectado / Nd = No detected.
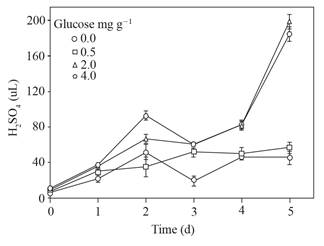
Figura 3 Ácido sulfúrico utilizado para ajustar el pH (~ 4) del sobrenadante obtenido del suelo con glucosa agregada e inundado hasta 5 d. Barra de error estándar n=8.
Los esclerocios de P. omnivora sobrevivieron entre 90 y 100% en los sobrenadantes en los que no se ajustó el pH, en contraste, una supervivencia del 0 al 20% de los esclerocios que permanecieron una hora en sobrenadantes obtenidos del suelo con 2.0 y 4.0 mg g-1 de glucosa añadida, con dos días de inundación y cuyo pH se ajustó ~ 4, (Figura 5). El porcentaje de humedad en los suelos no desecados y donde se aplicaron tratamientos osciló de 6.8 a 9.6, de 9.6 a 11.1 y de 10.9 a 11.6% en las profundidades de 0-20, 20-40 y 40-60 cm, respectivamente; mientras que en suelos desecados la humedad fue de 1.7 a 3.9%.
En tratamientos donde se agregó melazas al suelo, el pH promedio varió de 7 a 6.5, pero donde no se agregó fue de 7 a 7.5. Los rangos promedio de ORP de -20 a -60 mV se observaron en tratamientos de suelo sin melaza, pero en suelos con melaza, los rangos de ORP fueron de -120 a -200 mV. Los tratamiento (M) suelos con melaza agregada, el pH mínimo fue de 6.4, pero donde no se agregó la melaza (C) fue de 7.3; mientras que en tratamientos similares, el ORP mínimo de -60 mV y -200 mV, respectivamente. (Figura 6).

Figura 4 Izquierda, pH ajustado a ~ 4 del sobrenadante obtenido del suelo con glucosa agregada e inundado hasta 5 d. A la derecha, pH del sobrenadante después de colocar 25 esclerocios de P. omnivora durante 1 h.

Figura 5 Supervivencia de los esclerocios de P. omnivora en los sobrenadantes, donde el pH no se ajustó (derecha) o donde el pH se ajustó a ~ 4 (izquierda). Ambos sobrenadantes se obtuvieron del suelo con glucosa agregada e inundado hasta 5 d. Barra de error estándar n=8.

Figura 6 Izquierda, cambios en pH y derecha, cambio de ORP (mV). Ambos cambios después de cuatro o siete días para los tratamientos con melaza (M), con T. harzianum (T), suelo desecado (DS), sin tratamiento o control (C) y combinaciones (DS+T, DS+M y DS+T+M). Barra de error estándar n=4, las mismas letras sobre la barra no son significativamente diferentes según la prueba de separación de medios de Duncan (P>0.05).
Para cada año, no hubo diferencias significativas en incidencia y muerte de los nogales. En 2013, no se detectaron nogales con síntomas de pudrición texana ni muertos. Para 2014, la incidencia de la enfermedad fue de 2 a 48% y para 2015 de 27 a 69%. La mortandad de los nogales varió de 2 a 29 y de 27 a 54%, en los años 2014 y 2015, respectivamente. El tratamiento DS+T+M tuvo la menor incidencia y mortandad de nogales, con 0, 2 y 27% para los años 2013, 2014 y 2015, respectivamente.
La RSD puede inducirse con residuos de cultivos, fertilizantes o materiales orgánicos que proporcionen C orgánico para los microorganismos del suelo; sustratos utilizados tan diversos como melaza, glucosa, etanol, salvado y pajas de cereales, residuos de canola (Brassica napus), orujo de uva, alfalfa, semillas de mostaza (Brassica juncea), residuos de pasto, excreta líquida de cerdo, entre otros (Conn et al., 2005; Hewavitharana y Mazzola, 2016; Shrestha et al., 2016).
Cuando las fuentes de C son residuos de cultivos o abono verde, las cantidades que se usan generalmente para RSD varían de 20 a 40 t ha-1, lo que permite el control de hongos, bacterias, nematodos y malezas (Katase et al., 2009; Shrestha et al., 2016; Shennan et al., 2014).
Dos indicadores del proceso de RSD son cambios de acidez de pH (<7) y ORP reductivos (-200 mV) (Momma, 2008); estos cambios se observaron en este trabajo, tanto en suelos agregados con glucosa como con melazas. En este trabajo, la cantidad de C agregada como glucosa (2.0-4.0 mg g-1) que indujo la muerte de los esclerocios de P. omnivora fue consistente con trabajos previos (Liu et al., 2016; Samaniego-Gaxiola, 1994) y concordó con el C (4 mg C g-1) calculada para el control de otros fitopatógenos en suelo (Shennan et al., 2014). El ácido acético en solución necesario para matar más del 50% de los esclerocios de P. omnivora en un período de tiempo entre 5 y 1 h fue de 17 a 33 mmol L-1, respectivamente (Samaniego-Gaxiola y Balagurusamy, 2013); en contraste, en este estudio, observamos que el 80% de los esclerocios murieron en 1 h después de permanecer en los sobrenadantes a pH ~ 4 que contenían de 5,8 a 22 mmol L-1 de VAFs (Cuadro 1 y Figura 5). Esto sugiere que los sobrenadantes pueden contener otros compuestos tóxicos para los esclerocios y que el pH debe ajustarse para que estos compuestos aumenten su toxicidad. Otros compuestos orgánicos como el alil isotiocianato, sulfuros, disulfuros y trisulfuros se producen en la RSD utilizando semillas de mostaza, que han demostrado ser antifúngicas y nematicidas (Hewavitharana et al., 2014); así como los iones Fe2 + y Mn2 + son igualmente tóxicos en condiciones RSD para Fusarium oxysporum f. sp. lycopersici (Momma et al., 2011). En concordancia con Samaniego-Gaxiola y Pedroza-Sandoval (2013); Tenuta et al. (2002); Tenuta y Lazarovits (2002), la ecuación de Henderson-Hasselbalch predice la toxicidad y las formas químicas de los VAFs, del ácido nitroso y del amoníaco en función del pH. Adicionalmente, la RSD permitió el control de hongos fitopatógenos si los VAFs, pasaban a ácido nitroso y el amoníaco en un pH≤5 y un pH≥8, respectivamente, Lazarovits (et al., 2005). Lo último, también concuerda con nuestros resultados, donde los esclerocios solo murieron en los sobrenadantes donde se ajustó el pH ~ 4.
Tres veces más ácido sulfúrico se necesitó para ajustar el pH ~ 4 de los sobrenadantes con 0.0 y 0.5 que con 2 y 4 mg g-1 de glucosa agregada en el suelo (Figura 3) ello apunta a la formación de compuestos con la capacidad de amortiguadora de pH, además de los VAFs. Asimismo, los cambios en el pH observados en las soluciones donde permanecieron los esclerocios (Figura 4) sugieren que responden a la modificación del pH de su entorno, previamente consignado (Samaniego-Gaxiola, 2013).
En el campo, los suelos con o sin melaza mostraron diferencias en pH y ORP (Figura 6). Si bien, durante el primer año no hubo síntomas de nogales enfermos, en los años siguientes observamos lo contrario, posiblemente debido a la colonización de las raíces por P. omnivora fuera del suelo tratado y la restauración de una condición favorable para ello. Los nogales del huerto de Hormiguero, durante los tres años de nuestro trabajo de campo, ninguno de los nogales adultos murió, sin embargo, en un vivero alrededor de nuestro lugar de trabajo, 179 (11% de 1504) de nogales murieron por la pudrición texana ( Samaniego-Gaxiola et al., 2014). Lo que sugiere que Phymatotrichopsis está ampliamente distribuida en el suelo de Hormiguero, pero el nogal adulto tolera su ataque y sobrevive pero el árbol joven no. Esto explicaría por qué los nogales adultos del de Hormiguero no murieron durante los tres años de este estudio. Aunque, este trabajo no tuvo el alcance para evaluar el papel de Trichoderma spp. en suelo de la huerta, la colonización de Trichoderma sobre cordones de P. omnivora y las raíces de los nogales fue evidente; en contraste, la muerte de nogales durante el tercer año fue de 27-54% (Figura 7) muy por encima del 11% mencionado, lo que sugiere que ninguno de nuestros tratamientos tuvo efecto en la protección de los nogales contra P. omnivora.
En La Laguna, México, en el suelo de huertos de nogal, es común encontrar especies de Trichoderma (Samaniego-Gaxiola y Chew-Madinaveitia, 2007) e incluso en las raíces o en la rizósfera (inédito). Si bien, no hubo diferencias significativas en ningún año en la incidencia y muerte de los nogales, los tratamientos con Trichoderma tuvieron la incidencia más baja de la enfermedad (Figura 7). Es posible que T. harzianum utilizado en este trabajo u otros Trichoderma nativos, se conviertan en antagonistas de P. omnivora, colonicen permanentemente el suelo y raíces o los árboles adquieran resistencia al ataque del fitopatógeno; aunque estas relaciones estaba fuera del alcance de este trabajo y aún se está investigando, fue evidente la presencia de T. harzianum en el suelo y en las raíces del nogal, que inicialmente se consideró muerto (Figura 8).
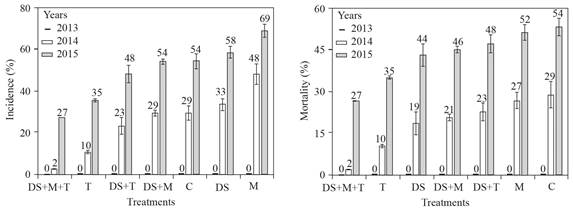
Figura 7 Incidencia de pudrición texana (izquierda) y mortandad de árboles (derecha) en tratamientos aplicados al suelo de Melaza (M), T. harzianum (T), suelo desecado (DS), sin tratamiento o control (C) y las combinaciones (DS+T, DS+M y DS+M+T). La barra de error estándar n=4, el número sobre la barra indica el porcentaje de incidencia y muerte de los nogales.
Shrestha et al. (2013) encontraron que con RSD los Sclerotium rolfsii Sacc. se colonizaron entre 93-94% por Trichoderma spp. nativos del suelo. En consecuencia, los hongos y las bacterias antagonistas de los hongos fitopatógenos en el suelo podrían establecerse después de la RSD, lo cual es un beneficio potencial de este método. Esta idea está respaldada por RSD donde se eliminó patógenos y modificó la biota del suelo, con antagonistas de los fitopatógenos y al ciclo de nutrientes benéficos para el crecimiento de los cultivos (Huang et al., 2015). Si bien, el aporte de C utilizado en la RSD y el subsiguiente establecimiento de cultivos, determinará el tipo de microbiota dominante en el suelo (Huang et al., 2016); es decir, la adición de fuentes de C en la RSD, induce un cambio de microbiota en el suelo, lo que depende tanto de la fuente de C como de la microbiota nativa del cultivo. Una modalidad de la RSD es usar varios sustratos como fuente de C para el control de un solo patógeno (Phytophthora nicotianae) (Serrano-Pérez et al., 2017).
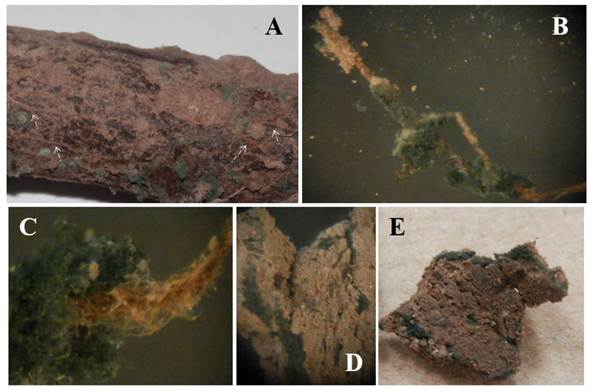
Figura 8 Trichoderma sp. en la raíz del nogal y cordones de P. omnivora y en suelo. A. Cordones en las raíces (flechas blan cas), las áreas verdes son Trichoderma sp. sobre cordones y raíces. B y C. Trichoderma sp. envolviendo los cordo nes. D y E. Cordones envueltos por Trichoderma sp. dentro de las grietas del suelo.
Según Liu et al. (2018) después de la RSD fue posible reducir las poblaciones de Fusarium oxysporum f. sp. en el suelo cultivado con sandía (Citrullus lanatus (Thunb.) Matsum y Nakai), también se redujo significativamente el marchitamiento causado por F. oxysporum; pero las poblaciones del patógeno se restauraron cuando la sandía se sembró en un segundo ciclo, la enfermedad se restableció y se favoreció el aumento de otros patógenos del cultivo como Monosporascus. En nuestro caso, P. omnivora posiblemente recoloniza el suelo a partir del segundo año, donde los cordones fueron evidentes en las raíces del nogal.











 texto em
texto em 


