Ante el inminente ingreso a territorio mexicano de Candidatus Liberibacter asiaticus (CLas), SENASICA desarrolló en 2008 un Plan de Emergencia el cual derivó en una Campaña Contra el HLB de los Cítricos sustentado en la detección en planta y vector del agente bacteriano CLas (SIRVEF, 2018; Flores-Sánchez et al., 2017; Mora-Aguilera et al, 2014). Sin embargo, la confiabilidad del diagnóstico molecular debe incluir a CLas y otros organismos capaces de inducir síntomas similares al HLB, consistentes en moteados cloróticos y asimétricos, leve aclaramiento de nervaduras y amarillamiento foliar (Esquivel-Chávez et al, 2012). En Brasil y China en 2008 y 2009, y recientemente en 2018, se reportaron fitoplasmas pertenecientes a los grupos 16Sr I y IX en Citrus sinensis causando síntomas similares al HLB (Wulff et al., 2018; Chen et al., 2009; Teixeira et al., 2008). Debido a la importancia del muestreo en la planeación y operación de Campaña Contra el HLB y a la necesidad de diagnósticos moleculares masivos y confiables, el presente trabajo tuvo como objetivo detectar la ocurrencia de fitoplasmas en árboles de Citrus spp mediante PCR anidado y secuenciación con el propósito de establecer la potencial implicación de estos organismos en la detección de CLas en diferentes especies citrícolas e identificar hospederos alternos y potenciales insectos vectores para su eventual integración en modelos de riesgo y control.
A partir de una alerta fitosanitaria emitida por el Comité Estatal de Sanidad Vegetal de Hidalgo, en la cual árboles de Citrus spp con síntomas típicos a CLas tuvieron un diagnóstico negativo, en julio 2013 se exploraron 15 huertas familiares y comerciales de los municipios Atlapexco, Huejutla, Orizatlán, Xochiatipan y Jaltocan. Se realizó un muestreo dirigido a 16 árboles de Citrus sinensis, C. latifolia, C. aurantifolia y C. limetta con síntomas foliares consistentes en moteados cloróticos asimétricos, aclaramiento de nervaduras y corchosis (Cuadro 1). Se conformó una muestra compuesta por árbol a partir de tejido colectado por cada orientación cardinal y centro del dosel. Por cada orientación se colectó una vareta de 10-15 cm con 2-5 hojas maduras del ciclo vegetativo anterior. Adicionalmente, se colectaron hojas, ramas y tallos de 13 malezas que presentaron síntomas sospechosos a infección por fitoplasmas consistentes en clorosis, acortamiento de entrenudos, proliferación de brotes, filodia y/o virescencia. Las muestras de tejido vegetal se conservaron en hieleras para su traslado a laboratorio donde se mantuvieron a 4 °C por 2-3 días hasta su procesamiento. Los insectos asociados a árboles y malezas muestreadas se colectaron con una red entomológica de golpeo y se conservaron en alcohol al 70% para su posterior identificación en la UACH y posterior confirmación en el laboratorio de entomología del Centro Nacional de Referencia Fitosanitaria, DGSV. Las muestras de malezas positivas a fitoplasmas se identificaron taxonómicamente en el herbario del Colegio de Postgraduados, Campus Montecillo. Otras regiones y cultivos que se seleccionaron por el grupo de investigación COLPOS-LANREF incluyeron C. aurantifolia en Armeria, Colima en 2012 con 10 árboles; C. sinensis y C. latifolia en Acateno, Puebla; Papantla, Martínez de la Torre, Tihutlán y Álamo, Veracruz en 2018 con un total de 49 muestras obtenidas de árboles con síntomas típicos de HLB pero con antecedentes de resultados negativos a CLas (Cuadro 1).
Cuadro 1. Especies de cítricos y arvenses positivas a CLas, al Brazilian Huanglongbing disease-associated phytoplasma, y a un putativo fitoplasma del Aster yellow group. Principal síntoma observado en muestreos dirigidos a huertos comerciales y de traspatio de cuatro entidades federativas de México en 2012, 2013 y 2018.
| Estado | Especie Botánica | Muestras Positivas | Principal Síntoma | xBHDA phytoplasma | yAY phytoplasma | zHLB |
|---|---|---|---|---|---|---|
| Hidalgo | Citrus latifolia | 1/6 | Aclaramiento nervaduras | + | - | 0/6 |
| C. aurantifolia | 1/3 | Moteados | + | - | 0/3 | |
| C. limetta | 0/5 | Variegado | - | - | 0/5 | |
| C. sinensis | 0/2 | Clorosis | - | - | 0/2 | |
| Bidens odorata | 1/1 | Filodia | + | - | 0/1 | |
| Cajanus cajan | 1/1 | Escoba de bruja | + | - | 0/1 | |
| Catharanthus roseus | 2/2 | Filodia y virescencia | - | + | NA | |
| Commelina difusa | 0/1 | Clorosis | - | - | NA | |
| Cuscuta sp | 0/1 | Clorosis | - | - | NA | |
| Murraya paniculata | 0/1 | Clorosis | - | - | 0/1 | |
| Otras especies | 0/6 | Clorosis | - | - | NA | |
| Colima | C. aurantifolia | 7/10 | Moteado | - | - | 7/10 |
| Puebla | C. paradisi | 1/1 | Moteado | - | - | 1/1 |
| Veracruz | C. sinensis | 0/17 | Moteado | - | - | 0/17 |
| C. reticulata | 0/12 | Moteado | - | - | 0/12 | |
| C. latifolia | 0/9 | Moteado | - | - | 0/9 | |
XBrazilian Huanglongbing disease-associated phytoplasma, iniciadores P1/P7 y D7f2/D7r2 / Brazilian Huanglongbing disease-associated phytoplasma, primers P1/P7 and D7f2/D7r2
Y Putativo fitoplasma perteneciente al Aster yellow group, iniciadores P1/P7 y R16F2/R16R2 / Putative phytoplasma belonging to the Aster yellow group, primers P1/P7 and R16F2/R16R2
ZCandidatus Liberibacter asiaticus, iniciadores A2/J5 / Candidatus Liberibacter asiaticus, primers A2/J5.
La extracción de ADN total se realizó con DNaesy® Plant Mini Kit (Qiagen) a partir de 0.1 gr de tejido vegetal consistente en peciolos, nervaduras centrales y trozos de tallos de ramillas de 1-0.5 cm diámetro. La detección de fitoplasmas se realizó mediante PCR anidado con iniciadores asociados al gen 16S del rRNA (Ahrens & Semüller, 1992). Para la primera reacción de PCR se emplearon los iniciadores universales P1/P7 (Berges et al., 2000; Ahrens & Semüller, 1992). La segunda reacción PCR se realizó en forma independiente con dos pares de iniciadores: R16F2/R16R2, universales a fitoplasmas (Lee et al., 1993), y con D7f2/D7r2 específicos al Brazilian Huanglongbing disease-associated phytoplasma (BHDA-Phytoplasma) (Teixeira et al., 2008). Para la primera PCR, el volumen de reacción consistió en 25 µL constituido por: 1X de buffer GoTaq, 1.5 mM de MgCl2, 200 mM dNTP´s, 20 pmol de cada primer, 2 unidades de DNA Taq polimerasa (Promega) y 2 µL de ADN total. El programa térmico consistió en desnaturalización por 4 min a 94 °C continuado con 35 ciclos a 92 °C por 45 s, 58 °C por 45 s y 72 °C por 90 s y una extensión final a 72 °C por 7 min. Para la segunda PCR, la reacción se realizó con 25 µL totales que incluyeron: 1X de buffer GoTaq, 1.5 mM de MgCl2, 200 mM dNTP´s, 20 pmol de cada primer, 2 unidades de DNA Taq polimerasa (Promega) y 5 µL producto del primer PCR diluido 1:10. El programa térmico para la reacción con los iniciadores R16F2/R16R2 consistió en desnaturalización a 94 °C por 5 min seguido de 35 ciclos: 94 °C por 30 s, 53 °C por 50 s ,72 °C por 80 s y una extensión final a 72 °C por 10 min. Para la reacción con los iniciadores D7f2/D7r2 se realizó desnaturalización a 94 °C por 3 min y 40 ciclos a 92 °C por 45 s, 62 °C por 45 s, 72 °C por 90 s y una extensión final a 72 °C por 7 min.
Las muestras de cítricos también fueron analizadas mediante PCR para la detección de CLas, utilizando los iniciadores A2/J5. El volumen de reacción consistió en 25 µL: 1X de buffer GoTaq, 1.5 mM de MgCl2, 200 mM dNTP´s, 20 pmol de cada primer y 2 unidades de DNA Taq polimerasa. El programa térmico consistió en desnaturalización a 94 °C por 4 min seguida de 35 ciclos a 92 °C por 45 s, 58 °C por 45 s, 72 °C por 90 s y una extensión final a 72 °C por 7 min. En todos los casos, los fragmentos amplificados fueron analizados por electroforesis mediante un gel de agarosa al 1.5% y visualizados con un transiluminador de luz UV previo teñido con bromuro de etidio. Amplicones positivos a fitoplamas fueron secuenciados en el Laboratorio de Biología Molecular del Centro Nacional de Referencia Fitosanitaria (DGSV, CNRF). Las secuencias parciales del gen 16S rRNA obtenidas con los iniciadores D7f2/ D7r2 se alinearon con las reportadas en el National Center for Biotechnology Information (NCBI) y se registraron en dicho sistema. Se realizó un análisis filogenético con las secuencias encontradas en C. latifolia y C. aurantifolia y las reportadas por otros investigadores (Wulff et al., 2018; Arratia et al., 2015; Chen et al., 2009). Previamente se empleó Seq Scanner v2 para depurar las secuencias, seguido de BioEdit para editar la alineación y obtener las secuencias consenso en formato FASTA. Finalmente se utilizó MEGA v7 para generar el árbol filogenético.
Únicamente muestras de cítricos y arvenses de Hidalgo fueron positivas a fitoplasmas pero no a CLas. El PCR anidado con los iniciadores P1/P7 y D7f2/D7r2 amplificaron un fragmento de 857 pb correspondiente al BHDA-Phytoplasma, perteneciente al Pigeon pea witches’-broom phytoplasma grupo 16Sr IX (99% homología). Las muestras positivas fueron de C. latifolia (1/6), C. aurantifolia (1/3) y de arvenses identificadas como Bidens odorata y Cajanus cajan (2/13), aunque con homologías entre 80 y 89% (Cuadro 1, Figura 1). Las secuencias obtenidas de C. latifolia y C. aurantifolia fueron registradas en NCBI con los números de accesión MK282760 y MK282761, respectivamente. Con los iniciadores P1/P7 y R16F2/R16R2 se amplificó un fragmento de 1200 pb en 2 muestras de Catharanthus roseus posiblemente perteneciente a un fitoplasma del grupo Aster Yellow (Torres et al., 2004). En las muestras de los otros estados se detectó a CLas pero no fitoplamas. El 70% muestras de C. aurantifolia provenientes de Colima (7/10) resultaron positivas a CLas, mientras que en el corredor citrícola Acateno-Álamo, solo 1/39 resultó positiva a pesar de que los cítricos mostraron sintomatología de clorosis moteada similar a la causada por la bacteria (Esquivel-Chavez et al., 2012). Estos resultados indican la presencia restringida del BHDA-Phytoplasma, y posiblemente del un miembro del grupo Aster Yellow en malezas (Torres et al., 2004), pero no asociado en infecciones mixtas con CLas. Complementariamente, Arratia y colaboradores (2015) detectaron en Sinaloa, Nayarit y Colima a Candidatus Phytoplasma asteris, un novel taxón incluido en el grupo 16SrI (Lee et al., 2004), causando síntomas similares al HLB en árboles de C. aurantifolia, C. latifolia y C. sinensis en infecciones independientes o mixtas con CLas (20/86 muestras). Aunque no se incluyeron arvences o potenciales insectos vectores en ese trabajo, la frecuencia de este fitoplasma, la diversidad de cítricos infectados y la presencia de infecciones mixtas en la vertiente del Pacífico sugiere la necesidad de incluir este patógeno en estudios epidemiológicos considerando que el grupo 16SrI es uno de los más prevalentes al infectar a más de 100 hospedantes de importancia económica a nivel mundial (Lee et al, 2004).

Figura 1 Visualización en gel de agarosa de fragmentos ADN amplificados mediante PCR anidado a partir de muestras vegetales provenientes de Hidalgo, México. Fragmentos de 1200 pb obtenidos con iniciadores P1/P7 y R16F2/ R16R2 de muestras de Catharanthus roseus. Fragmentos de 857 pb obtenidos con iniciadores P1/P7 y D7f2/D7r2 de muestras de Citrus aurantifolia y C. latifolia, Bidens odorata y Cajanus cajan. Marcador peso molecular (MPM- 100 Pb), (+) Testigo positivo y (-) Testigo negativo.
Los síntomas foliares en C. latifolia se caracterizaron por un amarillamiento y engrosamiento de nervaduras, manchas cloróticas angulares, moteados difusos y acorchamiento. En C. aurantifolia se observó un moteado clorótico irregular y moderado engrosamiento de nervaduras (Figura 2). En Brasil, los síntomas causados por BHDA-Phytoplasma en C. sinensis son indistinguibles a los CLas (Teixeira et al., 2009); mientras que en México, los síntomas inducidos por este fitoplasma en cítricos agrios no corresponden a los reportados para HLB (Esquivel-Chávez et al., 2012; Robles et al., 2010). B. odorata exhibió filodia, coloraciones rojizas, reducción de área foliar, acortamiento de entrenudos, proliferación y achaparramiento de planta (Figura 3). En general, estos síntomas han sido ampliamente asociados a infección por fitoplasmas (Bertaccini y Duduk, 2009). Esta arvense, la cual concurrió en el huerto con un árbol positivo de C. latifolia, tuvo una predominancia del 80% indicativo de su potencial como reservorio de inóculo. La muestra positiva de C. cajan se encontró en un huerto de traspatio de Citrus limetta. El síntoma de escoba de bruja consistente en proliferación de brotes, acortamiento de entrenudos, reducción general de crecimiento y clorosis foliar apical se mostraron en 50% del dosel planta (Figura 3). Sintomas similares causados por el mismo fitoplasma se han reportado en Brazil para Crotalaria juncea, una arvence de la familia fabaceae asociados con cítricos (Marques et al., 2010). Este es el primer reporte de B. odorata y C. cajan como hospedantes alternos del BHDA-Phytoplasma en México.

Figura 2 Síntomas de muestras positivas al Brazilian Huanglongbing disease-associated phytoplasma. A-D: Síntomas folia res en Citrus latifolia consistente en amarillamiento y engrosamiento de nervaduras, manchas cloróticas angu lares, moteados difusos y acorchamiento de nervaduras. E y F: Síntomas en C. aurantifolia caracterizados por moteados cloróticos irregulares.
Del total de insectos colectados en huertos citrícolas de Hidalgo se identificaron 77 ejemplares, pertenecientes a las familias Cicadellidae, Membracidae y Liviidade, con potencial de transmitir mollicutes y baterías (Weintraub y Beanland, 2006). Seis especies correspondieron a la familia Cicadellidae (Young, 1977; Medler, 1960; Beamer, R.H., 1944): Chlorogonalia coeruleovittata (7/61), Apogonalia stali (4/61), Graphocephala sp (7/61), Tylozygus fasciatus (8/61), Agrosoma syklis (9/61), Acinopterus sp (5/61). Únicamente se encontró una colonia (20/61) con estados inmaduros y adultos de Membrasis mexicana (Membracide) en C.cajan. De D. citri (Liviidae), vector de CLas, se colectaron 17/77 ejemplares (Figura 4). De estas especies, se han reportado miembros de los géneros Graphocephala y Acinopterus como potenciales vectores de fitoplasmas de los grupos 16Sr III-A y Aster Yellow, respectivamente (Weintraub y Beanland, 2006). En el futuro, es importante la caracterización a nivel de especie de los ejemplares de esos géneros encontrados en este trabajo y la revisión de otros reportes de cicadélidos asociados a cítricos en México. Por ejemplo, Blanco (2014), reportó 21 especies en la Península de Yucatán pero ninguna enlistada con capacidad de transmitir fitoplasmas (Weintraub y Beanland, 2006).

Figura 3 A-C: Síntomas en Cajanus cajan positiva al Brazilian Huanglongbing disease-associated phytoplasma (BHDA-phytoplasma); (A) Clorosis en ápices foliares, (B) Proliferación tipo fascinación en tallos, (C) Membrasis mexicana (Membracidae) en proliferación de tallos. E-G: Síntomas en Bidens odorata positiva a BHDA-phytoplasma; (E y F) Filodia en inflorescencias, (G) coloración rojizas en hojas. I-K: Síntomas en Catharathus roseus putativo a un fitoplasma del Aster yellow group; (I) Filodia floral, (J y K) Virescencia de flores. D-L: Síntomas de escoba de bruja en C. cajan (D), B. odorata (H) y C.roseus (L).
El análisis filogenético de secuencias parciales del gen 16S rRNA obtenidas en este trabajo y las publicadas para fitoplasmas que inducen síntomas similares o indistinguibles a los causados por CLas en cítricos muestra una clara discriminación genética entre grupos y posibles subgrupos (Figura 5).
El grupo 16Sr IX Pigeon pea witches-broom phytoplasma es aparentemente el más homogéneo e incluye las muestras de este trabajo y Brasil (Teixeira et al., 2010; Teixeira et al., 2008). Por otra parte, el grupo 16Sr I Aster Yellow Phytoplasma (AY180957), definió tres subgrupos con secuencias de Sinaloa, Colima y Nayarit (AB858474.1, AB858473.1 y AB858472.1, respectivamente) reportadas como miembros del novel taxón Candidatus phytoplasma asteri subgrupo S (Sinaloa y Colima) y B (Nayarit) (Arratia et al., 2015), así como una secuencia de C. sinensis procedente de China (Chen et al., 2009) con similar distancia a la secuencia tipo Aster Yellow. Aunque la agrupación asociada al 16Sr III X-Disease es preliminar debido a que las secuencias del fitoplasma recientemente reportado en Brasil aún no están publicadas en NCBI (Wulff et al., 2018), el empleo de secuencias referidas en dicha publicación permiten establecer que es un grupo relativamente más próximo al grupo 16Sr IX.

Figura 4 Insectos colectados en huertos con árboles cítricos o arvenses positivos al Brazilian Huanglongbing disease-asso ciated phytoplasma y a un putativo fitoplasma del Aster yellow group. Cicadellidae: (A) Chlorogonalia coeruleo vittata, (B) Apogonalia stali, (C) Graphocephala sp, (D) Tylozygus fasciatus, (E) Agrosoma syklis, (F) Acinopterus sp.; Liviidae: (G) Diaphorina citri; Membracidae: (H) Membrasis mexicana.
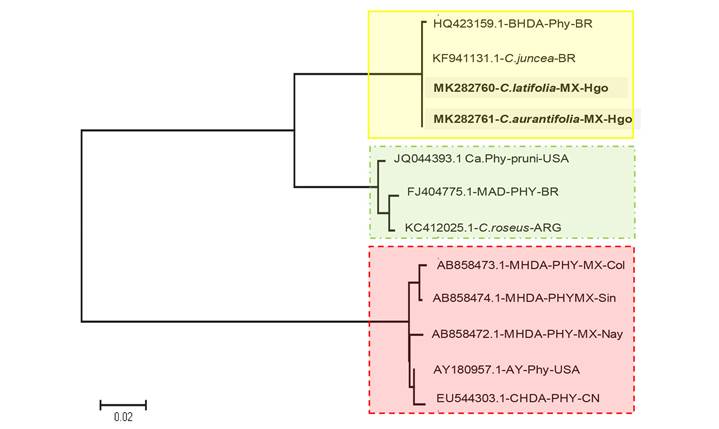
Figura 5 Árbol filogenético reconstruido con el método Maximum likelihood con base en el modelo de sustitución de nucleó tidos General Time Reversible (GTR+I) con 500 bootstrap. Tres ramas principales se conforman diferencialmente: 1). 16Sr IX con muestras de C.sinensis y Crotalaria juncea de Brasil, y C. latifolia y C. aurantifolia de Hidalgo, México encontradas en este trabajo (recuadro amarillo y línea sólida). 2). 16Sr III con el reciente reporte de Brasil en C. sinensis (recuadro verde y línea punteada-guion), y 3). 16Sr I conformado con muestras de Citrus spp repor tadas porArratia et al., 2015(recuadro rojo y línea en guiones).
Estos resultados demuestran la presencia del Brazilian Huanglongbing disease-associated phytoplasma (BHDA-Phytoplasma), miembro del grupo 16Sr IX, asociado a C. latifolia y C. aurantifolia en México induciendo síntomas similares, no indistintos a los causador por CLas. Estos hospederos se reportan por primera vez en adición su original reporte en C. sinensis en Brasil (Teixeira et al., 2008). Por otra, parte se reporta a B. odorata y C. cajan como probables hospederos alternos del BHDA-Phytoplasma en México. Este fitoplasma se suma al reportado por Arratia et al., 2015 para la región del Pacífico mexicano perteneciente al taxón Candidatus phytoplasma asteri del grupo 16Sr I. La presencia de estos fitoplasmas indican la necesidad de desarrollar sistemas de diagnóstico robustos para CLas, patógeno con aparente mayor aptitud parasítica y epidemiológica, pero que puede desarrollar síntomas confundibles con al menos tres tipos de fitoplasmas (miembros de 16SrI, 16SrIII y 16Sr IX). Estudios epidemiológicos, incluyendo el rol de potenciales vectores y hospederos alternos, requieren ejecutarse en México para establecer los factores de riesgo e implicaciones simbióticas entre organismos parasíticos del bioma de los cítricos con el fin de un efectivo manejo fitosanitario.











 texto em
texto em 


