El papayo (Carica papaya L.) es un frutal originario de Centroamérica y del Sur de México, aunque su área de domesticación no se ha definido completamente (Fuentes y Santamaría, 2014). La introducción de la variedad (var) Maradol en México desplazó y puso en riesgo de extinción a los genotipos nativos que carecen de propiedades adecuadas para el mercado, pero que presentan diversidad de caracteres, entre los que se encuentran el cera, mamey y coco, comercializados en mercados locales (Villanueva-Jiménez et al., 2015); en estado silvestre se puede colectar al papayo de monte o pajarito (Romero, 2013). El germoplasma de papayo nativo no se ha evaluado a profundidad, especialmente la susceptibilidad al virus de la mancha anular (PRSV-p), Potyvirus que reduce entre 5 y 100% el rendimiento, impide el crecimiento de la planta y afecta drásticamente el tamaño y calidad del fruto. Este virus es transmitido de manera no persistente por áfidos (Hemiptera: Aphididae), entre los que resaltan Myzus persicae, Aphis gossypii y A. nerii. (Villanueva-Jiménez et al., 2015; Hernández-Castro et al., 2015). La Red Papaya del Sistema Nacional de Recursos Fitogenéticos para la Alimentación y la Agricultura (SINAREFI (2017) rescata el germoplasma nativo de México, en el que pudiera existir material tolerante al PRSV-p. Por tanto, se planteó como objetivo evaluar la respuesta de 13 accesiones (Acc) de papayo nativo y la var Maradol roja respecto a la incidencia y severidad del PRSV-p, inoculado con el insecto vector A. nerii, y su relación con el manejo de la planta durante su colecta.
Material utilizado. Las Acc originales las colectó el Dr. Catarino Ávila Reséndiz (†), ex coordinador de la Red Papaya del SINAREFI (2017). El Centro de Conservación de Semillas Ortodoxas Sur Sureste de la Red proveyó un número limitado de semillas de estas colectas. Por ser recalcitrantes, estas semillas presentan problemas de germinación después de periodos prolongados de conservación. Se obtuvo un bajo número de individuos por accesión, por lo que se utilizaron las Acc que produjeron al menos tres plantas. El Cuadro 1 presenta las características de cada accesión y el tipo de manejo en que fueron colectadas. Además, se utilizó la var Maradol roja de Semillas del Caribe®, por ser la más cultivada en México. La semilla se remojó por 48 h con cambios de agua cada 8 h, y en ácido giberélico 0.1% por 12 h; se colocaron sobre una franela húmeda estéril (15 x 20 cm) doblada, a 35 °C y 80 % de humedad relativa. Las que germinaron, se sembraron en charolas con mezcla (1:1) de Peat Moss® y suelo rico en materia orgánica. Las plántulas se mantuvieron en malla sombra (75%), se regaron y trasplantaron a macetas (20 x 15 cm); al desarrollar entre 8 y 10 hojas verdaderas se pasaron al invernadero del Campus Veracruz, Colegio de Postgraduados. El PRSV-p se obtuvo de hojas de papayo colectadas en una huerta comercial en Jamapa, Veracruz, México. La presencia del patógeno se confirmó mediante la técnica RT-PCR para extracción del RNA del PRSV-p, con retrotanscripción para generar DNA complementario y PCR con transcriptasa reversa, el cual se realizó con el kit de extracción de RNA Zymo Research®, según indicaciones del fabricante. La RT-PCR se realizó en un termociclador Multigene y Labnet® con el producto de Promega RT-PCR System®: se amplificó la región CP del PRSV-p con primer 3F y 11R descrito por Noa-Carrazana et al. (2006). Se colocaron áfidos (A. nerii) provenientes de una colonia libres de virus en hojas con PRSV-p por un período de adquisición de 45 a 55 s (Gonsalves et al., 2010; Osorio-Acosta et al., 2010). Se pasaron 10 áfidos a cada una de 13 plantas sanas de papayo Maradol, se mantuvieron durante 2 h, y se eliminaron manualmente. Veinte días después se confirmó la eficiencia de la transmisión mediante RT-PCR, en muestras de hoja de cada planta. Se utilizaron diez plantas positivas al PRSV-p como fuente de inóculo.
Ensayo de invernadero. El ensayo se estableció con tres plantas por Acc o var, las que se inocularon tres veces con áfidos infectivos con la metodología de Osorio-Acosta el al. (2010). 1ª inoculación: 31/10/2017; 2ª 21/11/2017; 3ª 22/01/2018. La planta con los áfidos infectivos se confinó en una jaula entomológica de 20 a 30 min. En seguida, se retiraron los insectos.
Las plantas se mantuvieron a 24±3 °C en un invernadero con malla antiáfido durante 63 días después de la inoculación. Se realizaron evaluaciones semanales de la incidencia y severidad de síntomas del PRSV-p en hojas, tallo y peciolos (Cuadro 2).
Incidencia. La incidencia final evaluada por síntomas se confirmó con el kit para PRSV-p de AGDIA®. Se colectó tejido vegetal de 42 plantas de las 13 Acc y la var Maradol roja; se etiquetó en bolsas y transportó en frío al Lab. de Virus, Programa de Fitosanidad, Colegio de Postgraduados. Cada muestra se maceró en un molino de rodillos (Dayton Electric®, Mod: 4Z522); el extracto se recolectó con 100 µl del buffer de extracción. Se adicionaron dos repeticiones por muestra en una placa de 96 pozos junto a controles positivos y negativos. Para las incubaciones, el conjugado enzima-sustrato y los lavados con buffer se siguieron las indicaciones del fabricante. Los pozos se leyeron a 405 nm (Thermo Scientific®, Multiskan FC). El valor ≥2.0 nm se consideró positivo a PRSV-p. El porcentaje de incidencia (I%) de la enfermedad se determinó mediante la fórmula: 1% = (n 1/N j )*100, donde: n 1 = Número de plantas enfermas por parcela experimental en el momento de la observación; y N j = Número total de plantas evaluadas por parcela experimental. Las plantas de las Acc y la var Maradol inoculadas mostraron síntomas visuales del PRSV-p en 64.29 %, confirmado mediante DAS-ELISA. El número de plantas enfermas en las 13 Acc y la var Maradol roja aumentó en el tiempo, con incidencias final del PRSV-p inoculado con A. nerii de entre 33.3 y 100 %. Es decir, todas las Acc fueron susceptibles al PRSV-p en condiciones de invernadero, con claras diferencias en la proporción de plantas infectadas (Cuadro 3). Las Acc 65, 94a, 205 fueron las primeras en mostrar síntomas del PRSV-p en una planta durante la 3ª semana después de la inoculación (SDI), mientras que Maradol roja inició con síntomas en dos plantas; las Acc 80a, 210b, 147a, 60 y 203 mostraron una planta con síntomas a la 4ª SDI, y las Acc 188a y 169a mostraron dos plantas con síntomas; las Acc 64, 150 y 197a fueron las últimas en manifestar los primeros síntomas del PRSV-p, ambas en dos plantas hasta la 5ª SDI.
Cuadro 1 Accesión o variedad, ubicación geográfica, tipo de fruto y grado de manejo de la colecta de Carica papaya.
| Fecha | Accesión/Variedad | Localidad-Municipio, Estado | Latitud N Longitud O (°) | Altitud (m) | Tipo | Manejo | Peso fruto (g) | Color pulpa | °Brix | Grosor pulpa (cm) |
|---|---|---|---|---|---|---|---|---|---|---|
| 07/2010 | 60 | Ahuateno-Chicontepec, Veracruz | 20.97-98.17 | 642 | Mamey | Traspatio | 2020 | Amarilla-anaranjada | 11 | 3.7 |
| 08/2011 | 64a | Chilpancingo-Acapulco, Guerrero | 17.22-99.53 | 646 | Papaya | Traspatio | 650 | Amarilla-anaranjada | 9 | 3.1 |
| 08/2011 | 65 | Col. San José-Tierra Colorada, Guerrero | 17.16-99.53 | 273 | Criolla colorada | Traspatio | 800 | Amarilla-anaranjada | 8 | 3.0 |
| 09/2011 | 80 | El Pericón-Tecoanapa, Guerrero | 16.98-99.32 | 627 | Papayo | Traspatio | 78 | Amarilla | 13 | 2.1 |
| 09/2011 | 94a | Cariedad-San Marcos, Guerrero | 16.75-99.31 | 56 | Pico de pajarito | Silvestre | 7.1 | Amarilla | 21 | 0.6 |
| 07/2012 | 147a | Col. José María Pino Suarez-Huimanguillo, Tabasco | 17.78-93.64 | 25 | Papayitas | Silvestre | 8.5 | Amarilla-anaranjada | 18 | 0.9 |
| 07/2012 | 150 | Miguel Hidalgo-Huimanguillo, Tabasco | 17.67-93.74 | 24 | Papaya | Cultivada | 457 | Amarilla-anaranjada | 10 | 2.6 |
| 07/2012 | 169a | La Venta-Huimanguillo, Tabasco | 18.1-94.04 | 15 | Papaya | Cultivada | 834 | Amarilla | 11 | 3.4 |
| 07/2012 | 188a | San Carlos-Tenosique, Tabasco | 17.43-91.49 | 42 | P. Zapote | Cultivada | 2004 | Amarilla | 11 | 2.8 |
| 07/2012 | 197a | Tamulté de las Sabana-Centro, Tabasco | 18.16-92.79 | 8 | P. Zapote | Cultivada | 1980 | Amarilla | 9 | 2.9 |
| 11/2012 | 203 | Becan-Calakmul, Campeche | 18.51-89.46 | 277 | - | Silvestre | 7.2 | Amarilla | 17 | 0.6 |
| 11/2012 | 205 | El Plan de San Luis-Calakmul, Campeche | 18.53-89.56 | 255 | - | Silvestre | 11.5 | Amarilla | 14 | 1.3 |
| 12/2012 | 210b | Conguas-Calakmul, Campeche | 18.54-89.92 | 176 | - | Silvestre | 8.0 | Amarilla | 18 | 1.1 |
| 08/2017 | Maradol roja | Cuba | - | - | Variedad | Comercial | 1800 | Rojizo-anaranjada | 12 | 4.0 |
Cuadro 2. Escala de severidad y descripción de síntomas para la evaluación de plantas de papayo (C. papaya) infectadas por el virus del PRSV-p. Ajustado deRodríguez et al. (2013).
| Severidad | Descripción de síntomas | Rango promedio para calcular severidad |
|---|---|---|
| 0 | Ausencia de síntomas (0%) | 0 |
| 1 | Síntoma inicial del virus, aún sin estar bien definido (1-9%) | 5 |
| 2 | Síntoma evidente, pero puntual en un órgano (10-24%) | 17 |
| 3 | Síntoma que no se encuentra generalizado en todos los órganos y que abarca el 25-50% del órgano afectado | 38 |
| 4 | Síntoma severo y generalizado en el órgano, aunque sólo en 51-75% del órgano | 63 |
| 5 | Síntoma severo y generalizado en todos los órganos (76-100%). | 88 |
La proporción de plantas afectadas en Maradol roja y en las Acc 188a y 80 aumentaron gradualmente hasta alcanzar 100% en incidencia final, mientras que en las Acc 169, 65, 210b, 94a, 64a, 150 y 197a incrementaron más lento su incidencia hasta alcanzar 67%. Las Acc 147a, 60, 203 y 205 se mantuvieron con la misma proporción de plantas afectadas durante todo el periodo (33%), y resultaron menos afectadas por el virus. Esto pudo deberse a que estas accesiones son menos susceptibles a ser transmitidas por A. nerii. Al seleccionar Acc con índices de transmisión menores a 100% se podría garantizar la producción de fruta en la huerta; este factor, aunque no es el más fuerte, podría aportar tolerancia al virus. Rodríguez et al. (2013) también mencionaron que todas las Acc de papayo que evaluaron en campo resultaron sensibles al PRSV-p, con diferencias en tiempo de infección entre ellas. Por tanto, es probable que las diferencias de tolerancia de las Acc al PRSV-p sean de origen genético. Gonsalves et al. (2010) indican que no se ha identificado resistencia natural a este virus en C. papaya, pero se conocen líneas tolerantes en Filipinas, Taiwán, Tailandia y Florida, EUA, las que al enfermarse, tampoco producen frutos aptos para su venta en el mercado. Sin embargo, el retraso del inicio de la infección permite que se produzcan frutos con calidad (Hernández-Castro et al., 2015); por ello se deben reconocer las Acc con un periodo largo de incubación que permitan obtener los primeros frutos sanos. En Taiwán la incidencia de la enfermedad en líneas no transgénicas de papayo en campo se presentó a los 29 días del trasplante, mientras que las líneas transgénicas enfermaron cinco meses después (Bau et al., 2004).
Cuadro 3. Incremento temporal de la incidencia del PRSV-p en 13 accesiones de papayo nativo y var Maradol roja en condiciones de invernadero.
| Accesiones | Inicio de la incidencia (Semana) | Incidencia inicial (%) | Incidencia final (%) | Área bajo la curva de incidencia vs. severidad |
|---|---|---|---|---|
| Maradol | 3 | 67 | 100 | 242 |
| 188a | 4 | 67 | 100 | 201 |
| 80 | 4 | 33 | 100 | 139 |
| 169 | 4 | 67 | 67 | 155 |
| 65 | 3 | 33 | 67 | 155 |
| 210b | 4 | 33 | 67 | 132 |
| 64a | 5 | 67 | 67 | 107 |
| 94a | 3 | 33 | 67 | 101 |
| 150 | 5 | 67 | 67 | 92 |
| 197a | 5 | 67 | 67 | 57 |
| 147a | 4 | 33 | 33 | 77 |
| 60 | 4 | 33 | 33 | 57 |
| 203 | 4 | 33 | 33 | 41 |
| 205 | 3 | 33 | 33 | 39 |
Severidad. La estimación visual del valor de severidad por planta se transformó al promedio del rango porcentual indicado en la descripción de síntomas (Cuadro 2); esto constituyó el nivel de daño en el momento de la evaluación (X ki ), que se utilizó para calcular el índice de severidad promedio (IS) por accesión, mediante la siguiente fórmula: , donde además, N ki = Número de plantas con el nivel del daño en el momento de la evaluación; y N j = Número total de plantas evaluadas. Todas las Acc y la var Maradol roja mostraron un incremento en la proporción de síntomas evaluados durante las nueve semanas después de la inoculación (SDI), aunque se presentaron diferencias entre ellas. La severidad más alta por el PRSV-p se pudo observar en la var Maradol roja (con un índice de severidad promedio de 4.8), seguida de las Acc 88, 169 y 188a (4.3), las 210b y 65 (3.3), la 150 (2.8) y la 64a (2.5), por lo que se consideraron las de mayor susceptibilidad a la enfermedad (Figura 1, Derecha). Probablemente, la alta susceptibilidad de Maradol roja al PRSV-p se deba a que esta var comercial no fue seleccionada por tolerancia a este virus. De las Acc que presentaron la incidencia más tardía, la 205 y la 203 exhibieron el menor índice de severidad promedio (1.0) a la semana nueve. Las Acc 60 y 147a mostraron un índice de severidad promedio de 1.7, seguidas de la 94a con un valor de 2.0 y la 197a con 2.2 (Figura 1, Izquierda). Estos genotipos tienen el potencial para ser usados como fuente de tolerancia en programas de mejoramiento genético del papayo. En Cuba, Rodríguez et al. (2013) evaluaron cuatro accesiones prometedoras durante siete meses bajo condiciones de campo; en tres de ellas obtuvieron baja severidad final promedio de los síntomas reportados en tallo, peciolo, follaje y fruto: Sapote de Pilón en Cuba (2.3), Amarilla de Duaba (2.4) y Amarilla de Nava (2.5); la Acc Tallo Morado de Nava resultó ser la más afectada en el ensayo (3.1); sin embargo, en ninguna de las cuatro, la severidad final en fruto fue mayor a 2.5; los autores consideraron estos materiales como tolerantes y con potencial para ser utilizados como material base en programas de mejoramiento genético de papayo en ese país. El nivel de tolerancia por severidad en esta investigación es comparable con el de 10 líneas transgénicas que Bau et al. (2003) clasificaron como resistentes, al mantener síntomas atenuados cinco SDI. Debido a que el presente ensayo se llevó a cabo durante nueve SDI, es posible que la severidad aumente durante la vida de las plantas. Sin embargo, un retraso de la infección de al menos 5 semanas, al inicio de desarrollo vgetal, puede lograr diferencias en rendimiento superiores al 50%, incluso en materiales susceptibles como Maradol roja (Hernández-Castro et al., 2010). Por otro lado, cruzas intergenéricas avanzadas (F6) de C. papaya (var Arka Surya) con Vasconcellea cauliflora realizadas por Yanthan et al. (2017) generaron siete progenies tolerantes al PRSV-p bajo condiciones de campo. En años anteriores, el grupo de Gonsalves et al. (2010) introdujo la cápside del PRSV-p cepa HA 5-1 a var transgénicas comerciales del grupo Solo y desarrolló resistencia al PRSV-p. Sin embargo, en México aún no ha permitido el cultivo de var de papayo transgénicas.
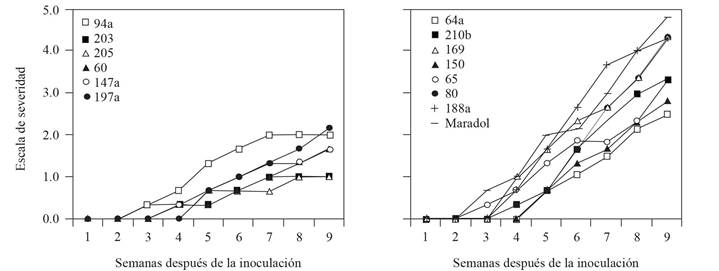
Figura 1 Dinámica del índice de severidad promedio del PRSV-p inoculado con A. nerii, durante nueve semanas después de la inoculación. Izquierda: Las seis accesiones de menor índice de severidad. Derecha: Variedad Maradol roja y las siete accesiones de mayor índice de severidad.
Manejo de accesiones durante la colecta. Los datos del IS se analizaron por Kruskal y Wallis para separar los grupos de Acc respecto al manejo observado durante la colecta del material. El análisis mostró diferencias (P=0.032) entre el porcentaje de síntomas de las Acc asociados a los manejos. Las Acc encontradas en estado silvestre sin manejo presentaron la menor severidad respecto a la var comercial Maradol roja, mientras que las Acc con manejo de traspatio y cultivadas no presentaron un porcentaje de severidad diferente entre sí (Figura 2). Esto corrobora que es en los genotipos silvestres donde podría estar el mayor banco de genes para tolerar la infección al virus, por ser genotipos que aún no han sido seleccionados por el hombre.

Figura 2 Distribución de severidad entre grupos de ac cesiones de papayo (Carica papaya L.), según su manejo.
Al respecto, d’Eeckenbrugge et al. (2014) mencionan que dentro de Caricaceae existen 21 especies silvestres del género Vasconcellea, que cuentan con un potencial de resistencia al virus PRSV-p, que podrían ser usadas en la generación de poblaciones comerciales resistentes. En Filipinas, Alviar et al. (2012) indican que Sinta es un híbrido de papayo con una línea parental del género Cariflora que le hereda alta tolerancia al PRSV-p, con lo que las plantas infectadas no reducen sus rendimientos. Esto resalta la importancia de evaluar el comportamiento de una var o accesión con respecto a la infección del virus como una estrategia para el desarrollo de var resistentes.
A pesar de su carácter preliminar, se sugiere replicar esta investigación con más accesiones y evaluarlas hasta la etapa de fructificación. Debido a las limitaciones para el uso de transgénicos, los esfuerzos mexicanos para mantener bancos de accesiones de material silvestre de papayo deberán aprovechar la disponibilidad del genoma completo del papayo para identificar marcadores genéticos e identificar los genes de tolerancia o resistencia en materiales sobresalientes de C. papaya (Porter et al. 2013), con lo que se podrá sistematizar rápida y eficientemente el avance de programas de desarrollo de genotipos resistencia a este y otros virus.











 texto en
texto en 


