Antes del uso de productos químicos para el control de plagas y enfermedades, la rotación de cultivos y la incorporación de materia orgánica en el suelo fueron los dos métodos más utilizados en la agricultura para este fin (Bailey y Lazarovits, 2003). Esta última se sigue utilizando, pero los resultados para el control de enfermedades de plantas en el suelo tienen una amplia variación, relacionada con la cantidad y tipo de materia orgánica, cultivo a proteger y patógeno que se desee controlar (Bonanomi et al., 2007). Recientemente, el control de plagas y enfermedades de plantas promovió el uso de materia orgánica selectiva o productos derivados de ésta (Meghvansi y Varma, 2015). Particularmente, la degradación de materia orgánica en el suelo bajo condición anaerobia, indujo la aparición de la biofumigación y paralelamente sus variantes; todas ellas, con la finalidad de sustituir al bromuro de metilo, pesticidas y contribuir con una agricultura orgánica (Meghvansi y Varma, 2015; Shennan et. al., 2014; Shrestha et al., 2016).
La biofumigación se ha centrado en la incorporación al suelo de residuos, plantas completas, o semillas de las especies de la familia Brassicaceae, entre las que destaca Brassica carinata, B. juncea y B. napus, posteriormente cubrir el suelo con plástico, donde al descomponerse los residuos, se producen compuestos tóxicos para organismos perjudiciales de los cultivos agrícolas (Ríos-Cano, 2017). Variantes de la biofumigación, son la desinfestación biológica del suelo (DBS), luego nombrada desinfestación anaerobia del suelo (DAS) y finalmente desinfestación reductiva del suelo (DRS). Las desinfestaciones tienen la finalidad de eliminar o reducir organismos en el suelo que dañan los cultivos agrícolas, mediante la incorporación tanto de especies de Brassicaceae, como de otras plantas, compuestos orgánicos y residuos de cosecha, todo en un ambiente donde el suelo se satura con agua y se cubre con plástico (Momma et al., 2008). En un principio, se denominó DBS, debido a que la degradación del material añadido implica un proceso microbiológico; luego se acuñó la DAS, por ser indispensable que el suelo careciera de oxígeno; finalmente, el término DRS, está sustituyendo a los anteriores, al determinar que además de una condición de anaerobiosis, es indispensable que el potencial oxido-reducción (POR) llegue a un nivel reductivo con valores de -100 a -400 mv, el pH de suelo se acidifique y que se produzcan ácidos grasos volátiles (AGVs). No obstante, los términos DBS y DAS continúan en uso y paulatinamente son sustituidos por DRS; en esta revisión se usará DRS como sinónimo de DBS y DAS.
La DRS es una técnica relativamente novedosa, poco conocida en México y cuyas causas no se conocen del todo, pero se investigan en distintos países; consecuentemente, los objetivos de ésta revisión son mostrar los avances, logros y proponer como mejorar la eficiencia y eficacia de esta técnica, utilizada para el manejo de organismos en el suelo perjudiciales para los cultivos agrícolas. Con anterioridad, el tema de la DRS ha sido revisado, en donde se evaluaron diferentes insumos, para distintos tipos de patógenos e incluso con un enfoque de meta-análisis (Momma et al., 2013; Shennan et al., 2014; Shrestha et al., 2016), lo cual apoya al objetivo de este ensayo.
Consecuentemente, el enfoque de la presente revisión hace énfasis en: i) desarrollo histórico; ii) principios que la sustentan; iii) propuestas para mejorar y evaluar sus variantes. Todo ello, sustentado en integrar parte del conocimiento generado recientemente, así como fundamentar modificaciones adicionales para mejorar la DRS.
Análisis retrospectivo de la DRS. Recientemente, en México, se analizó el estatus de los pesticidas, incluidos los fumigantes, los criterios del análisis, se fundamentan en la peligrosidad detectada por agencias internacionales, entre las que destacan la Organización Mundial de la Salud, la Organización de las Naciones Unidas para la Agricultura y la Alimentación y la Red Internacional de Plaguicidas; el Cuadro 1, destaca los fumigantes comúnmente utilizados en México, algunos como el Bromuro de Metilo, la Cloropicrina, el 1,3-Dicloropropeno y el metam-sodio son considerados altamente peligrosos; consecuentemente, la necesidad en México y el mundo de buscar nuevas alternativas para una agricultura sostenible (Bejarano-González, 2017).
Cuadro 1 Fumigantesx,y,z o pesticidas del suelo utilizados en México y su peligrosidad.
| Ingrediente activo | Formula | Usos principales | Peligrosidad1 | Peligrosidad2 |
|---|---|---|---|---|
| Bromuro de metilo | CH3Br | Fungicida, herbicida, insecticida y nematicida | 0/0/0/1 | ¿??? |
| Cloropicrina | Cl2CNO2 | idem | 1/0/0/0 | |
| 1,3-Dicloropropeno | C3H4Cl2 | idem | 0/1/0/0 | |
| Dibromuro de etileno | C2H4Br2 | Insecticida, nematicida. | NI | Toxico a humanos efecto dañino al ambiente |
| Yoduro de metilo | CH3I | Fungicida, herbicida, insecticida y nematicida. | NI | ídem |
| metam-sodio | C2H4NNaS2 | ídem | 0/1/0/0 | |
| Dazomet | C5H10N2S2 | ídem | NI | Toxico a humanos efecto dañino al ambiente |
| Dimetil disulfuro3 | CH3SSCH3 | Fungicida, nematicida | NI | NI |
| Tetratiocarbonato de sodio3 | CNa2S2 | Nematicida | NI | NI |
x Información obtenida de Bejarano-González (2017), el valor numérico entre las diagonales ( / / / /), indican toxicidad aguda, efectos a largo plazo, toxicidad ambiental e infringir acuerdos internacionales de protección al ambiente, salud o derechos humanos por uso de pesticidas, respetivamente / Information obtained from Bejarano-González (2017); the numeric value between slashes ( / / / /), indicate acute toxicity, long term effects, and the infringement of international environmental protection, health of human rights agreements due to the use of pesticides, respectively.
y Información obtenida de De la Cruz y Ramírez, (2018) / Information obtained from De la Cruz and Ramírez, (2018).
NI = Peligrosidad no incluida en las fuentes de información 1 y 2. / Harmness not included in information sources 1 and 2.
z La peligrosidad del Dimetil disulfuro y Tetratiocarbonato de sodio, son expuestas en las ligas: http://www.kooragro.com.mx/media/products/F.T._PALADIN_JoLxNOq.pdf y http://www.afipa.cl/web/files/afipa/arysta2015/ENZONE.pdf, respectivamente / The harmness of Dimethyl disulfide and sodium Tetrathiocarbonate are shown in the links http://www.kooragro.com.mx/media/products/F.T._PALADIN_JoLxNOq.pdf and http://www.afipa.cl/web/files/afipa/arysta2015/ENZONE.pdf, respectively.
Una alternativa para el manejo de fitopatógenos en el suelo es la DRS, que incluye inundación, la adición y descomposición de la materia orgánica, la anaerobiosis, los cambios de pH y POR y la producción de AGVs. En el pasado, cada tópico fue investigado por separado, como métodos para el control de fitopatógenos en el suelo y se abordarán como antecedentes de la DRS.
La inundación de los suelos cultivados con plantaciones de banano, resultó en la erradicación de Fusarium oxysporum f. sp. cubense (Stover, 1955). Posteriormente, se encontró que los esclerocios de Verticillium dahliae Kleb, morían o no podían reproducirse en suelo inundado, donde se descomponía materia orgánica en condición anaerobia (Ioannou et al., 1977; Menzies, 1962). De tal manera que, se detectó como una constante la inundación y descomposición de la materia orgánica en condición de anaerobiosis, lo que inducían la muerte de fitopatógenos. Paralelamente, la descomposición de materia orgánica en suelo inundado se asoció con la generación de AGVs lo que fue consignado en el clásico de microbiología del suelo desde los años 60s (Alexander, 1961); además con cambios de pH y POR (Ponnamperuma, 1972).
Los AGVs son producidos por los microorganismos al degradar la materia orgánica del suelo, mediante un metabolismo fermentativo (Figura 1). Anterior a la DRS, se sabía que los ácidos acético, butírico, fórmico, propiónico y otros AGVs tienen efecto biosida en hongos (Cochrane, 1958) y en bacterias (Goepfert e Hicks, 1969) y más recientemente para otros organismos (Samaniego-Gaxiola y Pedroza-Sandoval, 2013). Pero fue en Japón, donde Okazaki (1985) encontró que adicionando glucosa en suelo e inundando se generaban compuestos volátiles, los que mataban las clamidosporas de Fusarium oxysporum f. sp. raphani, en un dispositivo que diseñó (Figura 2); de manera similar, Samaniego-Gaxiola (1994), añadió glucosa en suelo e inundando observó que morían los esclerocios de Phymatotrichopsis omnivora (Duggar) Hennebert. Entretanto, Okazaki y Nose (1986) determinaron que los AGVs acético, propiónico y butírico se producían en esta condición y mataban a F. oxysporum; aunque éste trabajo y el de Okazaki (1985) aparecieron traducidos del japonés y publicados en inglés cerca del año 2000. De ésta manera se tuvo evidencia del efecto letal de los AGVs para organismos durante la DRS o simplemente in vitro; lo cual se ha confirmado con trabajos posteriores (Momma 2008; Momma et al., 2006; Samaniego-Gaxiola y Balagurusamy, 2013; Tenuta et al., 2002).
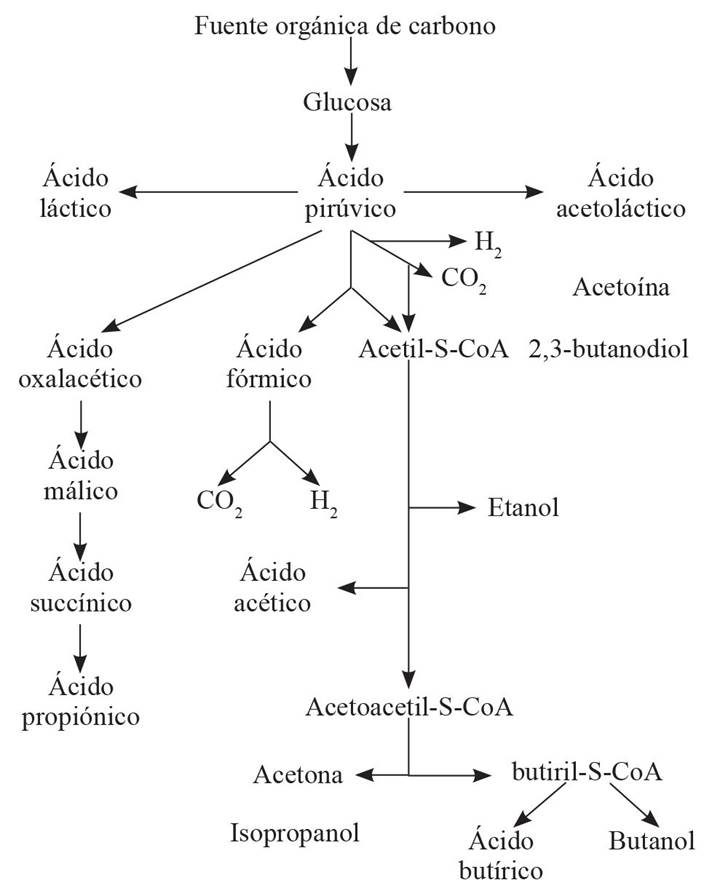
Figura 1 Ácidos grasos volátiles producidos donde al fer mentar una fuente orgánica de carbono. Adapta do de Steiner et al., 1977.

Figura 2 Dispositivo de Okazaki (1985) las clamidosporas de Fusarium oxysporum murieron al añadir glucosa en suelo e inundar.
Cabe señalar, que la presencia de AGVs en residuos de plantas como la col (Brassica oleracea) ya se conocía desde los 50s (Barnett y Ducan, 1953); así como los efectos fitotóxicos de los AGVs en el suelo con residuos de paja de trigo y las cantidades de ácidos producidos (Lynch, 1977; Lynch et al., 1980), lo cual es de importancia debido a que cascarilla de trigo y la col son residuos comúnmente utilizados para inducir la DRS y biofumigación, respectivamente.
Finalmente, los dos primeros trabajos donde se integraron los principios de la DRS fueron Shinmura et al. (1999) en Japón y Blok et al. (2000) en Holanda, ambos para el control de hongos fitopatógenos en el suelo. Posteriormente, se determinó que los AGVs contenidos en excretas de cerdo mataban a Verticillium dahliae (Tenuta et al., 2002). La aplicación de cascarilla de trigo para inducir DRS y matar bacterias y hongos fitopatógenos en suelo (Momma et al., 2006). También se ha utilizado etanol para generar DRS (Momma et al., 2010), así como residuos de pastos, alfalfa, melaza, semillas, glucosa, entre otros (Conn et al., 2005; Hewavitharana y Mazzola, 2016; Momma, et al., 2010; Shrestha et al., 2016).
Los AGVs. Estos ácidos que se generan en la DRS, son tóxicos para nematodos, hongos y bacterias, preponderantemente cuando se encuentran en forma no ionizada en la solución del suelo u otro medio (Goepfert e Hicks, 1969; Katase et al., 2009; Tenuta et al., 2002). Por ejemplo, el ácido acético en su forma no ionizada o disociada (AGVsni) se puede representar como CH3CCOH, mientras que en su forma ionizada (AGVsi) como CH3CCO- + H+, una u otra forma predominará en función del pH del medio donde se encuentren; los principios y cálculos para determinar las formas ionizada no ionizada se detallan por Samaniego-Gaxiola y Pedroza-Sandoval (2013). La concentración de AGVsni en la solución del suelo desciende dramáticamente conforme el pH es menos ácido; la Figura 3, indica la concentración de cuatro AGVsni en función del pH. Este comportamiento de los AGVs es de suma importancia para predecir su toxicidad hacia los organismos; por ejemplo 100 mmol L-1 de ácido acético a pH 5.5 genera alrededor de 13.7 mmol L-1 en su forma no ionizada (tóxica), mientras que 25 mmol L-1 de ácido butírico a pH 4.5 genera 15.4 mmol L-1; es decir, la acidificación de una unidad (de 5.5 a 4.5) permitiría usar cuatro veces menos de ácido butírico que acético con similar generación de AGVsni. Cabe señalar, que cada AGVs tiene diferente comportamiento en función del pH, particularmente el ácido fórmico (Figura 3); asimismo, la toxicidad de V. dahliae y P. omnivora murieron en función del tipo, concentración y el tiempo de su exposición a los AGVs (Samaniego-Gaxiola y Balagurusamy, 2013; Tenuta et al., 2002).
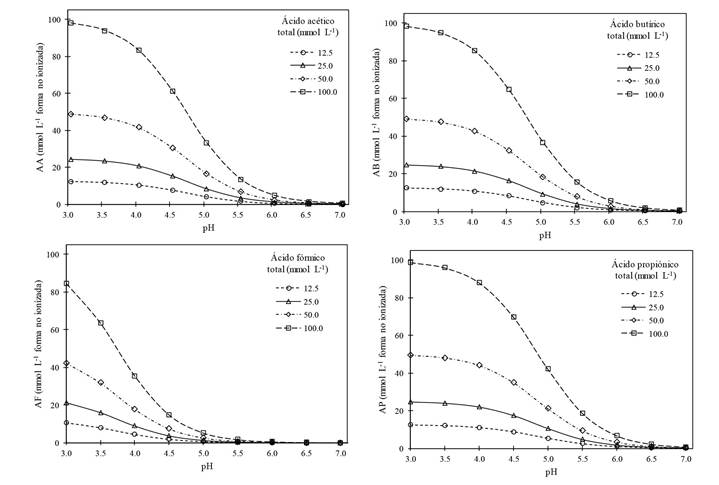
Figura 3 Formas no ionizadas de los ácidos acético, butírico, fórmico y propiónico, cuando se encuentran a concentraciones de 12.5, 25.0, 50.0 y 100.0 mmol L-1, todo en función del pH de la solución. Las gráficas fueron elaboradas por los autores utilizando los datos del peso molecular y pK de cada ácido y la ecuación Henderson-Hasselbalch, todo citado por Samaniego-Gaxiola y Pedroza-Sandoval (2013).
Propuesta, AGVs modificando el pH. Desde 1969, Goepfert e Hicks (1969) demostraron que al acidificar con HCl el medio que contenía AGVs únicamente moría la bacteria Salmonella typhimurium; recientemente, Samaniego-Gaxiola et al. (2018) registraron la muerte de los esclerocios de P. omnivora solo sí se acidificaba con H2SO4 una solución obtenida del suelo tratado para DRS y que contenía AGVs. Por tanto, en condiciones de campo, la adición de algún ácido fuerte después de dos a siete días de iniciado el proceso de DRS muy probablemente incremente la toxicidad de los AGVs, y consecuentemente, la muerte de los organismos susceptibles que se desee eliminar o disminuir su población. En el laboratorio, se determinó la cantidad de H2SO4 necesario para ajustar el pH ~4 en suelos con DRS (Samaniego-Gaxiola et al., 2018). Datos adicionales se muestran en este estudio, adaptados de Estupiñán-Herrera et al. (2010) donde se indujo cambios de pH en suelo adicionado con fructosa e inundación, posterior a ello, disminuciones adicionales del pH ~4 añadiendo H2SO4, Figura 4 A-D.
De la Figura 4, se demuestra que el pH puede bajar ~4. Una agenda a investigar que proponemos, sería evaluar el cambio de pH~4 después de la DRS al adicionar H2SO4; hacerlo en distintos tipos de suelo en campo, utilizando varios insumos, y determinando la viabilidad de los fitopatógenos. Asumiendo que un suelo una vez que alcanzó su máximo descenso de pH después de la DRS, que puede saturarse con agua en un 25 % de su volumen, entonces se requerirían alrededor de 3.3 toneladas de H2SO4 para ajustar el pH ~4; todo ello extrapolando a una hectárea los datos de la Figura 4C, los complementarios de Estupiñán-Herrera et al. (2010) y Samaniego et al. (2018).
Figura 4 A-D. Cambios en el pH y cantidades de H2SO4 necesarias para ajustar el pH ~4 después de adicionar fructosa en suelo e inundar. A. Cambio de pH con distintas dosis de fructosa añadida al suelo inundado. B. Disminución de siete veces (seis ciclos) el pH ~4 añadiendo H2SO4 (flechas) a las soluciones del suelo, las soluciones provienen del día cuatro de la Figura 4A. C. Cantidad acumulada (uL) de H2SO4 adicionado por siete veces para ajustar el pH ~4, lo que corresponden con las flechas de la Figura 4B. D. Tiempo de retorno del pH después de ajustarlo con el ácido a ~4, para las soluciones del día cuatro de la Figura 4A. Adaptado de Estupiñán-Herrera et al. (2010).
Uso de otros compuestos y/o AGVs directamente. Durante la DRS, además de los AGVs, distintos compuestos letales para fitopatógenos en el suelo se han detectado y otros compuestos volátiles más que se han destacado por inhibir a fitopatógenos (van Agtmaal et al., 2015). Por tanto, la DRS podría incrementar su eficiencia y eficacia al combinarla con la adición de los compuestos letales ya conocidos y aquellos por determinar. Algunos de esos compuestos podrían adicionarse justo después de que el pH y POR alcancen su máximo cambio.
En la DRS además de los AGVs se pueden formar compuestos biosidas como los isotiocianatos y nitrilos que son productos del hidrólisis (en el suelo) de los glucosinolatos, éstos últimos son metabolitos secundarios contenidos en las especies de plantas de la familia Brassicaceae, producidos en el suelo tanto en la biofumigación como en la DRS (Blok et al., 2000; Ríos-Castaño, 2017). Los iones Fe2+ y Mn2+ en agua en una condición reductiva alcanzada por la DRS, fueron letales para F. oxysporum, aunque Momma et al. (2011) sugiere confirmar e indagar el mecanismo por el que los iones tienen tal efecto. De acuerdo al pH alcalino o ácido del suelo, los AGVs pueden continuar descomponiéndose en compuestos igualmente letales para fitopatógenos en el suelo; a pH ácido y alcalino se formarán ácido nitroso y amoniaco, respectivamente (Lazarovits et al., 2005; Tenuta y Lazarovits, 2002).
Los AGVs pueden estar presentes en grandes cantidades en medios como excretas líquidas de cerdo, las emulsiones de pescado procesado industrialmente y otras fuentes (Abbasi et al., 2009; Samaniego-Gaxiola y Pedroza-Sandoval, 2013; Tenuta et al., 2002); por tanto, su uso potencial a partir de dichas fuentes. Adicionalmente, AGVs podrían generarse en suelo o solución acuosa utilizando melaza, para su uso posterior. En experimentos de nuestra autoría, utilizando la metodología de Samaniego-Gaxiola et al. (2018) y donde se mezclaron melaza, agua y suelo, o melaza y agua, fueron medidos el pH y el POR cómo se muestran en la Figura 5; el pH y el POR cambiaron de manera esperada, si bien, no se determinaron las cantidades de AGVs, de cualquier manera, es de esperar la formación de AGVs al mezclar melaza en suelo y/o agua.
Una modalidad de la DRS es el uso de etanol (Momma et al., 2010). También podría utilzarse los ácidos acético, fórmico y otros de manera directa en suelo previamente saturado, como para incrementar o complementar los efectos de la DRS, tal es el caso de la patente en trámite solicitada por He et al. (2012). La distribución de AGVs también se ha realizado por el sistema de riego (Rosskopf et al., 2014).

Figura 5 Tratamientos donde se registraron cambios de pH y POR (mV). El suelo, agua corriente y melaza, permanecieron 20 min en autoclave antes de mezclarlos ; suelo, agua destilada y melaza permanecieron 20 min en autoclave antes de mezclarlos ; suelo, agua corriente y melaza se mezclaron ; suelo, agua destilada y melaza se mezclaron ; mezcla de agua corriente y melaza ; mezcla de agua destilada y melaza . Cuando se utilizó suelo, agua y melaza fue 150 g, 90 ml y 1% v/v (agua-melaza), respectivamente; y cuando se utilizó agua más melaza se utilizó 90 ml y 1% v/v, respectivamente. La autoclave estuvo a ~121 °C y 280 kPa.
El pH ácido, inducido por DRS, podría utilizarse para incrementar la toxicidad de fungicidas o pesticidas convencionales, es decir, combinar ambas prácticas, e incluso una práctica adicional podría ser la adición de un ácido fuerte posterior a la DRS y uso de pesticidas. Al respecto, se determinó que en solución amortiguador a pH 4 (base de acetato-ácido acético) y 1000 ppm del fungicida Propiconazole (Tilt ®), los esclerocios de P. omnivora murieron en 20 min hasta en un 60%; bajo la misma condición, pero a pH 7 se necesitó de 72 horas para que los esclerocios murieran en similar porcentaje (Samaniego-Gaxiola, 2008). Asimismo, la DRS se ha utilizado combinándola con la solarización, como una alternativa para sustituir la fumigación con Bromuro de Metilo (Butler et al., 2014).
Inoculación de suelo y planta con otros organismos después de la DRS. Numerosos cambios biológicos se han reportado después de la DRS, como la aparición de antagonistas de los fitopatógenos, aumento del ciclo de nutrimentos, mayor crecimiento de los cultivos, la disminución de los índices de diversidad de bacterias y hongos y la aparición de microrganismos dominantes, todo con respecto a suelos sin DRS (Huang et al., 2015, 2016; Hewavitharana y Mazzola, 2016; Liu et al., 2016). Después de la DRS, se ha registrado el establecimiento de manera espontánea o inducida de especies de Trichoderma colonizando fitopatógenos como P. omnivora y Sclerotium rolfsii (Samaniego-Gaxiola et al., 2018; Shrestha et al., 2013); pero también, el restablecimiento de fitopatógenos previamente eliminados, tal es el caso de Fusarium oxysporum f. sp. niveum y Monosporascus en un segundo ciclo del cultivo de sandía Citrullus lanatus (Liu et al., 2018). Sin embargo, después de la DRS, la inoculación al suelo, semillas y plántulas con especies de Trichoderma u otros hongos y bacterias, probablemente tendría efectos benéficos para el control de enfermedades de plantas; particularmente al evaluar bacterias obtenidas de la DRS que muestren antagonismo hacia fitopatógenos (Ueki et al., 2017, 2018), los endofíticos de Trichoderma, bacterias y otros hongos (Druzhinina et al., 2011; Eljounaidi et al., 2016: Santoyo et al., 2016).
Una gran cantidad de compuestos tóxicos para los fitopatógenos y benéficos para las plantas son producidos por bacterias y hongos en el suelo tanto in vitro como en la DRS (Hayat et al., 2010; Hewavitharana et al., 2014; Siddiquee et al. 2012); tanto los compuestos como los microrganismos, después de la DRS, podrían seguir evaluándose, introduciéndolos o favoreciendo su producción para el control de los fitopatógenos. Por ejemplo, de Trichoderma harzianum se detectaron 258 compuestos volátiles, con 50 % de abundancia de ácido acético cuando la extracción para su detección se realizó con metanol (Siddiquee et al. 2012), es decir, se podría investigar sí el hongo es capaz de producir este ácido en cantidad significativa posterior a una DRS.
Aplicaciones prácticas de la DRS. Los cultivos próximos a rastrear, como la alfalfa en su último año de cultivo; residuos de cultivo como los cereales; la poda del césped; residuos de cosecha como los rueznos de la nuez pecanera; así como materiales orgánicos abundantes en cada región de México, son algunas de las múltiples fuentes de Carbono que se podrían usar y evaluar para una DRS.
Habrá que considerar para una evaluación en particular, la temperatura a la que la DRS es más efectiva, y aunque está poco estudiada, temperaturas del suelo de 17 a > 30 °C ha funcionado satisfactoriamente (Shennan et al., 2014; Yossen et al., 2008). Los tipos de materia orgánica y sus cantidades son también factores que afectan la DRS, de manera general, se necesitan 4 mg de Carbono por cada gramo de suelo (4 mg g-1), lo que equivale a 2 Kg m-2 de paja de arroz/suelo (salvado) (Serrano-Pérez et al., 2017). El carbono orgánico fácilmente oxidado (CFO) es una forma altamente apropiada para incorporarse al suelo y provocar una exitosa DRS. Por ejemplo, la glucosa y la cascarilla de trigo tienen 276 y 122 g Kg-1 de CFO, respectivamente, pero la primera induce los cambios más grandes y efectividad de la DRS para controlar a Fusarium oxysporum (Liu et al., 2016). Composta de estiércol (11 Mg ha-1) no fue efectiva para inducir los cambios típicos de la DRS y no controló a R. solani y Pratylenchus penetrans (Hewavitharana y Mazzola, 2016); entretanto, estiércol y otros tipos de materia orgánica descompuestos en condiciones aerobias han tenido efectos inconsistentes y algunas veces han favorecido fitopatógenos como R. solani (Bonanomi et al., 2007). Por tanto, no se ha determinado que estiércol (maduro o composteado) induzcan DRS, aunque evaluaciones adicionales podrían determinar que si lo puede ser.
Es importante mencionar que los AGVs se pierden por volatilización y degradación microbiana, como ocurrió entre uno a dos días a concentraciones hasta ~ 500 mmol L-1 contenido en estiércoles frescos de cerdo y ganado lechero (Kirchmann & Lundvall, 1993); sin embargo, cuando el suelo tiene un suministro constante de AGVs su degradación puede retrasarse meses (Hrapovic y Rowe, 2002). Consecuentemente, el uso y aplicación continua de excretas frescas de ganado que contengan AGVs podría evaluarse, tomando en cuenta sí bacterias patógenas de animales y humanos sobreviven.
En los últimos 10 años, la investigación en la DRS se ha enfocado en mejorar su eficiencia, pero en México aún falta por evaluarse en distintos cultivos, suelos y fitopatógenos. No obstante, la DRS podría ser particularmente útil en la zona sur de México, en donde la lluvia es abundante y los suelos son ácidos, ambos factores favorables para la DRS.
En el Cuadro 2, se ejemplifican algunos insumos utilizados para generar la DRS y el control de organismos. Ésta información, puede servir como base para evaluarse en suelos, donde cultivos son afectados negativamente por organismos. La Figura 6, muestra algunos aspectos de DRS en la alfalfa, nogal e higuera que actualmente están en evaluación.
Cuadro 2 Insumos utilizados para inducir la DRS, para controlar organismos perjudiciales para cultivos agrícolas.
| Insumos | Cantidades | Organismos a controlar | Cultivo | Referencia |
|---|---|---|---|---|
| Brassica oleracea y Lolium perenne. | 5 y 8 Mg/ton peso seco para Brassica y Lolium, respectivamente. | F. oxysporum f. sp. asparagi, V. dahliae y Rhizoctonia solani | Ninguno (suelo) | Blok et al. 2000. |
| Paja de trigo | 1-1.6 % (paja-suelo, p/p) | F. oxysporum f. sp. lycopersici and Ralstonia solanacearum | Ninguno (suelo) | Momma et al., 2006. |
| Melaza | 13.9-27.7 m3 ha-1 | Nematodos | Tomate | Di Gioia et al., 2016. |
| Melaza | 8.2 Mg ha-1 | Macrophomina phaseolina F. oxysporum | Fresa | Rosskopf et al., 2014 |
| Pajas de trigo y arroz, etanol, orujo de uva, residuos de cebolla, pasta de mostaza. | ~ 9 Mg ha-1 como carbono contenido, excepto el etanol, aplicado (1%). | V. dahliae | Ninguno (suelo) | |
| Etanol | 2-0.5% (v/v), 50-200 L m-2 | Bacterias, hongos, malezas y nematodos | Hortalizas (8) | Shennan et al., 2014. |
| Paja de arroz | 4.9 Mg ha-1 | |||
| Etanol | 8.9 kL ha-1 | Frutas (4) | ||
| B. junacea | 4.9 Mg ha-1 | |||
| Césped | Hasta Mg ha-1 | Pratylenchus penetrans y R. solani | Manzano | Hewavitharana y Mazzola, 2016. |
| Paja de arroz | 4.4 Mg ha-1 | |||
| B. junacea | 4.4 Mg ha-1 | |||
| Paja de arroz | 2 kg m-2 | Phytophthora nicotianae | Pimiento | Serrano-Pérez et al., 2017. |
| Pasta de B. junacea | 2 kg m-2 | |||
| Orujo de uva | 4 kg m-2 | |||
| Residuos de cebada fermentada | 3.5 kg m-2 | |||
Conclusiones
La DRS tiene un enorme potencial de uso en México, debido a las grandes extensiones de cereales cultivados, a partir de los cuales se pueden obtener las fuentes de Carbono necesarias. Adicionalmente, el re-uso de plástico negro convencional y la posible adaptación a sistemas de riego sub-superficiales, pueden complementar esta tecnología; particularmente, la DRS es altamente rentable en cultivos de invernadero. La melaza es otra fuente de Carbono sumamente económica en algunas regiones de México, así como la disponibilidad de excretas de cerdos y ganado. De esta manera, la DRS tiene la ventaja de poder usar una gran diversidad de fuentes de Carbono en comparación con la biofumigación.

Figura 6 Izquierda, plástico en parcela experimental cubriendo suelo después de aplicar melaza para inducir DRS, en donde posteriormente se estableció alfalfa. Centro, Melaza adicionada en suelo en microparcela en donde se sem braría nueces de nogal. Derecha, plástico cubriendo suelo donde se aplicó melaza, donde previamente murió una higuera atacada por P. omnivora.











 texto en
texto en 


