El género Fusarium comprende muchas especies de hongos filamentosos ampliamente distribuidos a nivel mundial. Varios miembros de este género pueden causar enfermedades en plantas, animales y humanos. Diferentes especies de Fusarium causan enfermedades en algunos de los más importantes cultivos, como arroz, maíz, trigo, frijol, soya, calabaza, melón y sandía, entre otros (Smith, 2007).
El cultivo de sandía (Citrullus lanatus) genera alrededor de 300 millones de dólares anuales en México y el estado de Sonora es su principal productor. La derrama económica por el cultivo de sandía en Sonora supera los 30 millones de dólares al año (SIAP, 2017). Sin embargo, frecuentemente los plantíos de sandía, en este estado, se ven amenazados por diversas enfermedades de origen fúngico.
La mayoría de los trabajos señalan a Fusarium oxysporum y F. solani como los principales responsables de la muerte por marchitez y pudrición de raíz, en plantas de sandía. Fusarium oxysporum f. sp. niveum es considerado el más importante de los hongos causantes de marchitez en los cultivos de sandía alrededor del mundo (Egel y Martyn, 2007; Zhou et al., 2010; Turóczi et al., 2011; Zhang et al., 2014). F. solani f. sp. cucurbitae, razas 1 y 2, es otra especie causante de marchitez en plantas de sandía, aunque su prevalencia es menos reconocida. La raza 2 solamente afecta a los frutos causando una pudrición seca; la raza 1 afecta tanto a frutos maduros como a plantas causando pudrición seca y pudrición cortical del tallo, respectivamente (Boughalleb et al., 2005; Mehl y Epstein, 2007).
Recientemente, Rentería-Martínez et al. (2018), identificaron a Fusarium falciforme (perteneciente al complejo de especies de Fusarium solani), F. brachygibbosum y F. oxysporum, además de Rhizoctonia solani y Ceratobasidium sp., como los hongos asociados a marchitez y pudrición de raíz en plantas de sandía cultivadas en Sonora, México.
Fusarium brachygibbosum ha sido identificado como patógeno en leguminosas (Tan et al., 2011), en plantas de palma datilera (Al-Sadi et al., 2012), Euphorbia larica (Al-Mahmooli et al., 2013), Nerium oleander (Mirhosseini et al., 2014), Striga hermonthica (Rna et al., 2014), plantas medicinales (Gashgari et al., 2016), almendro (Stack et al., 2017), maíz (Shan et al., 2017), olivo (Trabelsi et al., 2017), girasol (Xia et al., 2018) y remolacha azucarera (Cao et al., 2018). En estos reportes, la identificación de la especie se realizó mediante técnicas moleculares y solo se incluyó una somera descripción morfológica, tomando como referencia, en todos los casos, al morfotipo reportado por Padwick (1945), sin considerar la diversidad de morfotipos existente en la especie.
De acuerdo con Leslie et al. (2001), las diferencias en la forma de los macroconidios son fundamentales para la identificación de muchas especies de Fusarium, pero además hay otros caracteres útiles para diferenciar entre las especies de un género. Tradicionalmente la identificación de las especies de Fusarium se realiza en base a características morfológicas, tales como: forma y tamaño de macro y microconidios, la ausencia o presencia y forma de las clamidosporas. La apariencia, forma y pigmentación de las colonias, así como las velocidades de crecimiento en diferentes medios, también son tomadas en consideración (Leslie y Summerell, 2006; Ismail et al., 2015). Esto resalta la importancia de conocer que caracteres morfológicos son los que pueden ayudar en la identificación de las especies de Fusarium causantes de muerte en plantas de sandía en Sonora.
En base a lo anterior, el objetivo de este trabajo fue analizar y comparar la variabilidad morfológica entre morfotipos de Fusarium brachygibbosum, F. falciforme y F. oxysporum encontrados como agentes causales de marchitez en plantas de sandía cultivadas en Sonora, México, con el fin de establecer las características macroscópicas y microscópicas distintivas entre las especies.
Materiales y métodos
Los sitios y la metodología de muestreo de las plantas sintomáticas, el aislamiento y obtención de cultivos monospóricos, la extracción de ADN, la identificación molecular y las pruebas patogenicidad de los aislados en cumplimiento con los postulados de Koch se describieron y publicaron por Rentería-Martínez et al. (2018). En total se identificaron 25 aislados de Fusarium falciforme, cinco de F. brachygibbosum y dos F. oxysporum.
Clasificación de morfotipos. Los morfotipos de cada especie se establecieron con base en el tipo de crecimiento, coloración del micelio y pigmentación del medio de cultivo. Las determinaciones se realizaron en un aislado representativo de cada morfotipo.
Morfología y velocidad de crecimiento de las colonias. Las características macroscópicas de las colonias (tasa de crecimiento del micelio, color de la colonia y pigmentación) se evaluaron en medio PDA. La tasa de crecimiento de cada aislado se determinó tomando un disco de 8 mm de diámetro de colonias de 7 días de desarrollo en PDA y colocándolo al centro de otra placa con PDA. Las placas se incubaron a 27 °C y se midió diariamente el diámetro de la colonia en dos direcciones perpendiculares hasta que el cultivo cubrió completamente la placa. Se evaluaron cinco repeticiones por cada aislado. Se registró la morfología de las colonias y la pigmentación aérea del micelio (Nelson et al., 1983).
Análisis de las características microscópicas. Los diferentes morfotipos se cultivaron en agar hojas de clavel (CLA), de acuerdo con Fisher et al. (1982). Para promover la formación de clamidosporas, se utilizó agar de suelo (SA), según Klotz et al. (1988). Los cultivos en CLA y SA se incubaron en las mismas condiciones: 25 °C, 12 h luz /12 h oscuridad durante dos semanas.
Las preparaciones microscópicas en portaobjetos se examinaron con un microscopio de luz compuesto (VELABTM). Para observar y medir el tamaño de los conidios, fiálides y clamidosporas se tomaron fotografías a 40X y 100X, luego se analizaron utilizando el software TSView, versión 6.2.4.5. Se midió la longitud y el ancho de cincuenta macroconidios y cincuenta microconidios seleccionados al azar de cada aislado.
Análisis estadístico. Los datos de longitud y ancho de macroconidios y microconidios fueron sometidos a un análisis de varianza y separación de medias por la prueba de Tukey (α<0.05), utilizando el programa JMP v5.0.1a.
Resultados
Clasificación de morfotipos y velocidad de crecimiento. Los 25 aislados de F. falciforme se agruparon en tres morfotipos (Ff-14, Ff-49 y Ff-50), los cinco aislados de F. brachygibbosum en cuatro (Fb-8, Fb-9, Fb-41 y Fb-67) y los dos de F. oxysporum en uno (Fo-38). En el Cuadro 1 se presentan las velocidades de crecimiento y las características macroscópicas observadas en los morfotipos de F. brachygibbosum, F. falciforme y F. oxysporum en PDA. La Figura 1 evidencia la presencia de los cuatro morfotipos patogénicos de F. brachygibbosum, encontrados en los campos de sandía en Sonora.
Características microscópicas. En el Cuadro 2 se resume la morfología de las clamidosporas y las células conidiógenas observada en los aislados representativos de cada morfotipo en las tres especies. En todos los casos se observaron clamidosporas redondas intercalares y terminales, principalmente sencillas y dobles; sin embargo, el mayor grosor en la pared de las clamidosporas de los morfotipos de F. brachygibbosum (Figura 2A) parece ser una característica que lo diferencia de F. falciforme y F. oxysporum (Figura 2B-C). En lo referente a las células conidiógenas, los morfotipos de F. falciforme (Figura 2B) se distinguen de los demás, por tener monofiálides más largas y delgadas.
Cuadro 1. Velocidad de crecimiento en PDA y características macroscópicas de los morfotipos de F. brachygibbosum, F. falciforme y F. oxysporum patogénicos en sandía.
| Velocidad de crecimientox | Morfología de las colonias | Pigmentacióny | |
|---|---|---|---|
| F. brachygibbosum | |||
| Fb-8 | 4.9 | Micelio aéreo, velloso de color blanco, tornándose amarillo y rosa con esporodoquios amarillos después de 2 semanas. | Café claro, con manchas café oscuro alrededor de los esporodoquios. |
| Fb-9 | 4.2 | Micelio aéreo, velloso de color amarillo, con esporodoquios color café después de 2 semanas. | Amarillo-naranja con el centro café rojizo en forma de estrella. Con manchas café oscuras alrededor de los esporodoquios. |
| Fb-41 | 4.8 | Micelio aéreo, velloso de color café claro, con esporodoquios café después de 2 semanas. | Centro café oscuro con anillos concéntricos menos café hacia afuera. Con manchas café claro alrededor de los esporodoquios. |
| Fb-67 | 4.6 | Micelio aéreo, velloso de color blanco al inicio. Tornándose rosa con el desarrollo esporodoquios amarillos después de 2 semanas. | Rojo intenso brillante en todo el fondo de la caja. |
| F. falciforme | |||
| Ff-14 | 4.1 | Micelio postrado de color beige. Crecimiento en anillos concéntricos, sin formación de esporodoquios. | Café claro con halos café oscuros debido al crecimiento en forma de anillo. |
| Ff-49 | 3.6 | Micelio postrado de color beige, sin formación de esporodoquios. | Café claro. |
| Ff-50 | 3.9 | Micelio postrado de color blanco, sin formación de esporodoquios. | Beige muy claro, cubriendo toda la caja. |
| F. oxysporum | |||
| Fo-38 | 3.4 | Micelio velloso de color blanco, el cual se torna purpura después de una semana. Sin formación de esporodoquios. | Púrpura en toda la caja. |
x mm/día / mm/day.
y Fondo de la caja Petri / Bottom of the Petri dish.
En el Cuadro 3 se presenta la descripción morfológica de los macroconidios y microconidios de los aislados representativos de cada morfotipo. Se observaron algunas diferencias entre las tres especies. Los cuatro morfotipos de F. brachygibbosum presentaron macroconidios delgados y rectos, con tres a cinco septos, las células del centro ligeramente anchas centro y las intermedias curvadas hacia la parte basal. Las células apicales tuvieron ligera forma de gancho y las células basales la forma típica o ligera forma de pie (Figura 3). Los macroconidios de F. falciforme fueron anchos y rectos o ligeramente curvados, pero con el plano ventral y dorsal paralelos en la mayor parte de su longitud, sus células apicales fueron redondeadas y las basales rectas y cilíndricas con el extremo apenas recortado o redondeado (Figura 4B). La forma de los macroconidios de F. oxysporum fue parecida a la de F. brachygibbosum, pero con células basales puntiagudas y en menor cantidad con forma de pie apenas visible (Figura 4C).

Figura 1 Características morfológicas de las colonias de los 4 morfotipos de Fusarium brachygibbosum en PDA. A = Frente B = Fondo
Cuadro 2 Morfología de clamidosporas y células conidiógenas en los morfotipos de F. brachygibbosum, F falciforme y F. oxysporum patogénicos en sandía, desarrollados en CLA.
| Forma de las clamidosporas | Tipo de células conidiógenas | |
|---|---|---|
| F. brachygibbosum | ||
| Fb-8 | Dobles. Intercalares y terminales. Pared gruesa. | Monofiálides cortas. Algunas polifiálides cortas. |
| Fb-9 | Sencillas. Intercalares. Pared gruesa. | Monofiálides cortas. Algunas polifiálides cortas. |
| Fb-41 | Sencillas. Intercalares. Pared gruesa. | Monofiálides cortas. Algunas polifiálides cortas. |
| Fb-67 | Sencillas y dobles. Intercalares y terminales. Pared gruesa. | Monofiálides cortas. Algunas polifiálides cortas. |
| F. falciforme | ||
| Ff-14 | Sencillas, dobles y en cadena. Intercalares y terminales. Pared mediana. | Monofiálides muy largas y algunas cortas. Pocas polifiálides. |
| Ff-49 | Sencillas y dobles. Intercalares y terminales. Pared de grosor medio o delgado. | Monofiálides muy largas y algunas cortas. Pocas polifiálides. |
| Ff-50 | Sencillas y dobles. Terminales. Pared de grosor medio o delgado. | Monofiálides muy largas abundantes. Pocas polifiálides. |
| F. oxysporum | ||
| Fo-38 | Sencillas y dobles. Intercalares y terminales. Pared de grosor medio o delgado. | Monofiálides cortas y escasa presencia de polifiálides. |

Figura 2 A-C: Morfología de clamidosporas. A = F. brachygibbosum, B = F. falciforme y C = F. oxysporum. D-F: Morfología de células conidiógenas. D = polifiálides y monofiálides de F. brachygibbosum, E = monofiálide de F. falciforme y F = monofiálides de F. oxysporum.
Cuadro 3. Morfología de macroconidios y microconidios de los morfotipos de F. brachygibbosum, F falciforme y F. oxysporum patogénicos en sandía, desarrollados en CLA.
| Forma de macroconidios | Forma de microconidios | |
|---|---|---|
| F. brachygibbosum | ||
| Fb-8 | Delgadas, largas y rectas. Células centrales ligeramente anchas y curvadas hacia la parte basal. Células apicales con ligera forma de gancho y células basales con ligera forma de pie. Tres o cuatro septos. | Ovales y algunas ovoides. Con uno y escasamente con ninguno o con dos septos. |
| Fb-9 | Delgadas, largas y rectas. Células centrales ligeramente anchas y curvadas hacia la parte basal. Células apicales con ligera forma de gancho y células basales con típica forma de pie. Tres a cinco septos. | Ovales y algunas ovoides. Con uno y escasamente con ninguno o con dos septos. |
| Fb-41 | Delgadas, largas y rectas. Células centrales ligeramente anchas y curvadas hacia la parte basal. Células apicales con ligera forma de gancho y células basales con típica forma de pie. Tres a cinco septos. | Ovales y algunas ovoides. Con uno y escasamente con ninguno o con dos septos. |
| Fb-67 | Delgadas, largas y rectas. Células centrales ligeramente anchas y curvadas hacia la parte basal. Células apicales con ligera forma de gancho y células basales con ligera forma de pie. Tres a cinco septos. | Ovales y algunas ovoides. Con uno y escasamente con ninguno o con dos septos. |
| F. falciforme | ||
| Ff-14 | Anchas y rectas. Ligeramente curvadas con el plano ventral y dorsal paralelo en la mayor parte de su longitud. Células apicales redondeadas. Células basales rectas y cilíndricas, con extremos apenas recortados o redondeados. Con tres a seis septos. | Ovales, elipsoides, reniformes y fusiformes. Con la parte basal truncada. Con ningún o con un septo. |
| Ff-49 | Anchas y rectas. Ligeramente curvadas con el plano ventral y dorsal paralelo en la mayor parte de su longitud. Células apicales redondeadas. Células basales rectas y cilíndricas, con extremos apenas recortados. Con tres a seis septos. | Ovales, elipsoides y reniformes. Con cero, uno o dos septos. |
| Ff-50 | Anchas y rectas. Ligeramente curvadas con el plano ventral y dorsal paralelo en la mayor parte de su longitud. Células apicales redondeadas. Células basales rectas y cilíndricas, con extremos apenas recortados. Con cuatro a seis septos. | Ovales, elipsoides, reniformes y ocasionalmente piriformes. Con cero, uno y ocasionalmente dos septos. |
| F. oxysporum | ||
| Fo-38 | Cortas a medianas y esbeltas. Rectas o ligeramente curvadas. Células apicales cónicas con ligera forma de gancho y células basales en forma puntiaguda. Tres o cuatro septos. | Ovales típicas, elípticas y forma de riñón. Sin septos. |

Figura 3 Morfología de las macroconidios de los cuatro morfotipos de F. brachygibbosum. A = células apicales con forma ligera de gancho y B = células basales con ligera forma de pie (Fb-8 y Fb-67) y típica forma de pie (Fb-9 y FB-41).
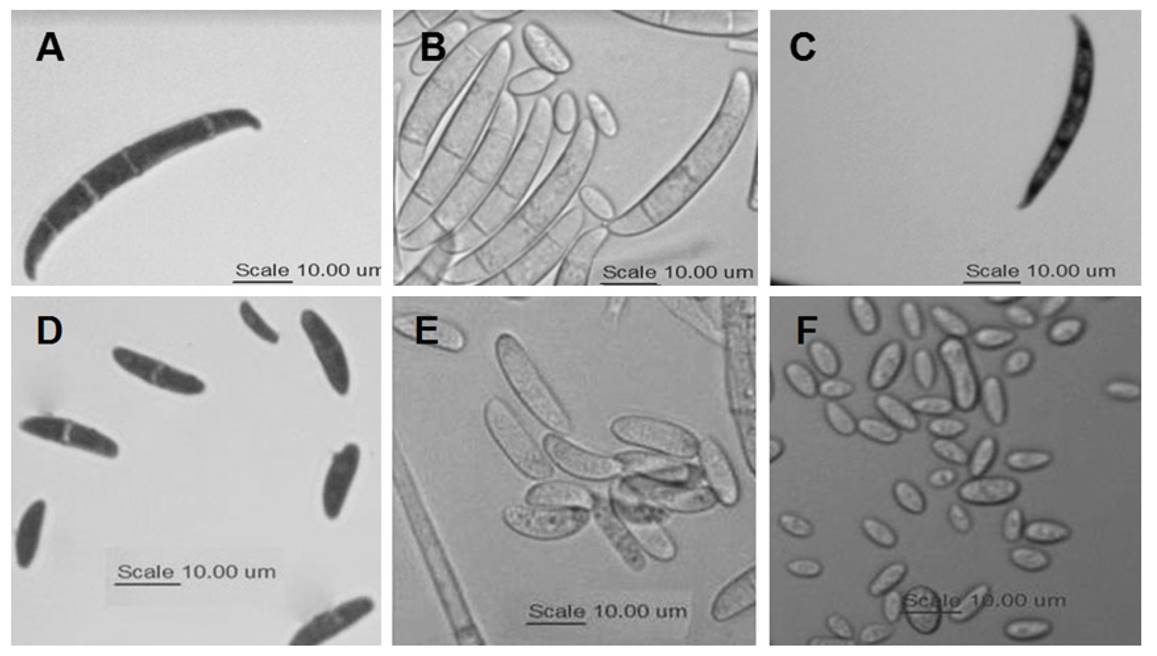
Figura 4 Morfología de macroconidios y microconidios de las tres especies de Fusarium patogénicas de sandía. A = ma croconidios de F. brachygibbosum, B = macroconidios de F. falciforme y C) macroconidios de F. oxysporum. D = microconidios de F. brachygibbosum, E = microconidios de F. falciforme y F) microconidios de F. oxysporum.
Los microconidios de F. brachygibbosum fueron ovales y ocasionalmente ovoides, por lo general con un septo, rara vez con dos o ninguno. Los de F. oxysporum fueron ovales elípticos y en forma de riñón sin septos. F. falciforme presentó microconidios con la parte basal trunca, ovales, elipsoides y reniformes, con algunos piriformes y fusiformes, con ninguno, uno o dos septos (Cuadro 3, Figura 4 D-F). La variabilidad de formas no permitió observar diferencias en los microconidios de las diferentes especies; solo la ausencia de septos en todos los microconidios observados en F. oxysporum (Figura 4F) parece ser un rasgo distintivo.
Cuadro 4. Tamaño de macroconidios de aislados de los morfotipos de F. brachygibbosum, F. falciforme y F. oxysporum patogénicos en sandía, desarrollados en CLA, de acuerdo con su número de septos.
| Tamaño de macroconidios (μm) x | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Número de septos | ||||||||||||||||||||
| 3 | 4 | 5 | 6 | Promedio y | ||||||||||||||||
| F. brachy-gibbosum | Largo | Ancho | Largo | Ancho | Largo | Ancho | Largo | Ancho | Largo | Ancho | ||||||||||
| Fb-8 | 30.74 ± 4.49 | 3.29 ± 0.35 | 35.13 ± 3.79 | 3.18 ± 0.35 | - | - | - | - | 31.45 ± 4.09F | 3.28 ± 0.35E | ||||||||||
| Fb-9 | 34.16 ± 3.72 | 3.58 ± 0.52 | 38.98 ± 2.16 | 4.04 ± 0.30 | 42.34 ± 2.93 | 3.54 ± 0.13 | - | - | 35.52 ± 4.35 E | 3.65 ± 0.51D | ||||||||||
| Fb-41 | 35.52 ± 4.49 | 3.70 ± 0.55 | 38.25 ± 5.08 | 3.85 ± 0.64 | 39.46 ± 9.50 | 4.13 ± 0.51 | - | - | 37.04 ± 5.33DE | 3.80 ± 0.59D | ||||||||||
| Fb-67 | 40.01 ± 7.19 | 4.28 ± 0.37 | 45.04 ± 5.65 | 4.32 ± 0.47 | 50.08 ± 1.54 | 4.61 ± 0.28 | - | - | 43.04 ± 6.97AB | 4.33 ± 0.42C | ||||||||||
| F. falci- forme | ||||||||||||||||||||
| Ff-14 | 40.11 ± 0.65 | 4.69 ± 0.11 | 43.55 ± 1.16 | 5.03 ± 0.10 | 45.90 ± 0.68 | 5.35 ± 0.08 | 47.3 ± 0.23 | 5.64 ± 0.10 | 44.04 ± 0.82A | 5.13 ± 0.10A | ||||||||||
| Ff-49 | 37.60 ± 1.59 | 4.47 ± 0.28 | 39.10 ± 1.46 | 4.82 ± 0.20 | 40.67 ± 1.30 | 4.69 ± 0.42 | 43.30 ± 1.55 | 5.07 ± 0.36 | 39.90 ± 1.45CD | 4.77 ± 0.29B | ||||||||||
| Ff-50 | - | - | 38.74 ± 0.57 | 3.80 ± 0.16 | 41.04 ± 0.92 | 3.74 ± 0.10 | 43.45 ± 0.62 | 3.88 ± 0.06 | 40.56 ± 0.71BCD | 3.83 ± 0.12D | ||||||||||
| F. oxys-porum | ||||||||||||||||||||
| Fo-38 | 32.22 ± 3.07 | 3.32 ± 0.47 | 35.48 ± 2.84 | 3.26 ± 0.31 | - | - | - | - | 33.26 ± 3.00E | 3.30 ± 0.42E | ||||||||||
x Media ± SD. Letras diferentes indican diferencia significativa (p<0.05) / Means ± SD. Different letters indicate a significant difference (p< 0.05).
y Promedio de 50 células (Average of 50 cells) / Average of 50 cells.
- No se observaron suficientes células para su medición (No observed sufficient cells to measure) / Not enough cells observed.
En el Cuadro 4 se observan las medias de largo y ancho de los macroconidios de acuerdo con el número de septos y el promedio de 50 células. El análisis estadístico permitió detectar diferencias significativas en el largo y ancho promedio de los macroconidios entre los aislados; sin embargo, la variabilidad de tamaños dentro de las especies no permitió establecer diferencias entre ellas. Los macroconidios de los morfotipos Fb-8 y Fb-9 no mostraron diferencias significativas en tamaño con respecto a los morfotipos Fo-38 de F. oxysporum. No se detectó diferencia significativa entre el tamaño de los macroconidios de Fb-41, Fo-39 y Ff-49. Tampoco se observó diferencia significativa entre Fb-67, Ff-50 y Ff-14.
El Cuadro 5 presentan las medias de largo y ancho de los microconidios de acuerdo con el número de septos y el promedio de 50 células. Se detectaron diferencias significativas en el tamaño de los microconidios entre los aislados en general, pero no entre especies. Los morfotipos Fb-41, Fb-67 y Fb-9 presentaron los microconidios de mayor longitud, mientras que Fb-8 fue el de menor tamaño.
Discusión
Padwick (1945) describió que F. brachygibbosum crece en PDA desarrollando abundante micelio aéreo, blanco, con tonos rosados y medio de color rojo-sangre. Con microconidios típicos de forma ovoide a fusiforme, o ligeramente curvados cuando son septados, con ninguno, uno, dos o tres septos. Macroconidios dispersos finamente en la superficie del agar, hiperbólicamente curvados, células centrales anchas y de 0 a 5 septos. Células del ápice afiladas y células basales ligeramente afiladas con forma de pie típica. Clamidosporas terminales e intercalares, simples y en cadenas; generalmente unicelulares y globosas, ocasionalmente de 2 células, lisas, granulares. Esta descripción concuerda con los cuatro morfotipos de F. brachygibbosum encontrados en el presente trabajo; sin embargo, el color de las colonias y del medio solo concuerda con lo observado en Fb-67 y no con Fb-8, Fb-9 y Fb-41.
Cuadro 5. Tamaño de microconidios de los morfotipos de F. brachygibbosum, F. falciforme y F. oxysporum patogénicos en sandía, desarrollados en CLA, de acuerdo con su número de septos.
| Tamaño de microconidios (μm)x | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Número de septos | ||||||||||||||||||
| 0 | 1 | 2 | Promedioy | |||||||||||||||
| F. brachygibbosum | Largo | Ancho | Largo | Ancho | Largo | Ancho | Largo | Ancho | ||||||||||
| Fb-8 | - | - | 13.79 ± 1.84 | 3.95 ± 0.46 | - | - | 13.79 ± 1.84b | 3.95 ± 0.46C | ||||||||||
| Fb-9 | - | - | 7.15 ± 0.43 | 2.40 ± 0.64 | - | - | 7.15 ± 0.43b | 2.40 ± 0.64A | ||||||||||
| Fb-41 | - | - | 18.78 ± 2.92 | 3.81 ± 0.47 | - | - | 18.78 ± 2.92a | 3.81 ± 0.47A | ||||||||||
| Fb-67 | - | - | 17.73 ± 3.67 | 3.91 ± 2.53 | - | - | 17.73 ± 3.67a | 3.91 ± 2.53A | ||||||||||
| F. falciforme | ||||||||||||||||||
| Ff-14 | 11.42 ± 2.29 | 3.21 ± 0.34 | 11.06 ± 2.39 | 3.15 ± 0.35 | - | - | 11.18 ± 2.36c | 3.17 ± 0.35A | ||||||||||
| Ff-49 | 9.41 ± 0.86 | 2.94 ± 0.63 | 10.61 ± 0.88 | 3.85 ± 0.51 | 11.18 ± 1.02 | 4.91 ± 0.47 | 10.29 ± 0.89cd | 3.73 ± 0.55AB | ||||||||||
| Ff-50 | 10.26 ± 1.10 | 3.68 ± 0.53 | 11.99 ± 0.45 | 4.18 ± 0.25 | - | - | 11.17 ± 0.75c | 3.95 ± 0.38A | ||||||||||
| F. oxysporum | ||||||||||||||||||
| Fo-38 | 8.56 ± 1.40 | 3.05 ± 0.56 | - | - | - | - | 8.56 ± 1.40de | 3.05 ± 0.56BC | ||||||||||
x Media ± SD. Letras diferentes indican diferencia significativa (p< 0.05) / Means ± SD. Different letters indicate a significant difference (p< 0.05).
y Promedio de 50 células (Average of 50 cells) / Average of 50 cells.
-No se observaron suficientes células para su medición (No observed sufficient cells to measure) / Not enough cells observed.
En general el tipo de micelio, el color de las colonias, color del medio de cultivo y la morfología de los macroconidios y microconidios, observados en los trabajos más recientes sobre F. brachygibbosum (Al-Sadi et al., 2012; Mirhosseini et al., 2014; Renteria-Martinez et al., 2015; Stack et al., 2017; Shan et al., 2017; Xia et al., 2018), corresponden al morfotipo descrito por Padwick (1945). En todos estos estudios se registraron colonias blancas que se tornan amarillo claro con tonos rosa o naranja y el medio PDA teñido en rojo brillante. El crecimiento en CLA permitió observar macroconidios de paredes gruesas, un centro abultado con extremos ligeramente curvados (gancho atenuado) y una célula basal típica en forma de pie o ligeramente en forma de pie, en su mayoría con 4 a 5 septos.
El morfotipo de F. oxysporum desarrolló un micelio aéreo blanco que se tornó purpura después de una semana en PDA, similar a lo descrito por Kleczewski y Egel (2011) acerca de F. oxysporum f.sp. niveum raza 1, aunque sin formación de esporodoquios. Al cultivarse en CLA, las características de clamidosporas, células conidiógenas, macroconidios y microconidios correspondieron a lo señalado por Leslie y Summerell (2006), para la especie.
El tipo de crecimiento de las colonias en PDA permite distinguir entre los morfotipos de F. brachygibbosum (aéreo) y los de F. falciforme (postrado). La presencia de monofiálides largas y delgadas, mostradas en los morfotipos F. falciforme (Summerbell y Schroers., 2002), es una característica que permite diferenciarlos de F. brachygibbosum y F. oxysporum, los cuales desarrollaron monofiálides más cortas. La forma de los macroconidios de F. falciforme es otro rasgo que lo distingue de las otras especies. Similar a lo reportado por Chehri et al. (2015) los macroconidios de esta especie fueron poliseptados, anchos y rectos o ligeramente curvados, con células apicales redondeadas y células basales con extremos apenas recortados.
La coloración desarrollada en el agar, el tipo de células conidiógenas, además de la morfología y tamaño de los macroconidios pueden hacer que F. brachygibbosum sea identificado erróneamente como F. oxysporum, que es más común en la mayoría de los cultivos de la región; pero la morfología de las clamidosporas, específicamente el grosor de la pared, puede ser una característica distintiva que permita diferenciar entre las dos especies. La morfología de las clamidosporas de F. brachygibbosum correspondió con lo observado por Cao et al. (2018). Otra característica diferente entre estas especies fue la ausencia de septos en los microconidios de F. oxysporum, mientras que en F. brachygibbosum predominaron los de un septo.
La variabilidad en el tamaño de macroconidios y microconidios entre los morfotipos de una misma especie, no permitió diferenciar entre las tres especies de Fusarium.
Se han reportado diferentes tamaños en los conidios de F. brachygibbosum (Xia et al., 2018; Shan et al., 2017; Mirhosseini et al., 2014; Al-Mahmooli et al., 2013;), en la mayoría de los casos de menor tamaño a los observados en el presente trabajo. El tamaño de los macroconidios de F. falciforme fue similar a lo reportado por Chehri et al. (2015). Por su parte, la morfología y tamaño de los macroconidios de F. oxysporum concordaron con lo señalado por Chehri et al. (2011).
Conclusiones
Algunas características, tales como: el grosor de paredes en las clamidosporas, la morfología de los macroconidios, el tipo de células conidiógenas y la presencia o ausencia de septos en microconidios pueden ser distintivas y de utilidad en la identificación de F. brachygibbosum, F. falciforme y F. oxysporum, patogénicas en plantas de sandía en cultivos localizados en Sonora, México. No obstante, es necesario que la identificación morfológica sea corroborada con un análisis molecular.











 texto en
texto en 


