Como agentes antimicrobiales, actuando de manera individual o combinada, el quitosano y los aceites esenciales (AE) han demostrado su capacidad fungicida contra varios hongos poscosecha (Sivakumar y Bautista-Baños, 2014). Como otra medida de control alternativa, la nanotecnología ha abierto nuevos caminos por medio del uso de nanopartículas, ya que debido a su gran área superficial relativa a la masa, pueden ser altamente reactivas. Según Foladori (2009), la fuerza de la nanotecnología reside principalmente en hacer productos más eficientes y multifuncionales, ahorrando así materias primas. Las nanopartículas de quitosano, ya sea de forma individual o en combinación con otros compuestos, pueden integrarse en cubiertas que pueden contener compuestos antimicrobiales tales como los AE (Sotelo et al., 2015; Sotelo-Boyás et al., 2017). En estudios anteriores, Saharan et al. (2013) reportaron un mejor efecto inhibitorio al aplicar nanopartículas de quitosano a una concentración de 0.1% en Alternaria alternata, Macrophomina phaseolina y Rhizoctonia solani. Yien et al. (2012) también reportaron un efecto inhibitorio en Fusarium solani, con las nanopartículas de quitosano de peso molecular bajo y alto en un rango de concentraciones mínimas de 0.86-1.2 mg mL-1 y 0.5-1.2 mg mL-1, respectivamente, mientras que, Beyki et al. (2014) estudiaron el efecto contra Aspergillus flavus mediante la aplicación de una concentración de 800 ppm de aceite esencial de menta piperita (Mentha piperita) encapsulado en nanogeles de quitosano con ácido cinámico. El objetivo de este estudio fue evaluar el crecimiento fúngico de varios hongos patógenos tratados con nanopartículas de quitosano, nanopartículas de quitosano-aceite esencial y cubiertas nanoformuladas de quitosano-aceite esencial.
Los aislados evaluados fueron: A. alternata, que se obtuvo de de higos infectados, Colletotrichum gloeosporioides de papaya y guanábana, C. fragariae de chirimoya y Rhizopus stolonifer de papaya y fresa. Los aceites esenciales de limón y tomillo se obtuvieron de Essential Oils-Essencefleur (grado terapéutico) y el aceite de canola, de una marca registrada. El quitosano (peso molecular medio, desacetilación = 89%) se obtuvo de Sigma-Aldrich. Las nanopartículas de quitosano y de limón y tomillo se sintetizaron de la siguiente manera: soluciones de quitosano a concentraciones de 0.05% (w/v) se disolvieron en ácido acético glacial (1% v/v) (Fermont Chemicals Inc.) y agua destilada. Se agregaron 2.5 mL de la solución de quitosano al limón y tomillo en concentraciones de 1, 3, 5% (w/v) previamente disueltos en etanol (40 mL) (Fermont Chemicals Inc.) usando una bomba peristáltica (Bio-Rad, EP-1 Econo Pump) y revolviendo de manera moderada. La solución obtenida se colocó en un evaporador giratorio (Rotary Evaporator RE 300, BM 500 Water Bath, Yamato CF 300) a 40 °C y 50 rpm. El volumen final de nanopartículas fue de 2 mL. Los tratamientos independientes fueron: nanopartículas de quitosano al 0.05% (ChNp 0.05%), nanopartículas de quitosano y aceite esencial de limón al 1%, (Ch-LEO-Np 1%), 3% (Ch-LEO-Np 3%) y 5% Ch-LEO-Np 5%), nanopartículas de quitosano y aceite esencial de tomillo al 1% (Ch-TEO-Np 1%), 3% (Ch-LEO-Np 3%) y 5% (Ch-TEO-Np 5%), y controles [control-Papa Dextrosa Agar (C-PDA) y metanol (Meth) y aceite de canola al 0.1 % (CO 0.1 %)]. Las cubiertas nanoestructuradas consistieron en: 98.6% quitosano + 1% Ch-TEO-Np 5% (COAT1), 89.6% quitosano + 10% Ch-TEO-Np 5% (COAT2), 49.6% quitosano + 50% Ch-TEO-Np 5% (COAT3), 46.6% quitosano + 53% Ch-TEO-Np 5% (COAT4), 44.6% quitosano + 55% Ch-TEO-Np 5% (COAT5) y control-PDA (COAT6) (Correa-Pacheco et al., 2017). Todas las formulaciones contenían glicerol al 0.3% (J.T.Baker®) y aceite de canola al 0.1%. Los tratamientos (0.5 ml) se esparcieron de manera uniforme en el medio de cultivo PDA. Discos de 5 mm de diámetro de cada aislado (4-14 días de edad) se colocaron por separado en el centro de las placas de Petri con el tratamiento y se incubaron a 20-25 ºC, hasta que los hongos alcanzaron su desarrollo máximo (4-14 días). El crecimiento micelial radial de los hongos se midió (cm) en 5 placas Petri (8 cm de diámetro) por tratamiento al final del periodo de incubación, con un calibrador vernier Truper, que fue de 14 días para A. alternata, 10 para las especies de Colletotrichum y cuatro para R. stolonifer. Los resultados se expresaron como porcentaje de inhibición del crecimiento micelial. Se llevó a cabo un experimento adicional para evaluar el proceso de germinación durante períodos de incubación de 0, 6, 8 y 10 h. Para esto se colocaron alícuotas de esporas de 30 ml de una concentración de 105 en 6 discos de PDA con el tratamiento individual o con las formulación de las cubiertas. La germinación se detuvo cuando se adicionó lactofenol-safranina. Las observaciones se llevaron a cabo con el uso de un microscopio óptico Nikon ALPHAPHOT-2YS2-H con un lente 40X. Los datos para cada periodo de incubación se expresaron como porcentaje de germinación. Los tratamientos se arreglaron en un diseño completamente aleatorio. También se calcularon los promedios y las desviaciones estándar. Los datos del crecimiento micelial y germinación finales se sometieron a un ANOVA y la prueba Tukey de comparación de medias a p ≤ 0.05, al final del periodo de incubación. Para ambas variables, se realizó una transformación de la raíz cuadrada para cumplir las suposiciones del ANOVA de homogeneidad y distribución normal de los datos. El software estadístico que se utilizó fue Sigmaplot v.13.
La inhibición micelial final y la germinación presentaron diferencias significativas (p≤0.05) entre los tratamientos individuales y las nanoformulaciones. En general, la respuesta de los aislados presentaron diferencias en el crecimiento y la sobrevivencia de las esporas, según el tratamiento aplicado y el aislado. En este estudio, en todos los hongos estudiados, el crecimiento micelial se afectó de forma considerable por la aplicación de nanopartículas de quitosano-aceite esencial de tomillo al 1, 3 y 5 % (Ch-TEO-Np 1%, Ch-TEO-Np 3% and Ch-TEO-Np 5%). Además, en las últimas dos concentraciones, 3% y 5%, la inhibición alcanzó el 100% y por lo tanto, no hubo formación de esporas (Cuadro 1). En cuanto a las cubiertas nanoestructuradas, la inhibición del crecimiento micelial en todos los aislados fue evidente en aquellos tratamientos en los que el porcentaje de nanopartículas de quitosano-aceite esencial 5%, aumentó en 50, 53 y 55% (COAT3, COAT4 y COAT5). En general, a medida que el aceite esencial de tomillo aumentó, la inhibición fúngica se incrementó, siendo más sensibles aquellos tratados con COAT3 en C. fragariae, seguido por ambos aislados de R. stolonifer (Cuadro 2). Para todos los aislados, se observó que el número de esporas germinadas aumentó con el tiempo de incubación. Con respecto a los aislados no tratados, no existió un patrón definido con los tratamientos restantes. Sin embargo, en C. fragariae el proceso de germinación se retrasó hasta la 6º hora de incubación en la mayoría de los tratamientos (Figura 1). Para C. gloeosporioides (guanábana) y R. stolonifer (papaya) la mayoría de los tratamientos promovieron su germinación después de 6 h de incubación. Con respecto a las cubiertas nanoestructuradas, en el más alto porcentaje de nanopartículas (55%), se obtuvo una inhibición total en los aislados de A. alternata, en ambos aislados de C. gloeosporioides, así como en R. stolonifer y C. fragariae durante las 10 h de incubación (Figura 2).
Cuadro 1 Resumen del efecto de nanopartículas de quitosano y nanopartículas de aceites esenciales sobre la inhibición micelial al final del periodo de incubación.
| Individual treatments |
Mycelial inhibition (%) | |||||
|
A. alternata (fig) |
C. gloeosporioides (papaya) |
C. gloeosporioides (soursop) |
C. fragariae (custard apple) |
R. stolonifer (papaya) |
R. stolonifer (strawberry) |
|
| ChNp 0.05% | 0a* | 0a* | 0a* | 1.6a* | 0a* | 0a* |
| Ch-LEO-Np 1% | 0a | 24.5c | 0a | 1.6a | 0a | 0a |
| Ch-LEO-Np 3% | 0a | 28.1c | 0a | 3.4b | 0a | 0a |
| Ch-LEO-Np 5% | 2.4a | 50.0d | 10.8b | 6.5b | 33.5b | 2.4a |
| Ch-TEO-Np 1% | 40.3b | 45.3d | 54.4c | 52.7c | 74.0c | 71.7c |
| Ch-TEO-Np 3% | 100c | 100e | 100d | 100d | 100d | 100d |
| Ch-TEO-Np 5% | 100c | 100e | 100d | 100d | 100d | 100d |
| C-PDA | 0a | 0a | 0a | 0a | 0a | 0a |
| Meth | 0a | 5.2b | 1.7a | 0a | 0a | 0a |
| CO 0.1% | 0a | 35.6cd | 0a | 4.7b | 0a | 0a |
*Promedios seguidos de la misma letra no representan diferencias significativas (p ≤ 0.05) determinadas por la prueba múltiple de Tukey. Valores p después de la transformación raíz cuadrada
Etiquetas de los tratamientos: Nanopartículas de quitosano 0.05% (ChNp 0.05%); nanopartículas de quitosano y aceite esencial de limón 1%, (Ch-LEO-Np 1%); 3 % (Ch-LEO-Np 3%), 5% (Ch-LEO-Np 5%); nanopartículas de quitosano y aceite esencial de tomillo 1 % (Ch-TEO-Np 1 %), 3% (Ch-TEO-Np 3 %), 5 % (Ch-TEO-Np 5%); Control-Papa-Dextrosa-Agar (C-PDA); metanol (Meth) y aceite de canola 0.1% (CO 0.1%)
Cuadro 2 Resumen del efecto de las cubiertas nanoestructuradas a base de quitosano-aceites esenciales, sobre la inhibición micelial al final del periodo de incubación.
| Treatments | Mycelial inhibition (%) | |||||
|
A. alternata (fig) |
C. gloeosporioides (papaya) |
C. gloeosporioides (soursop) |
C. fragariae (custard apple) |
R. stolonifer (papaya) |
R. stolonifer (strawberry) |
|
| COAT1 | 0a* | 0a* | 0a* | 0a* | 0a* | 0a* |
| COAT2 | 0a | 0a | 0a | 0a | 0a | 0a |
| COAT3 | 19.2b | 17.7b | 30.0b | 85.0b | 72.5b | 62.0b |
| COAT4 | 70.2c | 65.0c | 92.0c | 100c | 100c | 62.4b |
| COAT5 | 100d | 100d | 100d | 100c | 100c | 100c |
| COAT6 | 0a | 0a | 0a | 0a | 0a | 0a |
* Promedios seguidos de la misma letra no representan diferencias significativas (p ≤ 0.05) determinadas por la prueba múltiple de Tukey. Valores p después de la transformación raíz cuadrada.
Etiquetas de los tratamientos: 98.6% quitosano + 1% Ch-TEO-Np 5% (COAT1); 89.6% quitosano + 10% Ch-TEO-Np 5% (COAT2); 49.6% quitosano + 50% Ch-TEO-Np 5% (COAT3); 46.6% quitosano + 53% Ch-TEO-Np 5% (COAT4); 44.6% quitosano + 55% Ch-TEO-Np 5% (COAT5) y control (COAT6)

Figura 1 Proceso de germinación conidial durante un periodo de incubación de 10 h en: a) A. alternata (higo), b) C. gloeosporioides (papaya), c) C. gloeosporioides (guanábana), d) C. fragariae (chirimoya), e) R. stolonifer (papaya) y f) R. stolonifer (fresa) y sujeto a los siguientes tratamientos: nanopartículas de quitosano a 0.05% (Ch-NPs 0.05%), nanopartículas de quitosano y aceite esencial de limón al 1% (Ch-LEO-NPs 1%), 3% (Ch-LEO-NPs 3%) y 5% (Ch-LEO-NPs 5%), nanopartículas de quitosano y aceite esencial de tomillo al 1% (Ch-TEO-NPs 1%), 3% (Ch-TEO-NPs 3%) and 5% (Ch-TEO-NPs 5%), PDA, metanol (Meth) y aceite de canola al 0.1% (CO 0.1%).
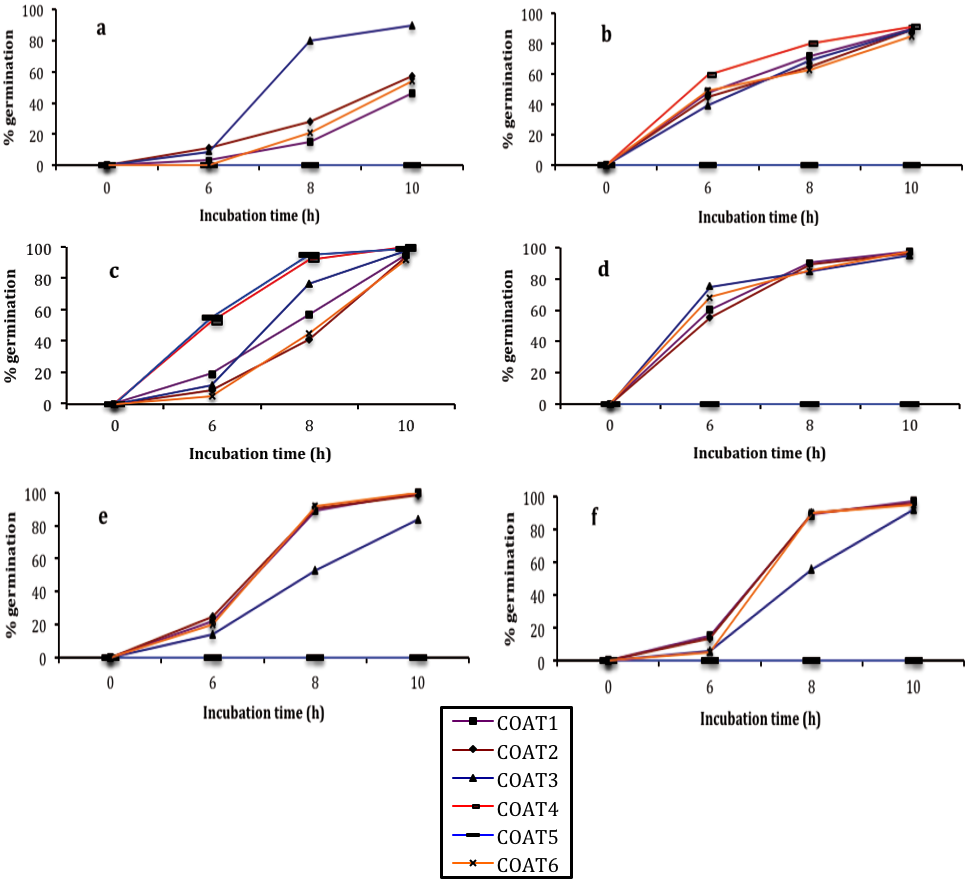
Figura 2 Proceso de germinación de los conidos de los hongos a) A. alternata (fig), b) C. gloeosporioides (papaya), c) C. gloeosporioides (guanábana), d) C. fragariae (chirimoya), e) R. stolonifer (papaya) y f) R. stolonifer (fresa) durante un período de incubación de 10 h y sujetos a diferentes cubiertas nanoformuladas. Barras verticales indican la desviación estándar promedio.
En general, los resultados de nuestra investigación coinciden con lo que anteriormente publicó Zahid et al. (2013) y Correa-Pacheco et al. (2017), donde el control efectivo de C. gloeosporioides aislado de la pitahaya (Hylocereus undatus) y aguacate (Persea americana), tratado con nanoemulsiones de quitosano, preparadas con quitosano de bajo peso molecular al 1%, y formulaciones nanoestructuradas de quitosano-aceite esencial de tomillo al 1-5%, respectivamente, en términos de inhibición micelial y germinación conidial del hongo, en comparación con el control sin tratamiento. En otra investigación llevada a cabo por Khalili et al. (2015), se demostró una mayor eficacia del AE de tomillo encapsulado en quitosano y ácido benzoico convertido en nanogeles, en comparación con el AE de tomillo contra A. flavus. En dichos estudios, la mejor concentración fungicida de 300 mg L-1 bajo condiciones herméticas, fue suficiente para inhibir de forma significativa el número de colonias fúngicas, mientras que a 700 mg L-1, la vida de anaquel de los jitomates tratados se prolongó hasta un mes. En esta investigación, el principal efecto fungicida provino en su mayoría del AE de tomillo y su concentración. Estos resultados concuerdan con los de otros investigadores. Por ejemplo, Barrera-Necha et al. (2009) y Sellamuthu et al. (2013) expusieron la actividad antifúngica del AE de tomillo in vitro y en la fruta del aguacate contra C. gloeosporioides. En otros reportes, también se reportó un notable efecto antifúngico en A. flavus, A. alternata y F. oxyspsorum con bajas concentraciones (1.0-8-0 µg mL-1) de dos diferentes especies del género Thymus: T. kotschyanus y T. daenensis (Mohammadi et al., 2014) mientras que, la concentración mínima de 62.5 µg mL-1 se presentó en A. flavus para evitar la germinación de esporas con estas mismas especies de AE (Pekmezovik et al., 2015). Los resultados de las investigaciones anteriores demuestran con claridad los resultados tradicionales del AE de tomillo, ya sea solo o incorporado en otras sustancias; sin embargo, un problema para la mayoría de los AE y sus principales componentes respectivos, es su alta volatilidad al ser aplicados solos. Como expusieron Correa-Pacheco et al. (2017) ‘para superar el aspecto de volatilidad de los AE, la incorporación de nanomateriales y antimicrobiales incluyendo los AE en cubiertas comestibles, dará nuevas propiedades a la cubierta nanoestructurada, además, de que sus efectos sinérgicos pueden mejorar’.
El desarrollo de nuevos tratamientos para el control de hongos con compuestos amigables con el ambiente mediante el uso de la nanotecnología puede ofrecer medios efectivos y más confiables para el control de microorganismos. En esta investigación, las nanopartículas de quitosano-AE de tomillo en las más altas concentraciones (5%), probadas, individualmente o integradas en una formulación (50, 53 o 55 %), presentaron un control notable en el crecimiento in vitro sobre los hongos evaluados, aunque aún es necesario estudiar sus efectos in situ.











 texto en
texto en 


