En el presente siglo los productos utilizados en el control fitosanitario no contrarrestan el desarrollo de las enfermedades, radicando el problema en la baja eficiencia de penetración en la cutícula, la actividad del principio activo y la acumulación en el tejido de las plantas (Campa et al., 2017; Pérez et al., 2017). Por lo cual, el desarrollo de productos alternativos con actividad antifúngica y que sean de naturaleza microbiana, vegetal o animal, son actualmente una opción y una realidad (Correa et al., 2015; Ramírez et al., 2016). Estudios recientes han identificado a la miel de las abejas como una alternativa en el control de hongos in vitro, siendo esta de origen natural derivado del proceso de transformación del néctar por las abejas (Apis mellifera).
La miel presenta una variedad de propiedades de interés nutracéutico (Ramalivhana et al., 2014) además, de ser empleada como alternativa medicinal desde tiempos ancestrales (Vallianou et al., 2014). Estudios recientes, han asociado las propiedades antimicrobianas a la concentración y composición de la miel (Fangio et al., 2007; Pimentel et al., 2013). La acción antifúngica se ha observado contra los géneros de hongos Trichophyton, Microsphorum, Aspergillus, Penicillium y Candida (Moussa et al., 2012; Londoño-Orozco et al, 2008; Montenegro et al., 2009; Olaitan et al., 2007). Por lo anterior, el presente estudio tuvo como objetivo evaluar la actividad antifúngica de las mieles de abeja en el crecimiento in vitro de Colletotrichum gloeosporioides.
Muestras de mieles
Las muestras de mieles de abeja se colectaron en los meses de Febrero y Marzo del 2016, en meliponarios pertenecientes a la “Asociación de Meliponicultores del Soconusco S. C. del R. L.” en los municipios de la región del Soconusco, Chiapas: Tapachula, Tuxtla-Chico y Cacahoatán.
Se utilizaron nueve muestras de mieles, correspondientes a tres especies de abejas: Melipona solani (n=3, de los siguientes lugares: Trinidad (MsTa), San Jerónimo (MsSjb) e Izapa (Mslc)), M. beecheii (n=2, de los siguientes localidades: Tapachula (MbTa) y (MbTb) y de Scaptotrigona mexicana (n=4, de los siguientes lugares: Cacahoatán (Smca), Francisco y Madero (SmFMb), Izapa I (Smic), Izapa II (Smid). Las mieles se recolectaron de tres cajas diferentes de los meliponarios, con la finalidad de contar con una miel compuesta por sitio, las cuales se extrajeron con jeringas estériles de 5 ml, y se guardaron en frascos debidamente etiquetados. Se almacenaron a -4 ° C hasta su análisis.
Actividad antifúngica de las mieles.
La actividad antifúngica de las mieles de abejas se evaluó mediante enfrentamientos en laboratorio con una cepa de C. gloeosporioides perteneciente a la colección del Instituto de Biociencias de la Universidad Autónoma de Chiapas. La cepa se reactivó en medio de agar papa dextrosa (PDA) sin miel y pH de 6.0. El bioensayo se realizó con medio PDA mezclado con solución de miel, para lo cual se elaboraron placas con un volumen de solución (en las concentraciones de: 25, 50 y 100% de miel) de 100 µl por cada 20 mL de medio. Posterior a la inoculación de la cepa (discos de colonia de 0.5 cm), las cajas Petri se incubaron a 32 °C en una estufa incubadora durante 12 días.
El crecimiento micelial se midió cada tercer día con un Vernier (Stainless Hardebed®) con capacidad de 0-150 mm (restando el tamaño del disco de inóculo).
La tasa de crecimiento de cada colonia, se determinó mediante la siguiente ecuación:
donde: µ, fue la velocidad de crecimiento de la colonia, Db, fue el diámetro de la colonia (mm) en el tiempo “b”; Da, correspondió al diámetro de la colonia en el tiempo “a”, y “tb y ta” fueron el tiempo en que se realizó la evaluación.
Determinación de la actividad antifúngica como equivalentes equiparables a Clorotalonil®
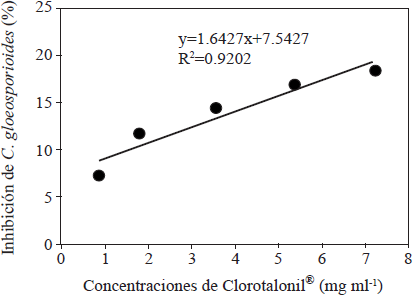
La actividad antifúngica de las mieles, se transformó a equivalentes de Clorotalonil® (2, 4, 5, 6-tetrachloroisophthalonitrile), el cual es un fungicida químico comúnmente empleado para el control de C. gloeosporioides. Para ello, se determinó la inhibición (%) del crecimiento de este hongo mediado por el Clorotalonil® a través de la preparación de soluciones con las siguientes concentraciones: 0, 0.9, 1.8, 3.6, 5.4 y 7.2 mg ml-1. Con los datos obtenidos se construyó una curva de calibración (Figura 1).
Análisis de resultados
Para analizar el diámetro de la colonia, la velocidad de crecimiento, inhibición del crecimiento y equivalentes de Clorotalonil, se realizó un análisis de varianza y posteriormente un contraste de medias por Tukey (p<0.05). El programa estadístico utilizado fue Infostat 2015. Todos los tratamientos tuvieron nueve repeticiones.
En los tratamientos con miel, se encontró una relación entre la concentración de este compuesto y el tamaño alcanzado de la colonia del hongo (r= -0.87, p<0.05), es decir, que el diámetro de la colonia fue menor a medida que aumentó la concentración de la miel. A partir del noveno día (Figura 2), en las concentraciones de 25 y 50% de miel, se observaron diferencias significativas (p<0.05) en el diámetro de la colonia entre las mieles aplicadas. En promedio, el diámetro máximo alcanzado por la colonia del hongo independientemente del tipo de miel, fue de 31.1, 20.4 y 3.2 mm para las concentraciones 25, 50 y 100%, respectivamente, a diferencia del testigo, que fue de 50 mm (Figura 2).

Figura 2 Cinética de crecimiento de C. gloesporioides en diferentes concentraciones de mieles de abeja (concentraciones de miel: 25%, 50% y 100%).
La velocidad de crecimiento (µ) típica estuvo en el rango de 0.020 a 0.023 h-1, con las concentraciones de miel de 25 y 50%, a diferencia del testigo que fue de 0.025 h-1. A la concentración de 100% de miel, el rango fue de 0.004 h-1 a 0.008 h-1. En general, la velocidad de crecimiento de la colonia de C. gloeosporioides en las mieles, fue 40% menos que en el testigo (Cuadro 1).
Cuadro 1 Efecto de la aplicación de mieles de abeja sobre la velocidad de crecimiento einhibición micelial de C. gloeosporioides y su comparación con equivalentes Clorotalonil®.
| Tratamiento | Concentración (%) |
Velocidad de crecimiento (h-1) |
Inhibición micelial (%) |
Equivalentes de Clorotalonil® (mg ml-1) |
| Testigo | 0 | 0.025 a* | 0 | 0 |
| SMCA | 25 | 0.023 bc | 40.4 i* | 29.2 f* |
| 50 | 0.020 e | 66.1 c | 44.8 b | |
| 100 | 0.006 h | 95.2 a** | 62.5 a** | |
| SMIC | 25 | 0.023 bc | 39.0 jkl | 28.3 f |
| 50 | 0.020 e | 63.6 d | 43.3 c | |
| 100 | 0.004 i | 95.2 a** | 62.5 a | |
| SMFMB | 25 | 0.023 bc | 38.5 kl | 28.0 f |
| 50 | 0.021 de** | 59.1 e | 40.5 d | |
| 100 | 0.007 g | 94.6 ab | 62.1 a** | |
| SMID | 25 | 0.023 bc | 39.0 ijkl | 28.3 f |
| 50 | 0.021 de** | 58.5 ef | 40.2 d | |
| 100 | 0.008 f | 94.4 ab | 62.1 a | |
| MSTA | 25 | 0.024 b | 39.8 ijk | 28.8 f |
| 50 | 0.021 de | 57.7 fg | 39.5 d | |
| 100 | 0.007 g | 94.0 ab | 61.8 a | |
| MSSJB | 25 | 0.023 bc | 40.0 ij | 28.9 f |
| 50 | 0.020 e | 63.4 d | 43.2 c | |
| 100 | 0.007 g | 94.6 ab | 62.2 a | |
| MBTB | 25 | 0.024 b | 38.1 l | 27.8 f |
| 50 | 0.021 de | 58.3 ef | 40.1 d | |
| 100 | 0.008 f | 94.7 ab | 62.2 a | |
| MSLC | 25 | 0.024 b | 34.8 ll | 25.8 g |
| 50 | 0.022 cd | 56.5 g | 38.9 d | |
| 100 | 0.007 g | 93.8 b | 61.7 a | |
| MBTA | 25 | 0.024 b | 33.1 m | 24.7 g |
| 50 | 0.022 cd | 54.3 h | 37.6 e | |
| 100 | 0.007 g | 93.5 b | 61.5 a |
*p≤ 0.05.
**Letras iguales indican que no hay diferencia entre medias
En la actividad inhibidora del desarrollo de la colonia de C. gloeosporioides, se encontraron diferencias altamente significativas (p<0.0001) entre las mieles de los diferentes tipos de abeja encontrando, que independientemente de la concentración de miel, las provenientes de S. mexicana (Smca y Smic) inhibieron en un 95.2% el desarrollo de la colonia de C. gloeosporioides, mientras que, la miel proveniente de M. solani (Mssjb, y Msta), M. becheii (Mbtb) y de S. mexicana (Smid y Smfmb) la acción inhibitoria fue de 94% a 95%. Las mieles con porcentajes menores de inhibición fueron M. solani (Mslc) y M. becheii (Mbta), con valores correspondientes de 93.87 y 93.53%, respectivamente. Aún así, la inhibición fue alta.
Por último, la actividad antifúngica de las mieles relacionadas en equivalentes de Clorotalonil® (eC) estuvo también asociada a la concentración de miel (r=0.98, p<0.05). La concentración máxima relacionada a eC con acción inhibitoria sobre C. gloeosporioides, la presentaron las mieles de S. mexicana (Smca y Smic) con valores de 62.5 mg ml-1, 72.7 mg ml-1 y 62.5 mg ml-1, 72.6 mg ml-1, respectivamente.
El tiempo transcurrido para el crecimiento de la colonia de C. gloeosporioides, sin miel, fue de 12 días para alcanzar el diámetro interno de la caja Petri (Figura 2). A diferencia de los tratamientos que tuvieron miel de abeja, el crecimiento del testigo presentó una forma sigmoidal.
La reducción en el desarrollo micelial del hongo podría asociarse con los componentes bioactivos de la miel, ya que resultados similares se reportaron en el desarrollo de colonias de los hongos Aspergillus spp y Penicillium spp al incubarse en presencia de miel de Apis (Olaitan et al., 2007). Lira (2003) y Jasso et al. (2007, 2011) coincidieron en que el efecto inhibitorio sobre el desarrollo del micelio de hongos fitopatógenos reside en los componentes bioactivos de los productos biológicos utilizados, tal es el caso de las plantas.
Las mieles de Scaptotrigona o Melipona, presentaron potencial para ser usado como producto con acción antifúngica al utilizar concentración de 500 µL de miel por cada 100 mL de solución, alcanzando un nivel de inhibición del 95.0%, comparado con los productos comerciales que pueden aplicarse en un amplio rango de concentraciones que van de 0.5 mg kg-1 a 500 mg kg-1 (Rodríguez et al., 2008; Warnke et al., 2009).
La acción antifúngica observada sobre el crecimiento de C. gloeosporioides en presencia de miel de abeja a diferentes concentraciones podría atribuirse a la concentración de fenoles, flavonoides y al valor de pH, los cuales han sido reportadas por Marín et al. (2017). La similitud estructural de estos compuestos contenidos en la miel con la reportada por las moléculas químicas comerciales utilizadas para el mismo fin (Pérez-Cárdenas et al., 2013; Gregorí, 2005) sugiere que el mecanismo de acción antifúngica observada en las mieles estudiadas en el presente trabajo, podría asociarse en la alteración de la división celular, la permeabilidad de las membranas celulares y el transporte intracelular en el micelio fúngico.
Las mieles de Scaptotrigona y Melipona, presentaron un potencial en el control del hongo fitopatógeno C. gloeosporioides. Además, redujeron la velocidad de crecimiento micelial en un 95%, siendo 40% más eficientes que el fungicida comercial Clorotalonil®. El uso de la miel en el control de hongos patógenos de plantas, podría ser una alternativa de solución dentro de un manejo integrado.











 texto en
texto en