La Sigatoka Negra (SN) es una enfermedad de las hojas de bananos y plátanos producida por Mycosphaerella fijiensis Morlet. Esta enfermedad fue inicialmente observada en las islas Fiji y actualmente se encuentra en todas las áreas productoras de banano y plátano del mundo (Etebu y Young-Harry, 2011). En las partes enfermas de las hojas (obscurecidas) se impide el proceso de fotosíntesis y, si no hay control de la enfermedad, eventualmente la hoja muere. Limitados por fotosintatos, los frutos maduran prematuramente y la producción disminuye (Ewané et al., 2013). El control de SN es comúnmente realizado mediante la aplicación de fungicidas químicos. En América, la frecuencia anual de aplicación de los fungicidas químicos varía de 35 a 45 veces (Ploetz, 2000). Sin embargo, el aumento de la resistencia de M. fijiensis, los efectos residuales, el espectro de acción y la fitotoxicidad de los funguicidas químicos han orientado a la búsqueda de métodos alternos de control de SN (Bastos y Albuquerque, 2004).
Las plantas son los organismos que con mayor énfasis se han estudiado para contrarrestar la acción deletérea de los hongos fitopatógenos. Por lo anterior, una amplia gama de plantas (Castillo et al., 2012), y productos de plantas (Malik et al., 2016) han sido reportadas por poseer actividad fungicida. Las hierbas y las especias (plantas aromáticas) son las plantas que con mayor énfasis se han estudiado. De dichas plantas, tanto los aceites esenciales como los extractos obtenidos con diferentes disolventes y procesos, han mostrado efecto antifúngico contra fitopatógenos de los géneros: Colletotrichum (Sundaramoorthy et al., 2014; Radwan et al., 2014; Garcia, 2011), Aspergillus (Tijjani et al., 2014; Askun et al., 2008), Phoma (Touba et al., 2012), Fusarium (Taskeen-Un-Nisa et al.,2011), Penicillium (Daniel et al., 2015; Ikeura et al., 2011), Botrytis (Daniel et al., 2015; Sesan et al., 2015) y Alternaria (Nashwa y Abo-Elyousr, 2012). La actividad antifúngica expresada por los aceites esenciales y los extractos ha sido reportada tanto en el crecimiento del micelio como en la germinación de esporas; (Hernández et al., 2007) y puede ser biocida o bioestático (Landero et al., 2013).
Para el caso de M. fijiensis, Gutiérrez-Jiménez et al. (2017) reportaron que el aceite esencial de clavo (50 a 5000 ppm en medio ADP) inhibió el crecimiento radial de la colonia entre 3.5% a 10.5%. Así mismo Sharanamma (2012) reportó que la adición de 5%, 10% y 15% de extracto de ajo (Allum sativum) (1 gajo·mlH2O-1) al medio ADP inhibieron 14.8%, 18.5 % y 23.0%, respectivamente, el crecimiento de la colonia. Por su parte De Hora (2009) reportó inhibición de la germinación de las esporas de dicho fitopatógeno entre 92% y 86% en promedio, en medio ADP adicionado con 10% o 30% de aceite esencial de clavo (Syzygium aromaticum) o eucalipto (Eucalypto globulus), para el primer valor, y tomillo (Thymus vulgaris) para el segundo.
La información previa orienta a pensar que el empleo combinado de extractos y/o aceites esenciales de plantas aromáticas pueden ser una alternativa para disminuir el desarrollo de M. fijiensis, sin embargo, el empleo combinado de dos o más extractos y/o aceites esenciales con dicho fin ha sido poco explorado, por lo que, el objetivo de este trabajo fue determinar el efecto de la combinación de los extractos de ajo (Allium sativum) y clavo (Syzygium aromaticum) en el desarrollo de Mycosphaerella fijiensis.
MATERIALES Y MÉTODOS
Aislamiento de Mycosphaerella fijiensis
El aislamiento de M. fijiensis se realizó a partir de hojas de banano con síntomas de SN siguiendo el procedimiento descrito por Conde-Ferráez et al. (2008). Las hojas se lavaron con agua y detergente y posteriormente sometidas al proceso de asepsia (inmersión en hipoclorito de sodio al 5%, por 5 min, inmersión en etanol al 70%, por 5 min y enjuagadas con agua esterilizada). Las hojas fueron colocadas en bolsas de plástico, que contenían torundas de algodón saturado con agua destilada estéril e incubadas durante 48 h a 26 °C, en ausencia de luz. Al concluir el periodo de incubación, un círculo de 20 cm de diámetro de las hojas enfermas fue adherido a papel filtro esterilizado, y humedecido con agua estéril, teniendo precaución de que el envés estuviera hacia el papel. El arreglo anterior fue colocado en la tapa de la placa de Petri de forma tal que el haz de la hoja quedo frente al medio de cultivo (ADP) contenido en la base de dicha placa. La placa de Petri fue incubada a 27 °C por 12 horas. Concluido el tiempo de incubación, y bajo campana de flujo laminar, las ascosporas hialinas, de M. fijiensis fueron localizadas con el apoyo de un microscopio estereoscópico.
Identificación morfológica de ascosporas y caracterización de la colonia de M. fijiensis.
La identificación morfológica de las ascosporas de M. fijiensis fue realizada siguiendo el procedimiento sugerido por Pérez (2002). Las ascosporas fueron hialinas, globosas con una leve constricción en el septo. Para la caracterización de la colonia de M. fijiensis, las ascosporas fueron cultivadas en medio ADP en concordancia con lo reportado por Sepúlveda (2015) y Manzo-Sánchez et al. (2001). La morfología de la colonia fue cuasi-circular, de color blanco en la parte superior y color negro en la inferior, con presencia de exudados.
Elaboración de extractos de ajo (Allium sativum) y clavo (Syzygium aromaticum).
El extracto de ajo se obtuvo por reflujo en un equipo Soxhlet. Para lo anterior 45 g de ajo fresco, macerados en un mortero de porcelana, fueron colocados sobre papel filtro, y con ello se formó el “dedal” que se colocó en el equipo Soxhlet. Para el reflujo fue utilizado etanol al 60% (200 ml). Una vez alcanzada la temperatura de ebullición del etanol al 60%, el reflujo fue realizado por seis ciclos. Para obtener el extracto de clavo, 100 g del aromático, previamente molidos a partículas <2mm, fueron suspendidos en un litro de etanol al 96%. La mezcla fue almacenada, en obscuridad, por 28 días, con agitación manual cada 3 días. Los extractos fueron concentrados por evaporación a presión reducida, y 37 °C, en un rota-evaporador (Buchi R300), hasta sequedad. Los sólidos obtenidos fueron conservados a 6 °C, en frasco ámbar, hasta su empleo. Para el uso de los extractos, a la concentración requerida, los sólidos fueron disueltos en etanol absoluto.
Diseño de tratamientos
Se estableció un diseño factorial 42, de dos factores (extracto de ajo y extracto de clavo) a cuatro niveles (concentración del extracto), lo que resultó en 16 tratamientos (Cuadro 1).
Cuadro 1 Diseño de tratamientos utilizado para determinar la actividad inhibitoria del crecimiento de M. fijiensis de los extractos alcohólicos de clavo y ajo.
| Tratamiento | Extracto de ajo (µg·ml-1) |
Extracto de clavo (µg·ml-1) |
| 1 | 0 | 0 |
| 2 | 0 | 12 |
| 3 | 0 | 24 |
| 4 | 0 | 36 |
| 5 | 150 | 0 |
| 6 | 150 | 12 |
| 7 | 150 | 24 |
| 8 | 150 | 36 |
| 9 | 300 | 0 |
| 10 | 300 | 12 |
| 11 | 300 | 24 |
| 12 | 300 | 36 |
| 13 | 450 | 0 |
| 14 | 450 | 12 |
| 15 | 450 | 24 |
| 16 | 450 | 36 |
Determinación de la inhibición del crecimiento de M. fijiensis y velocidad de desarrollo de la colonia.
La inhibición del crecimiento de M. fijiensis se calculó después de analizar la ganancia en área de la colonia. Para ello se prepararon placas de Petri (15 cm de diámetro) con ADP adicionado con la cantidad de extracto de ajo y/o clavo correspondiente al tratamiento. En cada placa de Petri, cuatro por tratamiento, se colocó un disco de ≈3 mm de diámetro de micelio de la colonia de M. fijiensis crecida previamente en ADP. El cultivo del hongo se realizó a 30 °C. Cada 7 días, y por un periodo de 28 días, se midió el diámetro de la colonia con un calibrador digital (Mitutoyo, Digimatic, resolución 0.01 mm). Con el diámetro de colonia, el área de crecimiento fue calculada empleando la fórmula del círculo [A (mm2) = π r2)] y el cálculo de la inhibición (%) del tratamiento se realizó mediante la fórmula:
Inhibición (%) = [(AET1 - AETN) (AET1)-1] (100), donde
AET1 = Área de crecimiento efectivo del tratamiento control (mm2) = AT1n - AT10
AETN= Área de crecimiento efectivo del tratamiento
N (mm2) = ATNn - ATN0
AT1n = área de crecimiento del tratamiento control a cualquier tiempo (mm2)
AT10 = área de crecimiento del tratamiento control a t = 0 (mm2)
ATN0 = área de crecimiento de cualquier tratamiento a cualquier tiempo (mm2)
ATN0 = área de crecimiento de cualquier tratamiento
a t = 0 (mm2).
La velocidad de crecimiento de la colonia (µ=semana-1) fue calculada como la pendiente de la relación lineal entre la transformación del valor nominal de AETN a Ln y el tiempo (semanas).
RESULTADOS
En el Cuadro 2 se muestran los valores del área de crecimiento de las colonias de M. fijiensis en los diferentes tratamientos y tiempos de muestreo. Se puede observar que el inóculo fue de tamaño similar (semana 0) y que el crecimiento de la colonia durante la primera semana también fue similar. A partir de la segunda semana, y hasta la semana final, el área de la colonia fue diferencial. Al concluir el trabajo (semana 4), el área de las colonias de todos los tratamientos que tuvieron extracto de ajo y/o de clavo fue estadísticamente menor al del tratamiento sin extractos (Tratamiento 1). Así mismo, el área de la colonia del Tratamiento 1 fue 1.6 veces mayor respecto a la de los tratamientos 9 y 10. El análisis de la varianza de los valores del área de crecimiento de M. fijiensis mostró que las diferencias entre ellos fueron significativas, tanto para el extracto de clavo y el extracto de ajo, como para la combinación de ambos (Cuadro 3).
Cuadro 2 Área de la colonia de las colonias de M. fijiensis crecida por cuatro semanas en medio ADP adicionado de extracto de ajo y/o clavo.
| Tratamiento | Semana 0 | Semana 1 | Semana 2 | Semana 3 | Semana 4 |
| 1 | 7.23 R | 26.89 P | 100.88 LM | 193.98 CDE | 264.73 A |
| 2 | 6.52 R | 29.38 P | 97.52 MN | 150.94 GHIJK | 201.95 BCD |
| 3 | 8.45 QR | 28.26 P | 97.09 MN | 160.40 FGH | 210.77 B |
| 4 | 7.36 R | 27.65 P | 85.36 MN | 137.74 K | 194.97 BCDE |
| 5 | 7.42 R | 28.32 P` | 88.76 MN | 151.82 GHIJK | 194.39 BCDE |
| 6 | 7.76 R | 31.06 P | 100.49 LM | 163.20 FG | 200.00 BCDE |
| 7 | 7.23 R | 24.36 PQ | 82.05 N | 142.66 IJK | 168.83 F |
| 8 | 8.04 QR | 30.67 P | 52.38 Q | 88.07 MN | 163.61 FG |
| 9 | 7.15 R | 27.03 P | 92.01 MN | 145.49 HIJK | 185.31 E |
| 10 | 6.91 R | 34.95 P | 90.39 MN | 155.77 FGHIJ | 207.61 BC |
| 11 | 6.75 R | 25.22 P | 87.79 MN | 155.31 FGHIJ | 200.79 BCDE |
| 12 | 7.31 R | 34.26 P | 92.44 MN | 141.89 JK | 203.32 BCD |
| 13 | 7.24 R | 30.87 P | 115.01 L | 163.47 FG | 204.14 BCD |
| 14 | 6.84 R | 22.12 PQR | 85.02 MN | 148.97 GHIJK | 210.16 BC |
| 15 | 6.59 R | 25.30 P | 90.93 MN | 159.60 FGH | 192.00 DE |
| 16 | 6.93 R | 25.17 P | 86.14 MN | 159.00 FGHI | 191.87 DE |
Letras diferentes significan valores significativos [Tukey a< 0.05; diferencia mínima significativa (DMS) =16.05; error estándar = 5.91]. La composición del medio de cultivo del tratamiento fue ADP adicionado de extracto de ajo y/o clavo, en concordancia con el diseño estadístico
Cuadro 3 Análisis de la varianza de los valores de área de colonia de M. fijiensis crecida en medio ADP adicionado con extracto de ajo y/o clavo.
| Fuente de variación | gl | F | Valor de P |
| Ajo | 3 | 22.89 | <0.0001 |
| Clavo | 3 | 23.71 | <0.0001 |
| Ajo * Clavo | 9 | 10.5 | <0.0001 |
| Error | 260 |
Desde la perspectiva del efecto individual de los extractos, en la Figura 1 se muestra que conforme fue aumentada la concentración del extracto de ajo, mayor fue el área promedio de crecimiento de la colonia (menor inhibición); situación contraria con el extracto de clavo ya que, en este, a mayor concentración menor área promedio de crecimiento (mayor inhibición). En ambos casos, las diferencias fueron significativas (Tukey α<0.05; DMS = 3.57).
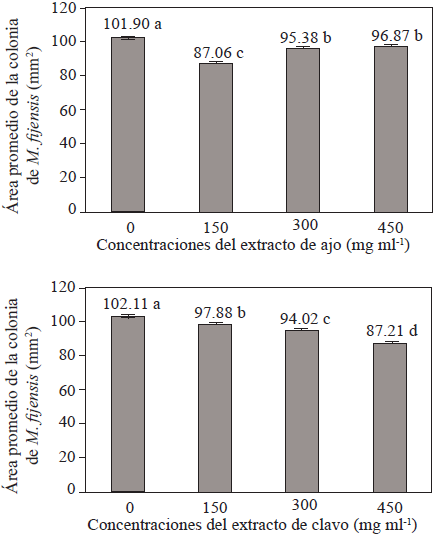
Figura 1 Área promedio de crecimiento de la colonia de M. fijiensis en medio de cultivo ADP adicionado con diferentes concentraciones de ajo (arriba) y clavo (abajo).
En la Figura 2 se muestra el porcentaje de inhibición de la colonia después de cuatro semanas de crecimiento en los medios de cultivo de los diferentes tratamientos. Todos los tratamientos mostraron capacidad de inhibición del desarrollo de la colonia de M. fijiensis(rango de 21.0% hasta 39.6%). El mayor porcentaje de inhibición fue observado en el medio de cultivo que contenía la menor cantidad de extracto de ajo y la mayor cantidad de extracto de clavo (Tratamiento 8).
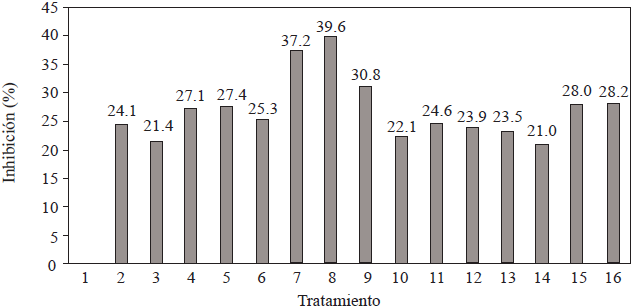
Figura 2 Inhibición del desarrollo de la colonia de M. fijiensis (porciento de área), después de cuatro semanas de cultivo, en los diferentes tratamientos planteados en el Cuadro 1.
La transformación de los datos de área de la colonia (mm2) al Ln para cada semana de cultivo mostró comportamientos similares para todos los tratamientos. En la Figura 3 se muestran los tratamientos extremos es decir el que tuvo las áreas más grandes, Tratamiento 1, y el que tuvo las áreas más pequeñas, Tratamiento 8. Los valores de la recta de regresión para todos los tratamientos se muestran en el Cuadro 4. Como se observa en el citado cuadro, la pendiente de la recta (m), o velocidad de crecimiento de la colonia (semana-1), en todos los tratamientos, estuvieron en el rango de 0.7081 semana-1 hasta 0.9177 semana-1. De ese modo la velocidad de crecimiento de las colonias del Tratamiento 10 fue 23% más lenta respecto a las del Tratamiento 1. Por su parte la ordenada al origen tuvo un valor promedio de 2.3589 ±0.07675 y, con la excepción del Tratamiento 13, todos los coeficientes de determinación fueron mayores a 0.9.
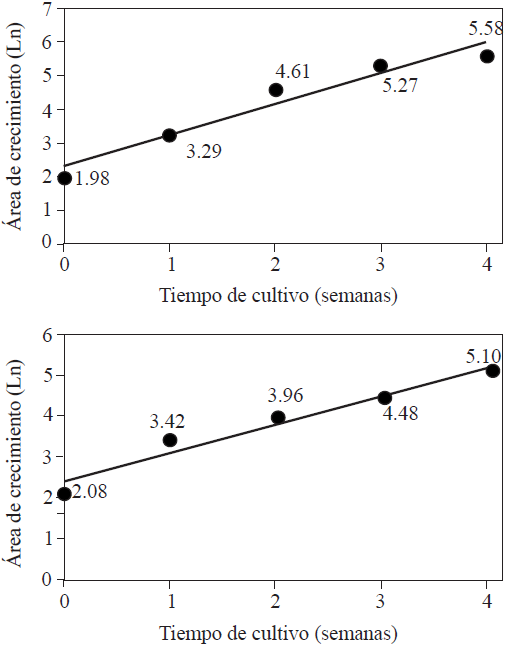
Figura 3 Correlación entre el Ln del área de la colonia de M. fijiensis del tratamiento sin extractos de ajo y/o clavo (Tratamiento 1, arriba) y del tratamiento con 150 µg extracto de ajo·ml-1 y 36 µg extracto de clavo·ml-1 (Tratamiento 8; abajo) y el tiempo de cultivo (semanas).
Cuadro 4 Valores de la pendiente (m), o velocidad de crecimiento (semana-1), ordenada al origen (b) y el coeficiente de determinación (r2) derivados de linealizar los datos de Ln del área de la colonia (mm2) y la semana de cultivo.
| Tratamiento | m | B | r2 |
| 1 | 0.92 | 2.31 | 0.94 |
| 2 | 0.85 | 2.33 | 0.91 |
| 3 | 0.82 | 2.46 | 0.93 |
| 4 | 0.82 | 2.36 | 0.93 |
| 5 | 0.82 | 2.38 | 0.92 |
| 6 | 0.82 | 2.47 | 0.91 |
| 7 | 0.81 | 2.32 | 0.92 |
| 8 | 0.71 | 2.39 | 0.95 |
| 9 | 0.82 | 2.36 | 0.91 |
| 10 | 0.83 | 2.42 | 0.91 |
| 11 | 0.86 | 2.27 | 0.93 |
| 12 | 0.81 | 2.45 | 0.91 |
| 13 | 0.83 | 2.44 | 0.89 |
| 14 | 0.88 | 2.21 | 0.94 |
| 15 | 0.86 | 2.27 | 0.92 |
| 16 | 0.85 | 2.29 | 0.9243 |
DISCUSIÓN
Al igual que muchos hongos fitopatógenos, M. fijiensis fue sensible a los componentes de los extractos etanólicos del ajo y clavo. El tipo de compuesto, y/o su concentración, flavonoides, fenoles, terpenos, aceites esenciales, alcaloides, lectinas, polipéptidos entre otros, pueden ser los responsables de dicha acción (Hernández et al., 2007). La oxidación de diversos compuestos provocada por los fenoles, la acción lipofílica de los aceites esenciales, el intercalado de los alcaloides en el ADN, la formación de canales iónicos en la envoltura celular mediados por lectinas y la inhibición competitiva de polisacáridos receptores por adhesión de polipéptidos son algunos de los mecanismos que pudieran explicar la actividad fungicida (Cowan, 1999; Nonsee et al., 2011; Rahnama et al., 2012).
La mayor sensibilidad de M. fijiensis a la acción antifúngica del clavo (Figuras 1) puede también atribuirse a la composición y/o a la concentración de los compuestos que éste contiene. En este sentido, el aceite esencial de clavo, miscible en etanol, contiene entre otros, eugenol, acetato de eugenilo, cariofileno y a-humuleno (Costa et al., 2011; Moura et al., 2012). Por su parte el ajo es rico en alicina, dialildisulfuro y dialiltrisulfuro (Campa-Siqueiros et al., 2017; Chong et al., 2015).
Inicialmente se esperaba que, al aumentar la concentración de los extractos de clavo y ajo, la actividad antifúngica fuera mayor. Aunque esto se cumplió para el extracto de clavo, para el extracto de ajo el comportamiento fue inverso (Figura 1), lo que corroboró los resultados reportados por Landero et al. (2013). Lo anterior pudiera ser explicado como un modelo de inhibición competitiva de alguna enzima donde al incrementar la concentración de extracto de ajo uno de sus componentes ocupa el lugar de aquel que tiene la actividad antifúngica. Es así que, al diluir el extracto, menor concentración, el componente competidor del antifúngico no es capaz de ocupar todos los “sitios activos” por lo que la inhibición del desarrollo de la colonia de M. fijiensis fue menor. Los resultados de la posterior etapa (Datos no mostrados), apoyan lo propuesto previamente ya que al disminuir hasta 100 mg·ml-1 la concentración del extracto de ajo la actividad antifúngica fue incrementada. En el futuro habrá que definir cuál(es)es (son)el (los) componente(s) competitivo(s) y cuál(es) es (son) el (los) sitio(s) de acción.
Por su parte el comportamiento de la actividad antifúngica del extracto de clavo (Figura 1) fue típico de moléculas que al aumentar la concentración aumentan la actividad. Sin embargo, tiene un valor máximo lo que puede ser indicativo, nuevamente, de que el trasporte del componente fungicida es activo y que el sistema transportador tiene una concentración limitada en la envoltura celular de M. fijiensis.
El hecho de no encontrar diferencias significativas en el área de crecimiento de las colonias de M. fijiensis durante las dos primeras semanas de tratamiento (Cuadro 2) puede ser indicativo de que a) el sitio de acción del antifúngico es intracelular por lo que primero deberá internalizarse a través de algún mecanismo de transporte, posiblemente activo y b) que el componente activo sea un compuesto derivado del procesamiento metabólico de algún componente de los extractos. En ambos casos el transporte a través de la envoltura celular parece ser la etapa limitante ya que, una vez alcanzada la concentración crítica del antifúngico, su impacto se expresa en reducir la velocidad decrecimiento (Figura 3).
El valor máximo de inhibición, expresada en la mezcla de los extractos de clavo y ajo en el Tratamiento 8 (Figura 2) muestra una posible sinergia entre los componentes de ambos extractos ya que en los Tratamientos con solo ajo (Tratamientos 5, 9 y 13) o clavo (Tratamientos 2, 3 y 4), en sus distintas concentraciones, la actividad inhibitoria promedio fue de 27.2% y 24.2% respectivamente. De tal situación se puede desprender que los componentes de ambos extractos actúan de forma independiente, lo que habrá de demostrar posteriormente.
Independientemente de lo anterior, la inhibición máxima del desarrollo de la colonia de M. fijiensis, ejercida por la mezcla ajo-clavo (Tratamiento 8), encontrada en este trabajo fue cuatro veces mayor a lo reportado por Gutiérrez-Jiménez et al. (2017) quienes utilizaron placas de Petri con ADP adicionadas con 50, 100, 500, 1000 y 5000 ppm de aceite esencial de clavo y fue de 2.7 a 1.8 veces mayor a lo reportado por Sharanamma (2012) quien utilizó placas de Petri con ADP adicionado con 5%, 10% y 15% de extracto acuoso de ajo (1 gajo·mlH2O -1).
Por otro lado, la inhibición máxima está dentro del rango reportado para extractos de ajo empleados en el control de diversos hongos fitopatógenos como, por ejemplo, Colletotrichum sp (García, 2011; Landero et al., 2013; Sundaramoorthy et al., 2014; Cruz et al., 2013; Hernández et al., 2007), Rhizoctonia sp. (Chávez y Aquino, 2012), Fusarium sp. (Taskeen-Un-Nisa et al., 2011; Chávez y Aquino, 2012), Sclerotium sp. (Chávez y Aquino, 2012), Botrytis sp (Daniel et al., 2015; Sesan et al., 2015), Alternaria sp (Nashwa y Abo-Elyousr, 2012), Aspergillus (Tijjani et al., 2014), Penicillium (Ikeura et al., 2011) o para extractos de clavo: Colletotrichum sp (Radwan et al., 2014).
CONCLUSIONES
Conforme en el medio de cultivo ADP se incrementa la concentración de extracto alcohólico de ajo menor es la inhibición del desarrollo de la colonia de M. fijiensis.
A mayor concentración de extracto alcohólico de clavo en el medio ADP la inhibición del desarrollo de la colonia de M. fijiensis fue mayor.
La mezcla de los extractos alcohólicos de ajo y clavo tienen un efecto sinérgico positivo para inhibir el desarrollo de la colonia de M. fijiensis.
En el medio de cultivo ADP adicionado con 150 mg·ml-1de extracto alcohólico de ajo y 36 mg·ml-1 de extracto alcohólico de clavo, se redujo en 39.6% el desarrollo de la colonia de M. fijiensis, lo que puede ser una alternativa para el control, en campo, de dicho fitopatógeno.











 texto en
texto en 


