El moho blanco es causado por Sclerotinia sclerotiorum, un hongo que pertenece a la familia Sclerotiniaceae. Es un patógeno fúngico que destruye numerosos cultivos agrícolas, como el girasol, la soya, la colza, el frijol, el garbanzo, la canola y la cebolla (Hegedus y Rimmer, 2005; Bolton et al., 2006). No tiene plantas hospederas específicas y, por tanto, infecta más de 400 especies vegetales, principalmente las dicotiledóneas (Fernando et al., 2004; Hegedus y Rimmer, 2005). Las condiciones ambientales que favorecen la infección fúngica son la humedad excesiva y temperaturas de entre 15 y 25 °C (Saharan y Mehta, 2008). La secreción de enzimas fúngicas, como las celulasas y las pectinasas que suavizan y degradan los tejidos vegetales, interviene en el proceso de infección de la planta (Fernando et al., 2004; Bolton et al., 2006), así como en la producción de ácido oxálico, que tiene efectos tóxicos en el tejido del huésped (Hegedus y Rimmer, 2005). Una característica de este patógeno es la formación de esclerocios, estructuras fúngicas de resistencia y propagación, que en condiciones favorables se mantienen viables durante varios años en el suelo (Bae y Knudsen, 2007; Calvo y Cary 2015; Smith et al., 2015).
Se han identificado tres etapas o fases en la formación de esclerocios: 1) inicio: formación de hifas, 2) desarrollo: crecimiento de hifas más grandes, y 3) madurez: creación de límites en la superficie, consolidación interna y melanización (Le Tourneau, 1979; Rollins y Dickman, 2001; Bolton et al., 2006; Saharan y Mehta, 2008). En las etapas de inicio y madurez pueden influir factores abióticos como el fotoperiodo, la temperatura, el oxígeno y la disponibilidad de nutrientes (por ejemplo, fuentes de carbono); la morfogénesis y el desarrollo de esclerocios comienzan entre las 12 y las 24 h del crecimiento fúngico (Hansberg y Aguirre, 1990).
El esclerocio está compuesto por tres capas: una capa externa gruesa y pigmentada, una capa intermedia fina, y una capa interna de color blanco conocida como la médula interna (Punja y Damiani, 1996; Bardin y Huang, 2001). Dependiendo de las condiciones ambientales, los esclerocios crecen debajo de la tierra, de una o dos maneras: 1) forman micelio que puede infectar las raíces y causar pudrición y marchitez de los tejidos de la planta, o 2) producen apotecios, en los cuales se producen y liberan las ascosporas, y, posteriormente, infectan los órganos aéreos de la planta (Humpherson-Jones y Cooke, 1977; Mónaco et al., 1998; Bolton et al., 2006).
Los bicarbonatos tienen propiedades antimicrobianas de amplio espectro, y además se ha comprobado que son eficaces para controlar muchos hongos fitopatogénicos (Bombelli y Wright, 2006; Arslan, 2015). La Agencia de Protección del Medio Ambiente (EPA) de los Estados Unidos reconoce también que los bicarbonatos son compuestos inocuos y seguros tanto para la salud humana como para el ambiente (Palmer et al., 1997; Bombelli y Wright, 2006), ya que su uso disminuye la utilización de plaguicidas. Algunos estudios han mostrado que los carbonatos y bicarbonatos de sodio, potasio y amonio inhiben el crecimiento de varios patógenos fúngicos en frutas, verduras y plantas ornamentales después de la cosecha (Karabulut et al., 2003; Arslan et al., 2006; Jabnoun-Khiareddine et al., 2016). Los bicarbonatos alteran la permeabilidad de las membranas fúngicas, inhiben las reacciones de fosforilación oxidativa, y producen efectos tóxicos en las estructuras del patógeno (Avis, 2007). Sin embargo, su eficacia depende de la concentración (0.2-3%) y de la susceptibilidad de cada microorganismo. Por ejemplo, los tratamientos con carbonato y bicarbonato de sodio mejoraron el control del moho verde causado por Penicillium digitatum Sacc. (Trichocomaceae) en cítricos (Smilanick et al., 1999). Los bicarbonatos de sodio y potasio redujeron también el oídio o mildiú polvoriento causado por Leveillula taurica (Lév.) Arnaud (Erysiphaceae) en chile (Fallik et al., 1997), y la conidiogénesis causada por Helminthosporium solani Durieu y Mont (Pleosporaceae) (Olivier et al., 1998). Además, Bombelli y Wright (2006) y Türkkan et al. (2017) observaron que el crecimiento de Botrytis cinerea Pers. Fr. (Sclerotiniaceae) se inhibe cuando se expone a diferentes bicarbonatos con medios de cultivo in vitro. Se ha reportado también que la aplicación de bicarbonatos controla enfermedades en cultivos de zanahoria, pepino y melón (Aharoni et al., 1997; Bombelli y Wright, 2006).
En general, se han descrito los efectos inhibitorios del bicarbonato de potasio (KHCO3) en el crecimiento de S. sclerotiorum, así como en la germinación y formación de esclerocios nuevos (Ordóñez-Valencia et al., 2009), pero no se conocen bien los efectos de este compuesto químico durante las primeras etapas del desarrollo morfológico de los esclerocios. Por tanto, el objetivo del presente estudio fue evaluar, mediante observaciones microscópicas, los efectos de diferentes dosis de bicarbonato de potasio en las primeras etapas y en el desarrollo de los primordios de los esclerocios de S. sclerotiorum.
MATERIALES Y MÉTODOS
El aislado de Sclerotinia sclerotiorum se obtuvo de la colección microbiana del Departamento de Microbiología del Suelo, Colegio de Postgraduados. El hongo que se utilizó en el presente experimento fue previamente aislado de material vegetal proveniente de cultivos de lechuga en la región de El Bajío en Guanajuato, México. Para examinar los efectos de diferentes concentraciones de bicarbonato de potasio (KHCO3) en el crecimiento microscópico de S. sclerotiorum, se utilizó la técnica de microcultivo de Riddell (Riddell, 1950). Esta técnica consistió en colocar una varilla de vidrio en forma de V en cajas de Petri que contenían portaobjetos y cubreobjetos de microscopio. A continuación, las cajas de Petri se esterilizaron a 150 °C por 5 h. Al concluir la esterilización, se colocó un disco de 10 mm de diámetro que contenía un medio de cultivo de papa-dextrosa-agar (PDA® Merck, Darmstat, Alemania) enriquecido con diferentes concentraciones de KHCO3 (Fermont®, Monterrey, México; 0, 2, 4, 6, 8, 10, 25 y 50 mM) en los portaobjetos de microscopio. Posteriormente, utilizando una aguja estéril, se inoculó S. sclerotiorum en un lado del disco con PDA y después se le colocó el cubreobjetos. Este procedimiento se repitió dos veces por cada concentración de KHCO3; se incluyó también un control sin bicarbonato.
Para mantener la humedad en las cajas de Petri, se agregaron 10 mL de glicerol al 10%. Todas las cajas de Petri se mantuvieron a temperatura ambiente (~20 °C) durante un fotoperiodo de aproximadamente 12 h. El crecimiento del hongo fue monitoreado todos los días bajo un microscopio óptico (Leica CME, Estados Unidos). Cuando el disco con PDA se cubrió totalmente con micelio del hongo (aproximadamente a los siete días de incubación), el glicerol se remplazó con una solución de formaldehído al 10%, la cual se conservó por 2 h para lograr la fijación permanente de las estructuras del hongo.
Posteriormente, el portaobjetos de microscopio se retiró de la caja de Petri para preparar los portaobjetos con el hongo. El cubreobjetos fue separado cuidadosamente del agar y colocado en un portaobjetos limpio, al cual se agregó una gota de colorante azul de algodón en lactofenol. El siguiente paso fue retirar el disco con PDA del portaobjetos de microscopio original, al cual también se le agregó colorante, e inmediatamente se le colocó un cubreobjetos. De esta manera, se obtuvieron cuatro preparaciones fúngicas de cada concentración de KHCO3, incluido el control sin bicarbonato. Cuando se eliminó el exceso de colorante, las preparaciones fúngicas a las que se había agregado colorante fueron selladas con barniz de uñas transparente y evaluadas bajo un microscopio óptico. Las evaluaciones microscópicas tuvieron por objeto identificar el crecimiento de los primordios de los esclerocios en cada concentración de KHCO3. Para esto se utilizó un microscopio óptico (OLYMPUS BX51, Japón) para tomar microfotografías de las estructuras fúngicas mediante microscopía de contraste de fases. Se realizaron pruebas de bondad de ajuste de chi-cuadrada/o con el fin de comparar el efecto de las diferentes concentraciones de bicarbonato de sodio en cada una de las cuatro fases de producción de estructuras. En este caso se utilizaron las herramientas de VassarStats: Sitio web de Computación Estadística (Lowry 2001-2018).
RESULTADOS Y DISCUSIÓN
Las estructuras fúngicas que se presentan son parte del proceso de la formación de esclerocios de S. sclerotiorum, que fueron observados microscópicamente antes de la fase de inicio. La formación de esclerocios en el tratamiento de control (Figura 1, A-C) comenzó con la proliferación de ramas primarias de las hifas principales, lo cual indicó la formación de los primordios de los esclerocios. En la segunda estructura, la ramificación de las hifas se volvió más profusa y se observó la presencia de septos en las zonas apicales (Figura 1, D-F), en tanto que la tercera estructura se caracterizó por la presencia de grupos pequeños de hifas (Figura 1, G-I). Por último, en la cuarta estructura, se observó un grupo masivo de hifas, en el cual se podían ver algunas células pigmentadas (Figure 1, J-L). La fase de inicio comenzó con la unión de varios grupos de hifas. Esta etapa se puede observar macroscópicamente cuando el conglomerado de hifas comienza a crecer en la superficie del medio de cultivo.
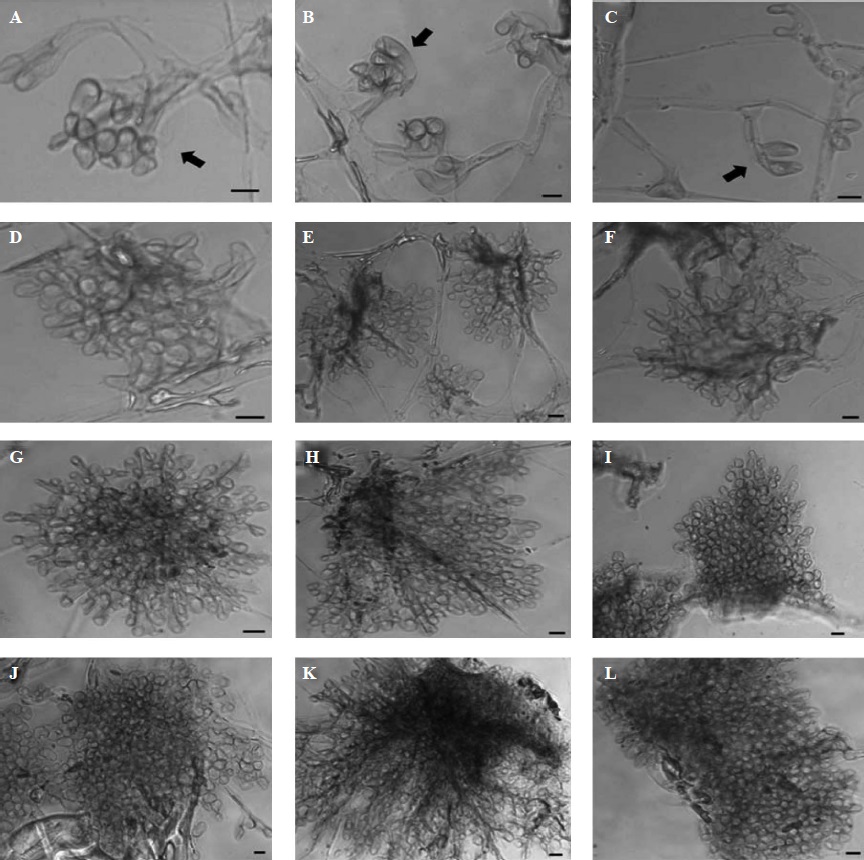
Figura 1 Formación de estructuras microscópicas observadas durante la formación de esclerocios de Sclerotinia sclerotiorum después de siete días de crecimiento fúngico, sin KHCO3 (control). Primera estructura: ramificación de hifas, que señalan las flechas (A-C); segunda estructura: ramificación profusa de hifas (D-F); tercera estructura: agrupamiento de hifas (G-I); cuarta estructura: agrupamiento masivo de hifas que forman los esclerocios en el proceso inicial (J-L). Las microfotografías fueron tomadas en un microscopio de contraste de fases a 40X de ampliación. Barras = 10 µm..
Los resultados mostraron que la aplicación de KHCO3 tuvo efectos inhibitorios en la morfología de los primordios de los esclerocios (Cuadro 1). Los resultados de la dosis de 50 mM no fueron incluidos en el análisis estadístico debido a la total ausencia de crecimiento micelial. A diferencia del tratamiento sin bicarbonato (control) y con 2 mM de bicarbonato, los tratamientos con todas las demás concentraciones de este compuesto químico mostraron solo tres estructuras de desarrollo, en las cuales notamos que los primordios tenían formas irregulares con la formación de células laxas. A medida que la concentración de KHCO3 aumentó, los primordios se hicieron más pequeños y menos compactos. Cuando la concentración de bicarbonato aumentó, se inhibió el crecimiento tanto de las hifas como de los esclerocios (Figuras 2 y 3). Sin embargo, a concentraciones de 2 mM, 4 mM y 6 mM de KHCO3 solo se observaron pequeños cambios morfológicos.
Cuadro 1 Frecuencia de los esclerocios en cada fase de producción de estructuras. El valor de la última columna indica la probabilidad de la ausencia de efectos debido a la exposición a bicarbonato de sodio en cada fase de producción de estructuras (prueba de bondad de ajuste de chi-cuadrada).
| Tratamientos Concentraciones de bicarbonato de sodio | ||||||||
| Fase de la estructura | Control | 2 mM | 4 mM | 6 mM | 8 mM | 10 mM | 25 mM | Probabilidad |
| I | 6 | 5 | 5 | 6 | 5 | 5 | 7 | 0.8606 |
| II | 5 | 5 | 5 | 5 | 5 | 5 | 0 | 0.2914 |
| III | 4 | 5 | 5 | 6 | 5 | 5 | 0 | <0.0001 |
| IV | 4 | 5 | 0 | 0 | 0 | 0 | 0 | <0.0001 |
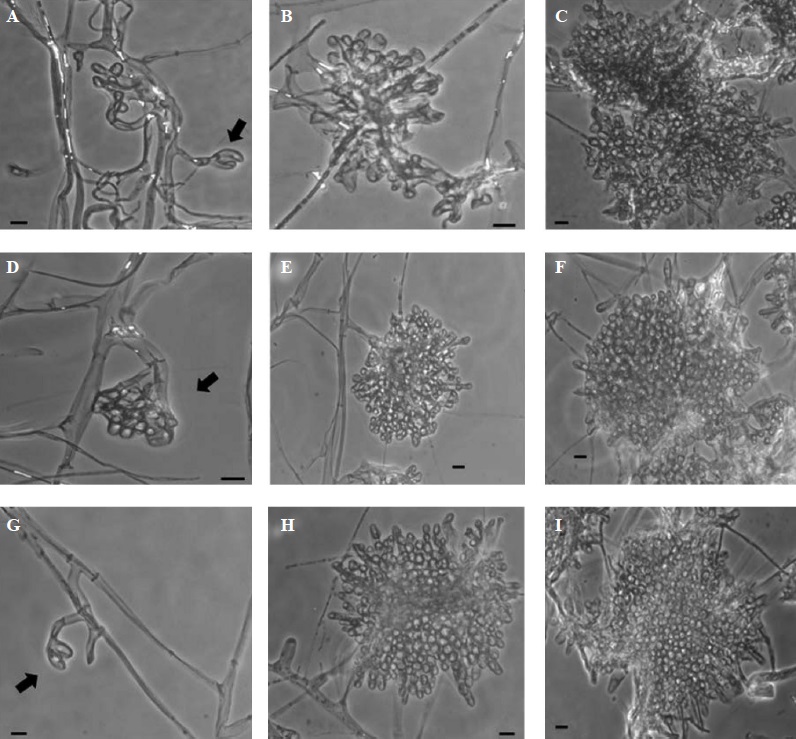
Figura 2 Estructuras microscópicas de desarrollo durante la formación de esclerocios de Sclerotinia sclerotiorum, después de siete días de crecimiento del hongo. La primera (que indican las flechas), la segunda y la tercera estructura del desarrollo de esclerocios en presencia de KHCO3: (A-C) 2 mM, (D-F) 4 mM, y (G-I) 6 mM. Se tomaron microfotografías en un microscopio de contraste de fase a 40X de ampliación. Barras = 10 µm.

Figura 3 Se observaron estructuras microscópicas de desarrollo durante la formación de esclerocios de Sclerotinia sclerotiorum, después de siete días de crecimiento del hongo. La primera (que indican las flechas), la segunda y la tercera estructura del desarrollo de esclerocios en presencia de KHCO3: (A-C) 8 mM, y (D-F) 10 mM. A la dosis de 25 mM se observó desorganización celular del primordio (G-I), en la cual no se observaron ni la segunda ni la tercera estructura de desarrollo de los esclerocios. Las microfotografías fueron tomadas en un microscopio de contraste de fases a 40X de ampliación. Barras = 10 μm
Los cambios morfológicos más notorios fueron evidentes después de que el hongo fue expuesto a concentraciones de más de 8 mM de KHCO3. Con la concentración de 10 mM, se notó la presencia de primordios, aunque no bien desarrollados. A pesar de esto, pudimos observar la tercera estructura de desarrollo (Figura 3, F), aunque no fue similar a la del control, debido a las formaciones irregulares del esclerocio, en el cual los grupos de hifas fueron más laxos (Figura 1, G-I). A la concentración de 25 mM, la formación de primordios de los esclerocios fue escasa y desorganizada (Figura 3, G-I), y, por esta razón, no pudimos observar ni se terminó de formar la segunda o la tercera estructura de inicio de los esclerocios (Cuadro 1). Por último, con la concentración de 50 mM, no se notó ningún efecto, debido a la ausencia de crecimiento fúngico en este tratamiento.
En este estudio, observamos el proceso de formación de esclerocios durante su primera fase, en la cual se identificaron las cuatro etapas de desarrollo (Bolton et al., 2006; Saharan y Mehta, 2008). Sin embargo, la formación de esclerocios mostró variaciones dependiendo de la concentración de KHCO3. El efecto inhibitorio de los bicarbonatos en el crecimiento de varias especies de hongos fitopatogénicos, sobre todo durante la postcosecha, ya ha sido documentado (Aharoni et al., 1997; Palmer et al., 1997; Bombelli y Wright, 2006; Jabnoun-Khiareddine et al., 2016), y Ordóñez-Valencia et al. (2009) demostraron que el KHCO3 inhibió el crecimiento de S. sclerotiorum en medios de cultivo in vitro. El efecto inhibitorio de las sales de bicarbonato en los hongos probablemente se produjo debido a la reducida presión de turgencia del hongo, que ocasionó el colapso y encogimiento de las hifas (Türkkan et al., 2017).
La formación de los primordios de los esclerocios de S. sclerotiorum comenzó con la ramificación y el agrupamiento de hifas (Figura 1), que formaron una masa de células que finalmente produjo esclerocios maduros. Smits y Noguera (1988) observaron efectos similares en la formación de esclerocios de Macrophomina phaseolina, la cual comenzó desde la ramificación y entrelazamiento de las hifas, además del aumento de tamaño de las células asociadas y la reducción del tamaño de la masa de esclerocios. Townsend y Willets (1954) observaron diferentes patrones de desarrollo (engrosamiento, ramificación y septación de las principales hifas y sus entrelazamientos) en Rhizoctonia solani, Botrytis allii, B. cinerea y Sclerotium cepivorum.
En el presente estudio, el KHCO3 produjo cambios morfológicos microscópicos durante las fases iniciales del desarrollo de los esclerocios. El aumento de las concentraciones de bicarbonato produjo la ramificación menos profusa y laxa de hifas, lo cual causó la reducción y la consecuente ausencia de esclerocios bien formados (Cuadro 1). Igwegbe et al. (1977) reportaron que al agregar 50 µg mL-1 de 6-metilpurina causó una reducción significativa en la formación de esclerocios de S. rolfsii.
Al agregar KHCO3, aumentó el pH (de 6.5 a 8.0) del medio de cultivo (Ordóñez-Valencia et al., 2009), lo cual dio como resultado la reducción del crecimiento fúngico. Al respecto, Alexander (1977) mencionó que muchos hongos se desarrollan mejor en condiciones ácidas que alcalinas, porque un ambiente ácido no es propicio para la existencia de bacterias ni de actinomicetos, y esto ocasiona que los hongos monopolicen el uso de sustratos orgánicos (Giri et al., 2005). Por otro lado, se ha observado que tanto el crecimiento como el desarrollo de esclerocios de S. sclerotiorum dependen del pH y de la producción de ácido oxálico (Rollins y Dickman, 2001; Chen et al., 2004). Los valores de pH neutros o alcalinos inhiben la formación de esclerocios, y la producción de ácido oxálico ayuda a reducir el pH alcalino del medio de cultivo, creando condiciones más favorables para el desarrollo de los esclerocios (Rollins y Dickman, 2001).
Aunque en algunos reportes se han descrito los efectos negativos del bicarbonato en ciertos hongos fitopatogénicos (Bombelli y Wright, 2006; Ordóñez-Valencia et al., 2009), el presente estudio es uno de los primeros reportes que describen los efectos inhibitorios que tiene el KHCO3 en S. sclerotiorum durante las fases iniciales de la formación de esclerocios, así como en la morfología de los primordios de los esclerocios.
Los efectos inhibitorios del KHCO3 en el crecimiento y desarrollo fúngico pueden explicarse en parte por el hecho de que este compuesto afecta procesos bioquímicos vitales, como la biogénesis, ya sea de la pared celular y/o la pared apical del hongo (Sentandreu et al., 1994; Sideri y Georgiou, 2000). Ciertos compuestos antimicrobianos causan estrés oxidativo en los hongos, y éstos pueden mostrar cambios morfológicos, tasa de crecimiento deficiente y bajo contenido de proteínas y ATP (Harel et al., 2005; Marcet-Houben y Gabaldon, 2011). A este respecto, la aplicación de KHCO3 puede causar la producción de especies reactivas de oxígeno (ERO) en respuesta al estrés generado por esta sal y, posteriormente, producir alteraciones en la morfología y desarrollo de S. sclerotiorum.
Los iones de bicarbonato producen alteraciones en las reacciones de oxidación y nitración en los sistemas biológicos, regulan el pH y estimulan la producción de especies reactivas de nitrógeno, como el peroxinitrito (ONOO-) o el superóxido (O2-) (Knorev et al., 2000; Arai et al., 2005; Lushchak et al., 2009). La combinación del estrés oxidativo con factores abióticos también tiene efectos negativos en la formación de esclerocios en hongos filamentosos (Georgiou et al., 2006). Por otra parte, Sideri y Georgiou (2000) demostraron que la producción de peróxido de hidrógeno (H2O2) en S. rolfsii (Typhulaceae) está expuesta a diferentes condiciones de luz y hierro, y que la mayor producción de H2O2 se registra durante las primeras etapas del crecimiento fúngico. Sin embargo, a medida que los esclerocios maduran, la producción de peróxido de hidrógeno disminuye. No obstante, es necesario realizar más investigación para esclarecer los efectos que tiene el KHCO3 en los procesos fisiológicos, bioquímicos o moleculares durante la morfogenésis fúngica.
CONCLUSIONES
Los presentes resultados claramente demuestran que el KHCO3 es eficaz para controlar tanto el crecimiento como el desarrollo de S. sclerotiorum en condiciones in vitro, lo cual ayudaría a reducir la formación de esclerocios, y también sería una opción viable para reducir el uso de plaguicidas sintéticos. Sin embargo, este es un estudio preliminar, y, por tanto, debe estudiarse también la eficacia del KHCO3 en el suelo e incluir las interacciones planta-patógeno. Además, S. sclerotiorum pasa el 90% de su ciclo vital en forma de esclerocios y, por tanto, es importante realizar más investigación a fin de conocer en detalle los procesos que intervienen en las primeras etapas de estas persistentes estructuras de hongos o en su desarrollo posterior.











 texto en
texto en 


