La pimienta gorda es una planta utilizada en el arte culinario, es producida en regiones tropicales en la zona costera del Golfo de México. Más de 15 mil toneladas de pimienta gorda por año se producen en municipios de la Sierra del Totonacapan, estas son distribuidas a nivel nacional y a países de la Unión Europea. Actualmente la producción es afectada por hongos que atacan follaje, tallo, flor y principalmente los frutos de esta planta, lo que ha contribuido en la perdida de la calidad en el producto, por lo que se investigan las causas que ocasionan dicha reducción (Carballo PI. 2016, abril 10).
La antracnosis es una enfermedad que afecta especies vegetales de diferentes familias botánicas de zonas calurosas y húmedas, causada por diferentes especies del género Colletotrichum. Los síntomas comunes que este patógeno provoca son: manchas hundidas de color café oscuro, en hojas, tallos, flores o frutos, dando lugar a la muerte de los tejidos (Rivera, 2007).
En agosto del 2014, la M. C. Silvia E. García Díaz (Comunicación personal), realizó un diagnostico en frutos, tallos y hojas de pimienta gorda con material procedente de campo de la zona norte de Veracruz, se detectaron síntomas de antracnosis enfermedad que causo pérdidas del 20 hasta el 50% de la producción en pre y postcosecha. Al no contar con información de este hongo en el hospedante se realizó el presente trabajo entre el 2015-2016, para detectar con certeza la presencia del patógeno. Por lo anterior, la presente investigación tuvo como objetivo caracterizar morfológica, patogénica y molecularmente diferentes aislados obtenidos de frutos de pimienta gorda (Pimenta dioica L. Merrill) con síntomas de antracnosis y determinar el agente causal.
El muestreo y colecta de material vegetal (hojas, tallos y frutos) con síntomas de antracnosis se realizó en tres huertos intercalados de pimienta gorda y cultivos básicos, ubicados al norte de Veracruz (Localidad 1: La Fábrica, Coxquihui (20.177222°/-97.560278°); Localidad 2: Chapultepec, Espinal (20.204444°/-97.545000°) y Localidad 3: Sta. Isabel, Espinal (20.191111°/-97.529722°)). De cada huerto se colectaros tres muestras, una por cada árbol seleccionado en base a la presencia de síntomas, el estado fenológico de los árboles fue etapa de fructificación. El primer experimento se realizó en julio del 2015 y el segundo en agosto de 2016 (época de producción), en el laboratorio de Enfermedades de Postcosecha del Instituto de Fitosanidad-Fitopatología del Colegio de Postgraduados, Campus Montecillos. De cada sitio de colecta, se seleccionaron frutos con síntomas de la enfermedad, se desinfestaron con hipoclorito de sodio al 1% por 1 min, se lavaron con agua destilada estéril y se secaron en papel absorbente estéril. Posteriormente, se colocaron en cámaras húmedas a 25 ± 1 °C por cinco días. Al observar signos del patógeno en la superficie de los frutos, se realizaron preparaciones y se confirmó el hongo de interés. De estos se obtuvieron cultivos monospóricos en medio de cultivo PDA (39 gr en 1L agua) siguiendo la metodología de dilución y rayado (Echandi, 1971). Cada cultivo monospórico se desarrolló en medio de cultivo durante siete días. Para la morfología se extrajeron discos de 0.5 cm de diámetro de esas colonias y se sembraron cuatro repeticiones por aislado en cajas de Petri con medio PDA (Bioxon), se incubaron a 28 °C y se evaluó el crecimiento cada 48 h hasta que el patógeno llenara la caja. Se registraron las siguientes variables macroscópicas evaluadas a los 10 días: 1) Crecimiento en diámetro; 2) Margen de la colonia; 3) Tipo de micelio; 4) Color de colonia; 5) Anillos concéntricos de crecimiento; 6) Colonia esporulada. Posteriormente de cada aislamiento se realizaron preparaciones para caracterizar a las microvariables. Las variables microscópicas evaluadas fueron: 7) Tipo de conidio; 8) Estado sexual; 9) Color y dimensión de apresorio, para observar estas características se utilizó un microscopio compuesto (Micro Star, American Optical) con objetivo 40x; 10) Dimensiones de 50 conidios por aislado; y 11) Dimensiones de 50 apresorios. Los apresorios se obtuvieron a los cinco días de poner preparaciones de conidios en cámaras húmedas para inducir su formación. Se utilizó un diseño experimental completamente al azar y los datos fueron analizados de dos formas: 1) aplicando un análisis multivariado por clusters para las variables empleadas en la identificación y así obtener un dendograma de agrupamiento de las características morfológicas para conocer las especies involucradas en el desarrollo de síntomas de antracnosis en pimienta gorda; 2) se realizó un análisis de varianza normal donde se compararon diámetros de colonias de seis días. Los análisis matemáticos se realizaron utilizando el paquete de análisis estadístico SAS® System for Windows V9, 2002. La identificación de los aislados de Colletotrichum en frutos de pimienta gorda se basó en las variables morfológicas, morfométricas, así también en el agrupamiento obtenido del análisis multivariado comparado con las descripciones y claves de (Bailey et al., 1996; Barnett y Hunter, 1998).
Para corroborar que los síntomas observados en los frutos colectados en campo, fueron ocasionados por los aislados obtenidos, se realizaron los postulados de Koch (Agrios, 2002). Se colectaron frutos sanos (aproximadamente 300 frutos de pimienta gorda) en los sitios de muestreo y se utilizaron 13 aislados monospóricos de Colletotrichum spp. obtenidos de pimienta gorda. Para incrementar el inoculo, los aislados fueron sembrados en medio de cultivo harina de Maíz (AHM), con las esporas desarrolladas se preparó una solución madre, la concentración se determinó con un Hematocitómetro y se ajustó a 1x106 esporas/mL. Los frutos fueron desinfestados con hipoclorito de sodio (NaClO) al 1% por 1 min y enjuagados dos veces con agua destilada estéril, se dejaron secar durante 15 min; se colocaron en cajas de Petri y estas en cámaras húmedas. La inoculación de los frutos se realizó con la suspensión de esporas; para dos aislados que no presentaron esporulación se utilizaron discos de 0.5 cm de diámetro que contenían micelio. Se colocaron 5 µL de la suspensión de conidios sobre frutos sin herida (s/h) y con herida (c/h) realizada con una aguja de disección a una profundidad de 1 mm; en los testigos se aplicaron 5 µL de agua destilada estéril en frutos s/h y c/h, por sitio de muestreo. Las cámaras húmedas fueron selladas e incubadas a 23±1 °C, con luz natural durante 11 días. Para evaluar la patogenicidad se determinó la presencia o ausencia de manchas necróticas circulares o deformes, el porcentaje de incidencia y la severidad del hongo sobre el fruto. La incidencia se evaluó como porcentaje de frutos afectados por el patógeno. Para el análisis se agruparon los datos c/h y s/h por aislado y por localidad, utilizando la siguiente ecuación (1), sugerida por Anculle y Álvarez (1999). La severidad se evaluó como porcentaje de tejido afectado por el patógeno, utilizando la escala visual de Anculle y Alvarez (2006), modificada y adaptada al experimento; teniendo en cuenta el grado de afección calificado visualmente en cada fruto, fue valorada con la ecuación 2 de severidad según Anculle y Alvarez (1999).
Los tratamientos fueron una combinación de aislado, método de inoculación y hospedante, establecido bajo un diseño completamente al azar con cinco repeticiones inoculados con herida (c/h) y cinco sin herida (s/h) comparando el grado del daño sobre el fruto, el aislado y el sitio de muestreo para la variable severidad; para la variable incidencia se utilizó un análisis multivariado comparando el número de frutos dañados c/h y s/h, los aislados y la incidencia en los tres sitios de muestreo. Los análisis matemáticos se llevaron a cabo usando el paquete de análisis estadístico SAS® System for Windows V9, 2002. Para la confirmación de los postulados de Koch, se reaisló el patógeno extrayendo fragmentos de tejido y/o esporulación, que fueron depositados en PDA, se observaron y compararon las variables macro y microscópicas de los reaislados con las que presentaron los originales de los frutos de pimienta gorda. El experimento se repitió dos veces.
Cultivos monospóricos de los 13 aislamientos fueron incubados por 10 días a temperatura ambiente 23 ±1 °C en medio de cultivo PDA. De cada aislado se tomó una muestra de micelio, se depositó en un tubo Eppendorf para ser macerado. La extracción de ADN se realizó por el método de extracción y purificación CTAB (Wagner et al., 1987). Posteriormente de cada muestra se cuantifico la concentración de ADN mediante un NanoDrop 2000 Spectrophotometer (Thermo Scientific). Se amplificaron completamente los genes ITS-1, ITS-2 y 5.8S; y parcialmente al gen 18S y 28S de los 13 aislados de Colletotrichum spp.; se utilizaron los primers ITS 5 e ITS 4. La amplificación PCR y la secuenciación (ITS) del ADN extraído se llevó a cabo con el método de Sanger en la empresa Macrogen (Korea). Las secuencias de los 13 aislados fueron comparadas con las depositadas en el Centro Nacional de Información Biotecnológica (NCBI), con apoyo de la herramienta Blast. Las secuencias de mayor similitud fueron extraídas del banco de datos para los análisis filogenéticos y posteriormente junto con las obtenidas de los frutos fueron alineadas (Clustar W) y después procesadas mediante el método UPGMA en el programa Mega 6 (Análisis de Genética Evolutiva Molecular), para la obtención de un análisis filogenético.
Se obtuvieron 13 cultivos monospóricos de Colletotrichum spp. de los cuales se identificaron cuatro especies aislados de frutos de pimienta gorda con síntomas de antracnosis (Figura 1). El crecimiento en diámetro fue similar para la mayoría de los aislados, excepto para tres con crecimiento lento, identificados como C. acutatum. El 69% de las colonias presentaron un crecimiento y margen circular, mientras que el 31% un crecimiento circular y un margen ondulado, pero la mayoría presentó anillos concéntricos. Andrades et al. (2009) y Chowdappa et al. (2012), describieron colonias con márgenes regulares y un crecimiento circular; Morales et al. (2009) y Saldarriaga et al. (2008), observaron formación de anillos de crecimiento en algunos de sus aislados. Por otra parte, el 15% de los aislados presentó un micelio aéreo y el 54% fue plano; el 8% micelio denso y el 23% fue escaso; resultados parecidos fueron reportados por Saldarriaga et al. (2008) el 70% de sus cepas presento creciemiento ralo superficial, agregados miceliales. El color de colonia inicialmente fue blanca-salmón, posteriormente se tornó gris obscuro; el 54% presentó una coloración salmón-blanco-gris, el 31% blanco-gris, el 8% salmón y el 7% colonias blancas, porcentajes similares fueron reportados por Dominguez et al. (2012). Por su parte, Freeman et al. (1998), reportan que C. acutatum desarrollo masas conidiales de color salmón y C. gloeosporioides una esporulación grisácea. El 77% de los aislados produjo conidios unicelulares, hialinos, con extremos redondeados y solo el 23% presentó conidios con un extremo redondeado y el otro agudo; Villanueva et al. (2008), reportaron la formación de conidios hialinos, aceptados, cilíndricos y rectos. Robles (2015), mencionó que el 83% de sus aislados desarrollaron conidios unicelulares, hialinos, con extremos redondeados, el 11% presentó conidios con un extremo redondeado y el otro agudo y el 6% conidios con ambos extremos agudos. Villanueva et al. (2008), reportó que los conidios de C. gloeosporioides presentaron extremos obtusos pero algunos angostos y en C. fragariae un extremo obtuso y otro angosto. La longitud y ancho de los conidios osciló entre 18.1 - 44.9 µm y 4.2 - 13.6 µm, respectivamente; el promedio total en tamaño de conidios fue de 28.4 x 8.4 µm; estadísticamente no se encontraron diferencias significativas en la longitud y ancho (Pr>F: <0.0001; α: 0.05; LSD largo y ancho de conidio: 1.2891 y 0.4377). Resultados similares fueron reportados por Villanueva et al. (2008). Se observaron apresorios irregulares, de formas diferentes, de color café oscuro; la longitud osciló de 9.2 - 90.2 µm mientras el ancho de 5.9 - 57.1 µm; el promedio fue de 25.9 x 15.5 µm; estadísticamente no se encontraron diferencias significativas en la longitud (Pr>F: 0.0014, α: 0.05, LSD: 6.0527) y ancho (Pr>F: 0.0001, α: 0.05, LSD: 3.4877). Robles (2015) y Oliveira et al. (2005) reportarón resultados similares a los obtenidos en este experimento; Villanueva et al. (2008), observaron que los apresorios formados por C. fragariae, C. gloeosporioides y C. orbiculare fueron de color café, forma y tamaño similar; C. boninense promueve apresorios solitarios o en cadenas cortas, color marrón, de paredes gruesas, borde entero o crenado, rara vez lobulados, de forma irregular comúnmente en forma de proyectil de 4.5-18 x 4-11 µm de acuerdo a Damm et al. (2012). Solo un aislado presentó ascas con ascosporas hialinas, ligeramente curveadas y con los vértices redondeados; los demás sin presencia; Robles (2015), reporta una escasa formación de peritecios en medio de cultivo PDA. Con los datos obtenidos de las 11 características macroscópicas y microscópicas se realizó un análisis multivariado; se encontró un eigenvalue de 2.07 a los cuatro clusters o grupos. Esta información se confirmó con el valor de la Pseudo F que alcanzó un punto máximo de 21.9 a los cuatro grupos o clusters. Con estos valores se asevera que al analizar paralelamente las variables evaluadas, los 13 aislados se pueden clasificar en cuatro grupos.
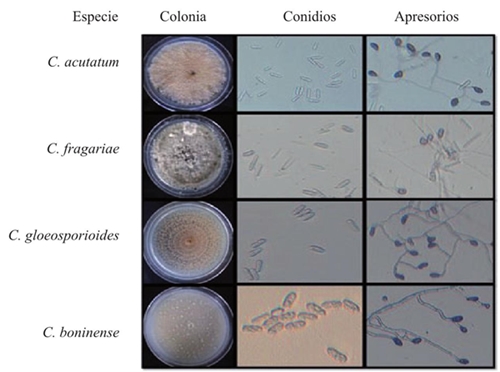
Figura 1 Características macroscópicas y algunas microscópicas de las especies de Colletotrichum spp., obtenidos de frutos de pimienta gorda en el norte de Veracruz.
La agresividad de los aislados fue variable en forma de inoculación (c/h y s/h), tipo de inoculación (suspensión y bocado) y entre los aislados; estas diferencias permitieron probar que algunos aislados son capaces de inducir más agresividad que otros, independientemente de la condición de inoculación. Se observaron frutos de pimienta gorda con manchas necróticas circulares de color café sobre la epidermis del fruto, lesiones hundidas, húmedas y blandas; conforme la infección avanzó, las manchas se tornaron marrón-café a oscuras, sobre las lesiones se presentó esporulación de color salmón, rosa a naranja y en algunos casos se desarrolló micelio blanco que cubrió los frutos a partir de la lesión inicial; Estos resultados coinciden con lo reportado por Somashekhara et al. (2013).
Se obtuvieron porcentajes de incidencia desde 20 a 100% por Colletotrichum spp. sobre la totalidad de frutos; se observó mayor incidencia en frutos de la localidad 2 y esta fue menor en proporción en aquellos procedentes de la localidad 1. Bogantes y Mora (2013), reportaron una alta incidencia (70%), pero baja severidad en frutos, de papaya. En el análisis multivariado se encontró un eigenvalue de 6.32 a los 2 clusters o grupos. Esta información se confirmó al revisar el valor de la Pseudo F que alcanzó un punto máximo de 20.9 a los dos grupos mayores o clusters. Por su parte, los resultados de la evaluación de severidad mostraron que esta fue mayor en frutos de pimienta gorda de la localidad 2, y en menor proporción en las localidades 1 y 3 (Pr>F: <.0001, α:0.05, LSD: 6.9888; diferencia en medias de: 35.644 A en la localidad 2 contra 5.604 B en la localidad 1 ) (Figura 2), así también se obtuvieron porcentajes de severidad altos en las inoculaciones, y se observó un nulo porcentaje en inoculaciones con agua (Pr>F: <.0001, α: 0.05; LSD: 13.778; diferencia en medias de: 16.773 A por suspensión contra 0.000 B en inoculación con agua). La severidad de cada aislado en frutos de la localidad 2 fue del 100% (Pr>F: 0.0094, α: 0.05 y LSD: 20.636), invadiendo completamente a los frutos, abundante esporulación y en algunos se desarrolló micelio de color blanco a gris. Resultados similares fueron reportados por Bogantes y Mora (2013), obteniendo un 100% de frutos de papaya afectados por antracnosis con un promedio de 36% de severidad en fruta.

Figura 2 Aislados de Colletotrichum spp. que causan el mayor grado de severidad en frutos de pimienta gorda.
Los reaislamientos que se obtuvieron de los frutos inoculados, presentaron síntomas y signos con características macro y micro morfológicas iguales a las de los aislados originales, con lo que se cumplió satisfactoriamente el 4° postulado de Koch.
La región ITS de los trece aislados obtenidos de frutos de pimienta gorda, fue amplificada permitiendo comparar y determinar las especies de hongos; los resultados obtenidos del GenBank mediante la herramienta Blast de las secuencias amplificadas de los iniciadores, revelaron que los 13 aislados existentes se dividieron en cuatro especies del género Colletotrichum: C. acutatum, C. fragariae, C. gloeosporioides y C. boninense. Con las secuencias se obtuvo un árbol filogenético (Figura 3), en el que se observa el agrupamiento de las especies asociadas, según las características similares de los aislados, se diferencian tres grupos: el grupo con mayor número de aislados lo conforma la especie C. gloeosporioides, dentro de este conjunto con características análogas se encuentra C. fragariae; el segundo grupo difiere en menor proporción del conjunto mayor y ubica a la especie C. boninense; y el último grupo que se desfasa molecular y morfológicamente de los demás aislados coloca a la especie C. acutatum.
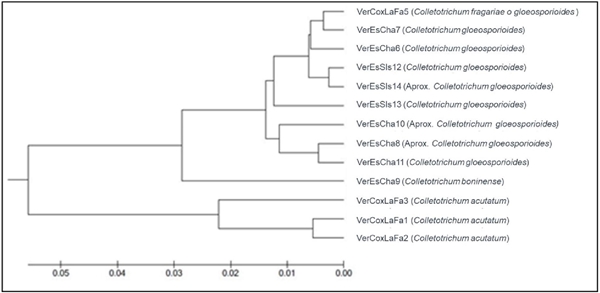
Figura 3 Árbol filogenético de los 13 aislados de Colletotrichum spp. obtenidos de frutos de pimienta gorda en el norte de Veracruz.
La utilidad de las técnicas moleculares para esta investigación fue de considerable importancia ya que las especies pertenecientes a este género muestran una gran variabilidad genética, que se expresa en variabilidad morfológica, virulencia y agresividad (Freeman et al., 2000).
Se obtuvieron 13 aislados monospóricos de Colletotrichum spp., de frutos de pimienta gorda provenientes de tres localidades productoras. Con la caracterización morfológica se identificó a C. acutatum (23%), especie con crecimiento lento, conidios con extremo redondeado y agudo; y C. gloeosporioides (77%), patógeno con crecimiento rápido, conidios con extremos redondeados; la variable estado o fase sexual se encontró en un aislado. En la caracterización patogénica se encontró variación en agresividad entre los aislados de Colletotrichum sobre los frutos de pimienta gorda, encontrando mayor número de aislados agresivos en frutos pertenecientes a la localidad Chapultepec, Espinal, Ver., lo que permitió aseverar que al menos para esta investigación, la patogenicidad sí depende de la localidad de donde se obtenga el aislado. De los dos métodos de inoculación (c/h y s/h) los mejores resultados se obtuvieron con el método c/h, que mostraron mayor incidencia y severidad de Colletotrichum en los frutos, en los testigos no se observó ningún síntoma. La identificación molecular confirmó los resultados de la caracterización morfológica y evidenció la presencia de dos especies adicionales, por lo cual de los 13 aislados: tres aislados correspondieron a C. acutatum; uno a la especie C. fragariae; ocho a la especie C. gloeosporioides y uno como C. boninense. Los resultados moleculares obtenidos coincidieron con un alto porcentaje de similaridad (97 a 99%) con las especies reportadas en el GenBank, de otros hospederos.











 texto en
texto en 


