La planta ornamental Petunia x hybrida, así como plantas de chile para huertos familiares, se producen en el estado de Morelos y en la Ciudad de México, dos de las más importantes entidades productoras de plantas ornamentales de invernadero en México (Mundo-Ocampo, 2006). Sin embargo, su producción es afectada por enfermedades que afectan a la raíz, causadas por varias especies de Phytophthora. P. capsici es un patógeno muy destructivo con un rango de plantas hospedantes de más de 50 especies vegetales a nivel mundial, entre ellas, solanáceas, cucurbitáceas, fabaceas y plantas ornamentales (Lamour et al., 2012; Fernández-Pavía et al., 2013). Por otro lado, se ha reportado que P. drechsleri afecta a más de 25 especies de plantas hortícolas y ornamentales (Lamour et al., 2012; Fernández-Pavía et al., 2013; Olson et al., 2011; Truong et al., 2012). En México, uno de los más importantes patógenos que afectan la raíz es Phytophthora capsici, y es sumamente destructivo en plantas de chile. Estas especies de Phytophthora son heterotálicas y requieren la presencia de tipos de compatibilidad opuestos (A1 y A2) para formar oosporas. La presencia de los tipos de compatibilidad de P. capsici y P. drechsleri en diferentes plantas hospedantes en un mismo vivero ha sido detectada en estudios anteriores realizados en nuestro laboratorio en México (datos no publicados). Sin embargo, no se ha documentado la presencia de ambos tipos de compatibilidad de esas especies en una misma planta hospedera en viveros de plantas ornamentales. El objetivo del presente estudio fue determinar si ambos tipos de compatibilidad (A1 y A2) de especies de Phytophthora pueden estar presentes en la misma planta hospedante, y si las oosporas se forman in planta bajo condiciones controladas de invernadero.
Los aislados de Phytophthora se obtuvieron de viveros comerciales de plantas de Capsicum annuum y Petunia x hybrida con síntomas de marchitamiento en Morelos y en la Ciudad de México en 2015. Para aislar el patógeno se analizó tejido vegetal de Capsicum annuum y Petunia x hybrida colectado de la rizósfera de plantas infectadas que mostraban síntomas de marchitez y pudrición de raíz. Los tejidos vegetales fueron enjuagados con agua corriente; se cortaron pequeños fragmentos infectados, se sembraron en un medio de cultivo NARPH-V8 (Delvocid Instant (0.02 g L-1) [(50% natamicina , 50 % lactosa)], ampicilina (0.27 g L-1), rifampicina (0.01 g L-1), PCNB (0.10 g L-1) e himexazol (0.075 g L-1), y se incubaron a 25 °C en obscuridad. Muestras de suelo de la rizósfera fueron sometidas a la utilización de hojas de Rhododendron sp. como cebo. Brevemente, se pusieron a flote seis hojas de Rhododendron sobre suelo completamente inundado (10 g de suelo:20 mL de agua estéril) e incubadas por 48 h a 25 °C; se eliminó el peciolo, se desinfestó con cloro comercial al 10% (0.6% hipoclorito de sodio) por 30 seg, se enjuagó dos veces con agua destilada estéril, se secó con toallas de papel estériles, se transfirió a cajas que contenían NARPH-V8 y se incubó como se indicó anteriormente. Los aislados de Phytophthora fueron identificados bajo el microscopio y, a continuación, se transfirieron a medio de cultivo harina de maíz agar (CMA, 17 g L-1), con la finalidad de obtener cultivos puros utilizando el método de punta de hifa. Se produjeron esporangios que fueron caracterizados morfológicamente incubando bloques de agar V8 con micelio en agua destilada estéril a 25 °C bajo luz fluorescente continua de tres a cinco días. El tipo de compatibilidad de los aislados de Phytophthora se determinó apareándolos con cepas conocidas, A1 y A2 de P. capsici y P. cinnamomi en agar V8 a 25 °C en obscuridad y examinándolos 20 días después. También se aparearon los tipos de compatibilidad opuestos de los aislados de Phytophthora capsici (A1 y A2) y de P. drechsleri (A1 y A2). El apareamiento de los tipos de compatibilidad opuestos in planta se llevó a cabo mediante la inoculación de aislados de Phytophthora en plantas sanas de Capsicum annuum y Petunia x hybrida. El inóculo consistió en discos de 6 mm con agar V8 con micelio y esporangios. Uno de los discos que contenía el aislado A2 de Phytophthora se colocó en la base del tallo, y el segundo, que contenía el aislado A1 de Phytophthora, se colocó a 3 cm de distancia del primer disco. Las plantas control fueron inoculadas con discos de 6 mm que contenían agar V8 sin el patógeno. Las plantas se inundaron durante 24 h para favorecer el desarrollo de la enfermedad. Para confirmar la formación de oosporas in planta se observaron muestras de tejido necrótico del tallo bajo un microscopio de campo luminoso con el objetivo 40x. Los tejidos fueron lavados con cuidado en agua jabonosa, enjuagados con agua destilada estéril, aclarados durante 40 seg en etanol al 96% hirviendo, enfriados durante 30 min; el aclarado con etanol se repitió durante 40 seg y posteriormente, el tejido se colocó en un portaobjetos de vidrio.
Para extraer el ADN genómico, los aislados se cultivaron en medio líquido de V8 clarificado al 2% a 21 °C por 15 a 20 días, y se siguió el protocolo de Möller et al. (1992) con modificaciones previamente descritas por Robideau et al. (2011). En el último paso, la pastilla de ADN fue re-suspendida en una solución amortiguadora 0.1X TE a la cual se agregaron 50 μg/mL de ribonucleasa (RNasa) A, y se incubó a 65 °C por 10 min.
La región del ITS (espaciador transcrito interno) del ADN ribosómico fue amplificada utilizando los iniciadores UN-up18S42 (Bakkeren et al., 2000), UN-lo28S1220 (Bala et al., 2010), Oom-up18S67, UN-lo28S22 y ITS4 (Lévesque y Cock, 2004). Secuencias parciales del gen mitocondrial COI (citocromo c oxidasa subunidad 1) fueron amplificadas con los iniciadores OomCoxILevup y Fm85mod (Martin y Tooley, 2003), y β-tubulina con los iniciadores Oom-Btub-up415 y Oom-Btub-lo1401 (Bilodeau et al., 2007).
Las amplificaciones en PCR se realizaron bajo las siguientes condiciones: todas las reacciones fueron sometidas a un paso inicial de desnaturalización a 95 °C por 3 min y un paso final de extensión a 72 °C de 8 a 10 min. La región ITS amplificada con los iniciadores Oom-up18S67 y UN-lo28S1220 se llevó a cabo en 35 ciclos de 95 °C por 30 seg, 58 °C por 45 seg, y 72 °C por 2 min. La misma región fue amplificada con los iniciadores UN-up18S42 y ITS4 en 40 ciclos de 95 ºC por 30 seg, 68 ºC por 45 seg y 72 ºC por 1.5 min.
Las condiciones para amplificar el COI fueron las mismas descritas por Robideau et al. (2011). La amplificación del gen β-tubulina de los aislados de P. capsici consistió en 40 ciclos de 95 °C por 1 min, 55 °C por 1 min y 72 °C por 1 min. Para los aislados de P. drechsleri se utilizó la técnica PCR touchdown bajo las condiciones descritas por Blair et al. (2008), pero disminuyendo la temperatura de 68 a 58 °C.
Para generar las secuencias del ADN de las reacciones de amplificación-secuenciación se utilizó un analizador genético Applied Biosciences Prism® 3130xl. Las secuencias fueron ensambladas, editadas para obtener secuencias consenso, alineadas con las secuencias publicadas (NCBI, Centro Nacional de Información Biotecnológica, https://www.ncbi.nlm.nih.gov/) y analizadas con el programa Blast (Geneious 8.1, http://www.geneious.com), a fin de determinar los porcentajes de identidad. Las secuencias fueron enviadas al Banco de Genes (GenBank).
Para confirmar la identidad de los aislados con secuencias ex-tipo, se llevó a cabo un análisis filogenético multi-locus aplicando el método de máxima verosimilitud e inferencia bayesiana, y se creó un perfil filogenético en el portal de ciencia de CIPRES v. 3.3 (Miller et al., 2010).
Dos aislados de P. drechsleri con tipos de compatibilidad opuestos se obtuvieron de suelo de la rizósfera de una planta de Petunia x hybrida. Dos aislados de P. capsici con tipos de compatibilidad opuestos se obtuvieron del tejido del tallo de una planta de C. annuum. La caracterización morfológica y molecular, así como el análisis filogenético (Figura 1), confirmaron la identidad de los aislados. Los números de Accesión de los aislados se muestran en el Cuadro 1. Todos los aislados mostraron 99% de similitud con las secuencias de la base de datos Phytophthora - Q-bank (http://www.q-bank.eu/bioloMICSSequences.aspx?file=Bacteria&file=FUNGI&file=Arthropods&file=Nematodes&file=Phytopl&file=Plants&file=Virus&file=Sequence&wsize=20). Los aislados LEV6716 (A1) y LEV6717 (A2) de Phytophthora capsici, y LEV6731 (A1) y LEV6732 (A2) de Phytophthora drechsleri fueron depositados en la colección del Departamento de Agricultura y Agri-Food Canadá, en Ottawa, Canadá.
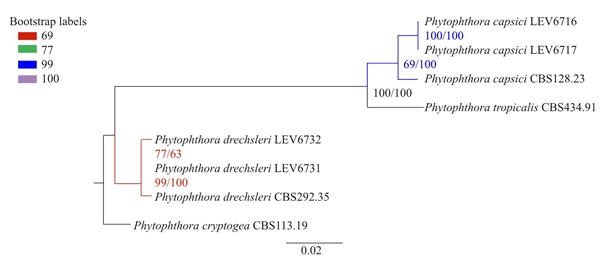
Figura 1 Análisis filogenético concatenado de los genes ITS, β-tubulina y COI utilizando máxima verosimilitud e inferencia bayesiana de Phytophthora capsici y P. drechsleri con Phytophthora cryptogea como grupo externo. Los valores bootstrap de máxima verosimilitud y las probabilidades posteriores de la inferencia bayesiana en porcentajes se indican en los puntos de la rama, respectivamente. La barra de la escala indica 0.02 sustituciones por sitio por rama.
Cuadro 1 Número de acceso de los genes ITS, b-tubulina y COI, de los aislados.
|
Código aislado |
Especies |
Hospedante o sustrato |
GenBank número de acceso |
||
|
ITS |
β -tubulina |
CO1 |
|||
|
LEV6716 |
P. capsici |
Capsicum annuum |
MH025883 |
MH013476 |
MH013474 |
|
LEV6717 |
P. capsici |
Capsicum annuum |
MH025884 |
MH013477 |
MH013475 |
|
LEV6731 |
P. drechsleri |
Petunia x hybrida |
MH025881 |
MH013478 |
MH013472 |
|
LEV6732 |
P. drechsleri |
Petunia x hybrida |
MH025882 |
MH013479 |
MH013473 |
Las plantas de Capsicum annuum inoculadas con aislados de ambos tipos de compatibilidad de P. capsici mostraron clorosis, defoliación, marchitez y necrosis en el tallo cinco días después de la inoculación (ddi). Las plantas de Petunia x hybrida inoculadas con los tipos de compatibilidad A1 y A2 de P. drechsleri mostraron síntomas de marchitez a los 10 ddi. Los aislados fueron re-aislados de las lesiones de las plantas e identificados mediante morfología para confirmar los postulados de Koch. Las plantas control permanecieron sanas. Se observaron abundantes oosporas en la epidermis de los tallos de C. annuum y Petunia x hybrida de las plantas inoculadas (Figuras 2 y 3), a los siete y 10 ddi, respectivamente.
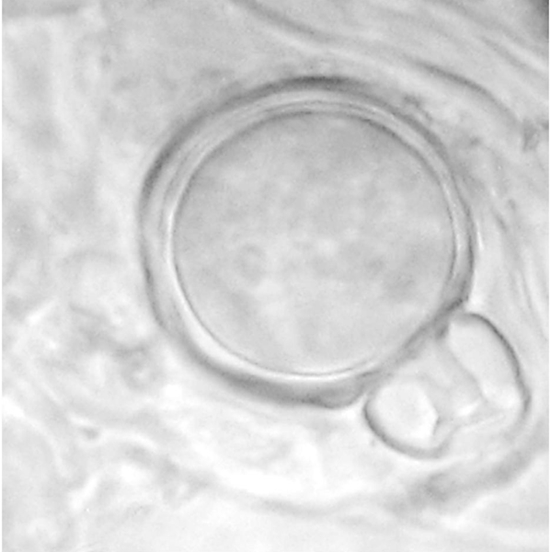
Figura 2 Oospora de Phytophthora capsici formada in planta en tejidos de la raíz de Capsicum annuum co-inoculados con aislados de los tipos de compatibilidad A1 y A2.
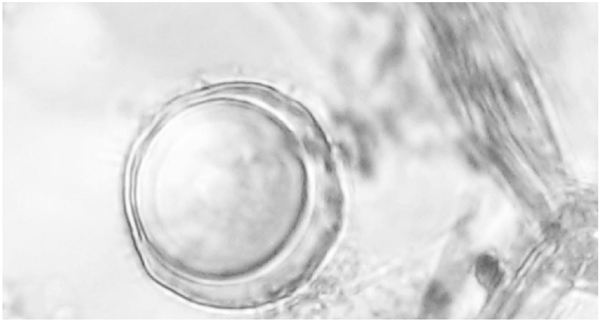
Figura 3 Oospora de Phytophthora drechsleri formada in planta en tejidos de la raíz de Petunia x híbrida co-inoculados con aislados de los tipos de compatibilidad A1 y A2.
La presencia de ambos tipos de compatibilidad en los aislados de P. capsici y P. drechsleri en la misma planta y rizósfera, respectivamente, indica que la reproducción sexual y la variación genética está ocurriendo en las plantas de vivero. La formación de oosporas podría servir como inóculo primario (Lehtinen y Hannukkala, 2004), ya que en México reutilizan el suelo y las macetas infestadas, lo cual contribuye a la presencia anual de Phytophthora en las plantas de vivero. Las oosporas son estructuras que resisten mucho tiempo en los viveros, lo cual permite que se vuelvan a colonizar las plantas hospedantes, y pueden introducir nuevos genotipos recombinantes de Phytophthora a zonas nuevas. Dado que los viveros comerciales muestreados distribuyen plantas a muchos estados de la República Mexicana, es muy probable que estos patógenos sean diseminados a nuevas zonas agrícolas, forestales y urbanas. Otro factor de riesgo es el amplio rango de plantas hospedantes de P. capsici y P. drechsleri (Erwin y Ribeiro, 1996; Lamour et al., 2012). Además, los aislados podrían generar resistencia a los fungicidas y sería más difícil controlar la enfermedad. El presente estudio mostró que ambos tipos de compatibilidad de P. capsici y P. drechsleri pueden ocupar el mismo nicho en los ambientes de los viveros. Los productores deberían mejorar sus prácticas de manejo, como lo recomiendan Parke y Grünwald (2012), dependiendo de sus recursos económicos, a fin de reducir las pérdidas. Este es el primer reporte sobre los tipos de compatibilidad A1 y A2 de P. capsici y P. drechsleri detectados en plantas producidas en maceta en viveros comerciales en México.











 texto en
texto en 


