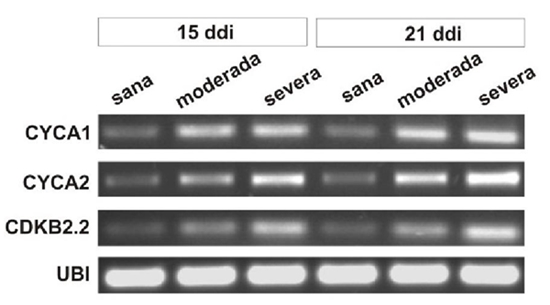
Euphorbia mosaic virus aislamiento Yucatan Peninsula (EuMV-YP) es un begomovirus bipartita con una amplia gama de hospedantes experimentales. El silenciamiento génico inducido por EuMV-YP en Nicotiana benthamiana inicia en las nervaduras y se extiende hacia el resto de la hoja (Villanueva et al., 2013), lo que sugiere que es capaz de alcanzar el mesófilo. La mayoría de los begomovirus bipartitas tienen hospedantes específicos, en los cuales permanecen restringidos al floema. El Tomato golden mosaic virus (TGMV) y el African cassava mosaic virus (ACMV) pueden invadir el mesófilo. Existe una correlación en su capacidad de salir del floema y la de producir síntomas severos en N. benthamiana (Wege et al., 2001). La replicación de los geminivirus ocurre en el núcleo de las células diferenciadas, para ello inducen su entrada al ciclo celular. Los begomovirus bipartitas y los mastrevirus promueven la síntesis de ADN sin pasar por la división celular (revisado por Hanley et al., 2013); mientras que los curtovirus inducen la mitosis, produciendo verrugas en la nervadura central (Park et al., 2004; Latham et al., 1997). En este trabajo se abordó la pregunta de si EuMV-YP es capaz de infectar las células del mesófilo de N. benthamiana y si su localización correlaciona con la severidad de los síntomas producidos. Para inocular con el virus silvestre se emplearon clonas infectivas construidas previamente (Villanueva et al., 2013), para localizar al virus se construyó el vector de expresión pEuMV-YPDAV1:GFP. Las combinaciones de plásmidos utilizados por tratamiento se indican en el Cuadro 1. En cada tratamiento se inocularon 20 plantas de N. benthamiana de cuatro hojas verdaderas, como se reportó previamente (Villanueva et al., 2013), en este trabajo se aplicó una presión de 70 psi a 6 cm de distancia y partículas de oro de 1 μm recubiertas con 5 μg de cada plásmido. A los 15 días después de la inoculación (ddi) se recolectaron las hojas número nueve y 10, denominadas “hojas con infección sistémica” porque emergieron después de la inoculación. Estas se fijaron y se embebieron en parafina, se hicieron cortes transversales de 8-10 μm en el centro de las hojas tal como se reportó previamente (Moo et al., 2012). Se adquirieron imágenes con el objetivo 40x de un microscopio confocal láser modelo Olympus FV100 SW y se procesaron con el software FV10 ASW versión 4.1. La fluorescencia de GFP se capturó con longitudes de onda de excitación/emisión de 488/507 nm, respectivamente. Para el análisis histológico, las secciones se tiñeron con azul de toluidina. Se registraron imágenes de secciones transversales y de la región media de las hojas con infección sistémica con el objetivo 6.5x de un microscopio Eclipse E200 Nikon. Se midió el grosor de la hoja y se contó el número de células por mm2 de cuatro plantas con síntomas moderados o severos a los 15 ddi. Se graficó el número de células y el espesor de la lámina foliar a partir de 12 valores individuales. Se probó la hipótesis nula de que las medias de las plantas con síntomas severos y moderados son iguales a las plantas sanas. Se llevaron a cabo pruebas F de dos muestras para determinar la homogeneidad de varianzas. La significancia estadística de la diferencia entre pares de medias (síntomas severos o moderados contra plantas sanas) se obtuvo con la prueba t de Student de dos muestras suponiendo varianzas desiguales, utilizando el programa Data Analysis ToolPak de Excel. Para los estudios de expresión génica, se tomaron hojas con infección sistémica de tres plantas, se congelaron y se molieron juntas en nitrógeno líquido. Se extrajo RNA total con el estuche RNeasy Plant mini kit (Qiagen) y un tratamiento con DNasa I. La primera cadena de cDNA se sintetizó con 500 ng de RNA total, Oligo-dT [d (T) 23VN] y el estuche ProtoScript M-MuLV, siguiendo el protocolo del fabricante (New England Biolabs, EE. UU.), el volumen final se ajustó a 50 μL. Para la segunda cadena, se utilizaron 0.2 μM de los cebadores para los genes cycA1, cycA2, cdkB2.2 (Caracuel et al., 2012) y ubi3 (Kotakis et al., 2010), 5 μL del cDNA, 0.2 mM dNTPs, 1.25 unidades de Taq polimerasa y amortiguador Thermo Pol (New England Biolabs) en 25 μL, con el programa: 94 °C por 5 min / 28 ciclos a 94 °C por 30 s, 56 °C por 60 s y 72 °C por 1 min / 72 °C por10 min. Se separaron 10 μL en un gel de agarosa al 0.8% teñido con bromuro de etidio. GFP se detectó en forma directa en todos los tipos de células del mesófilo, como la epidermis superior y el parénquima en empalizada (Figura 1A), el parénquima esponjoso y la epidermis inferior (Figura 1C) de las hojas con infección sistémica a los 15 ddi. No se detectó GFP en plantas sanas (Figura 1B y 1C). La fluorescencia de GFP fue baja y no fue posible detectarla en forma directa en el floema de la nervadura media y en otras células de los haces vasculares, pero si mediante inmunodetección (datos no mostrados). Estos resultados demuestran que EuMV-YP es capaz de invadir todos los tipos de células del mesófilo en N. benthamiana en una alta proporción, tal como lo hacen ACMV y TGMV (Wage et al., 2001). EuMV-YP también causó síntomas severos en N. benthamiana; a los 15 ddi se encontraron plantas con distintos grados de severidad: siete leves, ocho moderados y cinco severos. Las hojas con infección sistémica de plantas con síntomas severos presentaron enrollamientos pronunciados del margen hacia el envés, así como arrugamientos o abultamientos abundantes (Figura 2A, 2B y 2C), estos síntomas se mantuvieron hasta los 21 ddi. A los 25 ddi aparecieron mosaicos cloróticos y a los 28 ddi se observó la atenuación de síntomas (Figura 2D), que permanecieron así hasta la finalización del experimento. Estos resultados demuestran que al igual que ACMV y TGMV, EuMV-YP es capaz de inducir síntomas severos en N. benthamiana. Se han descrito tres determinantes genéticos que confieren la localización tisular de TGMV (Morra y Petty, 2000). EuMV-YP pertenece a un clado taxonómico distinto (Hernández et al., 2007), por tanto, los determinantes genéticos que le confieren la capacidad de invadir el mesófilo y de producir síntomas severos pueden ser distintos. Los abultamientos observados en las hojas de las plantas con síntomas severos sugerían que EuMV-YP causaba alteraciones anatómicas en las hojas (Figura 2A), además de una alta frecuencia de eventos de división celular (Figura 1A). Para caracterizar este hallazgo, se hizo un análisis histológico exhaustivo de las hojas en regiones discretas a lo largo de toda la lámina foliar (Figura 3A). En las plantas sanas se observó la organización tisular típica de N. benthamiana; epidermis superior, inferior y el parénquima en empalizada de una sola capa de células, éste último con células alargadas anticlinales; el parénquima esponjoso con dos o tres capas de células esféricas (Figura 1A). En plantas infectadas se observaron regiones con cambios en la morfología de las células y regiones engrosadas (Figura 4B, D, E y F), representando el 20 y el 50% de la hoja de las plantas con síntomas moderados y severos, respectivamente. El valor medio de las regiones engrosadas (alteradas) en plantas que mostraron síntomas severos fue significativamente diferente al de las regiones sin cambios (normales) en pruebas de t student (t ≤ 7.55, P << 0.01); lo mismo ocurrió en regiones alteradas vs normales de plantas con síntomas moderados (t ≤ 2.71, P ≤ 0.02) (Figura 3B Izq.). El número de células fue significativamente mayor en las plantas con síntomas severos o moderados en comparación con el de las sanas (t ≤ 6.18, P <0.01, t <3.87, P <= 0.01, respectivamente), con incrementos de 50 y 100% de las plantas con síntomas moderados y severos, respectivamente (Figura 3B Der.). La proliferación celular se observó en el parénquima en empalizada y esponjoso (Figura 4), que comúnmente tenían cuatro capas de células (Figura 4E y 4F). Sin embargo, en las plantas con los síntomas más severos, se encontraron hasta 10 capas (datos no mostrados). Ciertas regiones de las hojas presentaban alteración de la morfología celular, particularmente del parénquima en empalizada y esponjoso (Figura 4B y 4B). Además, se observaron células esféricas y de tamaño reducido en las regiones con mayor proliferación celular (Figura 4F). Estos resultados confirman que los abultamientos de las hojas son producto de la inducción de la división celular en el mesófilo de N. benthamiana. Resultados similares se encontraron al expresar la proteína C12 del Chrysanthemum virus B (CVB) en las hojas de N. tabacum, la cual es un determinante de patogenicidad y virulencia. CVB provoca enrollamientos y proliferación celular en las hojas del crisantemo, su hospedero natural (Lukhovitskaya et al., 2014). De hecho, muchos virus producen síntomas similares, pero no se han realizado los estudios histológicos que revelen la naturaleza de los síntomas, he aquí la relevancia del presente estudio. Cabe destacar que EuMV-YP es el primer ejemplo de un geminivirus que puede inducir la división celular en el parénquima en empalizada y esponjoso, por tanto, resulta un modelo interesante para estudiar los determinantes genéticos que están induciendo este fenómeno. Por el contrario, existen múltiples reportes de la inducción de la división celular en las células del floema y células asociadas en las nervaduras de las hojas. Tal es el caso de los Curtovirus y los begomovirus monopartitas, entre los geminivirus (Park et al., 2004; Srivastava et al., 2017) y de virus de RNA (Xie et al., 2014; Shen et al., 2016), en todos estos casos, la proliferación celular inducida conlleva a la producción de tumores en las nervaduras de las hojas. En concordancia con los resultados anteriores, la expresión los de los genes cycA1, cycA2 y cdkB2.2 se incrementó en las hojas de plantas infectadas a los 15 y 21 ddi en comparación con la de plantas sanas (Figura 5), mientras que el gen ubi3 se mantuvo sin cambio. La regulación positiva de genes que participan en la entrada a la fase mitótica (Breyne et al., 2002) es congruente con los incrementos del número de células en plantas con síntomas moderados o severos. Resultados similares se observaron en plantas infectadas con BCVT (Park et al., 2004), CBV (Lukhovitskaya et al., 2014) y el Rice black-streaked dwarf virus (RBSDV;Shen et al., 2016). Por el contrario, los begomovirus bipartitas Cabbage leaf curl virus (CaLCuV) y TGMV, activan la entrada al endociclo en Arabidopsis thaliana y en N. benthamiana, respectivamente (Nagar et al., 2002; Ascencio et al., 2008). CaLCuV activa la expresión de la mayoría de los genes que participan en la entrada al ciclo celular en la fase de síntesis de ADN y reprime la expresión de la mayoría de los genes asociados con la fase M o de división celular como CDKB2 en A. thaliana (Ascencio et al., 2008), lo que explica que CaLCuV induzca la endoreduplicación y no la división celular. Los aislados EuMV-Jal y EuMV-YP, que producen síntomas similares en varios hospederos experimentales y son incompatibles en replicación, han adquirido secuencias únicas en sus regiones intergénicas que los distinguen de virus filogenéticamente relacionados (Gregorio et al., 2010). EuMV-YP puede haber perdido las secuencias necesarias para bloquear el punto de control G2 / M o puede haber adquirido determinantes genéticos para inducir un ciclo mitótico completo, mediante mutación o la incorporación de secuencias genómicas de otros virus. Esto queda por determinarse. En conclusión, EuMV-YP es capaz de producir síntomas severos en N. benthamiana y de llegar el mesófilo, donde induce la mitosis y cambios en la morfología celular, así como la expresión de genes relacionados con la división celular.
Cuadro 1 Plásmidos usados por tratamiento
|
Tratamiento/treatment |
Plásmidos/plasmids |
Ensayo/Assay |
|
|
xTT |
ySH |
||
|
Testigo/control |
pBluescript II SK+ |
+ |
+ |
|
Virus silvestre/ Wild type virus |
pEuMV-YP:HA + pEuMV-YP:HB |
+ |
- |
|
Vector GFP / GFP vector |
pEuMV-YPDAV1:GFP |
+ |
- |
|
EuMV-YP GFP |
pEuMV-YPDAV1:GFP + pEuMV-YP:HB |
+ |
- |
|
EuMV-YP + EuMV-YP GFP |
pEuMV-YP:HA + pEuMV-YP:HB + pEuMV-YPDAV1:GFP |
+ |
- |
x T=Localización en tejidos, ySH=Síntomas e Histología

Figura 1 Localización de EuMV-YP en N. benthamiana. Plantas inoculadas con el virus silvestre + EuMV-YP GFP a los 15 ddi (A, C) y plantas sanas (B, D). Parénquima en empalizada (A, B) y esponjoso (C, D). Barras: 5 µm

Figura 2 Síntomas severos producidos por EuMV-YP. EuMV-YP (A-D) y plantas sanas (E-H), a los 15 (A-C, E-G) y 28 ddi (D y H). Vistas dorsal (B y F) y ventral (C y G).

Figura 3 Análisis cuantitativo del efecto de EuMV-YP. Sección transversal de una hoja (A). Gráficas de grosor de la lámina foliar y del número de células (B) en plantas con síntomas moderados, severos o sanas. Se incluyen barras de error de desviación estándar.
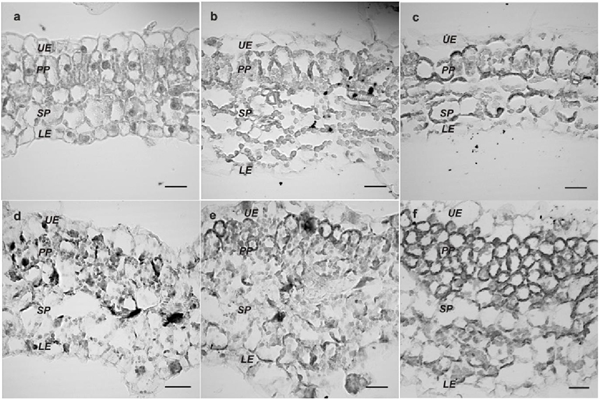
Figura 4 Cambios anatómicos inducidos por EuMV-YP. Plantas sanas (A) o con síntomas severos (B-F). Cambios de morfología celular en parénquima esponjoso (SP) y en empalizada (PP) (B-C). Epidermis superior (UE) e inferior (LE). Aumento de 680x. Barras: 20 μm.











 texto em
texto em