El género Bacillus comprende diversas especies de importancia industrial que por lo general se utilizan en la industria de la fermentación (Veith et al., 2004; Rey et al., 2004; Fujinami y Fujisawa, 2010). Al igual que muchas de las especies del género Bacillus, Bacillus subtilis es una bacteria muy común, pues se encuentra en el suelo, el agua, el aire y en materia vegetal en descomposición (Ashlee et al., 2008). Las bacterias del género Bacillus forman esporas, es decir, forman una pared gruesa que rodea su ADN y otras estructuras celulares internas. Esta característica las hace resistentes e inmunes a temperaturas extremas, químicos, factores ambientales e incluso algunos tipos de radiación, y, por tanto, se pueden utilizar en procesos industriales. Las bacterias tienen gran capacidad de mutación genética y, por ello, se utilizan en experimentos en el laboratorio (Ashlee et al., 2008; Schallmey et al., 2004). Al igual que la mayoría de sus parientes más cercanos, B. subtilis es no patogénico, se puede cultivar y manipular genéticamente con relativa facilidad y es eficaz en la secreción de proteínas y metabolitos (Matarante et al., 2004). Además, muchas bacterias grampositivas que viven en complejas comunidades ecológicas, como las que se encuentran en ambientes terrestres y acuáticos, producen una gran variedad de compuestos especiales que son valiosos por sus propiedades farmacológicas y antimetabólicas. Bacillus subtilis se utiliza en la producción de numerosos antibióticos, como dificidina, oxidificidina, subtilisina A, bacilomicina B y bacitracina, así como bacilisocina, auxiliar en el tratamiento de infecciones cutáneas causadas por bacterias, y evita infecciones en cortaduras y quemaduras leves (Shelburne et al., 2007; Stein, 2005; Tamehiro et al., 2002). Bacillus subtilis se utiliza también como fungicida (Savluchinske et al., 2004). Las bacterias colonizan el sistema radicular de las plantas y no permiten que se desarrollen organismos causantes de enfermedades fúngicas; en la agricultura se utiliza en semilla de verduras, ya que su comportamiento multicelular y la producción de una gran variedad de sustancias tóxicas respaldan el uso de Bacillus subtilis como un potente agente de biocontrol (Bais et al., 2004; Gong et al., 2006; Leclére et al., 2005; Nagórska et al., 2007). La producción de estos metabolitos sería decisiva en la formulación de estrategias para su adaptación al ambiente terrestre que ocupa la planta, lo cual contribuiría a la supervivencia del organismo en sistemas ecológicos complejos. Estos bacilos genéticamente diversos muestran resultados prometedores que justificarían promover su desarrollo en varios cultivos para el control biológico de diversos fitopatógenos (Bapat y Shah, 2000; Bernal et al., 2002; Kim, 2010). Desafortunadamente, la variabilidad en el comportamiento inherente de muchos agentes de biocontrol entre los sitios en el campo y los ciclos de cultivo ha impedido el desarrollo comercial de agentes biológicos de uso agrícola (Pal y Gardener, 2006). Mucha de esta variabilidad ha sido atribuida a las diferencias entre las propiedades de los hábitats naturales de los agentes de biocontrol y los lugares donde éstos son aplicados (O’Callagman et al., 2001; Zhang et al., 2005). Conocer los factores ambientales que regulan la biosíntesis de los compuestos antimicrobianos por las cepas de Bacillus es un paso fundamental para mejorar sus actividades antagónicas, las cuales no han sido adecuadamente descritas (Bloemberg y Lugtenberg, 2001). Es necesario realizar estudios fisiológicos para crear y optimizar el uso de agentes de biocontrol como protectores de plantas. Es importante establecer la relación entre la proliferación y las condiciones de las bacterias, así como la influencia de los factores ambientales que modulan la biosíntesis de los compuestos antifúngicos. Otros factores que se deben considerar son el tipo y la concentración de las fuentes de carbono y nitrógeno, la tensión de oxígeno, la presión osmótica, el pH, la temperatura y la disponibilidad de agua (Kamney, 2008). Estos estudios proporcionarían información básica para seleccionar nuevas cepas y nuevos productos para el control biológico de los fitopatógenos. En el presente estudio se evaluaron los efectos de la temperatura y el pH en la actividad antagonista de diferentes cepas de Bacillus subtilis y, al mismo tiempo, se consideró la fase fisiológica del desarrollo.
MATERIALES Y MÉTODOS
Cepas microbianas, medios y condiciones de cultivo
Rhizoctonia solani se obtuvo de la colección del laboratorio de bioquímica del Cinvestav-Irapuato. La cepa se cultivó principalmente en caldo de infusión de papa (Johnson y Curl, 1972). Las cepas BEB-8 y BEB-13 de Bacillus subtilis fueron aisladas de la rizosfera de un campo de papas en el estado de Guanajuato, México. La supuesta identificación se realizó con Microplacas Biolog GP2 (Biolog, Hayward, CA, EE UU). Las microplacas fueron inoculadas siguiendo las instrucciones de fabricante. La cepa PY-79 de Bacillus subtilis (Laboratorio de Bacteriología Molecular; Cinvestav-Irapuato) se utilizó como control negativo en la actividad antagonista, en tanto que la cepa Kodiak (GBO3) de Bacillus subtilis, que se obtuvo como una formulación de esporas secas (Bayer Crop Science Kansas City, MO, EE UU), se utilizó como control positivo en la actividad biológica. Para su almacenamiento prolongado, los cultivos de bacterias se mantuvieron a -80 °C en agar infusión de papa con glicerol al 20%.
Tasa de crecimiento bacteriano
Los estudios de la tasa de crecimiento se realizaron en frascos con 100 mL de caldo de infusión de papa. Antes de aplicar el inóculo, las densidades de población se ajustaron a una densidad inicial de 105 cfu /mL. Se agregó inóculo (1% v/v) de las diferentes cepas de Bacillus subtilis al medio líquido y se incubaron a 28 °C, moviendo constantemente a 120 rpm; la densidad óptima se monitoreó a 535 nm en un espectrofotómetro Cary Spectronic 50 (Varian, Australia Pty Ltd) cada hora durante 18 h. La concentración bacteriana (cfu/ mL) se estimó en placas que contenían infusión de papa con agar al 1.5% (w/v) (BD, Bioxon, Becton-Dickinson) en un Giraplacas Automático en Espiral 4000 (Spiral Biotech, Inc., EE UU). Los parámetros cinéticos y el momento en que ocurrieron las fases del crecimiento se obtuvieron aplicando el modelo Verhulst-Pearl (Slater, 1985) o el modelo logístico, de acuerdo con la siguiente ecuación:
En este modelo se utiliza un factor de correlación no lineal que es calculado estadísticamente por el programa SYSTAT (Inc. Programa para Windows V11.0).
Efecto del pH y la temperatura
Con el fin de estudiar la influencia del pH y la temperatura en el crecimiento bacteriano, el pH del caldo de infusión de papa se ajustó a 5, 6, 7 y 8 con 1M de HCl. Los cultivos iniciados con inóculo al 1% v/v fueron incubados a 15 °C, 28 °C y 37 °C, agitando constantemente a 120 rpm durante 18 h. El crecimiento bacteriano se determinó como se indicó anteriormente. Todos los análisis se realizaron por triplicado. Las condiciones óptimas para lograr la tasa de máximo crecimiento (dN/dtmax) se determinaron utilizando el programa estadístico S-Plus 4.0 para Windows.
Efecto del estado fisiológico en la actividad antagonista
En condiciones óptimas de desarrollo (dN/dtmax), el caldo de infusión de papa inoculado con (v/v) suspensión celular al 3% (No) fue incubado a rangos de pH y temperatura predeterminados con agitación constante a 120 rpm durante el tiempo requerido para alcanzar la fase de crecimiento deseada. Las células fueron recolectadas mediante centrifugación a 10,000 g durante 20 min 0 °C (J2-MC Centrifuge Beckman, Alemania) en todas las etapas de crecimiento. El sobrenadante esterilizado (a 115 °C por 15 min) y libre de células (CFS) de cada tratamiento se utilizó en la prueba cuantitativa de la actividad antagonista. Todos los análisis se realizaron por triplicado.
Prueba cuantitativa de la actividad antagonista
La actividad antimicrobiana fue determinada in vitro midiendo la inhibición del crecimiento micelial en un medio de agar de infusión de papa con el CFS obtenido. El agar de infusión de papa fundido fue enfriado a 45 °C y suplementado de manera homogénea con 3 mL de CFS de cada cultivo de cepas. En el centro de placas Petri que contenían los diferentes medios suplementados se inoculó un disco de 5 mm de diámetro de un cultivo de agar de Rhizotonia solani perteneciente al grupo de anastomosis AG3 (donado por el Dr. Gil Virgen de la Universidad de Guadalajara). Las placas se incubaron a 28 °C y se midió el crecimiento de los hongos a 24, 48, 72 y 96 h después de que comenzó la incubación. Cada CFS se hizo por triplicado. El crecimiento de hongos observado durante 96 h en el medio sin suplementos que se utilizó como control. La inhibición del crecimiento (%) se calculó como la relación entre el diámetro promedio de la colonia de hongos en un medio con CFS y el diámetro promedio de la colonia de hongos en un medio sin CFS multiplicado por 100, y al resultado se le restó 100.
Análisis AFLP
El protocolo AFLP que se utilizó fue similar al reportado por Vos et al. (1995), excepto que en este caso se utilizaron dos, en lugar de tres, nucleótidos selectivos, a fin de generar un número adecuado de bandas para el análisis. El ADN genómico bacteriano total fue digerido con las enzimas de restricción EcoRI y MseI, o con el isoesquizómero Tru 91. Los iniciadores oligonucleótidos utilizados en el paso de pre-amplificación fueron 5´-AGCTGCGTACCAATTC/A-3´ y 5´GACGATGAGTCCTGAGTAA/A-3´. Después del paso de la pre-amplificación se llevó a cabo una segunda amplificación selectiva en la que se utilizaron iniciadores similares, pero con dos nucleótidos selectivos. El iniciador EcoRI+AG se combinó con el iniciador MseI +AA, AC, AG y AT. El iniciador EcoRI que se utilizó en la segunda reacción de amplificación fue marcado radioactivamente con quinasa T4. Las reacciones de AFLP con los iniciadores sin ningún nucleótido o con uno selectivo se realizaron durante 20 ciclos de acuerdo con el siguiente perfil de ciclo: un paso de desnaturalización de ADN de 30 s a 94 °C, un paso de recocido de 1 min a 56 °C y un paso de extensión de 1 min a 72 °C. Las reacciones de AFLP con los iniciadores que tenían dos nucleótidos selectivos se realizaron durante 36 ciclos con el siguiente perfil de ciclo: un paso de desnaturalización de ADN a 94 °C, un paso de recocido de 30 s (ver abajo) y un paso de extensión de 1 min a 72 °C. La temperatura de recocido en el primer ciclo fue de 65 °C; posteriormente los ciclos se redujeron 0.7 °C durante los siguientes 12 ciclos, y continuaron a 56 °C en los 23 ciclos restantes. Los productos de la amplificación de la segunda reacción fueron analizados mediante la electroforesis utilizando un gel secuenciador de poliacrilamida y visualizados por autorradiografía. La electroforesis se realizó con corriente constante de 110 W por 2 h. Por último, el gel fue analizado en un secuenciador Automatas Li-Cor, mod. 4200 (Li-Cor Lincoln, Nebraska), las bandas se capturaron y se marcaron utilizando el programa LI-COR.
Análisis estadísticos
En los tratamientos se utilizó un diseño completamente al azar. Los datos se sometieron a un análisis de varianza (ANOVA) con el programa estadístico FAUANL versión 2.5 para Microsoft Windows (Universidad de Nuevo León, México). La significancia de los tratamientos fue determinada por la magnitud del valor de F (P < 0.05). Para determinar las diferencias entre las medias de los tratamientos, se aplicó la prueba de la diferencia mínima significativa (LSD), a fin de obtener intervalos de confianza simultáneos de 95%.
RESULTADOS
Los análisis de AFLP basados en el agrupamiento de coeficientes de similitud de Dice (Figura 1) revelaron tres grupos genéticos de bacilos. En el Grupo I se observaron Kodiak de B. subtilis y LS213 de B. amyloliquefaciens; en el Grupo II, BEB-13 y PY-79 de B. subtilis; y en el Grupo III, BEB-8 de B. subtilis. La caracterización fisiológica de estas bacterias confirmó que se trataba de cepas diferentes. Según la base de datos Biolog (equipo del Sistema Biolog), la microplaca de la cepa BEB-8 aislada mostró los valores de similitud SIM más altos (0.786), y B. subtilis tuvo una respuesta típica del perfil metabólico de esta cepa (datos no incluidos). Los efectos del pH y la temperatura en la tasa de crecimiento (dN/dt) de las diferentes cepas se muestran en la Figura 2. Las áreas de la superficie representan el crecimiento como una función del pH y la temperatura. Los análisis ANOVA indicaron que la temperatura, el pH y la interacción entre estos dos factores fueron muy significativos en la tasa de crecimiento (dN/dt) de la cepa PY-79 (Figura 2a. Con base en lo anterior, se estableció que las condiciones óptimas de desarrollo fueron 28 °C/pH 5 y 28 °C/pH 8 (Cuadro 1A-II), las cuales produjeron las máximas tasas de crecimiento de 2.19 x 105 y 2.36 x 105 cfu/ mL/ h, respectivamente (Cuadro 1A-III). En el caso de la cepa Kodiak, la temperatura y su interacción con el pH fueron significativas y produjeron la tasa máxima de crecimiento (Figura 2b). Esta tasa máxima se observó a 28 °C y a 5 unidades de pH (Cuadro 1A-II), pero no se observaron diferencias estadísticamente significativas en los valores de dN/dt en este rango (Cuadro 1A-III). En cambio, el pH influyó mucho en la tasa de crecimiento de la cepa BEB-8b, pero la temperatura y su interacción con el pH no mostraron diferencias significativas (Figura 2c). Las condiciones óptimas de crecimiento se obtuvieron con pH 5 y 8, independientemente de la temperatura de incubación, y alcanzaron un valor máximo de dN/dt, de 3.5 a 4 x 108 cfu /mL/h, respectivamente. Los patrones de crecimiento observados fueron muy diferentes entre las diferentes cepas de B. subtilis (Cuadros 1A-II y 1A-III).

Figura 1 Huellas AFLP de las cepas de Bacillus utilizando el iniciador EcoRI marcado como 32-P E+AG con tres iniciadores MseI: MseI+AA (I), MseI+AC (II) y MseI+AT (III). (a) Dendrograma de diferentes cepas de Bacillus con base en el análisis de AFLP de las muestras con los iniciadores EcoRI+AG y dos MseI; (b) Los fragmentos de AFLP fueron analizados y los dendrogramas fueron generados como se describe en la sección de materiales y métodos. Kodiak de B. subtilis (1), PY-79 de B. subtilis (2), LS213 de B. amyloliquefaciens (3), Pseudomonas sp. (4), BEB-8bs de B. subtilis (5), BEB-DN de B. subtilis (6).
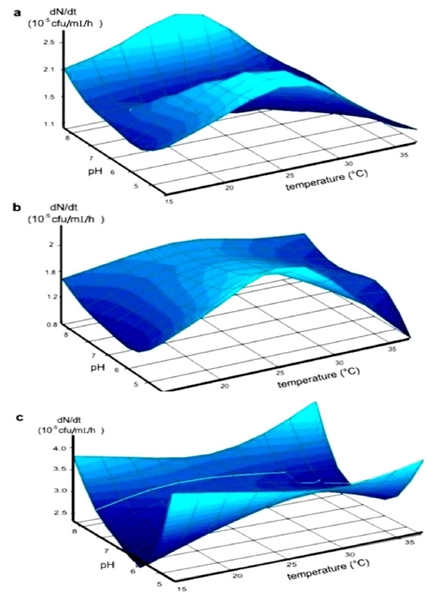
Figura 2 Efecto del pH y la temperatura en la tasa de crecimiento (dN/dt) de las cepas de Bacillus subtilis representado por la superficie, que es considerada una función del pH y la temperatura. Cepa PY-79 como control negativo de la actividad antagonista (a). cepa Kodiak; control positivo de la actividad antagonista (b), cepa BEB-8b (c).
Cuadro 1 Parámetros cinéticos del desarrollo de las cepas de Bacillus subtilis.
| A. Condiciones óptimas de desarrollo. | ||||||
| Cepa de Bacillus subtilis | I. No | II. Condiciones óptimas de desarrollo | III. Parámetros cinéticos: | |||
| K | μ | dN/dtmax | t dN/dt min | |||
| PY-79 | 2.8x105 | 28°C/pH 5 28°C/pH 8 | 1.97x105 1.88x105 | 0.444 0.498 | 2.19x105 2.36x105 | 4.90 12.21 |
| Kodiak | 1.2x106 | 28°C/pH 5 28°C/pH 6 28°C/pH 7 28°C/pH 8 | 0.804x106 0.806x106 0.752x106 0.816x106 | 0.808 0.779 0.713 0.701 | 1.62x106 1.57x106 1.34x106 1.43x106 | 6.32 6.08 5.65 6.65 |
| BEB-8b | 2.2x108 | 15°C/pH 5 15°C/pH 8 28°C/pH5 28°C/pH 8 37°C/pH 5 37°C/pH 8 | 3.14x108 3.43x108 2.35x108 1.16x108 2.43x108 2.62x108 | 0.535 0.439 0.633 0.608 0.442 0.602 | 4.20x108 3.77x108 3.37x108 3.30x108 3.98x108 3.41x108 | 8.93 9.20 6.36 6.02 5.66 5.95 |
| B. Condiciones subóptimas de desarrollo. | ||||||
| Cepa de Bacillus subtilis | I. No | II. Condiciones óptimas de desarrollo | III. Parámetros cinéticos: | |||
| K | μ | dN/dtmin | t dN/dt min | |||
| PY-79 | 2.8x105 | 37°C/pH 6 | 0.19x105 | 0.156 | 0.77x105 | 11.01 |
| Kodiak | 1.2x106 | 37°C/pH 5 | 0.65x106 | 0.459 | 0.74x106 | 5-78 |
| BEB-8b | 2.2x108 | 15°C/pH 6 | 2.48x108 | 0.319 | 1.19x108 | 8.71 |
No; inóculo inicial (cfu /mL), K; la capacidad de carga de los medios (10n cfu /mL), generalmente interpretada como la cantidad de recursos expresados en el número de organismos que estos recursos pueden mantener. µ velocidad específica de crecimiento / h, µ significativamente diferente de µ = 0, a > 95% del nivel de confianza, dN/dt; tasa máxima de crecimiento (10n cfu /ml/ h), tdN/dt; tiempo en que se alcanza la tasa máxima o mínima de crecimiento (h.min). El ajuste de r2 al modelo logístico fue de > 95% del nivel de confianza / x
Efecto de las condiciones de crecimiento y la etapa fisiológica de las cepas de Bacillus en la producción de metabolitos antagonistas
Los parámetros cinéticos de cada una de las cepas se determinaron en condiciones óptimas (Cuadro 1A) y condiciones subóptimas de desarrollo (Cuadro 1B). En condiciones subóptimas de desarrollo, se observó una reducción significativa en la tasa específica de crecimiento (μ) de cada cepa, lo cual contrasta con las condiciones que generaron la tasa máxima de dN/dt. En condiciones subóptimas, las tasas de crecimiento son más rápidas que en condiciones óptimas. Sin embargo, bajo esas condiciones no se detectó inhibición de Rhizoctonia, excepto en la cepa BeB 8 (Figura 3). Sin embargo, el tiempo requerido para alcanzar la fase estacionaria fue similar en las cepas Kodiak y Beb-8, en ambas condiciones, en tanto que PY-79 tardó casi 10 horas más en condiciones subóptimas (Cuadros 1A-III y 1B-III). No obstante, el efecto más significativo se observó en la capacidad de carga del medio (K). En condiciones subóptimas de desarrollo se detectó la reducción de una unidad logarítmica (1.97 a 0.19 x105 cfu /mL/ h) en la cepa PY-79; una ligera reducción de 0.804 x 106 a 0.65 x 106 cfu /mL/ h correspondió a la cepa Kodiak, y se observó una reducción de 3.14 x 108 a 2.48 x 108 cfu/ mL/ h en la cepa BEB-8. En la Figura 3 se muestra el efecto de la etapa fisiológica de cada cepa en la actividad antagonista contra Rhizoctonia solani AG-3, bajo condiciones óptimas y subóptimas de crecimiento. En condiciones óptimas de crecimiento, la cepa BEB-8b mostró una actividad antagonista similar a la de la cepa Kodiak (control positivo). En la fase de crecimiento exponencial (log), ambas causaron una inhibición de 15 a 25% en el crecimiento fúngico, en tanto que, en la fase estacionaria, causaron una inhibición de 64 a 72%. Como se había previsto, la cepa PY-79 (control negativo) no mostró inhibición significativa del crecimiento fúngico (Figura 3a). Bajo condiciones de crecimiento mínimo, la cepa Kodiak (control positivo) no mostró actividad antagonista en las diferentes etapas de crecimiento; sin embargo, la cepa BEB-8 redujo en 25% el crecimiento fúngico en la fase estacionaria. Estos resultados indican que la mayor actividad de biocontrol ocurre en la fase estacionaria.
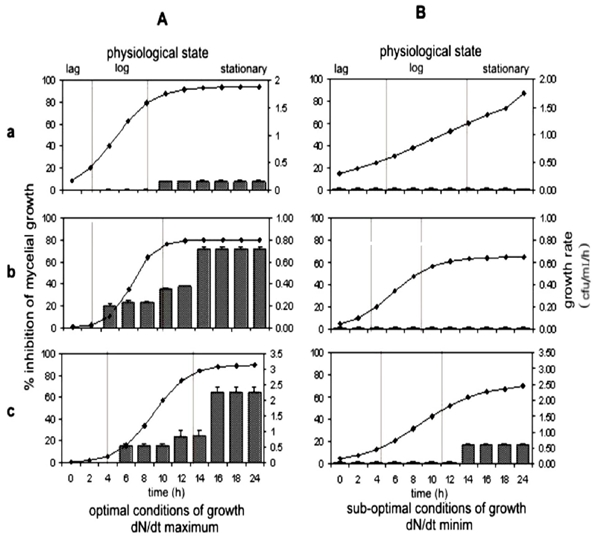
Figura 3 Efecto del estado fisiológico y condiciones de crecimiento de las cepas de Bacillus subtilis en la actividad antagonista contra Rhizoctonia solani AG-3. Crecimiento bacteriano en condiciones óptimas (A) y condiciones subóptimas (B) del aislado PY-79 de B. subtilis (a), Kodiak de B. subtilis (b), y BEB-8b de B. subtilis (c).
DISCUSIÓN
La aplicación de inoculantes microbianos como agentes de biocontrol no ha tenido mucho éxito (Compant et al., 2005). Esto se debe a que la protección de las plantas es determinada en gran medida por la eficiente colonización de la rizosfera por los inoculantes y la competencia con la microflora nativa, que está mejor adaptada (Castro-Sowinski et al., 2007; Conn y Franco 2004; Kozdrój y Van, 2000). Estos factores influyen mucho en el establecimiento, proliferación y actividad de los bacilos en un ambiente donde los nutrientes son limitados. La utilización de una amplia variedad de exudados de raíz está correlacionada con la capacidad competitiva de las bacterias y constituye la base nutricional de la colonización de la rizosfera (Bais et al., 2006; Haichar et al., 2008). En este estudio, la prueba BIOLOG indicó que el aislamiento BEB-8 es una cepa de B. subtilis y confirmó las identidades de las cepas PY-79 y Kodiak utilizadas como controles. Nuestros resultados también confirmaron la capacidad de las diferentes cepas de Bacillus de utilizar una gran variedad de fuentes de carbono. Como señalaron Goddard et al. (2001) y Smalla et al. (1998) en sus estudios, las placas microtituladoras BIOLOG originalmente fueron creadas para clasificar los aislamientos bacterianos con base en su capacidad de oxidar 95 distintas fuentes de carbono. Sin embargo, este método ha resultado ser útil para evaluar los patrones de utilización de las fuentes de carbono de las comunidades microbianas y las posibles diferencias metabólicas entre las poblaciones bacterianas de la rizosfera, así como estudiar los efectos de los inóculos introducidos en las comunidades microbianas del suelo. Además, aunque el perfil metabólico de las tres cepas mostró que se trataba de Bacillus subtilis, el análisis AFLP produjo huellas de ADN de alta calidad con polimorfismos detectables y reveló variaciones a nivel de cepa. La variabilidad entre estas cepas confirmó que son diferentes. Jones et al. (2005) describieron la individualización como el proceso mediante el cual las características morfológicas, bioquímicas o genéticas se asocian con un microorganismo, de manera tal que la combinación de características es únicamente de ese microorganismo y de ningún otro. Sin embargo, es fundamental conocer las condiciones ambientales en que el agente de biocontrol puede crecer, a fin de establecer las condiciones de producción en masa y también para que se convierta en un agente de biocontrol muy eficaz. Los parámetros ambientales más importantes son la disponibilidad de agua, la temperatura y el pH de la rizosfera (Costa et al., 2002). El estudio fisiológico de las cepas de Bacillus que se realizó como parte de este trabajo confirmó que los factores ambientales, como el pH y la temperatura, influyen directamente en la capacidad de crecimiento y en la actividad de biocontrol. Los resultados que se presentan en este estudio demuestran claramente que las condiciones ambientales para el crecimiento óptimo de la cepa BEB-8 incluyen rangos de temperatura de 15 a 37 °C y de pH desde 5 hasta 8. Es interesante notar que fue el pH y no la temperatura lo que influyó en la tasa de crecimiento en los rangos del presente estudio. Sin embargo, las condiciones ambientales favorables en que la preparación comercial de Kodiak crece son de 28 °C en un rango de pH desde 5 hasta 8, como lo indica la importancia del efecto de la interacción entre la temperatura y el pH en dN/dt. Una especie microbiana suele tener una diversidad bastante amplia de condiciones ambientales en las que puede crecer. Sin embargo, la tasa de crecimiento es la variable fisiológica microbiana que es inicialmente afectada por los cambios en el medioambiente. La falta de mediciones directas de este factor ha sido un gran obstáculo para entender los efectos de la rizosfera en el suelo. Con base en lo anterior, la caracterización biológica y fisiológica de Bacillus subtilis con actividad antagonista realizada en el presente estudio es muy importante. En un reciente informe, Costa et al. (2002) definieron la serie de condiciones ambientales en las que sería posible desarrollar la cepa CPA-2 de Pantoea agglomerans para control biológico. Los autores señalaron el efecto de la disponibilidad de agua, la temperatura, el pH y sus interacciones en el crecimiento de las bacterias en condiciones in vitro. Sin embargo, a diferencia de nuestros resultados, Costa et al. (2000) no correlacionaron las condiciones de crecimiento ni el estado fisiológico de las bacterias con la actividad antagonista de P. agglomerans. Los resultados que se muestran el Cuadro 1 y la Figura 3 resaltan los efectos de la proliferación, los parámetros cinéticos y el estado fisiológico de cada cepa en la actividad antagonista. En condiciones óptimas de desarrollo, el CFS obtenido en la fase de crecimiento exponencial de las cepas Kodiak y BEB-8 mostró inhibición del crecimiento micelial de R. solani. Sin embargo, hubo mayor actividad inhibitoria cuando se utilizó el CFS obtenido durante la fase estacionaria de cada cepa. En cambio, al alterar el pH y la temperatura para obtener una tasa de crecimiento mínima, la capacidad antagonista se redujo o se perdió, independientemente del estado fisiológico de la bacteria.
La relación entre la tasa de crecimiento bacteriano y las condiciones ambientales involucra diferentes mecanismos de respuesta. En este contexto, se ha reportado que la producción de numerosos metabolitos secundarios es regulada mediante un sistema de dos componentes que es activado por una señal externa o interna (Grahovac et al., 2015). Las señales que activan el sistema son el pH, la temperatura, la osmolaridad y la densidad bacteriana. Se ha identificado este sistema regulatorio en diferentes bacterias y se sabe que está relacionado en la regulación de numerosas y diferentes características bacterianas como la motilidad, la formación de pili, la patogenicidad, los sideróforos y la producción de metabolitos secundarios (Cosby et al., 1998; Horswill, 2007). Ahlem et al. (2012) mostraron que la biosíntesis del factor antagónico, así como la eficacia del control biológico, dependen estrictamente de las condiciones de crecimiento (pH, temperatura), y esto respalda nuestros resultados. De igual manera, también se debe tener en cuenta el estado fisiológico al pensar en la vida de las bacterias cuando se aplican al suelo. Esto depende de las condiciones que prevalecen en el suelo, lo cual representa un factor clave en el establecimiento y mantenimiento de los inóculos bacterianos en ambientes naturales. Esta hipótesis también es respaldada por los resultados obtenidos por Vandenhove et al. (1993), que demostraron que al inocular en el suelo células de Azospirillum con crecimiento exponencial, esto fomenta el establecimiento de una población más grande y estable que cuando se inoculan células durante la fase estacionaria. Los autores llegaron a la conclusión de que el estado fisiológico de un inóculo tiene gran influencia en su supervivencia. Además, Selim et al. (2005) reportaron que la producción del factor antagónico de la cepa B2 de Paenibacillus sp. fue detectada a mediados de la fase de crecimiento exponencial, pero la máxima producción ocurrió al final de la fase estacionaria. Estos resultados son similares a los que se presentan en este trabajo (Figura 3). Estas observaciones son particularmente relevantes, ya que la mayor parte de la literatura indica que B. subtilis produce metabolitos antagonistas en las primeras etapas de la fase estacionaria, que coincide con el comienzo del proceso de esporulación (Leclére et al., 2005; Savluchinske et al., 2004). Las enzimas requeridas para producir estos metabolitos empiezan a formarse en las primeras etapas del crecimiento de la población, pero no es sino hasta el final de la fase exponencial cuando se empieza formar el biopelícula, es decir, cuando tiene mayor actividad, como lo muestran los estudios transcriptómicos realizados por Kröber et al. (2016). La actividad enzimática posterior puede terminar en pocas horas. Sin embargo, esta no es una regla general, ya que, de acuerdo con los resultados que se muestran en la Figura 3, aún hay actividad antagonista en Rhizoctonia solani impulsada por las cepas BEB-8 y Kodiak.
Por último, cada metabolito requiere un rango específico de pH y temperatura para su actividad. Este estudio revela que todos los factores evaluados influyeron en la actividad antifúngica contra Rhizoctonia solani y que las interacciones entre los factores también fueron importantes. En conclusión, los estudios enfocados en las características fisiológicas y los parámetros cinéticos del crecimiento de las cepas de Bacillus subtilis nos permiten entender mejor el comportamiento bacteriano en el control biológico de Rhizoctonia solani.











 texto en
texto en 


