Se estima que solo un 5% de las especies fúngicas existentes han sido registradas y descritas (Hawksworth, 2001). Mortierelliales es uno de los órdenes más abundantes y diversos de los hongos basales y hay cerca de 100 especies descritas en 13 géneros de la familia Mortierellaceae (Yadav et al., 2014), género al cual corresponde el hongo Mortierella. La mayoría de las especies de este género producen ácidos grasos poliinsaturados (PUFA) al convertir el exceso de azúcares y otras fuentes de carbón en lípidos bajo diferentes condiciones de fermentación (Rayaroth et al., 2016). En varios estudios se ha demostrado que algunas especies de Mortierella pueden acumular ácidos araquidónico, gamma-linolénico, eicosapentaenoico y docosahexaenoico en el micelio (Ho et al., 2007; Dedyukhina et al., 2014). Estos compuestos están involucrados en la inducción de resistencia a fitopatógenos en plantas de importancia agrícola (Zlotek and Wojcik, 2014). Asimismo, estos PUFA son ampliamente utilizados como suplementos alimenticios y fármacos que mejoran la respuesta inmunológica en los seres humanos, lo cual confiere importancia tecnológica al género Mortierella como fuente alternativa de dichos compuestos (Dedyukhina et al., 2014). Sin embargo, existe información escasa u obsoleta acerca de la diversidad de los Mortierellales. La identificación de las especies de Mortierella se ha basado principalmente en sus caracteres morfológicos (Watanabe, 2010). Además, la identidad de las especies de estos hongos mediante técnicas moleculares ha recibido poca atención, sobre todo en México, donde actualmente existe un gran interés por encontrar microorganismos antagónicos para el control de fitopatógenos. Por tanto, el objetivo del presente estudio fue aislar e identificar especies nativas de Mortierella asociadas con manzanos con síntomas aparentes de enfermedades radiculares.
De junio a julio de 2015, se muestrearon tres huertas de manzanos (Malus x domestica Borkh. Rosales: Rosaceae) en las cuatro zonas productoras de manzana más importantes: Cuauhtémoc, Guerrero, Bachiniva y Namiquipa, Chihuahua, México (Cuadro 1). Se recolectaron muestras de suelo (500-600 g) de la rizosfera de cinco árboles con síntomas aparentes de enfermedades radiculares causadas por hongos y oomicetos en cada huerto (Ruiz-Cisneros et al., 2017).
Cuadro 1 Localidad donde se recolectaron muestras de suelo rizosférico en huertos de manzana en Chihuahua, México, en 2015.
| Localidad | Huerto | Localización geográfica | Altitud |
| Cuauhtémoc | Campo 2A | N28°26’40”; O106°59’18” | 2,130 |
| Campana 4 ½ | N28°33’49”; O106°54’24” | 1,995 | |
| Picacho | N28°29’28”; O 106°40’08” | 2,020 | |
| Guerrero | Alberto Gameros | N28°31’58”; O 107°26’57” | 2,096 |
| Alberto Gameros PIG30 | N28°31’58”; O 107°26’57” | 2,096 | |
| Efraín Sandoval | N28º32’59”; O 107º27’10” | 2,099 | |
| Namiquipa | Carlos Márquez | N29°11’20”; O 107°25’14” | 1,877 |
| San Rafael | N29°12’19”; O 107°25’22” | 1,858 | |
| El Terrero | N29°18’84”; O107°44’21” | 2,037 | |
| Bachiniva | La Cienega | N28°46’52”; O 107°15’21” | 2,009 |
| Santa Rosa | N28°50’17”; O 107°14’12” | 1,989 | |
| Los 40 | N28°48’07”; O 107°16’06” | 1,990 |
Para aislar las cepas de Mortierella se utilizaron dos medios de cultivo (Agar Dextrosa Papa y agar V8). Los medios agar-dextrosa-papa (PDA; BD Bioxon) y agar V8 [jugo V8, carbonato de calcio (CaCO3) - agar] contenían antibióticos [oxitetraciclina, 0.01 g/L; rifampicina, 0.03 g/L; pimaricina, 0.01 g/L, y 66.8 µL/L de un formulado fungicida con hymexazol (Summit Agro, México]. El aislamiento de cepas de Mortierella en agar V8 se llevó a cabo con y sin frutos de pera (Pyrus communis L.) y hojas de azalea (Rhododendron simsii Planch.) como sustratos trampa. Para el aislamiento en PDA y agar V8 sin sustratos trampa, se prepararon diluciones seriadas (1:10) en tubos de ensayo con 9 mL de agua estéril de peptona (peptona al 0.1% y NaCl al 0.85% en agua destilada), a las que se agregó 1 g de suelo previamente tamizado para generar diluciones de 103, 104 y 105. Utilizando la técnica de difusión, las alícuotas (50 µL) de cada suspensión se distribuyeron por triplicado en cajas de Petri de 90 mm que contenían uno de los medios. Posteriormente, las cajas de Petri se incubaron a 28 ± 1 °C por 72 h en una cámara ambiental sin luz (Precision Scientific, Winchester, VA, EUA). Para aislar las cepas de Mortierella utilizando frutos de pera como sustrato trampa, se colocaron 200-250 g de suelo húmedo en vasos de plástico de 1 L con tapa que contenían una pera previamente lavada con NaClO al 1.5% por 1 min. Los vasos fueron incubados a 26 ± 1 °C en oscuridad por 72 h. En seguida, los frutos se enjuagaron tres veces con agua destilada estéril y se secaron en papel de estraza en una campana de bioseguridad (Envirco Corporation, Albuquerque, EUA). Los frutos fueron incubados de manera individual a 26 ± 1 °C por 48 h. Se extirparon tres secciones (5 mm2) de la epidermis dañada del fruto (zona de transición), o de la epidermis con micelio, y se colocaron en cajas de Petri que contenían agar V8 con antibióticos. Las cajas se incubaron a 26 ± 1 °C por 72 h. Para el aislamiento con hojas de azalea como sustrato trampa, se utilizaron hojas jóvenes y frescas que fueron sometidas al mismo tratamiento que los frutos de pera. Las hojas se cortaron en círculos de 5 mm de diámetro. Los círculos se colocaron en cajas de Petri (60 × 15 mm) que contenían 10-15 g de suelo húmedo y se incubaron a temperatura ambiente por 24 h. Los círculos de las hojas se desprendieron de la caja, se lavaron con agua destilada estéril y se secaron en papel de estraza. Los círculos se colocaron en los cuatro puntos cardinales y en el centro de las cajas de Petri que contenían agar V8 con antibióticos y se incubaron a 28 ± 1 °C por 72 h. Estos experimentos se hicieron por triplicado.
Las colonias con morfología típica de Mortierella se aislaron y purificaron en los medios agar V8 o PDA sin antibióticos, aplicando la técnica de cultivo monospórico, y se incubaron a 28 ± 1 °C sin luz por 120 h.
Los aislados putativos de Mortierellales fueron agrupados según sus caracteres morfológicos macroscópicos y después se tomó un aislado de cada grupo para su identificación (Watanabe, 2010), de acuerdo con los caracteres microscópicos observados en un microscopio óptico (Carl Zeiss, Germany).
La extracción de ADN genómico (ADNg) se realizó de acuerdo con el método de Raeder y Broda (1985) y Ruiz-Cisneros et al. (2017). El ADNg se utilizó para amplificar la región espaciadora interna transcrita (ITS) del gen 18S ADNr con iniciadores universales ITS5 (5’-GGAAGTAAAAGTCGTA-ACAAGG-3’) e ITS4 (5’-TCCTCCGCTTATT-GATATGC-3’) (White et al., 1990). La amplificación se llevó a cabo de acuerdo a la metodología descrita por Ruiz-Cisneros et al. (2017). Los productos de PCR fueron examinados por electroforesis en gel de agarosa al 1%. Posteriormente, los productos fueron secuenciados por Macrogen Company (Rockville, MD, EUA). Las secuencias obtenidas se compararon con la base de datos del NCBI mediante el algoritmo de BLAST (Altschul et al., 1990) para verificar el porcentaje de identidad correspondiente a las especies analizadas. Además, se construyó un árbol filogenético, por el método de máxima verosimilitud, a fin de observar el agrupamiento de los hongos Mortierellales, para lo cual se utilizó el software Mega versión 6.0 (Tamura et al., 2013).
La patogenicidad de los 21 aislados de Mortierella se probó en porta injertos de manzana G30 (una de las que más se producen en México) en condiciones de invernadero, según el método de Ruiz-Cisneros et al. (2017) con modificaciones. Se evaluaron 10 porta injertos G30 (de 1 año de edad) por cada aislado de Mortierella, junto con diez árboles de testigo (sin inóculo). Dos meses después de la plantación, cada árbol fue inoculado con 10 mL de inóculo de Mortierella no cuantificado. El inóculo, de 6-7 días de edad, se sembró en jugo de verduras V8 [jugo V8 (Campbell’s™) y carbonato de calcio (CaCO3)], y se mantuvo a 28 °C con agitación orbital constante a 140 rpm (Orbit 1900, Labnet International Inc.). Posteriormente, los porta injertos inoculados se mantuvieron dos meses más en condiciones de invernadero y durante este periodo fueron monitoreados cada semana.
Se obtuvieron 119 aislados de Mortierella de las muestras de suelo evaluadas (Cuadro 1, Figura 1a-b). El uso de frutos de pera como sustrato trampa nos permitió obtener el mayor número de aislados (143 aislados, 34.1%), seguido del medio de V8-agar-antibióticos (133 aislados, 31.7%) y del método en que se utilizaron hojas de azalea como sustrato trampa (95 aislados, 22.7%). El método menos eficaz de aislamiento fue el medio de PDA-antibióticos (48 aislados, 11.5%) (Figura 1a). El alto número de microorganismos aislados utilizando frutos de pera pudo haber sido consecuencia de una mayor área de contacto de los frutos con el suelo y de una exposición más prolongada. Las hojas de azalea y frutos maduros de pera se han utilizado como sustratos trampa para aislar otros organismos con resultados favorables. A diferencia de nuestros resultados, Yadav et al. (2014) aislaron Mortierella alpina en el medio PDA de manera eficiente.

Figura 1 Aislados de Mortierella asociados con la rizosfera de manzanos enfermos en cuatro de las principales localidades productoras de manzana en el estado de Chihuahua, México; a) número de aislados obtenidos por sustrato; b) número de aislados obtenidos por localidad.
El número de aislados de Mortierella que se obtuvo en cada región se muestra en la Figura 1b. El mayor número de aislados (136, 32%) se obtuvo en la región de Cuauhtémoc. Webster y Weber (2007) demostraron que la frecuencia de aislamiento de cada hongo varía mucho, dependiendo del método de aislamiento, el medio de cultivo, la temperatura y otros factores durante el procesamiento de las muestras. La evidente variación en la abundancia de Mortierella en los huertos evaluados podría ser resultado de múltiples factores, como la ubicación geográfica, el tipo de suelo, el tipo de porta injertos, la edad de los árboles, las condiciones climáticas, el nivel de tecnificación, el contenido de materia orgánica, la vegetación existente, entre otros. Bosso et al. (2017) encontraron especies de Mortierella en suelo con diferentes usos y atribuyeron la alta presencia de Mortierella al posible control de fitopatógenos, ya que este género podría tener propiedades supresoras de enfermedades (Dedyukhina et al., 2014; Zlotek y Wojcik, 2014).
Se diferenciaron e identificaron 419 aislados de Mortierellales, de acuerdo con sus caracteres macro- y microscópicos distintivos, como el crecimiento radial en forma de flor de las colonias jóvenes de color blanco (Figura 2). Sin embargo, al crecer, algunas de las colonias cambiaron de color blanco a amarillo. El micelio de los aislados era hialino y cenocítico, pero en algunas, se observó la presencia de hifas septadas conforme maduraban (Watanabe, 2010). Se observaron también estructuras microscópicas típicas de la reproducción asexual de este género, lo mismo que estructuras de resistencia en forma de clamidosporas catenuladas e intercalares en la mayoría de los aislados (Figura 2, Cuadro 2; Watanabe, 2010). No se observaron estructuras de reproducción sexual como cigosporas. Park et al. (2001) demostraron que este tipo de estructura es poco común y suele estar rodeada de micelio cenocítico, y que los cambios morfológicos de Mortierella dependen de las condiciones de cultivo y del genotipo del aislado.
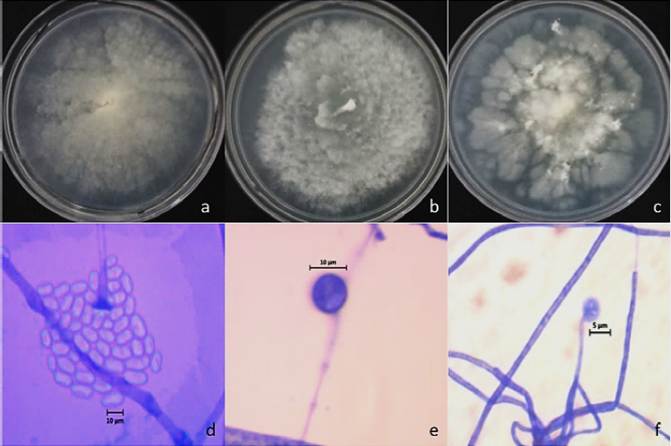
Figure 2 Morfología de Mortierella spp., a-c) características macroscópicas de M. alpina, M. alpina y Mortierella sp. sembradas en un medio de cultivo PDA; d-f) caracteres microscópicos, d) esporangiosporas hialinas y ovaladas, e) clamidospora intercalar, f) esporangios terminales.
Cuadro 2 Principales caracteres microscópicos de aislados de Mortierella asociados con la rizosfera de manzanos enfermos en el estado de Chihuahua, México.
| Código del aislado |
Identificación molecular | Forma de los esporangios |
Tamaño (µm) |
Esporangióforo (µm) |
Clamidospora (µm) |
Esporangiosporas (forma) |
| G11 | Mortierella sp. (TR065) | Ovalado | 5 | 43 | Ausente | |
| G3-2 | M. alpina (FCF20120803) | Esférico | 5 | 50 | Intercalar (5-10) | |
| G17 | M. alpina (ATT234) | Esférico | 5-7 | 35-50 | Intercalar (5) | |
| G18 | M. alpina (C051D16) | Ovalado | 10 | 50 | Intercalar (5-7) | |
| G21 | Mortierella sp. (FMR13-4) | Ovalado | 8-12 | 20 | Intercalar (5) | |
| G26 | Mortierella sp. (MEL2385001) | Esférico | 5-10 | 40-55 | Catenulada (7-10) | |
| G29-1 | M. alpina C08ID17 | Esférico | 10-15 | 30-50 | Intercalar (7-10) | |
| G61 | M. alpina MUT: 5194 | Ovalado | 5-7 | 20-30 | Intercalar (5) | |
| G31 | M. alpina strain xds08088 | Esférico | 5-10 | 50-60 | Ausente | |
| G12 | M. alpina voucher RIFA 12B | Esférico | 10-7 | 40-70 | Intercalar (8-10) | |
| G54 | M. alpina A03ID2 | Esférico | 10-7 | 30-50 | Intercalar (5-7) | Ovalada |
| G52 | M. alpina ATCC16266 | Esférico | 7-10 | 30-50 | Intercalar (5-7) | |
| G14 | M. alpina A01ID1 | Ovalado | 5-10 | 40-50 | Ausente | Ovalada |
| G44 | Mortierella sp. FMR23-12 | Esférico | 10-15 | 30-40 | Intercalar (5-10) | |
| G16 | M. gamsii aurium 1205 | Esférico | 5-10 | 20-40 | Intercalar (7-10) | |
| G2 | Uncultured Mortierellales | Esférico | 5-10 | 30-50 | Intercalar (5-10) | Ovalada |
| G9 | Mortierella sp. 11MA04 | Esférico | 5-10 | 20-40 | Intercalar (7-10) | |
| G25 | M. capitata | Ovalado | 10 | 30-40 | Catenulada (5-7) | |
| G32 | Mortierella sp. (FMR23-12) | Esférico | 5 | 40-50 | Intercalar (5-10) | |
| G35 | Mortierella sp. F0210-20S2 | Esférico | 7-10 | 40-50 | Intercalar (10-15) | |
| G43 | Mortierella sp. SD006 | Ovalado | 8-10 | 30-40 | Ausente |
Los fragmentos de ADNg obtenidos después de la amplificación de las muestras del hongo, con los iniciadores ITS4 e ITS5, mostraron mayor homogeneidad. De acuerdo con los caracteres morfológicos y las secuencias obtenidas de los productos de PCR, se determinó que 12 de los 21 aislados de Mortierellales pertenecían a Mortierella alpina, seis a Mortierella sp., uno a Mortierella gamsii, uno a Mortierella capitata y uno al orden de los Mortierellales (Figura 3). Todos los aislados mostraron de 99 a 100% de identidad y máxima verosimilitud con las puntuaciones moleculares y las claves taxonómicas, que corresponden a cada aislado y según las secuencias disponibles en la base de datos del GenBank (NCBI) (Altschul et al., 1990). Melo et al. (2014) encontraron M. alpina en tejidos de musgo antártico Schistidium antarctici, y demostraron que la presencia de Mortierella es muy frecuente. Estas diferencias podrían derivarse de la fuente de las muestras, ya que, en nuestro estudio, las muestras de suelo fueron recolectadas en agroecosistemas disturbados por actividades antropogénicas, principalmente por el uso intensivo de plaguicidas para el control de plagas agrícolas y el manejo de enfermedades. Nicola et al. (2017) descubrieron que Mortierella es un hongo que por lo general coloniza las raíces de las plantas y que normalmente se le asocia con enfermedades de replanteo de manzana. En nuestro estudio detectamos este proceso de replanteo en algunos huertos donde recolectamos las muestras.

Figura 3 Árbol de máxima verosimilitud de aislados de Mortierella obtenidos en la rizosfera de árboles de manzana enfermos en Chihuahua, México, con base en los resultados de BLAST utilizando las secuencias de la región ITS4 e ITS5 de cada aislado. La barra de escala representa las sustituciones de un nucleótido y los puntos de la rama numérica indican valores de soporte como porcentaje con base en 1,000 repeticiones de bootstrap (se muestran únicamente los valores > 50%).
El árbol de máxima verosimilitud mostró diferencias genéticas entre los aislados de Mortierella. Según O’Donnell et al. (2001), algunos géneros, e incluso algunas especies, del orden Mucorales son polifiléticos, tal como se puede observar en el árbol filogenético de los diferentes aislados. Los aislados de Mortierellales no fueron patogénicos en los porta injertos de manzana G30. Bosso et al. (2017) demostraron que estas especies de hongos pueden ser consideradas antagonistas debido a su capacidad de producir diferentes sustancias que pueden ayudar en la defensa de las plantas como inductores de resistencia sistémica.
En Chihuahua existen varias especies de Mortierella asociadas con la rizosfera de los manzanos que muestran síntomas aparentes de enfermedades radiculares. El método más eficaz para el aislamiento de Mortierella incluyó el uso de frutos de pera como sustrato trampa.











 text in
text in 


