La agricultura representa una actividad determinante en el desarrollo económico, social y ambiental del mundo, ya que contribuye con el 80% de los alimentos que se consumen (FAO, 2014). Sin embargo, aproximadamente entre el 20 y 30% de la producción agrícola anual es afectada por plagas y enfermedades, siendo los hongos, bacterias, nematodos, virus e insectos los principales agentes causales (Pérez-García et al., 2011). De esta manera, con el objetivo de combatir las enfermedades en los cultivos agrícolas se han utilizado ampliamente diversos compuestos químicos tales como: insecticidas, fungicidas y nematicidas. No obstante, el éxito de la aplicación de estos compuestos en el incremento de la productividad agrícola mundial, su uso excesivo ha impactado negativamente los suelos, ecosistemas y la salud humana, i.e. el captan, fungicida utilizado en México, cuyo uso se ha prohibido en otros países por su efecto cancerígeno (Arellano-Aguilar y Rendón, 2016).
Por otra parte, la incidencia de plagas y enfermedades puede ser minimizada por el uso de prácticas culturales, por ejemplo, la rotación de cultivos y el sistema de siembra por parcelas separadas; sin embargo, éstas no son completamente eficientes (Sainju et al., 2016). Así, el Manejo Integrado de Plagas y Enfermedades (MIPE) es una alternativa indispensable en el desarrollo de una agricultura sustentable que garantiza la seguridad alimentaria global, en el cual se utiliza la combinación de métodos biológicos, culturales y químicos de forma compatible (de Olivar et al., 2008). En el MIPE se destaca el uso de agentes de control biológico (ACB) como una alternativa sustentable para mitigar los efectos negativos en la productividad y calidad de los cultivos agrícolas causada por distintas enfermedades, disminuyendo la resistencia de los organismos fitopatógenos, y reduciendo la contaminación de los suelos y mantos acuíferos. Lo cual permite la producción de alimentos inocuos y disminuye los costos de producción agrícola (Reyes et al., 2015).
El uso de ACB inició a principios del siglo XIX, utilizando organismos vivos o sus metabolitos para mitigar las enfermedades en cultivos agrícolas (Badii et al., 2000). En las últimas décadas, se ha descrito el efecto que ejerce una gran diversidad de microorganismos rizosféricos en el control de organismos fitopatógenos, ya que la rizósfera representa la primera línea de defensa de la planta contra organismos fitopatógenos edáficos, evitando así el establecimiento de éstos en la raíz (Tejera-Hernández et al., 2011). Lo anterior ha conducido al estudio de múltiples mecanismos utilizados por los ACB para controlar el crecimiento, desarrollo e infección de organismos fitopatógenos en diversos cultivos agrícolas de importancia económica, entre estos mecanismos destacan: a) mecanismos de contacto como, hiperparasitismo y predación (Chen et al., 2016); b) la producción de compuestos de bajo peso molecular con efecto directo sobre el crecimiento del patógeno antibióticos (fenazinas, 2,4-diacetilfloroglucinol, lipopéptidos cíclicos), enzimas líticas (quitinasas, glucanasas, proteasas), productos de residuos no regulados (amoniaco, dióxido de carbono, cianuro de hidróxido) (Yan et al., 2011; Zhang et al., 2016; Jaaffar et al., 2017; Piechulla et al., 2017) y c) mecanismos indirectos por competencia de espacio y nutrientes (consumo de lixiviados-exudados, producción de sideróforos, inducción a la respuesta sistémica en plantas mediante la producción de fitohormonas y patrones moleculares) (Pal y Gardener, 2006; Yu et al., 2011; Chowdhury et al., 2015). Estos mecanismos de acción han sido observados en las cepas microbianas utilizadas como ACB, entre las cuales el género Bacillus ha sido ampliamente estudiado debido a su alta abundancia y diversidad en los agro-sistemas (suelo, agua y planta), siendo significativamente mayor su población en comparación a otros géneros microbianos, y además por sus diversas capacidades metabólicas, destacando su capacidad para producir antibióticos y otros metabolitos antimicrobianos y antifúngicos (Tejera-Hernández et al., 2011). Por ejemplo, diversos estudios moleculares han revelado que un porcentaje significativo del genoma de cepas del género Bacillus está relacionado con la producción de metabolitos secundarios asociados al control de fitopatógenos, i.e. el 8.5 y 4% del genoma de las cepas B. amyloliquefaciens FZB42 y B. subtilis 168, respectivamente (Raaijmakers y Mazzola, 2012). Esto justifica el amplio uso de cepas de este género bacteriano como ACB para el control de enfermedades que afectan los cultivos agrícolas. Sin embargo, la eficiencia de cepas sin riesgos a la bioseguridad del género Bacillus utilizadas como ACB es maximizada por su introducción efectiva al agrosistema, induciendo sus mecanismos de control biológico. Así, la presente revisión se centra en analizar y discutir el género Bacillus, sus principales mecanismos de acción contra enfermedades en plantas, así como su implementación, sin riesgos a la bioseguridad, mediante el desarrollo de bioplaguicidas, ya que el sustento científico de estos bioproductos sobre sus mecanismos de acción, implicaciones ecológicas, de bioseguridad, y la formulación de los bioplaguicidas son determinantes para el desarrollo de una agricultura sustentable.
Clasificación
El género Bacillus fue reportado por primera vez por Cohn (1872), quien lo describió como bacterias productoras de endosporas resistentes al calor. Las especies de Bacillus pertenecen al Reino Bacteria; Filo Firmicutes; Clase Bacilli; Orden Bacillales y Familia Bacillaceae (Maughan y van der Auwera, 2011). Actualmente, el género incluye más de 336 especies, las cuales por su similitud genética pueden clasificarse en distintos grupos, siendo los más destacados: a) el grupo de B. cereus, asociado a patogenicidad, que incluye a B. cereus-anthracis-thuringiensis; b) los bacilos ambientales que son caracterizados por su presencia en distintos hábitats, como el grupo de Bacillus subtilis, comprendido por B. subtilis-licheniformis-pumilus; c) el grupo de B. clausii-halodurans; y d) el grupo que incluye a Bacillus sp. NRRLB-14911-coahuilensis (Alcaraz et al., 2010; LPSN, 2016).
Ecología
Las especies de Bacillus se encuentran ampliamente distribuidas a nivel mundial debido a su habilidad para formar endosporas, característica que les confiere resistencia y potencia su aislamiento en diversos hábitats, tanto ecosistemas acuáticos como terrestres, e incluso en ambientes bajo condiciones extremas (Tejera-Hernández et al., 2011). Sin embargo, el suelo es considerado el principal reservorio de este género bacteriano, debido a que la mayoría de especies de Bacillus son saprófitas pudiendo utilizar la gran diversidad de sustratos orgánicos presentes en el suelo, siendo ésta una matriz compleja para el establecimiento de una gran diversidad genética y funcional de especies microbianas (McSpadden, 2004). Por lo cual, múltiples especies de Bacillus pueden desarrollarse en los suelos, cuyos recuentos cultivables se encuentra en el intervalo de log 3 a log 6 por gramo de peso fresco de suelo, esencialmente en especies similares genéticamente al grupo de B. subtilis y B. cereus (Vargas-Ayala et al., 2000). No obstante que estudios de ARNr en suelo contradicen la abundancia relativa de especies cultivables y no cultivables de este género bacteriano (Kumar et al., 2011).
Bajo un enfoque dirigido a la sustentabilidad agrícola se han realizado escasas investigaciones con el objetivo de comprender la diversidad y dinámica poblacional específica de Bacillus en suelos rizosféricos, donde las comunidades bacterianas que habitan la rizósfera responden particularmente a la fertilidad del suelo y los exudados de las raíces de las plantas, los cuales varían con la fenología y genotipo vegetal (de Souza et al., 2015), por lo que bacterias que interaccionen con las plantas y presenten capacidades asociativas, endofíticas o procesos simbióticos para adaptarse a las condiciones rizosféricas son reconocidas como potenciales inoculantes microbianos. Rudrappa et al. (2008) reportaron que la producción de biopelículas de B. subtilis FB17 es un mecanismo de colonización rizosférica, esto debido a su atracción por el ácido L-málico secretado por las raíces de Arabidopsis thaliana e inducido por el patógeno foliar Pseudomonas syringae pv tomato. Por otra parte, Kumar et al. (2011), López-Fernández et al. (2016) y Selim et al. (2016) señalan que diversas especies de Bacillus pueden ser residentes de tejidos internos en plantas de uva (Vitis vinífera) y algodón (Gossypium barbadense L). Estas características tienen un papel determinante en el desarrollo, colonización y función de Bacillus estimulando su asociación con la planta hospedera, cuyas características de control biológico son potenciadas.
Principales características
Entre las características del género Bacillus destaca su crecimiento aerobio o en ocasiones anaerobio facultativo, Gram positivas, morfología bacilar, movilidad flagelar, y tamaño variable (0.5 a 10 μm), su crecimiento óptimo ocurre a pH neutro, presentando un amplio intervalo de temperaturas de crecimiento, aunque la mayoría de las especies son mesófilas (temperatura entre 30 y 45 °C), su diversidad metabólica asociada a la promoción del crecimiento vegetal y control de patógenos (Tejera-Hernández et al., 2011); además destaca su capacidad de producir endosporas (ovales o cilíndricas) como mecanismo de resistencia a diversos tipos de estrés (Calvo y Zúñiga, 2010; Layton et al., 2011; Tejera-Hernández et al., 2011) (Figura 1).
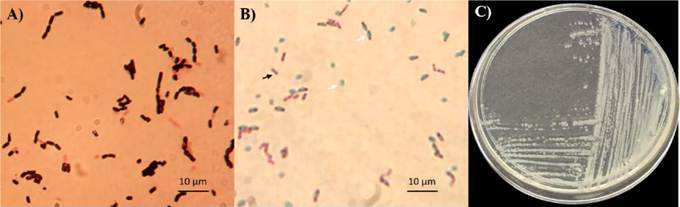
Figura 1 Características morfológicas de Bacillus sp. TE3 perteneciente a la Colección de Microorganismos Edáficos y Endófitos Nativo (www.itson.edu.mx/COLMENA). A) Células bacilares, Gram positivas; B) endosporas (flecha blanca) y células bacilares (flecha negra); y C) morfología macroscópica de la cepa TE3.
La presencia de endosporas le confiere al género de Bacillus su capacidad de diseminación y prevalencia en los ecosistemas, éstas se forman durante su segunda fase del ciclo de vida, el cual se encuentra conformado por una fase de crecimiento vegetativo y una fase de esporulación (Figura 2). Durante la primera etapa, la bacteria crece de forma exponencial mediante fisión binaria, ya que se encuentra en un medio con las condiciones favorables para su desarrollo. La segunda fase comienza como una estrategia de supervivencia en presencia de algún tipo de estrés (alta densidad de población, escasez de nutrientes, factores externos como salinidad, temperatura, pH, entre otros), así la célula vegetativa inicia la formación de la endospora, lo cual implica la división celular asimétrica, dando lugar a la formación de dos compartimentos, célula madre y la inmersión de una preespora. Posteriormente, la preespora es engullida, formando una célula dentro de la célula madre. Durante las etapas posteriores, la preespora es recubierta de capas protectoras (componentes proteicos, peptidoglicano y una pared que reside debajo de ésta, formada por células germinales), seguido de la deshidratación, y la maduración final de la preespora. Finalmente, la célula madre se lisa mediante muerte celular programada, liberando la endospora. La endospora puede permanecer viable en el ambiente hasta que las condiciones son favorables para iniciar sus procesos metabólicos y generar una célula vegetativa (Errigton 2003; Tejera-Hernández et al., 2011; CALS; 2016). Por lo anterior, la formación de endosporas resistentes al calor y desecación es una característica de importancia para la formulación de productos biotecnológicos a base de cepas de este género bacteriano (Pérez-García et al., 2011).
El género Bacillus como Agente de Control Biológico
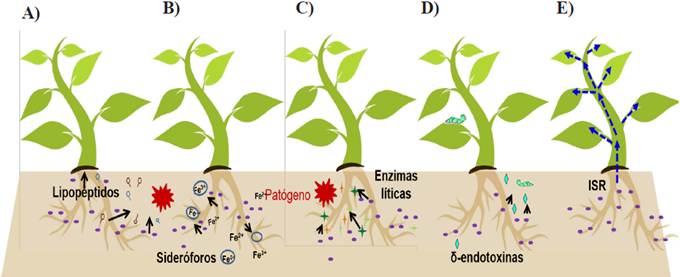
Una gran diversidad de especies del género Bacillus han demostrado tener actividad antagónica contra diversos microorganismos fitopatógenos de cultivos agrícolas, tales como maíz, arroz, frutales, entre otros (Wang et al., 2014; Li et al., 2015). El estudio de esta capacidad de Bacillus se inició por el descubrimiento de la actividad insecticida de las proteínas Cry producidas por B. thuringiensis; en la actualidad diversas especies del género Bacillus (B. subtilis, B. pumilus, B. amyloliquefaciens y B. licheniformis) son ampliamente estudiadas para mitigar la incidencia de enfermedades de importancia agrícola (Raaijmakers y Mazzola, 2012). Entre las principales vías por las cuales estas cepas evitan el establecimiento y desarrollo de organismos fitopatógenos es a través de diferentes mecanismos, que incluyen A) la excreción de antibióticos, B) sideróforos, C) enzimas líticas, D) toxinas y E) induciendo la resistencia sistémica de la planta (IRS) (Figura 3) (Layton et al., 2011; Tejera-Hernández et al., 2011).
Producción de lipopéptidos
Una de las características más importantes del género Bacillus es su capacidad de producir una gran variedad de antibióticos con capacidad de inhibir el crecimiento de agentes fitopatógenos, entre éstos, los lipopéptidos cíclicos no ribosomales han sido los más estudiados. Los lipopéptidos (LPs), estructuralmente consisten en un péptido cíclico unido a una cadena de ácido graso β-hidroxi o β-amino (Figura 4-A), clasificándose en 3 diferentes familias (iturinas, fengicinas y surfactinas), de acuerdo con su secuencia de aminoácidos y longitud del ácido graso (Ongena y Jaques, 2008; Falardeau et al., 2013). Estas moléculasson sintetizadas por complejos multi-enzimáticos, conocidos como sintetasas de péptidos no ribosomales (NRPS del inglés, nonribosomal peptide synthetase), las cuales son independientes del RNA mensajero (Chowdhury et al., 2015). Las familias de las iturinas, fengicinas y surfactinas, han sido ampliamente estudiadas por su actividad antibacteriana y antífúngica (Meena y Kanwar, 2015). La actividad antimicrobiana de estos LPs tiene lugar por su interacción con la membrana citoplasmática de células bacterianas o fúngicas, provocando la formación de poros y un desbalance osmótico, lo que desencadena la muerte celular de los microorganismos fitopatógenos (Figura 4-B) (Aranda et al., 2005; Gong et al., 2006). Sin embargo, recientemente se ha reportado que algunos lipopéptidos pueden tener múltiples mecanismos de acción, al terando procesos celulares como homeostasis intracelular de calcio, metabolismo energético y procesamiento del RNA (Zhang et al., 2016).El papel de los LPs se ha evidenciado en la inhibición del crecimiento de microorganismos fitopatógenos. Touré et al. (2004) identificaron múltiples isoformas de lipopéptidos en extractos generados a partir de cultivos líquidos de B. subtilis GA1. Posteriormente, en un ensayo de coinoculación de la cepa GA1 y Botrytis cinerea en frutos de manzano, identificaron la presencia de fengicinas e iturinas en concentraciones inhibitorias, demostrando la actividad de estos lipopéptidos in-situ. Además, análisis de expresión génica y mutagénesis dirigida han contribuido de manera significativa a comprender el papel de los lipopéptidos en la actividad antimicrobiana del género Bacillus contra microorganismos fitopatógenos (Xu et al., 2013). Por ejemplo, Li et al. (2014) mutaron el gen de la fosfopanteteína transferasa (sfp) en la cepa SQR9 de B. amyloliquefaciens, indispensable en el funcionamiento de sintetasas de péptidos no ribosomales (NRPS), y por tanto de la síntesis de lipopéptidos. Dicha mutación resultó en un fenotipo carente de actividad antifúngica contra diversos fitopatógenos de importancia agrícola, incluyendo Verticillium dahliae, Sclerotinia sclerotiorum, Fusarium oxysporum, Rhizoctonia solani, Fusarium solani, Phytophthora parasítica.
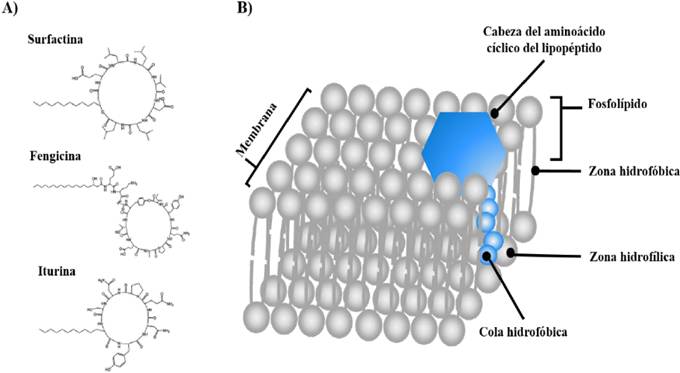
Figura 4 Los lipopéptidos como metabolitos involucrados en el control biológico de fitopatógenos. A) Representantes de las familias de lipopéptidos, B) Mecanismo de acción de los lipopéptidos. Modificado de Ongena y Jaques (2008); Bayer (2016).
El control eficiente de enfermedades por parte de los agentes de control biológico requiere que éstos sean capaces de establecerse e interactuar con su planta hospedera (Pérez-García et al., 2011). Así, además de la antibiosis, los lipopéptidos influyen en el establecimiento de Bacillus mediante la regulación de procesos celulares como motilidad y formación de biopelículas (Choudhary y Jhori, 2009; Xu et al., 2013). Esto último ha sido observado en la mutante de B. subtilis 6051 deficiente en la producción de surfactinas, observándose la formación de una biopelícula irregular durante la colonización, así como la disminución de su capacidad para controlar infecciones causadas por Pseudomonas syringae pv. tomato en Arabidopsis thaliana (Bais et al., 2004). De manera similar, el papel de los lipopéptidos en la motilidad de Bacillus ha sido demostrado mediante el estudio de mutantes deficientes en la producción de lipopéptidos, i.e. Bacillus subtilis 168 deficiente del gen sfp, mostró perdida de la motilidad en agar semisólido, sin embargo, ésta fue restablecida cuando lipopéptidos purificados fueron agregados al medio de cultivo (Kinsinger et al., 2003). Debido al papel de los lipopéptidos en múltiples procesos celulares (antibiosis, formación de biopelículas y motilidad), su estudio aislado sobre la motilidad in situ de Bacillus es complejo.
No obstante que los lipopéptidos no son los únicos metabolitos del antibioma del género Bacillus involucrados en el control biológico de fitopatógenos, éstos han sido propuestos como los metabolitos más eficientes para esta actividad biológica debido a su papel ecológico y capacidad antimicrobiana, por lo cual se han utilizado para la búsqueda y selección de ACB promisorios de este género (Cawoy et al., 2015; Mora et al., 2015).
Producción de enzimas líticas
La producción de enzimas involucradas en la degradación de la pared celular de agentes fitopatógenos es uno de los mecanismos de control biológico más reportados, especialmente contra patógenos de origen fúngico. La pared celular de hongos está conformada por glicoproteínas, polisacáridos y otros componentes que varían según la especie fúngica (Bowman y Free, 2006). La fracción de polisacáridos puede comprender hasta un 80% de la pared celular de hongos, encontrándose principalmente quitina (~ 10 - 20%) y glucano (~ 50 - 60%), los cuales están compuestos por residuos de beta-1,3-glucosa y beta-1,4-N-acetilglucosamina, respectivamente (Bowman y Free, 2006; Latgé, 2007). Estos polímeros tienen un papel estructural determinante en la rigidez de la pared celular, mediante una red extensa de enlaces glucosídicos. Así, la interferencia en estos enlaces puede deteriorar la pared celular de hongos fitopatógenos, provocando su lisis y muerte celular.
La producción de enzimas líticas como quitinasas (EC 3.2.1.14) y β-glucanasas (EC 3.2.1.6 y EC 3.2.1.39) excretadas por los ACB, incluyendo al género Bacillus, han mostrado un efecto inhibitorio contra patógenos de origen fúngico (Compant et al., 2005). Estas enzimas son responsables de la degradación de los principales polisacáridos que conforma la pared celular de hongos, mediante la hidrólisis de sus enlaces glucosídicos (Figura 5). Actualmente, existen diversos estudios científicos que reportan el papel de estas enzimas en la actividad antifúngica in vitro obtenidas de cepas del género Bacillus (Kishore et al., 2005; Liu et al., 2010; Shafi et al., 2017). Por ejemplo, Yan et al. (2011) demostraron el papel de una quitinasa en el control de Rhizoctonia solani por B. subtilis SL-13, evaluando la actividad inhibitoria de la enzima purificada y confrontada contra dicho patógeno. Chien-Jui et al. (2004) clonaron el gen chiCW de B. cereus 28-9 en Escherichia coli DH5α y demostraron que los productos purificados presentaron una alta actividad inhibitoria en la germinación de esporas de Botrytis elliptica. Así también, Martínez-Absalón et al. (2014) observaron que al someter sobrenadantes líquidos de B. thuringiensis UM96 al inhibidor especifico de quitinasas, alosamidina, éstos perdieron la capacidad de inhibir el crecimiento de Botrytis cinerea, evidenciando la importancia de las quitinasas en la actividad de control biológico de dicha cepa. De manera similar, diferentes autores han reportado a las β-glucanasas como componentes importantes en la actividad control biológico de cepas del género Bacillus; Aktuganov et al. (2007), reportaron que las β-1,3-glucanasas son las principales enzimas líticas involucradas en el control in vitro de Bipolaris sorokiniana por Bacillus sp. 739, y en estudios con B. amyloliquefaciens MET0908 se evidenció a través de microscopia electrónica de barrido la actividad lítica de una β -1,3-glucanasas sobre las hifas de Colletotrichum lagenarium. Además, estudios de ingeniería genética enfocados a incrementar la actividad antifúngica de cepas de Bacillus han logrado exitosamente la inserción de genes codificantes a enzimas líticas, tal como el gen ChiA de B. subtilis F29-3 en B. circulans, obteniendo un fenotipo más agresivo contra Botrytis elliptica (Chen et al., 2004). Además, Zhang et al. (2012) incrementaron significativamente la actividad antifúngica de Burkholderia vietnamiensis P418 frente a diferentes fitopatógenos fúngicos mediante la inserción cromosómica de gen Chi113, proveniente de una cepa de B. subtilis.
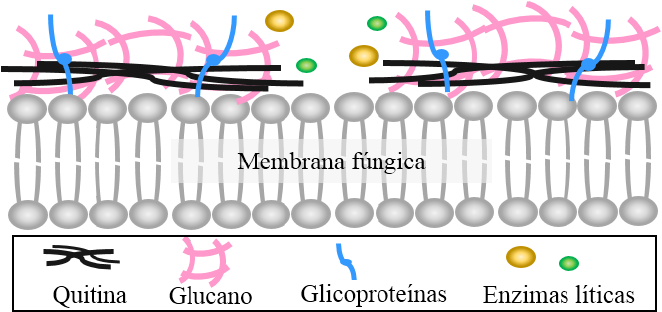
Figura 5 Degradación de la pared celular de hongos fitopatógenos por enzimas líticas. Modificado de Moebius et al. (2014).
Producción de sideróforos
El hierro (Fe) es un nutriente esencial para importantes funciones celulares, tales como en las reacciones redox de las proteínas con cofactores (Fe-S), en la cadena de transporte de electrones, y catalizando reacciones enzimáticas vitales, como aquellas en las que se encuentra involucrado el hidrógeno, oxígeno y nitrógeno (Faraldo-Gómez y Sansom, 2003). El Fe es encontrado en la naturaleza mayormente en forma férrica (Fe3+) de baja solubilidad, imposibilitando su uso por algunos seres vivos (Aguado-Santacruz et al., 2012). En respuesta a la restricción de hierro en el ambiente algunos microorganismos han desarrollado diversas estructuras proteicas receptoras, de bajo peso molecular y con alta afinidad por el hierro, llamadas sideróforos, facilitando la captación de Fe+3 (Thyagarajan et al., 2017). Los sideróforos son metabolitos secundarios que actúan como secuestrantes o quelantes de hierro, consecuencia de su elevada constante de disociación por este metal, oscilando entre 1022 y 1055. Lo cual permite la formación de complejos Fe3+- sideróforo, así los microorganismos productores de sideróforos, mediante un receptor específico localizado en la membrana, pueden utilizarlo por dos mecanismos: 1) directamente mediante el complejo Fe3+- sideróforo a través de la membrana celular, o 2) reducido extracelularmente a complejos Fe2+ (Neilands, 1995) (Figura 6-A). Los sideróforos en función de su principal grupo quelante se clasifican en: hidroxamatos (utilizando ácidos hidroxámicos), catecolatos (conteniendo anillos catecol), carboxilatos, fenolatos, y en combinación de dos o más de estos grupos (Wilson et al., 2016) (Figura 6-B). Una amplia diversidad de cepas con capacidad de control biológico pertenecientes al género Bacillus han mostrado la capacidad de sintetizar sideróforos, regulando la concentración de hierro en el medio a través de su quelación (Fe3+-sideróforo), ocasionando que este metal no se encuentre disponible para microorganismos patógenos, cuyo crecimiento es altamente dependiente de este elemento (Scharf et al., 2014). Por otra parte, la formación de dichos complejos no afecta el desarrollo de las plantas, la mayoría de ellas pueden crecer en concentraciones de hierro inferiores que aquellas requeridas por estos agentes de control biológico, así mismo algunas plantas presentan la capacidad de aprovechar estos complejos microbianos, incrementando su biodisponibilidad a este elemento (Aguado-Santacruz et al., 2012).
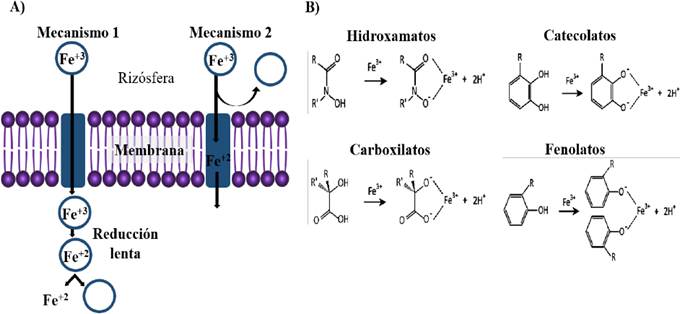
Figura 6 Los sideróforos como mecanismo de inhibición a fitopatógenos. A) Captura y solubilización de hierro, B) principales estructuras quelantes de los sideróforos. Modificado de Neilands (1995); Wilson et al. (2016).
Así, diversas especies de género Bacillus han sido reportadas por su capacidad para controlar enfermedades de plantas mediante la secreción de sideróforos, limitando el crecimiento y colonización de microorganismos fitopátogenos dependientes hierro (Fgaier y Eberl, 2011). Yu et al. (2011) demostraron en ensayos de co-cultivo en placas de agar cromo azurol sulfonato (CAS) que B. subtilis CAS15 antagonizó fuertemente el crecimiento de 15 patógenos fúngicos, pertenecientes a los géneros de Fusarium, Colletotrichum, Pythium, Magnaporthe y Phytophthora, con tasas de inhibición que se ubicaron en el intervalo de 19 a 94%, atribuyendo este efecto a sideróforos de tipo catecolato (Bacillibactina), identificado por ESI-MS y DHB. De forma similar, May et al. (2001) reportaron el potencial de cepas del género Bacillus sobre la producción de sideróforos mediante el análisis de genes involucrados en la síntesis de Bacillibactina (BB), particularmente en B. subtilis, observando que la cepa mutante JJM405 en el gen dhb, presentó una limitada producción de BB, mientras ATCC21332 (cepa silvestre) presentó una mayor producción de este sideróforo.
Producción de δ-endotoxinas
Las δ-endotoxinas, producidas particularmente por Bacillus thuringiensis (Bt), son cuerpos paraesporales proteicos conformados por unidades polipeptídicas de diferentes pesos moleculares, desde 27 a 140 kDa. Actualmente se han reportado 300 holotipos de toxinas Bt, clasificándose en 73 familias Cry, y 3 Cyt (Porcar y Juárez, 2004; Xu et al., 2014). Las toxinas Bt son producidas durante la fase de esporulación, la proteína Cry (cristal) es conocida por sus efectos tóxicos específicos en un organismo objetivo (la mayoría pertenece al orden de los insectos), así mismo las proteínas Cyt (citolítica) han sido relacionadas con efectos tóxicos sobre una gran variedad de insectos, principalmente dípteros; sin embargo, también se ha comprobado su citotoxicidad contra células de mamíferos (Soberón y Bravo, 2007).
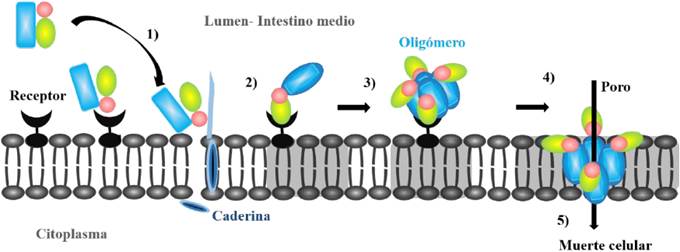
Las proteínas Cry se encuentran ampliamente utilizadas por su eficacia en el control biológico de insectos, cuyo mecanismo de acción inicia una vez que las proteínas Cry son procesadas proteolíticamente a través de proteasas presentes en el intestino medio del huésped, separando una sección de aminoácidos en la región N-terminal y en el extremo C-terminal (dependiendo de la naturaleza de la proteína Cry), liberando así fragmentos activos y tóxicos que interactúan con las proteínas receptoras presentes en células intestinales (Figura 7). Estos fragmentos son reconocidos por receptores específicos en la membrana e insertados a través de la caderina (1), dando sucesión a una serie de señales para la formación de una estructura oligomérica preporo (2-3) y consecuentemente el poro lítico (4), por el cual se efectúa un desequilibrio osmótico, que finalmente destruye el epitelio intestinal y en consiguiente la muerte celular (5) (Portela-Dussán et al., 2013; Xu et al., 2014).
Diversos autores han reportado el potencial de las proteínas Cry en la toxicidad de plagas de importancia agrícola. Por ejemplo, Niedmann y Meza-Basso (2006) señalan que la polilla del tomate (Tuta absoluta) ocasiona pérdidas de un 60 al 100% de los cultivos que no son tratados con insecticidas, con ello, demuestran el potencial de Bt destacando que en ensayos en hojas de tomate adicionadas con concentrados de proteínas Cry extraías de las cepas LM-11, LM-12, LM-14 y LM-33 de Bt, se logró la mortalidad entre un 20 y 60% de las larvas de T. absoluta, lo cual sugeriría la disminución de las pérdidas en un 12 y 60%. Por otra parte, Vázquez-Ramírez et al. (2015) destacan el papel preponderante que pueden ocupar cepas de Bt contra la plaga del gusano cogollero del maíz (Spodoptera frugiperda), en bioensayos realizados con extractos de proteínas Cry obtenidos de las cepas LBIT-13, LBIT-44, LBIT-383, LBIT-418 y LBIT-428 de Bt, demostraron que todas ellas tenían un efecto tóxico en el gusano cogollero, sin embargo, las cepas LBIT-13 y LBIT-418 mostraron alta toxicidad hacia S. frugiperda, con CL50 de 137.2 y 197.2 ng cm-2, respectivamente, esto en comparación con el estándar comercial HD-1 (CL50 de 142 ng cm-2).
Respuesta sistémica inducida
Durante la historia evolutiva, las plantas han desarrollado mecanismos para defenderse de la invasión de organismos patógenos (bacterias, hongos, nematodos, insectos, etc.). Dichos mecanismos se encuentran latentes y son activados por estímulos durante la interacción con agentes patógenos. En términos generales, estos mecanismos se conocen como resistencia sistémica adquirida (SAR del inglés, systemic acquiered resistance) y se caracteriza por activarse no solo en el sitio de la infección, sino de manera sistémica en otros tejidos (Pieterse et al., 2014).
SAR es activado a través de estímulos percibidos principalmente por dos receptores, los PRRs (pattern recognition receptors) y NB-LRRs (nucleotide-binding-leucine-rich repeat) (Pieterse et al., 2014). El primero de éstos percibe componentes celulares como quitina fúngica o flagelinas (PAMPs o MAMPs, pathogen o microbe associated molecular patterns) desencadenando la primera línea de defensa, conocida como PTI (PAMP-triggered inmmunity). En patógenos con mecanismos para evadir a PTI, una segunda línea de defensa es activada, la cual percibe proteínas efectoras de virulencia mediante receptores NB-LRRs (Boller et al., 2009). SAR es dependiente de la señalización de ácido salicílico (SA), el cual, activa genes PR (pathogenesis-related) codificando muchos de ellos a proteínas PR con capacidad antimicrobiana (e.i. PR1) (Vlot et al., 2009)De manera similar al SAR, la respuesta sistémica en plantas puede ser inducida (ISR, induced systemic resistance) por señales químicas (elicitores) producidas por microorganismos benéficos (Pérez-Montaño et al., 2014) (Figura 3-E). No obstante que SAR e ISR son considerados sinónimos debido a la similitud entre los mecanismos (Pieterse et al., 2014), la señalización en ISR es dependiente del ácido jasmónico y etileno (Pieterse, 1998).
La protección de cultivos de importancia agrícola (tomate, pimiento, frijol, arroz, etc.) mediante la inducción de respuesta sistémica utilizando cepas del género Bacillus ha sido bien documentada (Akram et al., 2016; Choudhary and Johri, 2009; Wang et al., 2013; Yi et al., 2013). Bacillus produce una gran diversidad de moléculas elicitoras que inducen respuesta sistémica en plantas, incluyendo a lipopéptidos (Chowdhury et al., 2015), fitohormonas (Ryu et al., 2003) y compuestos volátiles (Kim et al., 2015). Estos últimos activan genes PR, los cuales protegen de la invasión de agentes patógenos. Este hecho ha sido observado en plantas de tabaco, donde PR2 codifica por una β-1,3 glucanasa y PR3 codifica por una quitinasa, fueron activados en respuesta a compuestos volátiles de Bacillus sp. JS, confiriendo resistencia ante Rhizocronia solani y Phytophthora nicotianae (Kim et al., 2015). Además de genes PR, Bacillus activa otros mecanismos de protección en plantas, los cuales incluyen cambios estructurales en la pared celular mediante la acumulación de lignina (Singh et al., 2016) o la producción de metabolitos secundarios como flavonoides, fitoalexinas, auxinas o glucosinolatos en general (Pretali et al., 2016). No obstante que los mecanismos de protección de plantas inducidos por elicitores son activados por diferentes rutas metabólicas, un microorganismo es capaz de activar múltiples mecanismos de protección. Esto último ha sido observado en plantas de trigo, donde tras la inoculación de Bacillus amyloliquefaciens B-16, se indujo producción de múltiples proteínas PR y metabolitos secundarios como ácido gálico y ácido ferúlico, confiriendo resistencia contra Bipolaris sorokiniana (Singh et al., 2016).
El género Bacillus y los bioplaguicidas
El uso de plaguicidas químicos como principal método de control de plagas y enfermedades en la agricultura, ha permitido incrementar significativamente la productividad agrícola en las últimas décadas; sin embargo, su uso excesivo ha originado resistencia a estos compuestos por microorganismos fitopatógenos, y a su vez se han asociado efectos nocivos a la salud humana, y al medio ambiente. Lo anterior, hace evidente la necesidad de generar alternativas eficientes y amigables con el ambiente para reducir el uso de productos sintéticos, logrando de esta manera un manejo eficaz y sustentable del control de enfermedades en los cultivos agrícolas (Pérez-García et al., 2011).
El control biológico es una parte importante para el manejo de plagas y enfermedades, que consiste en la utilización de organismos vivos para reducir y mantener la abundancia de una plaga o un patógeno por debajo de los niveles de daño económico. El potencial de esta alternativa se fundamenta en un control eficiente de una plaga o enfermedad a mediano y largo plazo, compatible con un bajo riesgo ambiental, y una producción sustentable. Así, el manejo de plagas y enfermedades se puede llevar a cabo por varios métodos alternativos: el uso de plaguicidas sintéticos, cultivos genéticamente modificados resistentes a plagas, el control biológico, o bien la combinación de una o más de estas estrategias. Los bioplaguicidas son un grupo particular de herramientas de protección de cultivos utilizados en el MIPE, aunque no existe una definición formalmente para este término, un bioplaguicida hace referencia a un agente producido en masa a partir de un microorganismo vivo o un producto natural, y comercializado para el control de plagas o enfermedades de plantas (esta definición abarca la mayoría de los productos clasificados como bioplaguicidas, dentro de los países de la Organización de Cooperación y Desarrollo Económicos) (OCDE, 2009). Los bioplaguicidas pueden ser clasificados en tres tipos, de acuerdo con la sustancia activa: i) productos bioquímicos, que comprenden principalmente metabolitos secundarios de plantas y microorganismos; ii) productos semi-químicos, constituidos principalmente por feromonas; y iii) microorganismos, incluyen bacterias, virus, hongos y protozoarios, (Chandler et al., 2011).
Dentro de los bioplaguicidas microbianos disponibles comercialmente, Bacillus es el género más explotado en la biotecnología agrícola, con un 85% de los productos bacterianos, debido a su gran versatilidad metabólica que le permiten llevar a cabo el control biológico de plagas y enfermedades por diversos mecanismos. Además, este género bacteriano es capaz de producir endosporas, siendo éstas el principal ingrediente activo de los formulados, y confiriéndoles -como propiedad- una mayor viabilidad en el tiempo (Ongena y Jaques, 2008).
Uno de los mecanismos de control biológico que ha sido mayormente explotado en el mercado de los bioplaguicidas, es la capacidad del género Bacillus de producir δ-endotoxinas. Este mecanismo fue el parteaguas en el desarrollo del primer bioplaguicida microbiano para el control biológico de lepidópteros, el cual fue elaborado a base de B. thuringiensis var. kurstaki HD-1. Como se mencionó anteriormente, B. thuringiensis (Bt) produce proteínas Cry (Bt- δ endotoxinas) durante la formación de esporas, la cual es capaz de producir lisis en células del tracto digestivo cuando es consumida por insectos susceptibles. La cepa HD-1 es una de las cepas mejor estudiadas, ya que se caracteriza por la portación de variedad de genes cry antilepidópteros: cry1Aa, cry1Ab, cry1Ac, cry2Aa, cry2Ab y cry1Ia (Höfte y Whiteley, 1989; Sauka y Benintende, 2008).
Actualmente, los productos a base de B. thuringiensis representan el 75% de los bioplaguicidas comercializados mundialmente (Olson, 2015), impactando sustancialmente el mercado de bioplaguicidas nacional, desde 1980. En México, la aplicación de formulados a base de Bt representa una alternativa eficaz para el control de insectos, presentando un porcentaje de uso de 4 a 10% del total de insecticidas utilizados para los cultivos de maíz, algodón y hortalizas (Tamez et al., 2001). Además, otras especies del género de Bacillus, tales como: B. subtilis, B. pumilus, B. licheniformis y B. amyloliquefaciens, destacan por su implementación exitosa en formulaciones comerciales y desarrolladas principalmente para el control de enfermedades fúngicas (Cuadro 1). Por ejemplo, Galindo et al., (2015) desarrollaron el primer biofungicida mexicano de amplio espectro “Fungifree AB”, formulado con esporas viables de B. subtilis 83. Esta bacteria es un antagonista natural de diversos fitopatógenos, utilizado para la prevención de por lo menos 8 patógenos de distinta etiología: Colletotrichum, Erysiphe, Leveillula, Botrytis, Sphaerothecamacularis, en más de 20 cultivos agrícolas; incluso señalan que el éxito de su formulado reside, además del sustento científico, en la publicación de sus resultados en una revista de divulgación consultada por los profesionales en agronegocios, permitiendo con esto el vínculo que enlazó a las compañías exportadoras de cultivos en búsqueda de alternativas sustentables que les permitiera el control de fitopatógenos (i. e. Colletotrichum gloeosporioides).
Cuadro 1 Bacillus como ingrediente activo en formulaciones comerciales.
| Agente de Control Biológico |
Producto (Año) |
Patógeno | Cultivos | Empresa |
| B. pumilus QST2808q | Ballad Plus (2007) | Erysiphe sp., Puccinia spp., Pyricularia sp., Rhizoctonia sp., Tilletia sp., Xanthomonas spp, entre otros. | Gramíneas, oleaginosas, entre otros. | AgraQuest |
| B. subtilis QST713r, s | Serenade ASO (2017) | Pythium spp., Rhizoctonia spp., Fusarium spp., Phytophthora sp., entre otros. | Frutales, hortalizas, entre otros. | Bayer CropScience |
| B. subtilis 83t | Fungifree AB (2012) | Colletotrichum sp., Leveillula sp., Botrytis sp., entre otros | Frutales, hortalizas | Agro & biotecnia |
| B. subtilis var. amyloliquefaciens FZB24u, v | Taegro 2 (2014) | Rhizoctonia sp., Fusarium sp., Pythium sp., Botrytis sp., entre otros. | Diversas frutas, plantas ornamentales, entre otros. | ISAGRO |
| B. licheniformis SB3086w, x | EcoGuard-GN (2013) | Colletotrichum sp., Sclerotinia sp., Rhizoctonia sp., entre otros. | Plantas ornamentales, entre otros. | Novozymes |
| B. thuringiensis var kurstakiy, z | DiPel WG (2007) | Cydia sp., Otiorhychus sp., Spodoptera sp, entre otros. | Frutales, hortalizas, entre otros. | Valent BioSciences |
(qAgraQuest, 2007; rBayer CropScience, 2016; sEPA, 2004; tGalindo et al., 2015; uISAGRO, 2017; vEPA, 2014; wNovozymes, 2017; xEPA, 2013; yValent BioSciences, 2017; zEPA, 2007).
En los últimos años, el mercado de la producción de plaguicidas químicos ha declinado un 2% anual, mientras que la producción de bioplaguicidas presenta un incremento anual del 20% (Cheng et al., 2010). Existen varias razones para el interés creciente por los bioplaguicidas microbianos, las cuales incluyen el limitado desarrollo de resistencia por parte de los organismos patógenos a éstos, una disminución en la tasa de descubrimiento de nuevos insecticidas, una mayor percepción pública de los peligros asociados a los plaguicidas sintéticos, el mayor número de estudios sobre la especificidad de los bioplaguicidas microbianos, mejoras en la producción, la tecnología de formulación y divulgación, así como la interacción con productores e instancias de regulación. De esta manera, los bioplaguicidas representan una pequeña fracción del mercado global enfocados a la protección de cultivos, el 5% (valor aproximado de $3 000.00 millones de USD). Sin embargo, se espera que para el 2023 los bioplaguicidas posean una tasa anual compuesta (CAGR) de, al menos, el 8.64%, estimando un valor de más de $4 500 millones de USD (Olson et al., 2013; Olson, 2015). Cabe mencionar que la transición e integración del uso de bioplaguicidas en las prácticas agrícolas actuales deberá cumplir con los siguientes requisitos: a) efectividad contra la plaga o enfermedad; b) compatibilidad con otros métodos de control; c) impacto ambiental bajo o nulo; d) efecto duradero en el medio; e) economía, desde el punto de vista costo/beneficio; f) factibilidad técnica de su empleo; y g) aceptación por los productores y sociedad en general. Por lo tanto, el uso de bioplaguicidas ofrece una oportunidad para estimular el desarrollo y modernización de las prácticas agrícolas actuales con el objetivo de contribuir a la seguridad alimentaria bajo enfoques de bioseguridad.
Discusión y perspectivas de bioseguridad y biodiversidad en el uso del género Bacillus en los agro-sistemas
Las especies del género Bacillus poseen gran diversidad metabólica y funcional, propiciando su amplio uso en la agricultura. En este sentido, los grupos de Bacillus cereus y Bacillus subtilis son los mayormente utilizados; sin embargo, en términos de bioseguridad éstos deben ser estudiados ampliamente antes de su utilización como agentes de control biológico en el campo. El grupo de Bacillus subtilis que incluye especies de gran importancia en la agricultura como B. subtilis, B. licheniformis y B. pumilus, tradicionalmente no son considerados como patógenos para humanos, incluso a B. subtilis se le ha otorgado el estado de QPS (Qualified Presumption of Safety) por la Autoridad Europea de Seguridad Alimentaria (EFSA, 2015). Sin embargo, existen algunos casos aislados de intoxicaciones por manifestaciones digestivas, es así el reportado por Pavic et al. (2005), señalando a B. subtilis y B. licheniformis como agentes causantes del brote de intoxicación en un jardín de niños, ocasionado por la ingesta de leche en polvo, la cual contenía dichas especies bacterianas. Por otra parte, en el grupo de Bacillus cereus conformado por especies como B. cereus, B. thuringiensis, B. anthracis, B. mycoides, B. seudomycoides, B. cytotoxicus y B. weihenstephanensis, algunas cepas se han identificado como patógenos para humanos (Ceuppens et al., 2013; Kim et al., 2016). Entre éstos, B. cereus se ha identificado en una gran diversidad de alimentos (productos lácticos, vegetales frescos, entre otros), provocando crisis epidemiológicas importantes a nivel mundial, y en algunos casos hasta la muerte, debido a infecciones eméticas y diarreicas (Oh et al., 2012; Kim et al., 2016; Glasset et al., 2016). Además, recientemente, cepas de B. thuringiensis han sido asociados a intoxicaciones por el consumo de alimentos contaminados (Oh et al., 2012).
La virulencia de estas especies se ha asociado principalmente a la presencia de dos toxinas, la hemolisina BL (HBL) y la toxina entérica no hemolítica (NHE), los cuales forman un complejo proteico (Kim et al., 2016). Además, otras toxinas se han identificado en cepas patógenas, incluyendo la citotoxina K (cytK), enterotoxina FM (entFM), enterotoxina S (entS) y enterotoxina T (bceT). En cepas que producen la toxina emética (toxina de alta resistencia a los tratamientos térmicos, valores de pH extremos y la actividad de proteasas), la virulencia se ha relacionado con la presencia del dodeca depsipéptido sintetizado por sintasas de péptidos no ribosomales (NRPS) codificadas por genes ces, encontrándose en plásmidos tipo pXO1. Asimismo, productos de otros genes, como la hemolisina A (hlyA), hemolisina II y III (hlyI, hlyII), cereolisina A y B (cerA, cerB), y el factor transcripción pleitrópico (pclR) están involucrados en la patogenicidad de estas cepas (Ceuppens et al., 2013).
Históricamente, la clasificación y diferenciación de especies en el grupo de Bacillus cereus se ha llevado a cabo utilizando el gen 16S RNAr y otras características como i) virulencia (B. cereus), ii) contenido de plásmidos (B. anthracis y B. thuringiensis), iii) condiciones de crecimiento (B. cytotoxicus y B. weihenstephanensis) y iv) características morfológicas (B. mycoides y B. seudomycoides). Sin embargo, en especies estrechamente relacionadas como B. cereus, B. anthracis y B. thuringiensis, la diferenciación utilizando factores de virulencia y contenido de plásmidos es limitada, debido a su pérdida y transferencia durante la historia evolutiva de estas especies (Hoffmaster et al., 2006; Liu et al., 2015). Recientemente, estudios comparativos con genomas completos mediante dDDH (digital DNA: DNA hybridization), evidenciaron la amplia distribución de genes cry y plásmidos tipo pXO en miembros de este grupo, demostrando la baja correlación que existe entre posición filogenética y la presencia o ausencia de estos plásmidos (Liu et al., 2015). Además, el anterior estudio demostró la baja resolución del análisis multilocus (MLST) para la diferenciación a nivel de especies.
Así, debido a la gran versatilidad metabólica con aplicación agrícola que exhiben miembros del grupo de B. cereus, en especial B. cereus y B. thuringiensis, la correcta identificación y la determinación de su virulencia para el ser humano es determinante para la selección y comercialización de agentes de control biológico de estas especies. Siendo el estudio de genómica comparativa utilizando genomas completos, la única alternativa precisa de clasificar y determinar su virulencia, sin embargo, es importante considerar que son herramientas costosas para la discriminación de cepas patogénicas durante el proceso de selección primario de potenciales agentes de control biológico.
Por otra parte, en los agro-sistemas, el suelo es una matriz dinámica que alberga una gran cantidad (~ 1x109 células/gramo de suelo) y diversidad (1x104 especies/gramo de suelo) de microorganismos (Curtis et al., 2002). Esta microbiota edáfica tienen un papel ecológico muy importante ofreciendo diversos servicios ecosistémicos, por ejemplo: i) la sostenibilidad social y ecológica, ii) adaptación y mitigación del cambio climático, iii) recurso biotecnológico para la humanidad, iv) ciclaje de agua y nutrientes, y v) seguridad alimentaria, principalmente por el ciclaje de nutrientes (van der Heijden et al., 2008), y la promoción del crecimiento vegetal a través de la producción de fitohormonas, solubilización de nutrientes (Hayat et al., 2010) y evitando el establecimiento de agentes fitopatógenos (Compant et al., 2005). De esta manera, el uso de bioplaguicidas ha adquirido gran relevancia en el sector agrícola, ofreciendo una alternativa sostenible enfocada a incrementar la producción de los cultivos. Lo cual, generalmente implica la aplicación de altas poblaciones del microorganismo de interés con el objetivo de potenciar su establecimiento y colonización. Sin embargo, esta práctica puede causar perturbaciones en las comunidades microbianas de los agro-sistemas (Trabelsi et al., 2013), aún más cuando se inoculan agentes de control biológico, ya que generalmente su actividad biológica no es específica o selectiva para el agente fitopatógeno en cuestión, lo cual puede generar cambios impredecibles en la estructura microbiana de dichos agro-sistemas. De esta manera, es importante evaluar el impacto de la inoculación de agentes de control biológico sobre la estructura y composición de las comunidades microbianas en los agro-sistemas, con el objetivo de garantizar el equilibrio ecológico, además del efecto biológico buscado.
Diferentes estudios han demostrado el impacto de la inoculación de cepas con capacidad de control biológico, sobre comunidades microbianas en diferentes cultivos. Por ejemplo, Li et al. (2015) evaluaron el afecto de la cepa B068150 de B. subtilis sobre las comunidades microbianas en la rizósfera de plantas de pepino utilizando la técnica de DGGE (denaturing gradient gel electrophoresis). El estudio se llevó a cabo utilizando tres diferentes tipos de suelo, no encontrando cambios significativos en la diversidad microbiana asociada a la rizósfera de pepino, posterior a la inoculación de la cepa B068150. Por otra parte, You et al. (2016) reportaron que con la inoculación de B. subtilis Tpb55, además de reducir la infección de Phytophthora parasítica, también se observaron cambios significativos en la comunidad microbiana asociada a la rizósfera del cultivo de tabaco, mediante el análisis ANDRA (Amplified ribosomal 16S rDNA restriction analysis), destacando que la abundancia relativa de algunas comunidades fue favorecida, esencialmente en las pertenecientes a los filos dominantes: Acidobacterias y Proteobacterias, en un 2 y 10% de aumento respectivamente respecto al control, sin embargo, reduciendo en al menos un 50% la abundancia relativa de las comunidades correspondientes a Planctomycetes, Nitrospirae, Bacteroidetes y Chloroflexi, las cuales pudiesen estar involucradas en alguna actividad importante para el desarrollo de la planta. De esta manera, cada ACB es un organismo particular que efectúa su acción de forma específica, donde los estudios de cada cepa microbiana seleccionada se deben profundizar, con el objetivo de incrementar el conocimiento sobre la forma de potenciar su control biológico mediante una formulación efectiva, considerando aspectos de riesgo ecológico y la bioseguridad para el agro-sistema.
Conclusiones
El impacto negativo de los plaguicidas químicos en el ambiente se ha documentado ampliamente, tales como: daños a la salud, resistencia a compuestos por los fitopatógenos, contaminación de suelos y mantos acuíferos, surgiendo así la necesidad de desarrollar alternativas sostenibles para proteger a los cultivos agrícolas contra organismos patógenos, por ejemplo, la utilización de agentes de control biológico.
El género Bacillus presenta gran diversidad metabólica involucrada para el control biológico de fitopatógenos, así el sector académico e industrial ha enfocado esfuerzos para la generación de formulaciones comerciales para su aplicación en campo, y en la descripción de los principales mecanismos de acción involucrados en dicho efecto (competencia por espacio y nutrientes, antibiosis, producción de enzimas líticas, secreción de toxinas, induciendo la resistencia del hospedero); sin embargo, es inusual el hecho que un único mecanismo de acción sea utilizado por dicho antagonista para la supresión de fitopatógenos in situ. De esta manera, el conocimiento de los mecanismos por los cuales el antagonista ejerce su acción es determinante tanto para garantizar su efecto como para el desarrollo de formulaciones comerciales, cuyo éxito radica en la creación de microambientes que potencialice su actividad biológica sin estimular el desarrollo del patógeno. Actualmente, diversas formulaciones comerciales cuentan como ingrediente activo cepas del género Bacillus, debido a su capacidad de colonización, fácil reproducción y alta persistencia asociada a la formación de endosporas, siendo esta última una característica de especial interés ya que les permite sobrevivir bajo condiciones de estrés abiótico, facilitando su producción y almacenamiento durante largos periodos de tiempo. Por otra parte, posterior a la inoculación del bioplaguicidas, es posible observar un efecto dual en los cultivos agrícolas por la acción de control biológico, mitigando a fitopatógenos e indirectamente promoviendo el crecimiento vegetal con la mejora de la salud de la planta. Sin embargo, es necesario profundizar en estudios básicos que integren otras estrategias de MIPE (prácticas culturales, control químico), así como en la correcta identificación de cepas patogénicas para el ser humano, por ejemplo, Bacillus cereus y Bacillus anthracis, que incluso son cepas potencialmente eficientes en el control de fitopatógenos. La detección del riesgo potencial de estas especies se puede llevar a cabo mediante estudios de taxonomía, actividad β-hemolítica, detección con marcadores moleculares de virulencia definidos, garantizando el uso de cepas bioseguras en la agricultura. Por otra parte, estudios sobre el impacto ecológico de la introducción de un ACB a los agro-sistemas deben ser desarrollados, ya que bajo ciertas condiciones pudiesen ocasionar cambios en las comunidades microbianas con resultados agro-ecológicamente impredecibles. Finalmente, el éxito del uso de bioplaguicidas dependerá en gran medida de la innovación, investigación, eficiencia, estrategias de marketing y divulgación de resultados entre los productores y las instancias encargadas de la toma de decisiones referentes a la regulación y uso de este tipo de tecnologías.











 texto en
texto en