El papayo (Carica papaya L.) es una planta herbácea tropical nativa de México y Centroamérica, cuyo fruto es comercialmente importante. México es el quinto exportador de papaya a nivel mundial, con una producción de 951,921 toneladas. Colima es el segundo estado con mayor producción de papaya en el país con146, 244 toneladas, tiene una superficie de aproximadamente 1,800 ha sembradas, y ocupa el primer lugar con el 60% de las exportaciones. El cultivo genera alrededor de 1,500 empleos directos y una derrama económica de entre 300 y 400 millones de pesos al año (SIAP, 2016).
Las plagas y enfermedades son factores importantes que afectan la calidad del fruto de papaya para el consumo humano. Los virus que infectan plantas de papayo han causado enfermedades de importancia económica a nivel mundial, representando serios problemas en la reducción de la producción de fruta, e incluso, en la destrucción total de huertos infestados (Navanath et al., 2017). Se han reportado más de 10 virus que afectan este cultivo en todo el mundo, entre estos los más importantes son Papaya leaf distortion mosaic virus (PLD-MV), Papaya lethal yellowing virus (PLYV), Papaya mosaic virus (PapMV), Papaya melaira virus (PMeV) y Papaya ringspot virus (PRSV) (Abreu et al., 2015). Este último virus pertenece a la familia Potyviridae y al género Potyvirus (Fauquet et al., 2005), el cual se transmite por áfidos vectores de manera no persistente y genera síntomas de mosaicos, clorosis, distorsión en las hojas y manchas características en forma de anillo en el fruto, ocasionando pérdidas del 50 al 90% del cultivo y 30 al 40% en postcosecha (Hernández-Castro et al., 2004; Hernández-Castro et al., 2015).
Se ha observado, que la supervivencia del PRSV depende en gran medida de su capacidad para dispersarse a nuevos hospederos, donde las arvenses que se encuentran en los cultivos del papayo pueden fungir como reservorios del mismo. Los aislados de este virus pertenecen principalmente a dos cepas diferentes, denominadas como PRSV-P (papaya) y PRSV-W (watermelon), donde el rango de hospederos de la cepa P se limita a plantas de las familias Caricaceae, Cucurbitaceae y Chenopodiaceae, mientras que los aislados de la cepa W infectan principalmente a plantas de las familias Cucurbitaceae y Chenopodiaceae (Chin et al., 2007; Tripathi et al., 2008).
A nivel internacional, se han desarrollado trabajos encaminados en identificar maleza del cultivo de papayo portadoras de PRSV. En Brasil se efectuó un estudio para evaluar la infección natural de especies de cucurbitáceas localizadas dentro y fuera de cultivos de papayo infectados con PRSV-P utilizando ELISA y RT-PCR (Mansilla et al., 2013). En Florida, se reportó la presencia de PRSV-W en especies vegetales de la familia Cucurbitaceae, afectando los cultivos de pepino, calabaza, melón y sandía; también se detectó como hospedante de maleza, entre las cuales están Momordica balsamina, Melothria pendula y Coccinia grandis (Goyal et al., 2012; Tantiwanich et al., 2014). En el país de Jamaica se determinó mediante DAS-ELSA que M. charantia es una maleza hospedante del PRSV-P (Chin et al., 2007). A pesar de la información reportada en otros países, en México no se tiene una descripción sobre maleza hospedantes del PRSV asociada a cultivos de papayo, considerando que existe cerca de un 30% hasta 100% de incidencia de este virus (Hernández-Castro et al., 2015). El presente trabajo tuvo como objetivo determinar la presencia de PRSV, mediante técnicas serológicas y moleculares, en algunas especies vegetales de maleza hospedantes del virus asociadas a plantaciones comerciales de papayo en Colima, México.
Materiales y métodos
Material vegetal
El muestreo de plantas de papayo y maleza se realizaron en el estado de Colima, México, en el periodo de marzo a septiembre del 2014 en tres plantaciones ubicadas en las localidades de La Cumbre y Los Asmoles del municipio de Colima y Camino a Chanchopa del municipio de Tecomán. Se muestrearon hojas de varias especies de maleza con síntomas virales en general (mal formación de hoja, clorosis, mosaico y hoja corrugada principalmente). También se colectaron hojas de diferentes plantas de papayo con síntomas característicos de PRSV de las mismas plantaciones. Para la identificación de las maleza colectadas a nivel de género y especie, se utilizaron claves dicotómicas de acuerdo a Fryxell, (1988).
Detección serológica de PRSV
La identificación serológica del PRSV de todas las muestras foliares se llevó a cabo mediante DAS-ELISA, se utilizó el kit PhatoScreen® (Agdia). Las muestras se maceraron en amortiguador de extracción y se tomaron 100 µL del extracto crudo. Se depositaron en placas de ELISA junto con controles positivo y negativo suministrados en el kit. Las incubaciones, el conjugado de la enzima-sustrato, así como los lavados correspondientes con las soluciones amortiguadoras se realizaron según indicaciones del fabricante realizando la lectura de los pozos a 405 nm. Se consideró como un resultado positivo el valor de la absorbancia tres veces más alto comparado con la absorbancia del testigo negativo. Cada análisis se realizó por triplicado. A partir de estos datos se realizó un análisis descriptivo para determinar los porcentajes de muestras positivas a PRSV.
Extracción y purificación de RNA
Para la extracción de RNA viral de PRSV, se pesaron 0.5 g de hojas y se pulverizaron con nitrógeno líquido. Se tomaron 50 mg e inmediatamente se adicionaron 500 μL de TRIZOL® (LifeTechnologies™). La mezcla se homogeneizó y se incubó por 5 min a temperatura ambiente. Se centrifugó a 12,000 rpm durante 10 min a 4 °C y la fase acuosa se transfirió a un tubo nuevo y se agregaron 100 µL de cloroformo, se agitó vigorosamente y se incubó a temperatura ambiente durante tres min. Esta mezcla se centrifugó a 12,000 rpm durante 15 min a 4 °C. Se recuperó la fase acuosa y se adicionaron 250 µL de alcohol isopropílico frío y se centrifugó a 12,000 rpm por 10 min a 4 °C. La pastilla obtenida se lavó en 500 µL de etanol al 75%; se secó a temperatura ambiente y se resuspendió en agua libre de RNAasa tratada con dietilpirocarbonato. La concentración y pureza del RNA se verificó en un espectrofotómetro NanoDrop mediante la relación de absorbancias a 260 y 280 nm; mientras que la integridad del mismo se corroboró mediante electroforesis en gel de agarosa al 1% con amortiguador borato de sodio 10 mM, teñido con bromuro de etidio.
Detección de Potyvirus mediante reverso-transcripción de la reacción en cadena de la polimerasa (RT-PCR)
La reverso transcripción (RT) del RNA se realizó utilizando el kit “GoScript™ Reverse Transcription System” (Promega A5001. Madison, WI. USA). El RNA fue desnaturalizado a 70 °C durante 10 min mientras se preparó la mezcla de reacción RT que contenía 2 µL de MgCl2 25 mM, 1 µL de amortiguador RT 10X, 1 µL de dNTPs 10 mM, 0.25 µL de inhibidor de ribonucleasa (RNasin recombinante), 8 U de transcriptasa reversa AMV (0.32 µL), oligonucleótidos al azar 0.25 µg (0.5 µL) y 5 µL de RNA total (5 ng). La mezcla anterior se incubó a temperatura ambiente 10 min y luego a 48 °C durante 45 min. Inmediatamente después se incubó a 94 °C durante 2 min y finalmente a 5 °C. El DNAc fue amplificado por PCR empleando oligonucleótidos universales para Potyvirus descritos por Zheng et al. (2010). La mezcla final de reacción para la PCR se realizó en un volumen de 25 µL, la cual consistió de 17.5 µL de agua MQ, 2.5 µL de buffer Taq polimerasa 10X, 1 µL de MgCl2 50 mM, 0.5 µL de dNTPs 10 mM, 1 µL de cada oligonucleótido NIb2F (GTI TGY GTI GAY GAY TTY AAY AA) y NIb3R (TCI ACI ACI GTI GAI GGY TGN CC), 0.5 µL de Taq DNA polimerasa (5U/µL) (Invitrogen) y 1 µL de DNAc. La mezcla de reacción se incubó en un termociclador con el siguiente programa: desnaturalización de 95 °C por 3 min; seguido de 35 ciclos de desnaturalización a 95 °C por 45 seg, alineamiento a 45 °C por 45 seg, extensión a 72 °C por 45 seg y una extensión final a 72 °C por 5 min; al término, se mantuvo la temperatura a 4 °C. 12.5 µL del producto de PCR se corrieron por electroforesis en gel de agarosa al 1% con buffer SB (borato de sodio, 10 mM) a 100 V. Finalmente, los productos de la amplificación se tiñeron con bromuro de etidio y se visualizaron en un transiluminador con luz UV.
Clonación de productos de PCR
Los productos de PCR fueron purificados empleando el kit “PCR Clean-up” (Lamda Biotech), mientras que aquellos que mostraron más de una banda amplificada, se purificaron a partir del gel de agarosa con el kit “Rapid Gel Extraction System” (Marligen). Posteriormente, los fragmentos purificados se clonaron en el vector comercial “pGEM-T Easy” (Promega), y se introdujeron en células competentes de E. coli JM109 (Promega) de acuerdo a la metodología descrita por Riley et al. (2008).
Secuenciación y análisis de las secuencias
La extracción del DNA plasmídico se realizó empelando el kit “Pure Link® Quick Plasmid Miniprep” (Invitrogen) y el plásmido fue secuenciado en un equipo ABI PRISM 310 Genetic Analyzer por el método de terminación con el Big Dye de Applied Biosystems. El análisis bioinformático se realizó con el programa CLC Genomics Workbench versión 4; y se comparó la similitud de las secuencias obtenidas contra las reportadas para PRSV en la base de datos de NCBI empleando la herramienta “Basic Local Alignment Searh Tool” (BLAST) para determinar el origen de los aislados.
Resultados y discusión
Identificación de maleza y hospederos alternos para PRSV
La maleza de tipo pasto fue identificada a nivel de género como Eragrosis spp. Otro grupo de plantas arvenses se identificaron dentro del género Herissantia spp., en este estudio todas las especies de maleza que dieron positivo al PRSV fueron identificadas con base a su morfología y el uso de los descriptores según Fryxell, (1988). Las plantaciones de papayo presentaron diferente fenología y labores culturales en el control de maleza (Figura 1). Los cultivos de papayo de La Cumbre y Chanchopa se encontraron en plena cosecha de frutos y tenían 13 y 12 meses de edad, respectivamente. En la cumbre, se encontraron varias plantaciones de papayo con diferentes edades; las muestras de maleza se colectaron en una plantación del cultivo en desarrollo vegetativo con un mes de edad. Las plantaciones de La Cumbre y Chanchopa, presentaron un manejo adecuado de la maleza, mientras que el sitio Los Asmoles no tuvo labores de manejo en este sentido, por lo que presentó una gran cantidad y diversidad de especies arvenses. Lo anterior representa un foco de infección para los fitopatógenos, ya que en cultivos abandonados o con nulo manejo de maleza son más recurrentes las infecciones virales mixtas (Bermúdez-Guzmán et al., 2016). En algunos casos la presencia de maleza es intercalada en el cultivo a manera de cultivos trampa, sin embargo será de gran importancia identificar que estos no sean hospederos de virus y funcionen como atrayentes de posibles vectores como los áfidos que contribuye a la rápida propagación del virus (Kalleshwaraswamy y Kumar, 2008). En general, las plantas de papayo que se muestrearon, presentaron síntomas de mosaico y deformación de hojas, manchas aceitosas en tallos y manchas anulares en frutos, todos ellos característicos del PRSV (Figura 1). Estos síntomas observados en campo son similares a los reportados en plantas de papayo en varios estados de México y otros países como Hawaii, Florida, Taiwan y Tailandia, entre otros (Noa-Carranza et al., 2006; Tripathi et al., 2008).

Figura 1 A) Síntomas de PRSV en plantación de papayo mostrando la abundancia de maleza intercalada, B) Plantación con control total de maleza, C) Hojas distorsionadas de papaya con síntomas de clorosis y mosaico, D) Frutos con anillos característicos de PRSV.
Recientemente, Martins et al. (2016), colectaron en Brasil áfidos vectores presentes en 22 especies arvenses de plantaciones de papayo, la mayoría pertenecientes a las familias Euphorbiaceae, Commelinaceae, Brassicaceae y Malvaceae, también se identificó una Solanaceae: Solanum americanum. Chin et al. (2007) reportaron a Momordica charantia como portadora de PRSV-P, sin embargo, Spadotti et al. (2013) determinaron que ésta especie no es susceptible a ninguna de las cepas de PRSV (P y W), tras evaluar su inoculación mecánica y mediante áfidos vectores en la especie antes mencionada. En este estudio se encontró un ejemplar de M. charantia proveniente de Los Asmoles, el cual tuvo una apariencia sana y presentó un resultado negativo a PRSV por DAS-ELISA y RT-PCR, sin embargo, resulta conveniente analizar en un futuro un mayor número de muestras de esta especie para determinar si puede actuar como reservorio del virus.
La expresión de la diversidad de síntomas virales en maleza asociada al cultivo del papayo en tres localidades de Colima se muestra en la Figura 2. Las muestras de maleza que presentaron síntomas representa un 72.6% del total muestreado, exceptuando las especies de Eragrosis spp. y Herissantia spp. Se observaron mosaicos en plantas identificadas como abutilón (Abutilon abutilastrum), violeta de campo (Anoda cristata) y mala mujer (Solanum rostratum). Esta última especie también presentó distorsión de la hoja y clorosis, al igual que la calabacilla (Cucurbita pepo), cuya deformación de hoja fue muy severa. Por otra parte, se encontró un ejemplar asintomático de Momordica charantia en la localidad de Los Asmoles, la cual está reportada como hospedera de varios virus, mientras que C. pepo, S. rostratum y A. cristata son susceptibles a 62, 8 y 1 virus, respectivamente, así como para el género Abutilon se reportan cinco fitopatógenos virales (Brunt et al., 1996). Esta condición en que la maleza sirve como reservorio de una gran cantidad de virus ocasiona frecuentemente que los síntomas observados sean producto de la expresión sinérgica de infecciones virales mixtas (Zhang et al., 2001; Hii et al., 2002; Gastélum et al., 2007; Bermúdez-Guzmán et al., 2016).
Detección de PRSV
La detección de PRSV mediante DAS-ELISA y RT-PCR en plantas de C. papaya y maleza asociada al cultivo procedentes de tres localidades de Colima son mostrados en el Cuadro 1. De las 139 muestras colectadas se analizaron por DAS-ELISA 57 de ellas, provenientes de la localidad de La Cumbre, y resultaron positivas para PRSV C. papaya y C. pepo. Lo anterior puede atribuirse a que las muestras analizadas no alcanzaron la concentración mínima viral, ya que está reportado que la técnica de DAS-ELISA no detecta virus en plantas si su concentración es menor de 0.1 ng de virus por mL (Salazar, 1996). En el presente estudio se reportó hasta un 50% de muestras positivas por DAS-ELISA; porcentaje significativamente elevado a diferencia del obtenido por Hernández de la Cruz et al. (2007) quienes detectaron el 2.43% de PVYNTN en tubérculos de papa por DAS-ELISA.
Cuadro 1 Detección por métodos serológicos y moleculares de PRSV en maleza asociada al cultivo de papayo en tres localidades de Colima, México.
| Positivas a PRSV (%) | |||||
| Localidad | Muestras colectadas |
Especie | Familia | DAS-ELISA | RT-PCR |
| La Cumbre | 57 | C. papaya | Caricaceae | 40 | 40 |
| A. cristata | Malvaceae | 0 | 21 | ||
| C. pepo | Cucurbitaceae | 50 | 54 | ||
| Eragrosis spp. | Poaceae | 0 | 0 | ||
| S. rostratum | Solanaceae | 0 | 18 | ||
| Los Asmoles | 35 | C. papaya | Caricaceae | 40 | 90 |
| A. abutilastrum | Malvaceae | 0 | 28 | ||
| C. pepo | Cucurbitaceae | 50 | 80 | ||
| M. charantia | Cucurbitaceae | 0 | 0 | ||
| S. rostratum | Solanaceae | 20 | 33 | ||
| Chanchopa | 47 | C. papaya | Caricaceae | 40 | 75 |
| C. pepo | Cucurbitaceae | 0 | 0 | ||
| Herissantia spp. | Malvaceae | 0 | 0 | ||
El análisis de BLASTn de 13 secuencias generadas en el presente trabajo correspondientes a la región NIb de PRSV permitió identificar por primera vez a A. abutilastrum, A. cristata y S. rostratum como nuevas especies hospedantes naturales de PRSV. Además, también se incluyeron secuencias aisladas de C. papaya y C. pepo, aunque estas ya están ampliamente reportadas como hospederas de PRSV (Noa-Carranza et al., 2006; Sreenivasulu y Sai-Gopal, 2010; Goyal et al., 2012; Mansilla et al., 2013). La filogenia (Figura 3) permitió identificar tres grupos de secuencias similares. Se observa una clara agrupación de acuerdo a la zona de plantación, en las que se observó la muestra 11 y 12 correspondiente a C. pepo y A. abutilastrum respectivamente fue la misma que la encontrada en C. papaya correspondiente a la secuencia 9 y 8 perteneciente a Los Asmoles. Este hallazgo confirma de manera clara que la maleza aporta el mismo virus a las plantas de papayo. Otra observación importante fue la diversidad en secuencias que se encontraron para la zona de Colima que diferencia claramente con otros aislados incluso con el reportado para Veracruz (AY231130) con un 92% de homología. Esta diversidad en aislados de PRSV se ha observado para regiones de China, debido a la alta tasa de mutación del virus (Zhao et al., 2016), lo que complica las estrategias de control para este virus. Como era de esperarse, otros Potyvirus como: Japanese yam mosaic potyvirus (JYMV), Potato virus Y (PVY), Bean yellow mosaic virus (BYMV), Tobacco vein banding mosaic virus (TVBMV) fueron los más alejados en el dendrograma con un porcentaje de identidad en la secuencia del 70 al 73%.
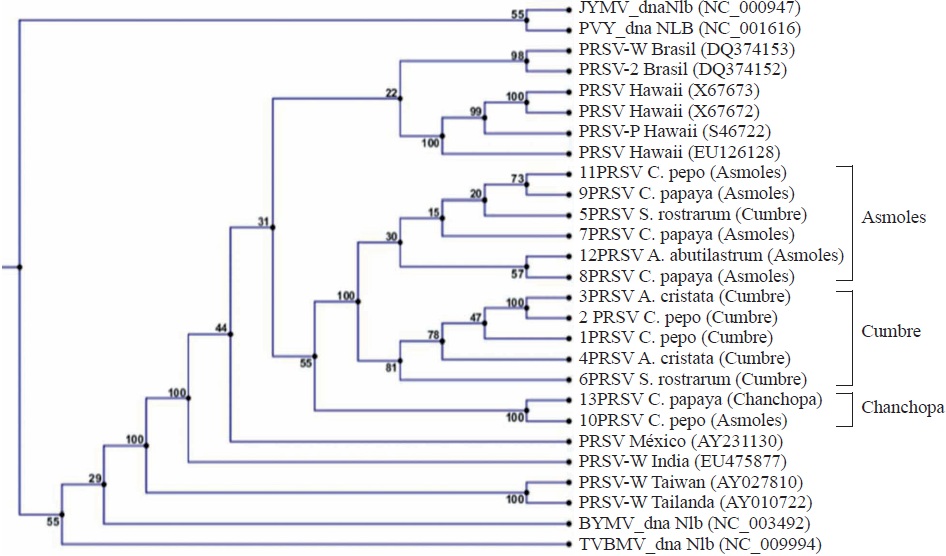
Figura 3 Filogenia generada a partir de la similitud de secuencias de la región NIb del genoma de Papaya ringspot virus (PRSV) de aislados de Colima, México (1-13) comparadas con aislamientos de Brasil, Hawái, India, Taiwan,Tailandia y otros Potivirus: Japanese yam mosaic potyvirus (JYMV), Potato virus Y (PVY), Bean yellow mosaic virus (BYMV), Tobacco vein banding mosaic virus (TVBMV).
El 28.15% plantas de papayo analizadas en este estudio presentaron sintomatología viral, pero resultaron negativas a PRSV mediante RT-PCR. Lo anterior puede deberse a que C. papaya, es susceptible a más de ocho virus fitopatógenos entre los que destacan Papaya apical necrosis virus (PANV), Papaya lethal yellowing virus (PLYV), Papaya Mosaic Virus (PMV), Papaya leaf distortion mosaic virus (PLDMV), entre otros (Lastra y Quintero, 1981; Brunt et al., 1996), por lo que muy probablemente el síntoma viral presentado, podría corresponder a la infección por alguno de estos virus.
Conclusiones
La técnica de DAS-ELISA permitió la detección del Papaya ringspot virus (PRSV) en C. papaya y alguna maleza presente en el cultivo sin embargo se subestimo el número de muestras positivas al comparar con la técnica de RT-PCR. La técnica molecular de RT-PCR permitió identificar la presencia de PRSV en las especies de arvenses asociadas al cultivo de papayo como A. abutilastrum, A. cristata, C. pepo y S. rostratum. No se detectó la presencia de PRSV en M. charantia. El presente trabajo reporta por primera vez a A. abutilastrum y A. cristata pertenecientes a la familia Malvaceae y S. rostratum de la familia Solanaceae como especies arvenses hospederas de PRSV.











 text in
text in 



