Lilium es un cultivo ornamental de gran importancia en el mercado mundial y ocupa el décimo primer lugar en demanda y el segundo lugar en plantas bulbosas en México (Gómez, 2009), lo anterior se atribuye principalmente a la diversidad de colores que se han logrado a través de la hibridación entre especies asiáticas y orientales; y la disponibilidad de la flor en prácticamente todo el año, gracias a los sistemas intensivos de producción (Álvarez et al., 2008). Estas prácticas son las que conducen a los horticultores a implementar programas de control de plagas y enfermedades qué si bien no se erradican, logran reducir las altas tasas de crecimiento de patógenos. Sin embargo, no consideran las consecuencias de utilizar indiscriminadamente fertilizantes o plaguicidas de naturaleza química que repercuten directamente en el suelo, aire y agua (Ortega et al., 2006). Por lo que es conveniente la implementación oportuna de programas de control de patógenos por medio de alternativas amigables con el medio ambiente, que además de reducir los costos, son una alternativa para evitar la contaminación por el uso de agentes químicos que además inducen la resistencia en el microorganismo (Keng et al., 2010; Bhromsiri y Bhromsiri, 2010). Tal es el caso del uso de extractos vegetales, aceites esenciales, extractos orgánicos y enzimáticos que dan la apertura al biocontrol de patógenos en la agricultura intensiva ya que han demostrado efectividad ante el crecimiento de bacterias, nematodos y hongos fitopatógenos aislados de una amplia diversidad de cultivos (Rodríguez et al., 2012; Alcalá de Marcano et al., 2005; Chávez y Aquino, 2012; Vinueza et al., 2006). En el caso específico de Lilium, los bulbos se desechan después de terminar el cultivo, por lo que una forma de reutilizarlos pudiera ser la extracción de compuestos activos en el control del hongo Fusarium oxysporum ya que la micosis que produce causa pérdida de turgencia de tejidos y la pudrición de frutos, de cuello o raíces de la planta, infecciones menores y posteriormente la muerte del huésped, estos son problemas a los que se enfrentan los productores año con año.
El objetivo del trabajo fue determinar la actividad antifúngica de extractos de bulbos de Lilium que se obtuvieron después de la cosecha de la flor como una medida para reutilizar un órgano considerado residuo al término de la producción, que no cuenta con un manejo adecuado además de representar una fuente potencial de contaminación. La cepa que se utilizó fue Fusarium oxysporum conservada en glicerol y agar nutritivo, la cual se aisló de suelos destinados a cultivos experimentales por el Departamento de Parasitología de la Universidad Autónoma Chapingo. Los bulbos de Lilium se obtuvieron de un único lote de importación de la empresa “Van den Bos Flowerbulbs B.V” provenientes de Dijkweg, Honselersddijk, Holanda. El lote estaba conformado por 300 piezas de bulbos calibre 14/16 del género Lilium híbridos L/A de la variedad “Indian summer”. Los bulbos se lavaron primero con agua de la llave para retirar impurezas y septos dañados, después con agua destilada, posteriormente se desinfectaron con hipoclorito de sodio al 1.5 % durante 5 min. Al finalizar se enjuagó en agua desionizada. Se pesó 50 g de bulbos y se maceraron con un mínimo de agua desionizada (5 mL) en un mortero desinfectado. El extracto obtenido se filtró en un paño de algodón y después con papel filtro (Papel Whatman®) esto se repitió tres veces. Los extractos filtrados se colocaron en viales estériles y se mantuvieron a 4 °C hasta su empleo. Para llevar a cabo la caracterización morfológica, Fusarium oxysporum se sembró en caja Petri con agar-papa-dextrosa (PDA) de acuerdo a BD Bioxon®. Cada colonia desarrollada se aisló y purificó por el método punta de hifa. Considerando 10 unidades de muestreo (10 cajas Petri con cultivos axénicos) se realizó la caracterización morfológica macroscópica y las preparaciones permanentes para observar al microscopio. Se identificaron las estructuras típicas y se midió el largo y ancho de las mismas en cada unidad. Se confirmó el género con base en las claves de Barnett y Hunter (1998). Las condiciones de incubación del extracto fueron las siguientes: Una vez obtenido el extracto vegetal crudo (EVC), se procedió al fraccionamiento por afinidad en la polaridad de compuestos analizados por cromatografía de capa fina (CCP) en el cual se emplearon placas de silica gel GF 254 de 0.25 mm de espesor y se corrieron en los eluyentes hexano 100 %, acetato de etilo 100 % y etanol 100 % Posteriormente al definir los eluyentes para el fraccionamiento de los extractos vegetales se obtuvo el extracto no polar (ENP) con hexano al 100 % en una relación 1:1, el extracto medianamente polar (EMP) se obtuvo con el eluyente acetato de etilo al 100 % en una relación 1:1 y el extracto polar (EVP) se obtuvo con etanol al 100 % en una relación 1:1.
La identificación molecular inició con la extracción de ADN la cual se realizó a partir de 30 a 50 mg de micelio. El procedimiento se repitió a partir de 3 muestras del hongo con los olígos ITS-1 5’-tccgtaggtgaacctgcgg-3’ y ITS-4 5’-tcctccgcttattgatatgc-3’ (White et al., 1990); los cuales amplifican un espaciador intergénico interno (ITS) y generan un producto de talla variable de aproximadamente 800 a 1200 pares de bases (pb). Esta práctica se realizó con una mezcla de reacción en un volumen final de 25µL, cuyos componentes finales fueron: amortiguador de reacción 1X, MgCl2 2mM, dNTP’s, 200 nM de cada uno, 20 pmoles de cada oligonucleótido y 1 unidad de Taq DNA polimerasa. El programa térmico consiste en mantener 2 min a 94 °C, 30 seg a 55 °C y 1 min a 72 °C (35 ciclos). Los productos de la reacción de PCR fueron separados por electroforesis en geles de agarosa al 1.5 %, y las bandas se observaron en un transiluminador de luz ultravioleta marca UVP y se tomaron fotografías. Los fragmentos amplificados fueron secuenciados directamente y los resultados se compararon con las secuencias del banco de genes (GenBank) del Centro Nacional de Información Biotecnológica (NCBI).
En las pruebas de patogenicidad, se utilizaron 7 escamas de bulbos de Lilium hibrido L/A “Indian summer” que se desinfectaron con hipoclorito de sodio al 1.5 % por 5 min. y posteriormente se enjuagaron con agua desionizada. Se consideró cada escama como unidad experimental en un arreglo completamente al azar. La cepa previamente aislada se cultivó en medio PDA durante 8 días para el incremento de inóculo, después se preparó una suspensión de conidias en agua destilada estéril; la cual se ajustó a una concentración de 80x103 propágulos·mL-1 como lo indican Díaz et al. (2014), se asperjaron las escamas de Lilium con un volumen aproximado de 2 mL de la suspensión de esporas. Como testigo se utilizó una escama que solo se enjuagó con agua desionizada. Las 7 unidades experimentales se colocaron en cajas Petri de vidrio previamente estériles y se incubaron a 26 °C ± 2 °C. Los síntomas se registraron diariamente por 15 días. De las zonas afectadas por invasión micelial se tomó tejido el cual se desinfectó con hipoclorito de sodio al 1.5 % durante 2 min. y se enjuagó 2 veces con agua desionizada. Después se sembraron en cajas Petri con medio PDA. La concentración del extracto vegetal en el medio fue al 30 %, tiempo de incubación: 23 d, temperatura incubación: 25 °C +/- 1.
Las características morfológicas macroscópicas (color, forma y propagación de colonia) y microscópicas (hifa, esclerocio, conidia, métula, fiálide, etc.) se compararon con las originalmente inoculadas, para comprobar los postulados de Koch. Para la realización de los bioensayos de repelencia (antibiogramas), previamente se adicionaron 20 mL de extracto vegetal a analizar con 100 mL de PDA para su esterilización, posteriormente se distribuyó en cajas Petri de 100 X 155 mm de diámetro (Araujo et al., 2007). Cuando el medio de cultivo se solidificó se hicieron las siembras en el centro de cada placa, con una muestra de 5x5 mm con F. oxysporum el cual se reactivó previamente en medio líquido (caldo nutritivo) por 48 h. y se transfirió a medio sólido (PDA) por las 48 h. siguientes. El crecimiento micelial se midió cada 24 h en los cuatro sentidos del cuadrante de la caja de Petri y se reportó el diámetro del halo de inhibición en mm hasta que la caja Petri del testigo (sin extracto vegetal) presentó un crecimiento completo. A los datos se les realizó un análisis de varianza (ANAVA). De igual forma se efectuó una prueba de comparación de medias utilizando el método Tukey con nivel de significancia al 5 %. Todos los análisis estadísticos se llevaron a cabo con el software Statistical Analysis System.
Las colonias aisladas de Fusarium oxysporum presentaron en su morfología macroscópica, durante las primeras 72 h una coloración blanquecina y una conformación algodonosa (Figura 1a) que inició en el punto de siembra y se extendió conforme a la propagación de nuevas hifas. Después de las 144 h se observó una coloración de rosa a purpura siendo mayormente intensa al inicio del crecimiento (Figura 1b) y más tenue hacia los bordes con un color lila-rosado. La pigmentación púrpura -obscuro se observó uniforme después de 312 h (Figura 1c y 1d). La cepa madura presentó hifas ramificadas de 3 - 4.5µm de diámetro, fiálides cortas simples, Microconidias cilíndricas abundantes y Macroconidias delgadas con una célula apical ligeramente curva (Figura 1d).
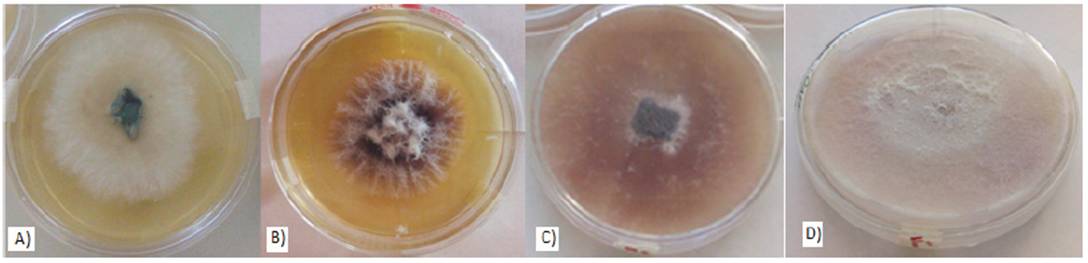
Figura 1 Morfología del crecimiento micelial de Fusarium oxysporum A) 72 h, B) 144 h, C) 240 h y D) 312 h.
En la caracterización molecular, el aislamiento identificado como Fusarium tuvo una talla de 1040 pb que concuerda con la talla esperada para la especie. La secuencia obtenida tuvo un 99 % de similitud con la región ITS, cuya alineación coincidió con F. oxysporum CM000589.1
La prueba de patogenicidad confirmó la capacidad de la cepa disponible para generar la sintomatología típica de una fusariosis en septos de bulbos de Lilium híbridos L/A. Después de 96 h se observaron las primeras señales de la infección sobre el tejido meristemático del septo en forma de manchas amarillentas-pardas (Figura 2). Después de 144 h el área dañada presentaba tejido degradado y de estas zonas se tomó una alícuota para resembrar en caja Petri, confirmando la presencia de Fusarium oxysporum de acuerdo a los postulados de Koch.
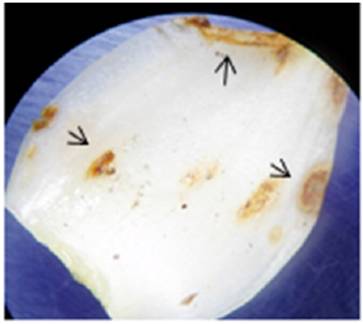
Figura 2 Septo de Lilium L/A después de 96 h bajo infección inducida por cultivo axénico de Fusarium oxysporum. Las flechas señalan las afectaciones al tejido.
En el caso de los bioensayos de inhibición, el efecto de los extractos vegetales sobre el crecimiento micelial de Fusarium sp. in vitro se puede observar en el Cuadro 1.
Cuadro 1 Comparación de medias del crecimiento micelial de Fusarium oxysporum en diferentes medios adicionados con extractos vegetales al 30 %.
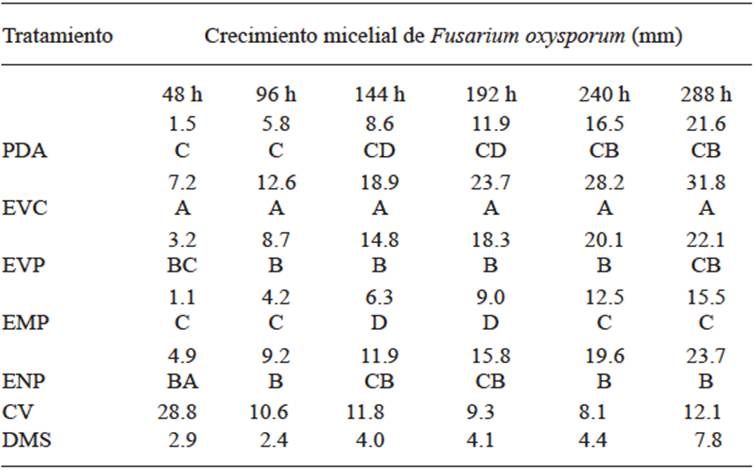
*Las medias con letras diferentes en cada columna, indican diferencia significativa al 5 % de probabilidad.
Existe diferencia estadística significativa entre los tratamientos, siendo el extracto vegetal crudo (EVC) el tratamiento estadísticamente superior a las 48 h con un incremento del 79 % sobre el tratamiento PDA, actuando como potencializador del crecimiento micelial. En el caso del extracto medianamente polar (EMP) se presentó diferencia estadística inferior al testigo con un decremento del 27 % presentando un efecto inhibitorio bajo. A las 96 h el EVC disminuyó la proporción de crecimiento micelial, sin embargo, se mantuvo como el tratamiento que presentó diferencia superior estadística con un incremento del 54 % sobre el testigo. Por otra parte, el EMP presentó diferencia estadística inferior, con una disminución del 28 % sobre el crecimiento micelial del testigo siendo mayor a la presentada a las 48 h y aumentando su efecto inhibitorio. A las 144 h el EVC es estadísticamente superior, con un aumento del 67 % al testigo recuperando su efecto promotor del crecimiento mostrado 48 h antes. Sin embargo, el EMP es inferior estadísticamente, 27 % menos sobre el crecimiento micelial del testigo manteniendo su actividad inhibitoria en el mismo. A las 192 h el EVC se mantuvo como el tratamiento estadísticamente superior siendo diferente al testigo con un incremento del 50 %. Cabe señalar que la actividad promotora del crecimiento se ve reducida, mientras que el efecto inhibitorio del tratamiento EMP se mantiene constante, siendo el que presenta diferencia estadística inferior al tratamiento PDA con una disminución del 26 %. A las 240 h el EVC permanece como el tratamiento superior estadísticamente con una media de crecimiento de 28.167 mm no obstante la diferencia que muestra con respecto al testigo es de 41 % en donde se obtuvo la menor cinética de crecimiento micelial. Por otra parte, el EMP es inferior estadísticamente al testigo en 25 % manteniendo estable su actividad inhibitoria 10 días después de la inoculación. A las 288 h el EVC recupera actividad para promover el crecimiento sin lograr un aumento superior al presentado a las 192 h, presentando diferencia estadística superior con un crecimiento del 51 % con respecto al testigo. En el caso del EMP se observó un aumento en la actividad inhibitoria, siendo estadísticamente diferente al testigo con un aumento del 28 %. Chávez y Aquino. (2012) señalan que el extracto vegetal de pirii (Cyperus spp.) presentó un efecto inhibitorio bajo en Fusarium sp., utilizando concentraciones del 20 %. No obstante, estos autores mencionan que el extracto de ajo inhibió por completo el desarrollo micelial de Fusarium sp., este resultado coincide con lo citado por López et al. (2005), que en concentraciones del 5 y 10 %, el extracto de ajo inhibe el 68.5 y 69.8 % del crecimiento de Fusarium oxysporum f. sp. lycopersici, respectivamente Por lo cual se deduce que a mayor concentración de los extractos vegetales, mayor es el efecto inhibitorio. El extracto vegetal de ortiga (Urtica dioica) presentó un efecto inhibitorio bajo en Fusarium sp., (Chávez y Aquino, 2012), en contraposición a los observado en ensayos con Colletotrichum gloeosporioides, en los cuales se obtuvo 100 % de inhibición de crecimiento con extractos acuoso y alcohólicos de esta planta. Con base en la respuesta favorable del EMP se procedió a la caracterización y determinación de la estructura orgánica del extracto en cromatografía de gases con columna universal, obteniendo el cromatograma mostrado en la Figura 3.
En el extracto vegetal (EMP) se identificó ácido hexadecanoico metil éster (ácido palmítico) y ácido octadecadienoico 9,16 metil éster (Cuadro 2) conocido como omega 6, compuestos conocidos por su capacidad de capturar radicales libres y presentar actividades antiinflamatorias, antialérgicas, antitrombóticas, antimicrobianas y antineoplásicas (Kuskoski et al., 2005).
Cuadro 2 Compuestos obtenidos en los tiempos de retención mostrados en el cromatograma del extracto medianamente polar.
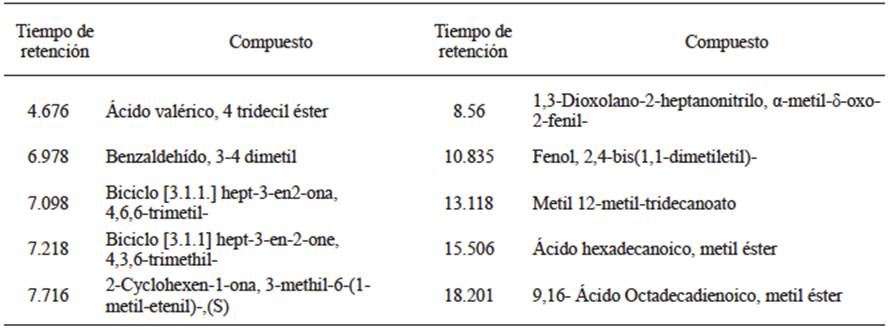
La presencia de los compuestos fenólicos como el 2,4-difenol 1,1-dimetil, etil y 1,3 dioxolano 2 heptanonitrilo α-metil δ-oxo- 2-fenil (precursor del timol e intermediario del carvacrol y eugenol) sugieren la actividad fungicida de los extractos vegetales, la cual es favorecida por la naturaleza ácida de su grupo hidroxilo el cual forma un puente hidrógeno con un sitio activo enzimático (Kalemba y Kunicka, 2003). Por otra parte la biosíntesis de estas moléculas es llevada ya sea de manera constitutiva, patógeno-independiente (fitoanticipinas) o si es inducida como una parte de la respuesta defensiva de las plantas en contra de una infección por bacterias, hongos o nematodos (fitoalexinas) en este grupo se encuentran los flavonoides, las isoflavonas, las auronas y los fenalenones (Tanaka et al., 2002; Kalemba y Kunicka (2003) sugieren que los extractos vegetales y aceites esenciales con fenol como componente principal expresan el más alto espectro de actividad antimicrobiana.
Se confirmó la especie fúngica blanco Fusarium oxysporum con clave de secuencia CM000589.1 del banco de genes del NCBI. Con base a los protocolos de extracción de ADN y PCR. Los compuestos de mayor abundancia en el extracto vegetal medianamente polar (EMP) 3-4 dimetil benzaldehído, 1,3-dioxolano-2-heptanonitrilo, α-metil-δ-oxo-2-fenil y 9,16-ácido octadecanoico, metil éster, han reportado actividad fungicida en cultivos de interés agrícola siendo componentes potenciales para estudios posteriores El extracto vegetal crudo de bulbos de Lilium hibrido L/A “Indian summer” presentó actividad promotora del crecimiento micelial de Fusarium oxysporum. El extracto medianamente polar (EMP) de los bulbos presenta actividad inhibitoria baja y se considera su utilidad como fungistático de Fusarium oxysporum.











 texto en
texto en 



