La familia Caricaceae se divide en seis grupos constituidos por 35 especies, distribuidos ampliamente en el mundo. En África tropical se encuentran dos especies del género Cylicomorpha, en América Central se encuentran los géneros endémicos Horovitzia y Jarilla, además de Jarilla y Vasconcellea que se encuentran en América del Sur (Antunes y Renner, 2014). La especie Carica papaya silvestre se encuentra extendida en bosques tropicales que van de México hasta Costa Rica (Chávez-Pesqueira et al., 2014). La versión hermafrodita de C. papaya cultivada es producto de la domesticación por grupos étnicos de México, presumiblemente los mayas (VanBuren et al., 2015).
Por lo anterior, se considera a los países de América Central y del Sur como centros de diversidad genética y biológica de la papaya e idóneos para la producción comercial del cultivo. Sin embargo, en México la papaya enfrenta varios problemas fitopatológicos de relevancia. Las enfermedades virales, transmitidas por insectos vectores, ocasionan pérdidas hasta del 90% de la plantación; es decir, hay merma en la densidad de plantas (Mora et al., 1992).
En el mundo se reportan, al menos, 12 virus que representan una amenaza para la producción de fruta de papaya: Papaya ringspot virus (PRSV-P), Papaya leaf distortion mosaic virus (PLDMV), Zuchinni yellow mosaic virus (ZYMV), Papaya mosaic virus (PapMV), Papaya leaf curl virus (PaLCV), Chilli leaf curl virus (ChiLCuV), Tomato leaf curl New Delhi virus (ToLCNDV), Croton yellow vein mosaic virus (CYVMV), Papaya droopy necrosis virus (PDNV), Tomato spotted wilt virus (TSWV), Papaya lethal yellowing virus (PLYV) y Papaya meleira virus (PMeV) (Mishra et al., 2015)
De ellos, los de mayor importancia en México son el PRSV-P, PapMV y PMeV, los cuales representan un problema por las pérdidas económicas causadas (Silva-Rosales et al., 2010; Rivas-Valencia et al., 2008). Esto por efecto de reducción del rendimiento de fruta por hectárea, lo cual reduce el ingreso neto por hectárea hasta 275% (Yorobe, 2009). El mayor impacto en la producción de papaya se debe, principalmente, a que ninguna de las variedades comerciales presenta resistencia genética al PRSV-P y al PMeV (Abreu et al., 2014; Singh et al., 2005); sin embargo, se ha reportado que algunas variedades no comerciales presentan bajos niveles de susceptibilidad (Rodríguez et al., 2013).
El PRSV-P es uno de los virus que provoca mayor daño en la productividad de papaya, que alcanza valores superiores al 70% (Tennant et al., 2007); en contraste, los efectos del PapMV no son tan agresivos. De forma natural la papaya hospeda ambos virus al mismo tiempo (Noa-Carranza et al., 2006), por lo cual pueden presentarse dos eventos: 1) Sinergismo, infección primaria por el PRSV-P y posteriormente la infección del virus PapMV, 2) Antagonismo, que se desarrolla con la primera infección de PapMV y posteriormente por PRSV-P, lo que sugiere que PapMV activa la respuesta de defensa en cascada en la planta infectada (Chávez-Calvillo et al., 2016).
Una de las alternativas para generar resistencia genética al virus PRSV-P es la transformación genética de embriones somáticos obtenidos in vitro, o de algún otro explante, por medio de Agrobacterium (cepa C58-Z707) o con el bombeo de partículas. El gen transferido a la papaya es el que codifica la proteína de la cápside de un aislamiento viral determinado; sin embargo, si el transgen es construido con la secuencia de un virus local, entonces se genera una probabilidad relativamente alta de que las plantas transgénicas no sean resistentes a los virus de otro origen geográfico (Mishra et al., 2015). Actualmente están disponibles en el mercado internacional dos variedades transgénicas (Rainbow y SunUp) de frutos del morfotipo Solo (Mishra et al., 2015), las cuales se caracterizan por ser de fruto pequeño con peso de 300 a 600 g, y fueron modificadas utilizando el gen del PRSV-P cepa HA 5-1 originaria de Hawaii (Gonsalves, 2006).
Como otra alternativa, se han evaluado 31 variedades de C. papaya (acervo genético primario) en búsqueda de resistencia genética, pero solo se ha identificado tolerancia en la variedad Califlora (Roff, 2007). Por tal razón se ha identificado la resistencia genética al PRSV-P, en la especie Vasconcellea cauliflora (acervo genético secundario) para posteriormente introducirla (introgresión) a los materiales del C. papaya, mediante técnicas de mejoramiento convencionales (Yanthan et al., 2017).
Toda vez que en México está prohibido el establecimiento de papaya transgénica (NOM-056-FITO-1995), la presente revisión aborda el avance del conocimiento en la introgresión de la resistencia genética a virus PRSV-P, a partir de algunas especies del genero Vasconcellea, mediante su recombinación con C. papaya, como alternativa para generar resistencia genética.
Diversidad genética viral
El PRSV pertenece al género Potyvirus, familia Potyviridae. Estos virus son transmitidos por semilla, de forma mecánica y por más de 25 especies de áfidos de forma no persistente, lo que constituye una característica distintiva del grupo. Existen dos biotipos: el “P” que infecta a la papaya y el “W” que ataca a cucurbitáceas como la sandía (Citrullus lanatus) y a las variedades del Melón (Cucumis melon) (Tripathi et al., 2008).
La variabilidad genética del PRSV-P es tan amplia como la diversidad de los nichos ecológicos en donde se cultiva la papaya. De acuerdo con Bateson et al. (2002), existe variabilidad en la secuencia nucleotídica del 12% entre regiones geográficas, tales como Asia, Australia y América del Norte. Además, se ha propuesto que Asia es su centro de origen y de ahí se propagó al resto del mundo.
En México, el primer informe de la presencia del PRSV-P fue registrado en Veracruz en 1964. Actualmente se reportan cinco grupos genéticos que se distribuyen en la costa del Pacifico, la costa del Golfo, regiones de Cotaxtla (Veracruz), la península de Yucatán y la costa occidental del Pacifico (Noa-Carranza et al., 2006). Dentro de esa diversidad, dos aislamientos de Veracruz y una de Chiapas están fuertemente correlacionadas con aislamientos de América del Norte y Australia; a la vez, todos estos aislamientos son genéticamente diferentes a los de China, Taiwán, Vietnam e India (Silva-Rosales et al., 2000).
Se han secuenciado 22 genomas completos del PRSV-P procedentes de varios países, y los análisis filogenéticos revelan que los aislamientos se agrupan en función de su país de origen; de esta forma Taiwán, China, Tailandia e India integran un grupo, y un segundo grupo se conforma por los aislamientos del continente americano (Brasil, México, Estados Unidos) (Mishra et al., 2015). En contraposición, los análisis de nucleótidos de los genes de proteína de la cápside de muestras virales colectadas en Cuba (7 muestras) y Brasil (21 muestras), indicaron que la distancia genética entre ellas varió de 0% a 9.2%. Los análisis dentro de cada país indicaron la formación de subgrupos genéticos en función de la región geográfica de colecta; es decir, la similitud genética es mayor entre aislamientos procedentes de regiones vecinas. No obstante, al incluir información genética del GenBank de virus de otros países se determinaron dos grupos, con una similitud genética máxima de 86%; el primero lo conformaron virus de India, Hawaii, México, Venezuela, Cuba y Brasil. El segundo grupo incluyó a los virus de China, Taiwán, Tailandia, Corea del sur y Malasia (Rodríguez et al., 2014).
El virus del mosaico de la papaya (PapMV) es miembro del género Potexvirus y de la familia Alfaflexiviridae (Mishra et al., 2016). El primer reporte de su presencia en México fue en 2001 (Noa-Carranza et al., 2006). Al comparar la proteína de la cubierta de las cepas de Canadá con las cepas de China la similitud es del 98% (Sit et al., 1989); sin embargo, al comparar cepas provenientes de China con las de México la similitud ha sido del 73% (Tennant et al., 2007), mientras que en México las cepas de ese virus presentan similitud mayor al 91% (Noa-Carranza et al., 2006).
En forma general, se percibe que la variabilidad genética de los virus PRSV-P y PapMV, dan lugar a la necesidad de usar los aislamientos de cada región para eventos de transformación genética, generación de virus atenuados o desarrollo de esquemas de selección convencional de materiales genéticos de papaya por tolerancia a la virosis. Ambos están presentes en las diversas regiones ecológicas de México (Figura 1).
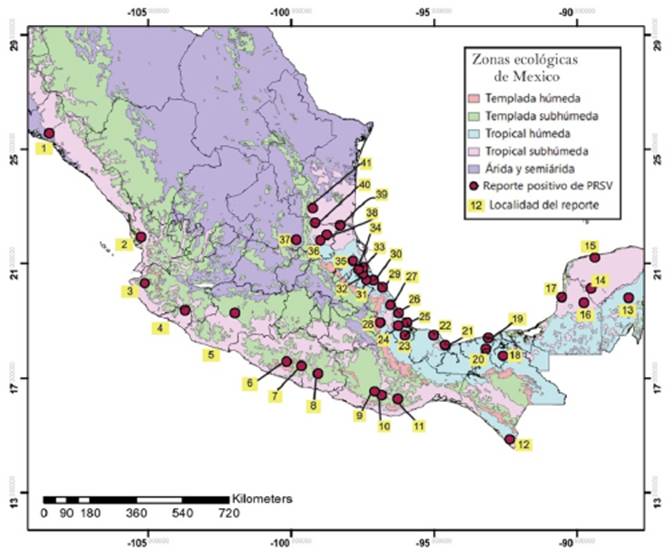
Figura 1 Distribución de los virus PRSV y PapMV en México. Elaboración propia de acuerdo al estudio de plantas con virosis, en 41 localidades, realizado por Noa-Carranza et al. (2006).
Síntomas ocasionados por PRSV-P Y PapMV
Las plantas infectadas de PRSV-P se caracterizan por presentar mosaico, deformación foliar, amarillamiento o clorosis (Figura 2), achaparramiento, manchas anilladas en las frutas, manchas de mosaico; además de bandas oleosas y acuosas en el peciolo y en la parte superior del tallo. Las plantas infectadas presentan desarrollo anormal, menor tamaño, poco vigor y menor producción y calidad comercial (Kumar et al., 2014). Los cambios observados en la acumulación de biomasa en las plantas infectadas con PRSV-P se asocian a la reducción de la tasa de fotosíntesis y al incremento de tasa de respiración (Marler et al., 1993).
Los síntomas en las plantas infectadas por PapMV expresan un moteado en hojas jóvenes, aclaramiento de venas y curvatura de la lámina foliar hacia el envés (Figura 2); además, las plantas infectadas poseen porte bajo y hojas pequeñas (Taylor, 2001). Sin embargo, con la co-infección de ambos virus se observan síntomas foliares de necrosis apical, torsión, moteado y mosaico (Noa-Carranza et al., 2006).

Figura 2 Síntomas ocasionados por PRSV-P y PapMV en una hoja de Carica papaya L. variedad Maradol. A) Hoja con síntomas de PRSV-P en fase intermedia. B) Hoja con síntomas de PRSV en fase avanzada. C) Hoja con síntomas de PapMV en fase intermedia. D) Hoja con síntomas de PapMV en fase avanzada. Tapachula, Chiapas, México, 2016.
La presencia y severidad de los síntomas debido a ambos virus depende de diversos factores ambientales que, en caso de presentarse, pueden aumentar o atenuar la severidad. Según Kassanis (2008), la susceptibilidad de plántulas inoculadas con PRSV-P aumenta si se someten a periodos cortos de oscuridad, debido al decremento del contenido de carbohidratos en la hoja, los cuales pueden interferir con el establecimiento del virus en las células. Así mismo, la temperatura se considera determinante para el desarrollo de la enfermedad. De acuerdo con Cabrera et al. (2010), con temperaturas superiores a 40 °C la acumulación viral desciende, lo mismo ocurre en temperaturas inferiores a 20 °C; pero con la oscilación de la temperatura del ambiente entre 26 °C y 31 °C la acumulación viral y expresión de los síntomas alcanza un nivel máximo. Esto podría deberse a que el mecanismo de defensa de silenciamiento regulado por ARN puede suprimirse fácilmente por la temperatura ambiental (Mangrauthia et al., 2009).
Estrategias de manejo de la virosis
Entre las estrategias de manejo de enfermedades relacionadas con virus están: uso de propágulos libres de virus, eliminación de plantas con infecciones tempranas, determinación de fechas de siembra, control y estudio de poblaciones de áfidos vectores, interferencia de la trasmisión por áfidos (barreras vegetales), aplicación de aceites minerales, protección cruzada, mejoramiento genético por resistencia, desarrollo de plantas transgénicas y prácticas cuarentenarias (Villegas, 2001; Rivas-Valencia et al., 2003; 2008; Subramanya y Zitter, 2014).
La estrategia más común de control de áfidos vectores es la aspersión de insecticidas; sin embargo, es latente la posibilidad de desarrollar variantes resistentes a determinadas moléculas como los neonicotinoides (Koo et al., 2014); por tanto, la dinámica de las poblaciones se considera importante en los análisis de incidencia de la enfermedad en plantaciones de papaya. Como ejemplo, Mora-Aguilera et al. (1996) indican que la localidad y fecha de trasplante (en febrero, abril o junio) son factores agronómicos importantes para coincidir con la menor incidencia de plantas infectadas, en la región central del estado de Veracruz, México.
La protección cruzada involucra la infección de la planta con virus atenuados para activar mecanismos de silenciamiento génico en la planta, antes de que sea infectada por cepas virulentas (Fermin et al., 2010). En el cultivo de papaya en Taiwán, Tailandia y Hawaii se han usado dos aislamientos atenuados: PRSV-P HA 5-1 y PRSV-P HA 6-1. Estos no generan una protección absoluta pero los productores obtienen un rendimiento aceptable, de forma consistente y más predecible (Subramanya y Zitter, 2014).
Desarrollo de papaya transgénica
Se han desarrollado tres estrategias para generar papayas resistentes al PRSV-P (Villegas, 2001): 1) cruzas intraespecíficas para desarrollar una variedad con tolerancia moderada y utilizarla como fuente de genes; 2) cruzas inter-específicas de C. papaya con los parientes silvestres resistentes (como Vasconcellea cauliflora, V. quercifolia y V. pubescens) y así desarrollar híbridos resistentes; y 3) obtener resistencia transfiriendo el gen de la cápside viral, mediante técnicas de ingeniería genética, a la papaya cultivada y así obtener una papaya transgénica.
El programa de mejoramiento de papaya de Hawaii, en 1981, se suplementó con herramientas biotecnológicas tales como: el cultivo de tejidos in vitro para la micropropagación de líneas, el rescate de embriones de cruzas interespecíficas y la ingeniería genética (Villegas, 2001). Se concibió la papaya transgénica insertando el gen que codifica la cubierta proteínica del virus PRSV-P cepa HA 5-1 en el genoma de la papaya. Luego se probaron en campo, inoculándolas mecánicamente y se indujo la infección con el pulgón Aphis spp. El 95% de los individuos evaluados presentaron resistencia. No obstante, el transgen solo fue efectivo para proteger la papaya contra el virus local, pero no contra el PRSV-P procedente de Taiwán, Tailandia y México (Gonsalves, 2006). Esto corroboró que la transgénesis requiere que la compatibilidad entre el virus y el transgen sea mayor a 98%, y a la vez que la diversidad de cepas de PRSV-P en los nichos ecológicos del mundo limita su uso (Gonsalves, 1998).
Por otra parte, Davis y Ying (2004) transformaron líneas de papaya con genes de la proteína de la cápside del PRSV-P, aislamiento H1K, de Florida. Se destaca que el porcentaje de plantas susceptibles, después de la transformación genética, estuvo relacionado con la arquitectura molecular del transgen usado en la transformación, el número de copias del transgen presente en el tejido, y el efecto del fondo genético de las variedades cruzadas con las líneas transgénicas.
En Hawaii, actualmente, más del 70% de la superficie dedicada al cultivo de la papaya corresponde a híbridos transgénicos SunUp y Rainbow (Azad et al., 2014). Por esta tendencia, algunos países como Jamaica, Venezuela y Tailandia desarrollaron tecnología propia, con el fin de generar materiales genéticos resistentes a las cepas endémicas de PRSV-P. En los últimos años la papaya transgénica se ha establecido en Australia, Jamaica, Venezuela, Vietnam, Tailandia, Taiwán y Filipinas (Fermin et al., 2010).
En el caso de México, existen limitantes legales para el establecimiento de plantaciones comerciales con papayas transgénicas, lo cual está establecido en la Norma Oficial Mexicana NOM-056-FITO-1995. La COFEPRIS, entre 1995-2015, ha evaluado la inocuidad alimentaria y autorizado 146 eventos de productos genéticamente modificados, dentro de los cuales no se incluye al cultivo de papaya (COFEPRIS, 2015). Esto es debido a la protección de los centros de origen y domesticación de plantas, como es el caso de la papaya en México.
Introgresión de genes de resistencia a virus
La introgresión de genes entre especies ocurre de manera natural y ha enriquecido la diversidad genética a través de la polinización cruzada (Droogenbroeck et al., 2006). Inclusive, esto facilita el desarrollo de nuevas variedades porque es factible la introgresión de genes de resistencia a enfermedades, a variedades importantes comercialmente, a partir de las especies silvestres (Dinesh et al., 2013).
La hibridación interespecífica ha resultado una estrategia de control genético de la virosis de largo plazo, la cual consiste en cruzar artificialmente la papaya domesticada (C. papaya L.) con otras especies del género Vasconcellea que forma parte de la familia Caricaceae (Drew, 2014).
En América Central y Sur existen 21 especies silvestres de Vasconcellea (Coppens d’Eeckenbrugge et al., 2014). Esto permitiría escudriñar este material genético, potencialmente resistente a virus nativos, para usarse en la generación de poblaciones resistentes. No obstante, en ese proceso es importante considerar la presencia de barreras precigóticas y postcigóticas para la producción de semillas híbridas funcionales: fallas en la germinación del polen y el desarrollo de semillas estériles debido al aborto de embriones y óvulos (Veena y Dinesh, 2013); pero también es importante considerar las distancias genéticas entre las especies en el esquema de cruzamiento (Sharma y Tripathi, 2016). Por lo anterior, la introgresión requiere la identificación de especies y variedades que presenten resistencia a virus PRSV-P y que sean compatibles en sus cruzas artificiales para usarse como progenitores.
En México, desde 1978 se manifestó la relevancia de evaluar los parientes silvestres de la C. papaya como fuentes resistencia genética a los virus PRSV-P y PapMV. En aquel tiempo, se reportó que Vasconcellea cauliflora (Vc), V. pubescens, V. stipulata y V. candicans son especies resistentes al virus de la mancha anular, siendo Vc la única que se puede localizar en México. No obstante, las cruzas entre C. papaya y Vasconcellea spp. presentaron barreras de la compatibilidad, como el desarrollo de semillas F1 sin embrión y semillas F1 sin endospermo (Mosqueda, 1978). En el caso de que los parentales tengan baja compatibilidad, es necesario contar con un protocolo de rescate de embriones híbridos inmaduros, mediante técnicas de cultivo de tejidos in vitro (Azad et al., 2014).
Algunas especies de Vasconcellea son resistentes a ciertas cepas de PRSV-P, e. g. V. quercifolia es resistente a cepas del virus originarias de Florida, Hawaii y Australia, pero presenta susceptibilidad a los aislamientos de Venezuela; V. cauliflora se considera resistente a cepas originarias de Maracay (Venezuela), México, Australia e India, no obstante, es susceptible a los aislamientos de Florida y también a algunos de Venezuela; otras especies resistentes son V. pubescenes, V. stipulata, V. heilbornii y V. candicans (Horovitz y Jimenez, 1967; Sharma y Tripathi, 2016). Estos resultados experimentales muestran la variabilidad de la resistencia en función del origen geográfico del virus PRSV-P.
Horovitz y Jimenez (1967) realizaron cruzamientos interespecíficos y algunos de los híbridos resultaron resistentes al PRSV-P; además postularon que es un gen dominante el responsable de la resistencia a la virosis. También en las cruzas de papaya con V. quercifolia se han obtenido varios híbridos fértiles (Villegas, 2001). Adicionalmente, en 2011 se obtuvieron poblaciones segregantes mediante cuatro retrocruzas (Backcross: BC1 a BC4) entre V. quercifolia y líneas de C. papaya. Después de inocularlas mecánicamente con PRSV-P, aislado en Filipinas, se registraron de 72.3% a 96.1% de plántulas sin síntomas en condiciones de invernadero. Después de 18 meses de desarrollo en campo, las plantas de la BC4 se analizaron con la técnica de ELISA y solo el 66% de ellas se consideraron resistentes (Siar et al., 2011). En la BC3 la proporción de segregantes resistentes: susceptibles fue de 3:1; por el contrario, en la BC4 se detectaron dos tipos de proporciones: 2:1 y 4:1, información que indicó que la resistencia a la virosis es de tipo poligénica (Alamery y Drew, 2014).
En la combinación de C. papaya x V. pubescens también se ha encontrado resistencia al PRSV-P, pero la descendencia ha resultado estéril para continuar un esquema de mejoramiento convencional. Por ello, se ha planteado un puente para la transferencia de genes de resistencia al cruzar V. pubescens x V. parviflora y luego con C. papaya (Drew, 2014). Por otro lado, Kumar y Tripathi (2016) plantean otro puente de transferencia al entrecruzar V. cundinamarcensis x V. parviflora, luego los individuos F1 se polinizan con C. papaya y así obtener híbridos resistentes a la virosis.
En estudios genéticos de la generación F2, a partir de la cruza de V. pubescens (resistente) x V. parviflora (susceptible) encontraron un gene marcador, STK (serine threonine protein kinase, por sus siglas en inglés), relacionado a la resistencia al PRSV-P. Con base en eso, Haireen y Drew (2014) clonaron el gene STK y descifraron que su secuencia genómica es equivalente al de Carica papaya (denominado: CP_STK). También determinaron un gen equivalente en V. pubesces (VP_STK2). Al compararse las secuencias genómicas evidenciaron diferencias estructurales y por lo tanto los productos proteicos presentarían una función diferenciada, lo cual estaría influyendo en la susceptibilidad o resistencia de las especies al virus.
Híbridos intergenéricos con Vasconcellea cauliflora
Magdalita et al. (1997) realizaron cruzamientos de C. papaya x Vc y los embriones F1 se rescataron in vitro para regenerar los individuos híbridos. Las plantas híbridas se inocularon artificialmente con dos aislamientos de PRSV-P de Australia. De 114 plantas inoculadas en invernadero, 22 sobrevivieron y el 100% no presentó síntomas de virosis. En otro lote de 20 plantas híbridas establecidas en campo abierto sobrevivieron 12 y todas estuvieron libres de virosis, lo cual se confirmó con la técnica de ELISA.
Actualmente existen protocolos de cultivo de tejidos in vitro, para rescatar los embriones resultantes de la polinización manual de la papaya con polen de Vc; se ha determinado que la fecha óptima para extraer los embriones de las semillas inmaduras deberá ser a los 90 días posteriores a la polinización (Azad et al., 2014; Vegas et al., 2003).
Otra alternativa de obtención de híbridos intergenéricos es romper las barreras de compatibilidad presentes en las cruzas artificiales de papaya con Vc. Con tal fin, Dinesh et al. (2007) aplicaron una solución de sacarosa al 5% en los estigmas florales antes de la polinización manual; con ello, lograron obtener semillas hibridas al cruzar variedades de papaya Surya y Pusa Dwarf con Vc; el 71.1% de las flores polinizadas produjeron frutos y desarrollaron 13.7 semillas F1 en promedio. La confirmación de que las semillas eran híbridos interespecíficos se realizó a través del uso de marcadores moleculares tipo ISSR. Posteriormente, Dinesh et al. (2013), generaron un esquema de selección a partir de la cruza C. papaya var. Arka Surya x Vc (Figura 3), con avances alentadores (Yanthan et al., 2017).
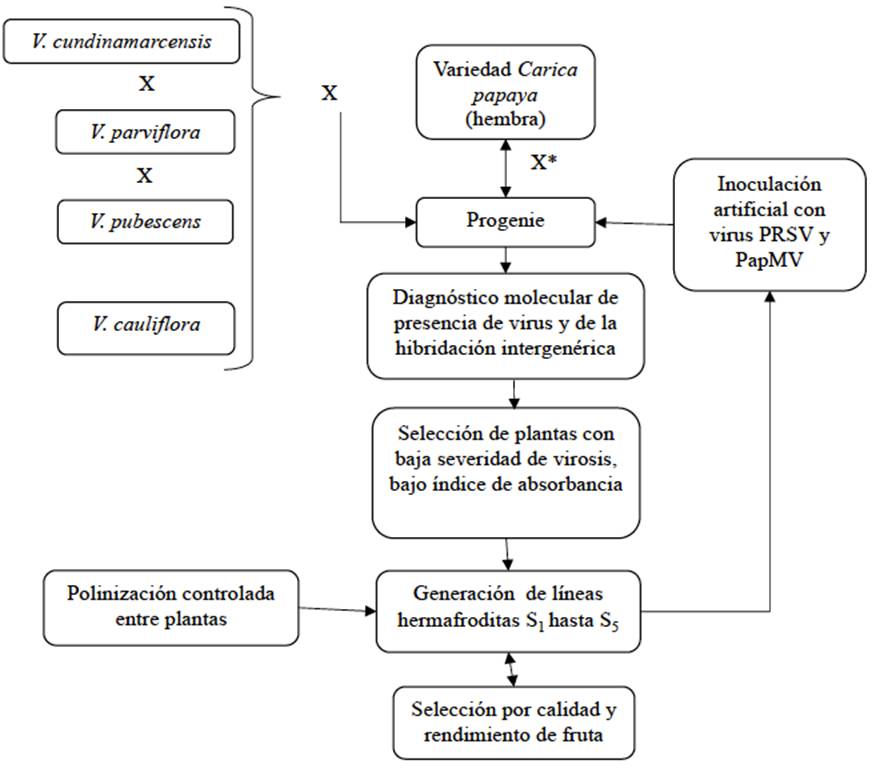
Figura 3 Esquema de cruzas entre especies de Vasconcellea con Carica papaya, para desarrollar líneas tolerantes a la virosis. Importante el uso de marcadores de ADN para confirmar los híbridos intergenéricos y pruebas de ELISA para estimar el nivel de carga viral en el tejido de las plantas. Elaborado con base en Dinesh et al. (2013) y Kumar y Tripathi (2016). X= Cruza, X*= Retrocruza.
Por su parte, Jayavalli et al. (2011, 2012) realizaron cruzas de Vc con nueve variedades de papaya de la India; también aplicaron soluciones de sacarosa al 5% y en combinación con cloruro de Calcio y Boro. Del total de flores polinizadas (n=1197), el 25.7% desarrollaron frutas. Cada fruta tuvo 2.3 semillas híbridas en promedio y del total de semillas germinaron el 58.1%. Estas plantas F1 desarrollaron y se inocularon artificialmente con PRSV-P, de las cuales el 23.6% no mostró síntomas de virus, pero el restante porcentaje mostró mosaico y deformación en las hojas meristemáticas, con lo cual determinaron que el mejor híbrido intergenérico fue Pusa Nanha x Vc.
Así mismo, Sudha et al. (2013), evaluaron la generación F2 de las cruzas de Vc con las variedades Pusa Nanha, CP50 y CO7; inocularon 700 plantas F2 con PRSV-P, el 46% de ellas no mostró síntoma alguno de virosis. Considerando los días transcurridos a partir de la inoculación hasta la aparición de síntomas y la severidad de los mismos, la mejor familia F2 procedió de la cruza Pusa Nanha x Vc. En la generación F3, evaluada por Sudha et al. (2015), se inocularon 1778 plantas con PRSV-P de las cuales el 30.7% no mostraron síntomas de virosis después de 27 días, y se consideraron resistentes de acuerdo con la escala de severidad; el porcentaje restante de plantas se clasificaron como susceptibles y altamente susceptibles. Al llevar las plantas resistentes a un invernadero y evaluarse hasta los 270 días después de la inoculación, aquellas plantas derivadas de la cruza Pusa Nanha x Vc fueron resistentes y medianamente resistentes.
La generación F2 de las cruzas: CO7 x Vc, Pusa Nanha x Vc y CP50 x Vc, también fue estudiada por Jayavalli et al. (2015). Para ello inocularon 683 plántulas de las tres cruzas con PRSV-P, encontrándose que el 12.8% de ellas no presentaron síntomas y en el ensayo de detección de virus con la técnica DAS-ELISA tuvieron bajos valores de absorbancia (< 0.24). En la cruza CO7 x Vc se obtuvieron plantas resistentes en proporción 15:1 (susceptibles: resistentes), mientras que en las otras dos cruzas (Pusa Nanha x Vc y CP50 x Vc) las plantas resistentes segregaron en proporción 13:3.
La estructura genética propuesta por Jayavalli et al. (2015), mediante la cual dedujeron que son dos genes dominantes los que estarían explicando esa proporción de individuos susceptibles, se muestra en el Cuadro 1. Además, señalan que no hubo segregación en proporción 3:1 como ocurre en la herencia mendeliana. En adición, las proporciones observadas indican que hay múltiples alelos en ambas especies que, al interaccionar, dan lugar a combinaciones genéticas relacionadas con la resistencia al virus PRSV-P.
Cuadro 1 Estructura genética de variedades de C. papaya, de V. cauliflora y de sus poblaciones segregantes en función de la reacción al virus PRSV.

Fuente: elaborado a partir de Jayavalli et al. (2015)
CONCLUSIONES
Los estudios de resistencia a virus se han centrado principalmente en el PRSV-P, debido a su efecto en reducir el rendimiento comercial del fruto. Mientras que PapMV no ha tenido gran auge en este tipo de investigaciones por su bajo impacto económico en el cultivo; sin embargo, con la evidencia de la co-infección y sus efectos en la severidad de los síntomas y daños, es importante incorporar a PapMV en el estudio de resistencia a virosis en México.
Considerando la importancia del cultivo de papaya y la disminución en el rendimiento atribuido al PRSV-P y PapMV en México, se requieren de alternativas para el desarrollo de variedades resistentes a estos virus. Dadas las restricciones del uso de variedades de papaya transgénica, se tiene la alternativa del mejoramiento genético a través del cruzamiento de líneas de C. papaya con especies del género Vasconcellea como donadoras de la resistencia a virus; en especial, V. cauliflora que se distribuye naturalmente en México. Además, es una oportunidad de insertar este tipo de investigaciones en un programa de mejoramiento genético que pueda atender la demanda de variedades resistentes no transgénicas, mediante cruzas directas o estableciendo un puente de transferencia de genes de resistencia al virus al usar la cruza triple interespecífica: V. cundinamarcensis x V. parviflora x C. papaya, y de esta forma obtener híbridos resistentes a la virosis.











 texto en
texto en 


