Colletotrichum es un género de hongos fitopatógenos que ocasiona enfermedades como cánceres, pudriciones y principalmente antracnosis en diferentes hospedantes; se manifiesta en lesiones semicirculares con hundimientos en forma de anillos concéntricos (Figura 1) (Hyde et al., 2009a). A nivel mundial se reporta la antracnosis en frutas, hortalizas, cereales, plantas herbáceas, maderables y ornamentales, entre otras; sobre todo en zonas templadas y tropicales (Udayanga et al., 2013).

Figura 1 Síntomas de antracnosis ocasionados por Colletotrichum spp. A) Colletotrichum sp. en hojas de limón mexicano; B) C. circinans en cebolla (Tomado de Montes-Belmont et al., 2003); C) C. gloeosporioides en litchi (Tomado de Martínez-Bolaños et al., 2015); D) y E) C. truncatum y C. gloeosporioides en papaya; F) C. gloeosporioides en mango.
Colletotrichum incluye más de 100 especies responsables de antracnosis en casi todos los cultivos destinados a la producción de alimentos, fibras y forrajes a nivel mundial, como por ejemplo C. gloeosporioides, C. truncatum, C. lineola, C. boninense, entre otras (Crouch et al., 2014). Debido a su importancia científica y económica, las especies de Colletotrichum ocuparon el octavo lugar en la clasificación mundial de patógenos de plantas (Dean et al., 2012).
La antracnosis genera pérdidas importantes en pre y postcosecha ya que ocasionan una reducción en la calidad y cantidad de diversos cultivos. Las pérdidas pueden llegar hasta el 100 % dependiendo del patógeno y las condiciones climáticas (Landero-Valenzuela et al., 2016); por ejemplo, en el cultivo intensivo de papaya bajo manejo de fungicidas, la prevalencia de antracnosis en campo y en postcosechaha provocado pérdidas superiores al 50 % (Torres-Calzada et al., 2013).
La diversidad poblacional de Colletotrichum a partir de reportes previos es complicada por las limitaciones en cuanto a herramientas de identificación de especies ya que los métodos tradicionales se basaron en diferencias morfológicas que hoy en día se saben insuficientes e imprecisas (Hyde et al., 2009b).
A pesar de que existe diversa información acerca de Colletotrichum spp., en México no existen publicaciones que describan a las especies de Colletotrichum que han sido estudiadas en el país, así como los hospedantes donde se han reportado causando daños. Por lo tanto, el objetivo de este trabajo es describir la situación actual de Colletotrichum en México mediante una recopilación de resultados publicados respecto a taxonomía, identificación, especies reportadas, patogénesis y control.
TAXONOMÍA
Colletotrichum comprende el estado asexual (anamorfo) de Glomerella (teleomorfo), el cual pertenece al phyllum Ascomycota, clase Hypocreomycetidae, orden Glomerellales, familia Glomerellaceae (Réblová et al. 2011). Glomerellaceae es una familia monotípica caracterizada por peritecios oscuros no estromáticos, ostiolos perifisados bien desarrollados, abundantes paráfisis de pared delgada. Glomerella inicialmente se ubicó en el orden Phyllacorales, pero algunas de sus características son claramente distintas a la de otros miembros: por ejemplo su falta de tejido estromático y sus anamorfos exclusivos de Colletotrichum (Zhang et al., 2006).
Colletotrichum es un género confuso taxonómicamente, debido a que existe variación del nombre del género de acuerdo a su estado sexual; en el año 2012, los miembros de la Subcomisión Internacional de Taxonomía de Colletotrichum (ISTC) apoyaron el uso del término Colletotrichum sobre el de Glomerella derivado de su mayor uso en ciencias aplicadas; lo que dio la expectativa de generar menores cambios taxonómicos en las especies de ese género (Damm et al., 2010; Zhang et al., 2013).
La identidad de especies importantes de Colletotrichum aún requiere consideración y aunque, las técnicas moleculares y filogenéticas mejoran la precision de los métodos morfológicos y bioquímicos tradicionales, se requiere un diagnóstico integral que brinde mayor robustez.
De acuerdo a análisis filogenéticos se han identificado complejos de especies dentro del género Colletotrichum, los cuales están clasificados en nueve clados principales: clado acutatum (comprende 29 especies) (Damm et al., 2012a), clado boninense (27 especies) (Damm et al., 2012b), clado destructivum (13 especies) (Damm et al., 2014), clado gloeosporioides (22 especies) (Weir et al., 2012), clado orbiculare (8 especies) (Damm et al., 2013), clado graminicola (13 especies), clado dematium (6 especies), clado spaethianum (5 especies) y clado truncatum (3 especies) (Cannon et al., 2012; Udayanga et al., 2013).
IDENTIFICACIÓN
Morfológica
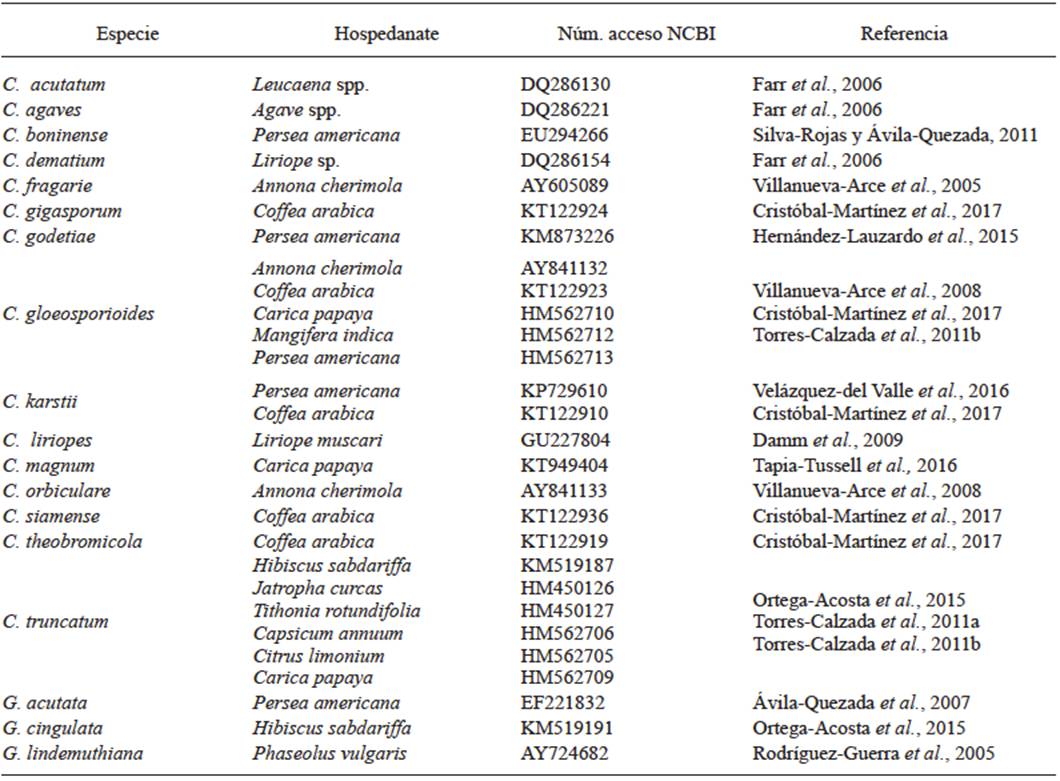
Tradicionalmente, el género Colletotrichum se ha identificado mediante caracteres morfológicos que incluyen: tamaño y forma de conidios, y apresorios; presencia o ausencia de setas, esclerocios, acérvulos, estado teleomorfo; así como características culturales como por ejemplo color de la colonia, textura y tasa de crecimiento (Hyde et al., 2009b). C. truncatum presenta conidios unicelulares de tamaño 22.8 - 23.8 x 3 - 3.02 µm, hialinos, de paredes lisas, sin septos, la parte central por lo general se encuentra ligeramente curvada con paredes paralelas, que termina abruptamente en base redonda y truncada, con contenido granular (Figura 2A); en contraste, C. gloeosporioides presenta conidios ovoides de tamaño 13.56 - 14.24 x 4 - 4.02 µm (Figura 2B). Las colonias de C. truncatum son de forma circular o irregular, con margen entero, de coloración blanco a salmón o gris a negro con masas conidiales producidas en anillos concéntricos (Figura 2C) y las de C. gloeosporioides muestran crecimiento micelial de forma radial, con margen entero u ondulado, generalmente de coloración blanco con masas conidiales de color anaranjado en el centro de la colonia (Figura 2D). Por otra parte, Colletotrichum presenta distintos morfotipos, como por ejemplo margen circular, entero, coloración de micelio gris, con masas conidiales anaranjadas (Figura 2E) (Torres-Calzada et al., 2012).
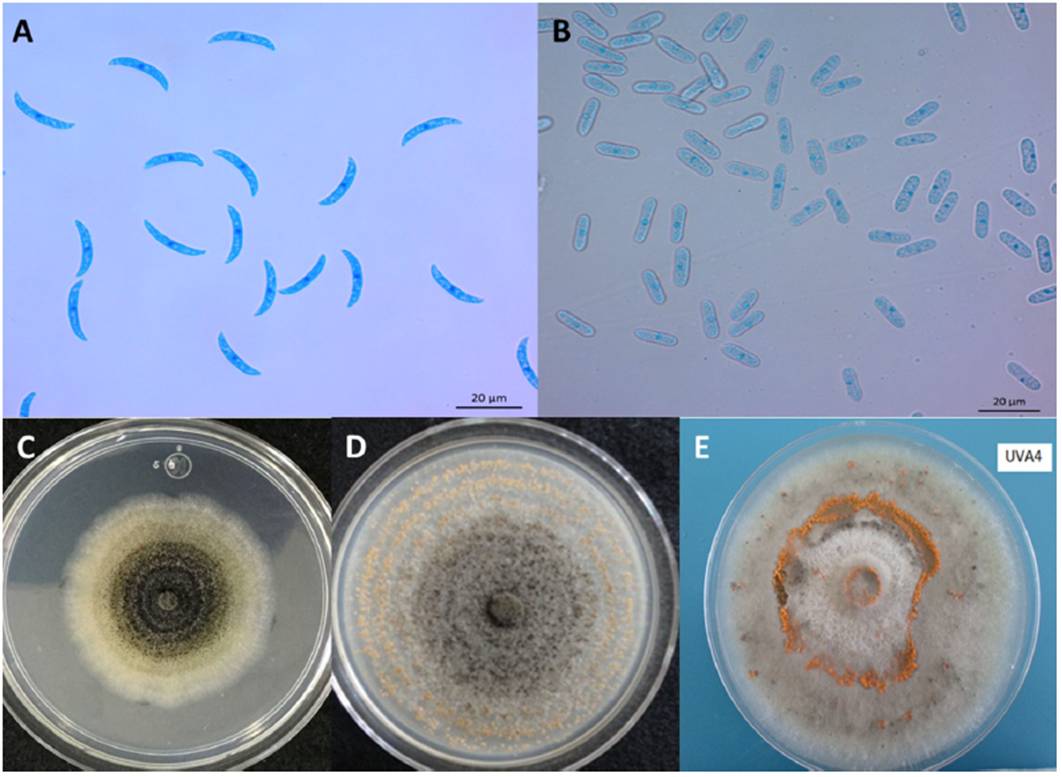
Figura 2 Características morfológicas de las principales especies de Colletotrichum en México. A) Conidios asexuales de C. truncatum; B) Conidios asexuales de C. gloeosporioides; C) Morfología colonial de C. truncatum en PDA; D) Morfología colonial de C. gloeosporioides en PDA; E) Morfología colonial de Colletotrichum sp. aislada de naranja.
De acuerdo con Barnett y Hunter (1998), Colletotrichum es un género que se caracteriza por presentar acérvulos separados en forma de disco o cojín, cerosos, subepidermales que emergen de la planta hospedante, típicamente contienen setas o espinas negras en los bordes o entre los conidióforos; los conidióforos son simples y elongados; los conidios son hialinos, ovoides u oblongos. No todas las especies de Colletotrichum tienen conidios ovoides u oblongos, ya que existen especies con conidios curvados como por ejemplo C. dematium y C. lineola (Damm et al., 2009).
Crouch et al. (2009a) consideran que la forma y tamaño de los conidios, al igual que en apresorios, son de poca utilidad taxonómica para caracterizar especies graminícolas. Las especies con características morfológicas similares pueden tener una considerable variación a nivel fisiológico y patogénico debido a las condiciones ambientales o de incubación, entre otras. Así mismo, las características morfológicas no son suficientes para un diagnóstico, puesto que existe gran variación en morfología del fenotipo entre especies bajo diferentes condiciones ambientales (Cai et al., 2009). Para superar las deficiencias de la identificación tradicional, en la actualidad, el uso combinado de caracterización molecular en conjunto con el diagnóstico tradicional constituyen una técnica adecuada para el estudio de complejos en especies de Colletotrichum (Hyde et al., 2009b).
Molecular
Debido a las limitaciones de la identificación tradicional, el análisis de ácidos nucleicos se considera confiable para identificar especies de Colletotrichum; sin embargo, un inconveniente importante de la dependencia de una pequeña porción del genoma para comprender las relaciones filogenéticas entre cepas de Colletotrichum es el riesgo de crear árboles filogenéticos de genes en lugar de árboles filogenéticos de especies; por lo tanto, se ha empleado la filogenética de múltiples genes para caracterizar sistemáticamente relaciones entre especies de Colletotrichum, lo cual sirve como base para la identificación en un complejo de especies (Cai et al., 2009).
En la actualidad se utilizan regiones génicas conservadas o códigos de barras genéticos para la identificación de especies fúngicas. La región más utilizada es el espaciador interno transcrito (ITS) del ADN ribosomal nuclear (Schoch et al., 2012). En Colletotrichum spp., además de la región ITS, para estudiar especies de Colletotrichum estrechamente relacionadas, se utilizan también regiones como: actina parcial (ACT), β-tubulina (TUB2), calmodulina (CAL), glutamina sintetasa (GS), quitin sintasa (CHS1), histamina (HIS3), liasa (APN2), región intergénica de apn2 y MATI-2-1 (ApMat), y gliceraldehido 3-fosfato deshidrogenasa (GAPDH) (Cai et al., 2009; Hyde et al., 2014). La filogenie de múltiples genes se ha aplicado con éxito para resolver relaciones entre especies con conidios curvados en hospedantes herbáceos, ejemplo de ello son los nuevos taxas de especies C. hanaui, C. nicholsonii, C. paspali, entre otras (Crouch et al., 2009a).
Aunque la filogenia de genes múltiples es una forma precisa y confiable para el diagnóstico de Colletotrichum spp., no es tan eficiente ni económicamente viable; actualmente es poco práctico utilizar la filogenética múltiple para todas las especies, por lo que distintos grupos de investigación utilizan diferentes regiones génicas. La región ITS es la más ampliamente secuenciada; sin embargo, las secuencias de esta región no son totalmente confiables en cuanto a la discriminación entre especies de Colletotrichum (Cai et al., 2009), ya que por ejemplo Crouch et al. (2009b) reportaron una tasa alta de errores de identificación (86 %) basada en la comparación de secuencias dentro del complejo de especies C. lineola. Por otro lado, las secuencias ITS depositadas en bases de datos públicas (Genbank) pueden causar confusión puesto que se introducen secuencias con nombres erróneos y pueden comprender especies crípticas.
Por lo tanto, el estudio del genotipo incluye secuenciación para realizar una combinación de caracteres filogenéticos, mientras que el estudio fenotípico debe ampliarse en un sentido polifásico que incluya morfología, fisiología, patogenicidad, proceso de infección, características culturales y metabolitos secundarios (Cai et al., 2009). Así, la identificación de Colletotrichum debe utilizar ambos estudios para establecer un diagnóstico confiable y eficaz.
ESPECIES DE Colletotrichum DESCRITAS EN MÉXICO
Diversas especies de Colletotrichum han sido reportadas como agentes causales de antracnosis en distintos hospedantes en México. Se han reportado 82 especies de Colletotrichum en plantas monocotiledóneas como maíz (Zea mays) (Álvarez, 1976), henequén (Agave fourcroydes) (Quijano-Ramayo et al., 2002), sorgo (Sorghum vulgare) (Álvarez, 1976), y dicotiledóneas como plátano (Musa spp.) (Marin et al., 1996), fresa (Fragaria chiloensis var. Ananassa) (Fraire-Cordero et al., 2003) y rosal (Rosa spp.) (Álvarez, 1976), entre otros.
Veintiocho especies se han descrito con base en la caracterización morfológica, de las cuales, 23 son anamórficas y cinco son teleomórficas (Cuadro 1). C. gloeosporioides es la especie más reportada de acuerdo al número de hospedantes. Las características morfológicas de C. gloeosporioides pueden variar incluso en el mismo hospedante; un claro ejemplo es el hallazgo de Torres-Calzada et al. (2013), quienes identificaron seis distintos morfotipos de C. gloeosporioides en papaya, éstos presentaron características culturales tales como crecimiento micelial de forma circular con margen entero u ondulado, de coloración blanca con masas conidiales de color naranja en el centro de la colonia o distribuidas en anillos concéntricos a lo largo de la colonia. Algunos morfotipos mostraron coloración oliva, gris oscuro a negro, con conidios de tamaño promedio de 13.56 - 14.24 x 4 - 4.02 µm.
Se han reportado 18 especies con base en caracterización molecular: 15 especies en estado anamorfo y tres en estado teleomorfo (Cuadro 2). En la mayoría de las especies, se realizó una identificación integral (morfológica y molecular), esta última se realizó con base en análisis de la región espaciadora interna transcrita (ITS); a pesar de que esta región del genoma no es totalmente confiable, es la más ampliamente utilizada debido a que esta región tiene una organización conservada en el genoma de todos los eucariotes (18S, 5.8S y 28S), se encuentra en unidades repetidas y tiene un gran número de copias, lo que facilita su amplificación; y hace que estas regiones sean útiles para el diseño de iniciadores. Por otro lado, estas regiones conservadas están separadas por secuencias divergentes, muy variables, polimórficas en longitud, que son muy informativas y representan una huella genómica para cada especie (Rodríguez-Tovaret al., 2004).
En la actualidad, la identificación a nivel molecular con base en una sola región conservada es insuficiente. Generalmente se utilizan dos o más regiones; por ejemplo, para las especies C. godetiae y C. karstii se utilizaron las regiones ITS y GADPH (Hernández-Lauzardo et al., 2015; Velázquez-del Valle et al., 2016) y para las especies C. gigasporum, C. gloeosporioides, C. karstii, C. siamense y C. theobrominicola las regiones: ACT, CAL, GAPDH, TUB2 e ITS (Cristóbal-Martínez et al., 2017).
Las especies reportadas con mayor número de hospedantes son C. truncatum (6 hospedantes) y C. gloeosporioides (5 hospedantes) basado en la identificación inicial con la region ITS (iniciadores ITS1-ITS4) y posterior uso de CcapF-CcapR y Cglnt-ITS4, respectivamente (Torres-Calzada et al., 2011b; Tapia-Tussell et al., 2008).
PROCESO DE INFECCIÓN
Durante el proceso de patogenicidad; en especies de Colletotrichum se desarrollan eventos progresivos como la adhesión al hospedante, germinación (incluye la formación de tubos germinativos), penetración (formación de apresorios melanizados) y nutrición (colonización mediante hifas intracelulares e hifas secundarias de infección). En la actualidad se conocen los procesos involucrados en la diferenciación de las estructuras de infección de Colletotrichum spp. así como los medios de interacción planta-patógeno (Cannon et al., 2012).
Las especies de Colletotrichum utilizan dos estrategias principales de infección: colonización hemibiotrófica intracelular o colonización intramural subcuticular. El estado inicial de infección es muy similar en ambas: el conidio se adhiere, germina sobre la superficie de la planta, produce el tubo germinativo y luego forma el apresorio melanizado con el cual penetra directamente la cutícula; sin embargo, el proceso de colonización es diferente en ambas estrategias (Perfect et al., 1999).
Durante la colonización hemibiotrófica intracelular, al penetrar las células epidérmicas del hospedante, las hifas aumentan de tamaño, formando vesículas de infección y una hifa primaria amplia, alrededor de la cual se invagina la membrana plasmática. La vesícula de infección y la hifa primaria están rodeadas por una matriz interfacial, por lo que el protoplasto del hospedante se mantiene vivo durante esta etapa de la interacción; posteriormente, la hifa primaria coloniza progresivamente nuevas células epidérmicas y mesófilas, a partir de las hifas primarias se forman hifas necrotróficas secundarias delgadas, las cuales se expanden rápidamente y degradan las paredes celulares mediante enzimas, lo que ocasionan lesiones necróticas (Perfect et al., 1999).
En contraste, durante la estrategia de infección intramural subcuticular, después de la penetración, el patógeno se desarrolla debajo de la cutícula formando una red de hifas intramurales. Durante las etapas posteriores de infección, las hifas inter e intracelulares penetran células epidérmicas y mésofilas, lo que ocasiona la muerte del hospedante (Perfect et al., 1999).
En México, los estudios del proceso de infección de Colletotrichum en su interacción con sus hospedantes son escasos y solo han reportado que las especies de Colletotrichum utilizan la estrategia intramural subcuticular y que el periodo en que ocurre la infección es distinto de acuerdo al hospedante. Estos estudios, a nivel histológico, es necesario complementarlos con estudios de expresión génica que se enfoquen en los genes relacionados a patogenicidad (Figura 3). Casarrubias-Carrillo et al. (2002) estudiaron el proceso de infección de C. gloeosporioides en su interacción con frutos de papaya. La germinación de conidios y penetración directa ocurrió entre las 48 y 72 h después de inoculación (hdi). La colonización mediante hifas intercelulares ocurrió entre las 90 y 120 hdi. Ocho días después de la inoculación ocurrió el colapso y la separación celular, así como el rompimiento de cutícula y formación de acérvulos y conidios, dando lugar a la formación de lesiones hundidas típicas de antracnosis, por lo que C. gloeosporioides en su interacción con papaya desarrolla una estrategia intramural subcuticular.
Por otro lado, Villanueva-Arce et al. (2006) estudiaron la patogénesis de C. fragariae en su interacción con frutos de chirimoya. Los conidios germinaron sobre la epidermis y tricomas de frutos inmaduros, la penetración fue directa a través de tricomas y células epidermales por medio de apresorios a las 24 hdi. La colonización del patógeno fue inter e intracelular sin etapa biótrofa visible, después de la necrosis, se formaron acérvulos subcuticulares, completando el ciclo de vida de C. fragariae a las 72 hdi, por lo que la estrategia de infección fue intramural subcuticular.
Por otra parte, Rodríguez-López et al. (2013) estudiaron el proceso de infección de C. gloeosporioides en su interacción con frutos de aguacate. La estrategia de infección fue colonización subcuticular intramural. No se detectó penetración directa por medio de apresorios; no obstante, se observó una capa mucilaginosa asociada a los tubos germinativos, la colonización fue intra e intercelularmente y la producción de acérvulos inició a partir de los doce días después de inoculación.
Rojo-Báez et al. (2016) estudiaron el proceso de infección de C. truncatum en su interacción con hojas de papaya y de chícharo. En ambos hospedantes, la penetración ocurrió de manera directa por medio de apresorios a las 20 hdi (Figura 4A-B). En papaya, la colonización fue inter e intracelular (Figura 4C-D); en contraste, en chícharo la colonización fue intracelular, se observaron hifas primarias de infección a las 36 hdi y durante el estado necrótrofo se observaron hifas secundarias a las 72 hdi. En ambos hospedantes se observaron acérvulos a las 96 hdi (Figura 4E). C. truncatum se comportó como patógeno intramural subcuticular en papaya y como hemibiótrofo intracelular en chícharo, por lo que la estrategia de infección depende del hospedante.
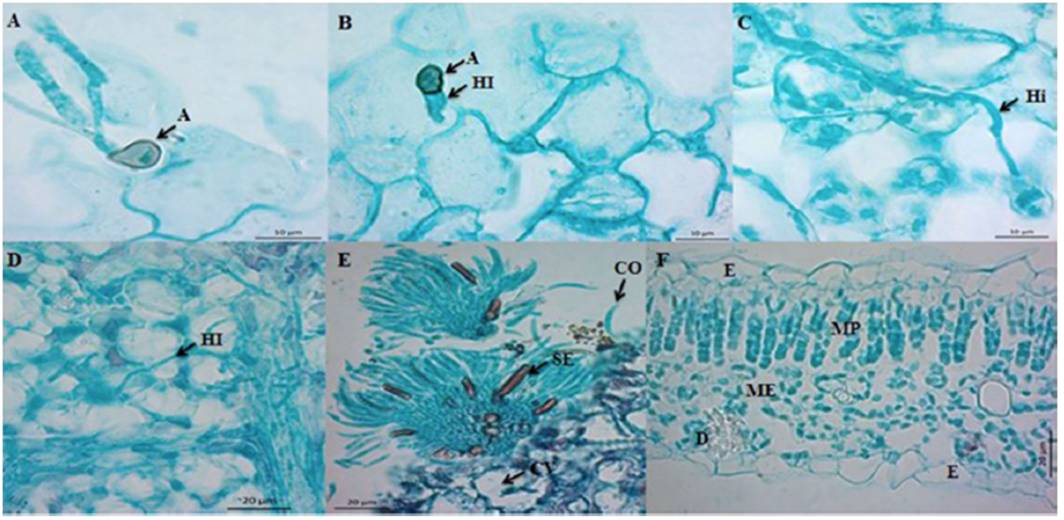
Figura 4 Colonización intramural subcuticular de C. truncatum en hojas escindidas de papaya cv. Maradol (Tomado de Rojo-Báez et al., 2016). A) y B) Penetración, A=apresorio, HI= hifa de infección; C) y D) Colonización, Hi= hifa intramural, HI= hifa intracelular; E) Reproducción, acérvulos con CO=conidios y SE=setas y F) Tejido sano, E=epidermis, MP=mesófilo en empalizada, ME=mesófilo esponjoso y D=drusa.
Además, Rojo-Báez et al. (2017) estudiaron el proceso de infección de C. truncatum en su interacción con fruto de papaya. La penetración directa por medio de apresorios ocurrió a las 30 hdi, las hifas intramurales crecieron en paredes celulares de la epidermis entre 30-48 hdi, la colonización necrotrófica inició a las 72 hdi causando una extensa degradación en células de parénquima y el rompimiento de cutícula por medio de acérvulos ocurrió entre 96-148 hdi. Las observaciones microscópicas en frutos de papaya revelaron que C. truncatum utiliza la estrategia de infección intramular subcuticular.
CONTROL
El control de enfermedades producidas por Colletotrichum/Glomerella depende principalmente de prácticas culturales tales como el uso de semillas libres de enfermedad, rotación de cultivos, variedades vegetales resistentes, remoción de ramas muertas y frutos infectados; tratamiento físico (ejemplo: tratamiento hidrotérmico, ozono y atmósferas modificadas en frutos); control químico (fungicidas) y biológico (extractos de plantas, microorganismos antagonistas) (Phoulivong, 2011; Landero-Valenzuela et al., 2016).
Dentro del control químico, los fungicidas de la clase benzimidazol y estrobilurinas (actúan inhibiendo la división nuclear y la respiración mitocondrial, respectivamente) se usan ampliamente en campo, estos fungicidas se encuentran vigentes en el registro sanitario de plaguicidas de la Comisión Federal para la Protección contra Riesgos Sanitarios (Torres-Calzada et al., 2015; COFEPRIS, 2017); además, fungicidas como azoxystrobin, clorotalonil, mancozeb y tiabenzadol se usan para el control de antracnosis en papaya y cuentan con registro por parte de la Agencia de Protección al Ambiente (EPA) de los Estados Unidos de América (Santamaría-Basulto et al., 2011).
En México, existen plaguicidas prohibidos y restringidos por su alto riesgo en la salud humana; además existen fungicidas de la clase benzimidazoles, maneb y captafol, los cuales están prohibidos en otros países pero están autorizados en México. El uso de plaguicidas que se han retirado del mercado y se ha prohibido su uso en países desarrollados como EEUU y Japón, puede deberse a la falta de actualización en la regulación de plaguicidas en México, así como la falta de monitoreo contínuo que proporcione resultados certeros para establecer políticas de uso y manejo de plaguicidas (Gutierrez-Alonso et al., 2004; Pérez et al., 2013).
Por otro lado, se ha reportado que el uso continuo de fungicidas sintéticos ha generado resistencia en cepas de Colletotrichum. Por ejemplo, Torres-Calzada et al. (2015) determinaron que en C. truncatum existieron aislados resistentes a los fungicidas azoxystrobin y tiabendazol, y susceptibles a los fungicidas mancozeb y cyprodinil-fludioxonil; confirmando que la resistencia a tiabendazol se debe a una mutación en el gen β-tubulina debido a la sustitución de ácido glutámico a alanina. La presencia de cepas resistentes, a algunos productos químicos, ha incrementado el interés por desarrollar otros métodos de control que sean efectivos y seguros para el consumidor y el ambiente, tal es el caso del control biológico.
Existen ejemplos del control biológico de antracnosis en manzana, papaya, aguacate, mango, entre otros (Carrillo-Fasio et al., 2005; Landero-Valenzuela et al., 2016). Bacillus subtilis es ampliamente utilizada en el control de antracnosis debido a su potencial antagonista por competencia y antibiosis. Carrillo-Fasio et al. (2005) evaluaron la efectividad de B. subtilis, Rhodotorula minuta y su combinación en aplicaciones precosecha para el control de antracnosis (ocasionada por C. gloeosporioides) en mango a nivel postcosecha. La combinación de R. minuta más B. subtilis (106 + 104 ufc mL-1), superó al control químico (benomil), lo que resultó prometedor para su uso comercial. Además, Patiño-Vera et al. (2005) desarrollaron un proceso de fermentación a nivel planta-piloto para la producción de la levadura R. minuta, lo que permitió desarrollar una formulación de bajo costo para la reducción de antracnosis en mango.
Por otra parte, los inductores de resistencia también forman parte del control de Colletotrichum spp. La inducción de resistencia a patógenos incluye el uso de elicitores físicos, químicos y biológicos; como por ejemplo el ácido salicílico y el ácido jasmónico, entre otros (Landero-Valenzuela et al., 2016). Además, se han realizado estudios enfocados a la caracterización de cultivares resistentes a especies de Colletotrichum. Rodríguez-Guerra et al. (2006) postularon genes de resistencia en cultivares mejorados de frijol de valor comercial en México como Negro INIFAP (el cual posee los genes de resistencia Co-1) y Negro 8025 (genes Co-6 o Co-8), los cuales son resistentes a la mayoría de los patotipos de C. lindemuthianum.
CONCLUSIONES
Las especies de Colletotrichum son patógenos importantes debido a su amplio rango de hospedantes. En México, la identificación de especies es principalmente a nivel morfólogico; sin embargo, en estudios recientes se ha realizado una identificación integral, la cual se basa en caracterización morfológica y análisis molecular. Debido al complejo de especies que existen en Colletotrichum, además del análisis de regiones ITS, es necesario incluir regiones conservadas adicionales. Las principales especies reportadas en México a nivel morfológico y molecular son C. gloeosporioides y C. truncatum; se han realizado estudios sobre patógenesis y control en estas especies; sin embargo, es necesario ampliar los estudios al resto de Colletotrichum spp. para establecer futuras estrategias de control.











 texto en
texto en