INTRODUCCIÓN
El maíz (Zea mays L.) es susceptible a enfermedades en diferentes etapas de su desarrollo. El carbón de la espiga, causado por Sporisorium reilianum f. sp. zeae (Kühn) Langdon y Fullerton, sinónimo Sphacelotheca reiliana (Khün) Clint. (Matyac y Kommedahl, 1985a; Matyac y Kommedahl, 1985b) es un problema serio desde la década de 1970 en EE.UU., México, Australia, China, Sudáfrica y Francia (Stromberg, 1981; Bernardo et al., 1992; Jin et al., 2000).
Los síntomas del carbón de la espiga son visibles en la floración, aun cuando el patógeno infecta la raíz durante la germinación y primeras etapas de desarrollo de la plántula (Martínez et al., 2000; Martínez et al., 2002; Zhao et al., 2015). El micelio infectivo invade sistémicamente los tejidos, hasta llegar al meristemo apical (Frederiksen y Reyes, 1980; Martínez et al., 1999; Zhao et al., 2015). El daño principal lo ocasiona durante la floración, cuando el micelio establecido en el meristemo produce soros que reemplazan granos en mazorca (inflorescencia femenina) y anteras. Al madurar, los soros liberan las teliosporas, que caen al suelo y el aire las transporta a distancias cortas (Montes y Díaz, 2006; Ghareeb et al., 2011).
Debido a que el inóculo se encuentra en el suelo de cultivo, los esfuerzos por combatir a ésta enfermedad se enfocan en evitar la infección durante el desarrollo de la plántula. Para esto, se utilizan estrategias de control como el tratamiento de semilla con fungicidas (Stienstra et al., 1985; Martínez y Ledesma, 1990; Pradhanang y Ghimire, 1996; Wright et al., 2006), prácticas culturales (Mack et al., 1984; Matyac y Kommedahl, 1985a) y la resistencia del hospedante (Baggett y Koepsell, 1983; Stromberg et al., 1984; Song et al., 2000; Aquino et al., 2011). Esta última es la estrategia más conveniente evitando daños ecológicos y reducir costos de producción.
Entre los estudios efectuados para identificar genotipos resistentes al carbón de la espiga destacan los realizados en Sudáfrica (Krüger, 1962), EE.UU. (Baggett y Koepsell, 1983), Kenya (Njuguna y Odhiambo, 1989), Francia (Lübberstedt et al., 1999) y China (Duan et al., 1992; Wang et al., 2008). En México, a pesar de ser una enfermedad importante en los Valles Altos (Estados de Hidalgo y de México), los programas de mejoramiento no contemplan la selección para resistencia y solamente se han enfocado a determinar porcentajes de incidencia en híbridos y variedades de maíz (Pérez y Bobadilla, 2002 y 2003; Aquino et al., 2011), en condiciones de infección natural (Quezada et al., 2013).
En 2006 y 2007, el Servicio Nacional de Sanidad, Inocuidad y Calidad Alimentaria (SENASICA), la Dirección General de Sanidad Vegetal (DGSV) y el Colegio de Postgraduados (CP), crearon los proyectos de mejoramiento genético PM0531 y PM0542 en los que se incluyó la selección de poblaciones y líneas de maíz con resistencia al carbón de la espiga para los Valles Altos. En los Estados de México e Hidalgo se formaron poblaciones de maíz con amplia base genética de endospermo blanco y amarillo con el propósito de seleccionar materiales resistentes a S. reilianum f. sp. zeae implementando un programa de selección recurrente.
Los métodos de selección recurrente de progenies o líneas autofecundadas S1 y S2, son los más usados para mejorar la resistencia a plagas y enfermedades; además de incrementar su eficiencia aumentando la frecuencia de genes favorables de una o más características agronómicas bajo selección y mantiene la variabilidad genética para continuar la selección (Hallauer y Miranda, 1988; Hallauer, 1992). La variación genética presente en las líneas autofecundadas permite seleccionar diferente nivel de susceptibilidad al patógeno. Así, el objetivo del presente estudio fue el de evaluar el nivel de resistencia o susceptibilidad de líneas C2-S1 y C2-S2 de maíz inoculadas artificialmente con teliosporas del patógeno.
MATERIALES Y MÉTODOS
Hospedante
La formación de poblaciones base de maíz de endospermo blanco y amarillo se inició (C0) en el ciclo primavera-verano de 2007 recombinando varias fuentes de germoplasma deseable en un vivero en el ejido de Cinta Larga, Hgo. (20° 13´ 47” N, 99° 12´ 52” O), seleccionado por la alta incidencia de carbón de la espiga (panoja) en condiciones naturales. En el ciclo otoño-invierno 2007/08, en un vivero establecido en el municipio de Valle de Bravo, Méx. (19° 11´ 42” N, 100° 07´ 52” O), se sembraron las mazorcas de medios hermanos, se autofecundaron las mejores plantas y se obtuvo la semilla C0-S1. El vivero en Valle de Bravo, Méx. se estableció por la presencia de carbón de la espiga y para avanzar una temporada de siembra en condiciones subtropicales sin heladas.
A partir de éste ciclo, se siguió el método de mejoramiento poblacional de S1 recurrente recombinando las familias S1 en el ciclo primavera-verano en Hidalgo y generando nuevas líneas S1 en el ciclo otoño-invierno en Valle de Bravo, Méx.
En 2009 se completaron dos ciclos de mejoramiento obteniéndose semilla C2-S1, con un total de 258 líneas de endospermo blanco y 71 de endospermo amarillo. En éstas líneas se evaluó la respuesta a la infección por S. reilianum f. sp. zeae mediante inoculación artificial de semillas y siembra en invernadero.
En 2010, en el vivero en el Estado de Hidalgo, se sembraron las líneas C2-S1, las cuales se recombinaron y autofecundaron y se obtuvo semilla C3 y C2-S2. Para obtener la semilla C2-S2, se seleccionaron las mejores líneas C2-S1 en base a características agronómicas con una presión de selección al carbón de la espiga entre 0 a 7.7% de incidencia en las líneas de endospermo blanco y de 0 a 12.5% en las de endospermo amarillo. El porcentaje de incidencia fue el resultado de la evaluación en condiciones de invernadero previamente descrito. Seis o siete plantas de las líneas seleccionadas se autofecundaron para obtener semilla C2-S2. Después de cosecha, semillas de 123 y 114 mazorcas C2-S2 de endospermo blanco y amarillo, respectivamente, se inocularon, se sembraron en invernadero y se evaluaron por su resistencia al patógeno.
Patógeno
En el estudio se usaron teliosporas de S. reilianum f. sp. zeae obtenidas de espigas y mazorcas de plantas de maíz infectadas naturalmente en el estado de Hidalgo. Las teliosporas se desinfestaron en una solución de 1% de CuSO4 por 24 h, se lavaron con tres cambios de agua destilada estéril y se recuperaron en papel filtro para su secado.
Para determinar la viabilidad del inóculo se preparó una suspensión de teliosporas con una concentración de 50,000 teliosporas mL-1 en agua destilada estéril. 0.5 mL de la suspensión se colocó y dispersó en cajas de Petri con medio de cultivo PDA. Las cajas se incubaron a 25 °C en obscuridad. El porcentaje de germinación se determinó a las 96 h en 4 campos de microscopio compuesto (40X), registrando el porcentaje de teliosporas germinadas.
Inoculación del hospedante
Una suspensión de teliosporas a una concentración de 1.7x107 esporas mL-1 se preparó en agua destilada estéril con carboximetilcelulosa de sodio como adherente (NaCMC; Droguería Metropolitana, México, D. F.). Las semillas de maíz (22 por cada línea), se sumergieron por 1 min en esta suspensión y se secaron a 22 °C durante 48 h. Como testigo y fuente de comparación se usaron semillas del híbrido susceptible AS-910.
Las semillas inoculadas se sembraron en macetas con suelo esterilizado, a una profundidad de 2 cm. El suelo tenía pH 8.0, conductividad eléctrica de 5.08 dSm-1, 3.23% de materia orgánica y textura franco-arenosa (arena 75.6%, limo 14.5% y arcilla 9.9%). Las macetas (40 cm de ancho x 40 cm de altura) se colocaron en invernadero distribuídas en un diseño completamente al azar, los tratamientos fueron 123 líneas de endospermo blanco y 114 de endospermo amarillo. La unidad experimental fue una maceta con 22 plantas y dos repeticiones por tratamiento. Después de la siembra, las macetas se regaron a capacidad de campo. Temperatura y humedad dentro del invernadero y del suelo se midieron con un registrador de datos (WatchDog Micro Station, Spectrum Technologies Inc.).
Evaluación de la incidencia de la enfermedad
En líneas C2-S1 y C2-S2, la susceptibilidad y resistencia se registraron durante la floración por observación visual de síntomas del carbón tanto en la mazorca como en la espiga de las plantas de cada línea. Una planta susceptible fue aquella con presencia de soros en la espiga, en la mazorca o ambas.
El porcentaje de incidencia se determinó como el cociente entre plantas con síntomas y el total de plantas en la unidad experimental multiplicado por 100; después se transformaron por arcoseno para homogeneizar las varianzas. De acuerdo a la incidencia, las líneas se clasificaron siguiendo la escala: 0%=altamente resistente, 11-25%= moderadamente resistente, 26-50%= moderadamente susceptible, 51-75%= susceptible y 76-100%= altamente susceptible. Los datos se analizaron utilizando el sistema de análisis SAS y comparación de medias.
RESULTADOS Y DISCUSIÓN
Las teliosporas de S. reilianum f. sp. zeae utilizadas como inóculo presentaron germinación de 31% después de 96 h de incubación en oscuridad a 25 °C. La infección por S. reilianum f. sp. zeae se identificó por la presencia de soros en la espiga, en donde las flores fueron reemplazadas por masas de teliosporas. En plantas infectadas se observaron espigas compactas (Figura 1A), con proliferación de espiguillas y presencia de teliosporas de color negro. Para observar la infección en la mazorca, fue necesario cortarlas a la mitad en sentido longitudinal; en las mazorcas infectadas se desarrollaron soros, dentro de estos teliosporas agrupadas en una masa de color negro (Figura 1B). Los síntomas y signos observados en la espiga y mazorca coinciden con los reportados por White (1999) y Baggett and Kean (1989).

Figura 1 Síntomas y signos del carbón de la espiga presentes en plantas de maíz provenientes de semilla inoculada con una suspensión de teliosporas de Sporisorium reilianum f. sp. zeae de 1.7x107 teliosporas mL-1 a 1% de carboximetilcelulosa de sodio y sembradas en invernadero. A) Formación de soros en la espiga. B) Formación de soros en la mazorca.
Las plantas que presentaron síntomas y signos sirvieron para determinar el porcentaje de incidencia de la enfermedad en las líneas C2-S1 y C2-S2 evaluadas.
Evaluación de incidencia en líneas C2-S1
Entre las líneas con endosperma blanco solamente una fue altamente susceptible a la enfermedad presentando una incidencia de 92.3%. En las líneas de endospermo amarillo, los valores más altos de incidencia fueron de moderadamente susceptibles con valores de 28.6, 30, 33.3 y 40%. La frecuencia de la enfermedad en las 258 líneas C2-S1 de endospermo blanco y 71 líneas C2-S1 de endospermo amarillo se presenta en las Figuras 2 y 3 y los valores del análisis de varianza se incluyen en el Cuadro 1, mostrando que solamente una línea de endospermo blanco presentó un valor promedio de incidencia de 92.3% superando al testigo que mostró un valor de 77.8% de incidencia de la enfermedad.
Cuadro 1 Respuesta de líneas S1 de endospermo blanco y amarillo a la infección por carbón de la espiga (Sporisorium reilianum f. sp. zeae) con inoculación artificial de la semilla.
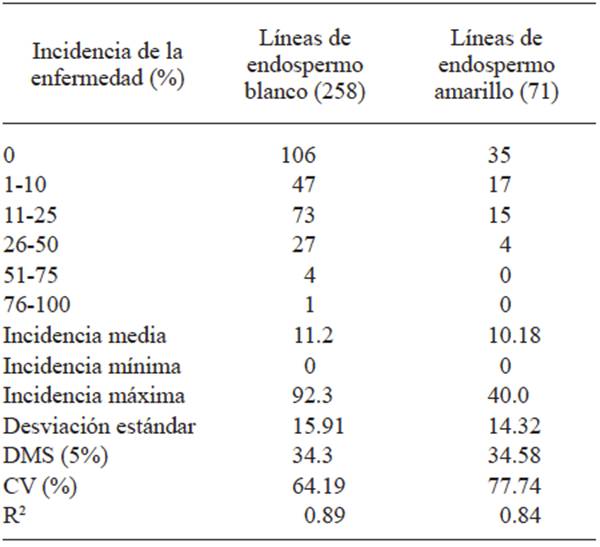
Las temperaturas promedio para suelo y ambiente fueron de 19.4 y 22.1 °C, respectivamente, y una humedad relativa de 70%, condiciones adecuadas para el desarrollo de la enfermedad.
Las líneas más susceptibles a la enfermedad presentaron valores de hasta 92.3 y 40% de incidencia en maíz de endospermo blanco y amarillo, respectivamente. Estos resultados sugieren que maíces con endospermo blanco son más susceptibles que los de endospermo amarillo.
La frecuencia de la enfermedad en las 258 líneas de endospermo blanco inoculadas fue: 106 líneas (41.1%) no presentaron la enfermedad, 47 (18.2%) con incidencia de 1-10%, 58 (22.5%) con incidencia de 11-20%, 46 (17.8 %) con incidencia entre 21-70%, solamente una línea presentó un valor promedio de incidencia de 92.3% superando al testigo que mostró un valor de 77.8% de incidencia de la enfermedad.
En el caso de las 71 líneas S1 de endospermo amarillo, la distribución de la incidencia fue: 35 líneas (49.3%) no presentaron la enfermedad, 17 (23.9%) con incidencia entre 1-10%, 13 (18.3%) con incidencia entre 11-20% y 6 (8.4%) con incidencia entre 21-40%. Los valores promedio de temperatura fueron de 19.4 y 22.1 °C para el suelo y ambiente, respectivamente, con una humedad relativa de 70%. Estos valores fueron conductivos para el desarrollo de la enfermedad.
Evaluación de incidencia en líneas C2-S2
La mayor incidencia del carbón de la espiga en líneas C2-S2 con endospermo blanco fue 42.8% y hasta 28.5% en las líneas de endospermo amarillo, mientras que en el testigo la incidencia fue 86.1%.
De las 123 líneas de endospermo blanco, 98 (79.7%) no mostraron la enfermedad y en las 114 líneas de endospermo amarillo, 84 (73.7%) no presentaron la enfermedad (Cuadro 2). La frecuencia de la enfermedad en las líneas S2 de endospermo blanco y amarillo se presenta en las Figuras 4 y 5. El análisis de varianza se muestra en el Cuadro 2.

Figura 5 Distribución de la incidencia de carbón de la espiga en líneas C2-S2 de endospermo amarillo.
Cuadro 2 Respuesta de líneas C2-S2 de endospermo blanco y amarillo a la infección por carbón de la espiga (Sporisorium reilianum f. sp. zeae) bajo inoculción artificial de la semilla.

Durante el desarrollo del ensayo en invernadero se registraron temperaturas promedio de 18.47 °C en el suelo y 21.61 °C en el ambiente, además de una humedad relativa promedio de 69.76%.
La respuesta de plantas de maíz a la infección de S. reilianum f. sp. zeae ha sido evaluada con el objetivo de identificar germoplasma resistente. Para esto se utilizan diferentes métodos de inoculación de semilla al momento de la siembra. Njuguna y Odhianbo (1989) reportan incidencias de hasta 62.8% al depositar teliosporas sobre la semilla. Stromberg et al. (1984), mediante inoculación a la semilla con sustrato contaminado con teliosporas, obtuvieron incidencias máximas de 56% y de 35.5% en líneas e híbridos de maíz, respectivamente. En el presente estudio en el que la inoculación de semilla se realizó con una suspensión de 1% de NaCMC y 1.7x107 teliosporas mL-1 (Quezada et al., 2013), y se obtuvieron incidencias en líneas C2-S1 de hasta 92.3% en los materiales de endospermo blanco y de hasta 40% en las de endospermo amarillo. Mediante la inoculación de semilla se simulan las condiciones naturales de la infección asegurando que el patógeno entre en contacto con el hospedante durante el proceso de germinación de la semilla (Prom et al., 2011).
Al avanzar las líneas C2-S1 a C2-S2, la proporción de líneas que presentaron algún grado de incidencia disminuyó y la proporción de líneas con 0% de incidencia se incrementó de 41.1 a 79.7% y de 49.3 a 73.7%, para el caso de maíz blanco y amarillo, respectivamente. Estos resultados muestran que este método de inoculación propicia niveles de infección y selección confiables en un programa de selección de germoplasma resistente al carbón de la espiga y permite identificar líneas que difieren en la respuesta a la infección. La presencia o ausencia de soros en la mazorca o en la espiga fue usada como indicador de la resistencia o susceptibilidad en nuestro estudio. De acuerdo con Zhao et al. (2015), la resistencia está determinada por la supresión de la invasión dentro de la planta y no con la supresión de la penetración del patógeno.
Además de contar con un método de inoculación eficiente, la temperatura y humedad del suelo son factores importantes en la epidemia. En nuestro estudio se encontró una excelente germinación de teliosporas e infección del hospedante a 18.47 y 19.4 °C, lo cual difiere con Matyac y Kommedahl (1985a) y Baier y Krüger (1962), quienes reportan que temperaturas entre 23 y 30 °C son ideales para la germinación de las teliosporas e infección de las plántulas. Los resultados obtenidos pueden explicarse debido a las temperaturas más bajas en el Altiplano de México, donde se presenta la enfermedad durante la germinación de las semillas y primeras etapas de desarrollo de las plántulas que es la etapa crucial para la infección o a la presencia de diferentes razas, las cuales varían en su comportamiento dependiendo de las condiciones ambientales y el genotipo de su hospedante (Pecina et al., 2004). El contenido de humedad del suelo en promedio se mantuvo en 26.18 kPa, equivalentes a 0.2618 bar, resultando en una incidencia de hasta 92.3% en el primer ciclo de evaluación. Este nivel de humedad difiere a lo consignado por Matyac y Kommedahl (1985a) quienes reportan que una humedad del suelo de 1.5 bar propicia un mayor número de plantas infectadas, con incidencias de 32%.
En la mayoría de los programas de mejoramiento genético en maíz la evaluación y selección contra enfermedades se realiza en condiciones de campo. En nuestro estudio se mostró que es posible combinar el uso de invernadero (mayor presión de selección en condiciones controladas) y hacer el trabajo de mejoramiento en campo solamente con germoplasma previamente evaluado en invernadero.
Por último, las líneas seleccionadas en el presente estudio se han utilizado en la formación de variedades sintéticas con buen comportamiento agronómico y resistencia genética al carbón, además de ser incorporadas en programas de mejoramiento genético para resistencia al carbón de la espiga en el Estados de México y el estado de Hidalgo.
CONCLUSIONES
El programa de selección S1-S2 recurrente probó ser eficiente en la generación y selección de líneas con diferente grado de susceptibilidad al carbón de la espiga.
La técnica de inoculación utilizada fue eficiente para descriminar germoplasma resistente del susceptible.
La selección en campo de líneas de maíz con características agronómicas deseables y evaluación de la infección por S. reilianum f. sp. zeae en invernadero, son metodologías complementarias para la generación de líneas resistentes en un programa de mejoramiento genético.











 texto en
texto en 





