INTRODUCCIÓN
Por la diversidad de climas y cercanía al mercado estadounidense, México cuenta con un gran potencial como productor de flores; sin embargo, su floricultura ha sido catalogada como un sector de baja calidad y bajos niveles de productividad (Claridades Agropecuarias, 2006). La FUNPROVER (2008), menciona que México se sitúa en el quinto lugar con respecto a la superficie dedicada a la floricultura a nivel mundial y al realizar la comparativa de valor comercial, México es ampliamente superado por países como Colombia y Ecuador cuya superficie de cultivo no es menor; a pesar de esto durante el período 2000-2011 el valor de producción de flores en México, aumentó a una tasa media anual de 9.5% y alcanzó un valor de cinco mil 646 millones de pesos (DISEMINA, 2012).
Los principales estados productores de flor de corte son: el Estado de México, Puebla y Morelos, aportando el 48, 22 y 12% de la producción respectivamente (CESAVEM, 2011). Los cultivos de importancia económica a nivel nacional son: crisantemo, rosa, clavel y gladiola. En términos de área cultivada y demanda, la gladiola es la flor primordial, pues se adapta con facilidad a las limitantes tecnológicas (limitado control fitosanitario, mal manejo postcosecha) y climáticas (temperaturas extremas, alta luminosidad). En el estado de Morelos el cultivo se concentra en los municipios de Cuautla, Yautepec y Ayala.
La calidad de la gladiola, como flor de corte, depende en gran medida del cormo que es la estructura de reproducción vegetativa; los países especializados en su distribución son: Holanda, Francia, Chile y Estados Unidos (Claridades Agropecuarias, 2006). Los productores cuando requieren renovar el cultivar, acuden a casas comercializadoras o con productores de la misma zona para la adquisición del nuevo material. Sin embargo, la sanidad del cormo no es garantizada; enfrentando así una de las principales limitantes conocida como “pudrición del cormo” que es asociada a los hongos del género Penicillium (Pataky, 1983; González-Pérez et al., 2009; IFBC, 2012).
En almacenamiento, el agente asociado a la pudrición del cormo en gladiola es Penicillium gladioli, descrito por McCulloch y Thom (1928); actualmente, existen reportes de otras especies de Penicillium que afectan los cormos por las que se estiman pérdidas del 50% en almacenamiento y del 15% en campo (Singh, 1970; González-Pérez et al., 2009; González-Pérez, 2011). El presente estudio tuvo como objetivos: a) aislar y caracterizar cultural, morfológica y molecularmente las especies de Penicillium causantes de la pudrición de cormos de gladiolo en almacenamiento y b) determinar la patogenicidad de los aislamientos de Penicillium.
MATERIALES Y MÉTODOS
Aislamientos
En agosto del 2012 se obtuvieron los aislamientos de los hongos fitopatógenos de cormos de gladiola comerciales variedad GrandPrix de circunferencia 10/12 cm (Grupo Nedermex, S.A. de C.V. del Estado de México) que presentaban daño severo ocasionado por Penicillium. En cámara de flujo laminar, el polvo característico de este tipo de pudrición se colocó en cajas de Petri con medio papa dextrosa agar (PDA) e incubó durante 10 d a 27 °C en oscuridad total. Las diversas colonias se aislaron, y purificaron hasta obtener cultivos monospóricos, en medio agar-agua por el método de dilución decimal seriada (Villanueva Arce et al., 2005), se incubó en condiciones ambientales de laboratorio por 36 h. Algunas esporas germinadas se transfirieron a cajas de Petri con PDA. La conservación de cepas fúngicas se realizó con la técnica de silica-gel (Chan y Elander, 1986).
Pruebas de patogenicidad
Se utilizaron cuatro cormos sanos por aislamiento, los cuales no presentaron daños visibles variedad GrandPrix 10/12, y cuatro más sin inocular como tratamiento testigo. Los cormos fueron despojados de la túnica, lavados con solución jabonosa y enjuagados con agua corriente. En campana de flujo laminar, los cormos se desinfestaron con solución de hipoclorito de sodio al 1.5% por 2 min, se enjuagaron con agua destilada estéril en tres ocasiones y colocaron sobre papel secante estéril contenido en charolas de poliestireno nuevas y desinfectadas. Una vez eliminada el agua superficial de los cormos, cada charola se dispuso en bolsas herméticas con cierre dentado. Los cormos se inocularon con cultivos de Penicillium de 10 d e incubaron 8 d a 8 °C más 22 d a temperatura ambiente. Los métodos de inoculación utilizados fueron dos: por infiltración de suspensión de esporas siguiendo la metodología propuesta por González-Pérez (2011); que consiste en ajustar la suspensión a una concentración de 1x105 esporas mL-1 más una alícuota de Tween 20 ajustando a una concentración del 0.1%; se infiltraron 2 mL, uno en el brote apical y el otro en el disco basal; por inoculación con micelio, éste se colocó en una herida hecha con un sacabocados de 3 mm de diámetro cerca del brote apical. La evaluación se basó en una apreciación visual usando una escala de siete puntos (Cuadro 1). Esta evaluación se complementó realizando un corte vertical en el centro de cada cormo; de cada mitad se midió la superficie expuesta total en mm2 y la superficie dañada con la ayuda de imágenes y el programa ImageJ (Rasband, 2006); los valores se reportaron como porcentaje de tejido afectado con respecto al área total.
Caracterización cultural y morfológica
En extracto de malta agar (MEA) y agar czapek (Cz’) se apreció coloración, textura, exudados y máximo crecimiento de las colonias a partir de una solución de esporas saturada proveniente de los cultivos monospóricos como lo recomiendan Frisvad y Samson (2004). Para las mediciones morfométricas se establecieron microcámaras de crecimiento (Moreno et al., 2005) a partir de las cuales se prepararon montajes para observar a detalle el micelio, conidióforos y conidios bajo microscopio compuesto (Olympus CX31, objetivo 40X). Las preparaciones se realizaron con lactofenol, midiendo en promedio 50 cuerpos fructíferos y 100 esporas por aislamiento. Se consideró longitud y ancho de estipe, métula y fiálide, y el diámetro del conidio; también se determinó forma, textura y patrón de ramificación del conidióforo. Para evaluar la tasa de crecimiento (TC), como característica fisiológica y diferencial entre especies, se utilizaron discos de 5 mm provenientes de los cultivos monospóricos de Penicillium para colocarlos en cajas de Petri de 50 mm de diámetro con PDA e incubó a temperatura ambiente hasta que el micelio alcanzó su máxima área de crecimiento. El crecimiento micelial consideró la evaluación de la máxima área diaria utilizando imágenes y el programa ImageJ (Rasband, 2006), finalmente se utilizó la siguiente ecuación para determinar la TC:
La caracterización cultural y morfológica de cada aislado se comparó con la especie referencia obtenida de la caracterización molecular utilizando las claves taxonómicas descritas por Frisvad y Samson (2004) y Pitt y Hocking (2009).
Extracción y purificación del ADN genómico
Con base en el protocolo propuesto por Doyle y Doyle (1990) con algunas modificaciones; para obtener el micelio del hongo se usaron discos de PDA de 5 mm de diámetro, provenientes de cultivos monospóricos, para sembrar en 50 mL de medio caldo papa dextrosa el cual se incubó por 4 d a 27 °C. El micelio recuperado con papel filtro estéril, se maceró y trituró con nitrógeno líquido en un mortero de porcelana. En tubos Eppendorf, se agregó 0.2 g de micelio pulverizado más 600 mL de solución amortiguadora de lisis, se agitó en vortex e incubó 30 min a 65 °C en un termomezclador (Thermomixer Compact-Eppendorf®). A continuación, se adicionaron 250 mL de acetato de potasio 5 M y se agitó hasta homogeneizar en vortex y centrifugo; esta al igual que las subsecuentes se realizaron durante 5 min, 13000 rpm, 4 °C. El sobrenadante se recuperó y colocó en un tubo nuevo más un volumen de fenol:cloroformo: isoamilico (25:24:1 v/v/v), se mezcló y centrifugó. Recuperado nuevamente el sobrenadante en un tubo nuevo, se agregó 1 mL de RNAsa e incubó por 30 min a 37 °C. Pasados los 30 min, se adicionó un volumen de Cloroformo:Isoamilico (24:1 v/v), se mezcló y centrifugó. Se recuperó el sobrenadante en un tubo nuevo, se adicionaron 2/3 de volumen de isopropanol frío, dejando reposar 2 h a -20 °C; posteriormente se centrífugo y eliminó el sobrenadante. La pastilla se lavó con 1000 mL de etanol 70%, y se dejó secar hasta que se evaporó totalmente el alcohol. Las muestras se resuspendieron en 50 mL de agua destilada estéril y almacenaron a -20 °C. La pureza del ADN obtenido, se verificó por electroforesis en un gel de agarosa al 1 % teñido con 1 mL de GelRed 10,000x (0.1 mg mL-1) y se observó en un fotodocumentador molecular (Imager®).
Cuantificación del ADN
Se determinó la concentración del ADN en el Nano Drop ® (ND-1000), para posteriormente ajustar a 50 ng mL-1, como lo establece el método para la cuantificación y secuenciación.
Amplificación por PCR
Los iniciadores utilizados para amplificar la región ITS del ADN ribosomal fueron ITS1 con la secuencia 5’TCCGTAGGTGAACCTGCGG3’ y el ITS4 5’TCCTCCGCTTATTGATATGC3’ (White et al., 1990). La Reacción en Cadena de la Polimerasa (PCR por sus siglas en inglés) se realizó con un volumen final de la mezcla de 50 µL y se corrió en un termociclador (Bio Rad DNA engine®). La mezcla de reacción se compuso de: 5.0 µL de solución amortiguadora para la PCR, 3.0 µL de MgCl2 (50 mM), 2.0 mL de la mezcla de dNTPs (10 mM), 1 mL de cada uno de los ITS’s (50 pmol µL-1) y 0.5 µL de Taq-DNA polimerasa (Invitrogen® 94 kDa). El programa para la PCR (por sus siglas en inglés) consistió de 30 ciclos: desnaturalización inicial 95 °C por 5 min; desnaturalización 95 °C por 1 min; alineación a 57 °C por 40 s; extensión 72 °C por 1 min. Los fragmentos amplificados se verificaron por electroforesis en gel de agarosa al 1% teñido con 1 µL de GelRed 10, 000x (0.1 µg mL-1) y comparados los pesos moleculares con el marcador TriDye 1kb DNA. Los productos de la PCR amplificados se purificaron mediante el kit GeneJet ™ (Fermentas, USA).
Secuenciación
El ADN se cuantificó y secuenció en ambos sentidos para evitar errores de ensamble y comparación; en el Instituto de Biotecnología de la Universidad Nacional Autónoma de México, Cuernavaca, Morelos. Las secuencias se alinearon y compararon con la base de datos del Centro Nacional para la Información de Biotecnológica mediante BLAST.
RESULTADOS Y DISCUSIÓN
Aislamientos
De los aislados que se obtuvieron de los cormos con síntomas de pudrición en almacén, se seleccionaron cuatro colonias representativas de Penicillium de acuerdo a su comportamiento cultural en PDA, las colonias se etiquetaron como 1P, 2P, 3P y 4P.
Pruebas de patogenicidad
La evaluación del porcentaje de superficie infectada y daño visual indicó que los cuatro aislados de Penicillium, inoculados en cormos de gladiolo variedad GrandPrix 10/12, fueron patogénicos con diferente grado de virulencia los aislados 1P y 4P fueron los más agresivos (Cuadro 2). Se observaron diferencias entre la inoculación por suspensión de esporas o micelio. El daño visual fue mayor en la inoculación con micelio. La evaluación de daño externo reportó necrosis de raíces de anclaje, manchas y hundimientos de color marrón, con presencia de micelio; aunque la presencia de micelio en raíces fue mayor. En general el daño interno mostró decoloración del tejido. En ambos casos, el hongo se reaisló y verificaron las características y el comportamiento cultural para cumplir con los postulados de Koch. Aún cuando la agresividad de Penicillium como fitopatógeno es considerada baja; las pruebas de patogenicidad realizadas en este trabajo, muestran que el nivel de infección incrementa dependiendo de los sitios lesionados y ruptura natural del cormo. González-Pérez et al. (2009), reportaron un aislado de Penicillium, afectando la zona productora de Puebla cuya agresividad se manifiesta sólo en el 2.7% del área expuesta de los cormos. El comportamiento de los aislados encontrados en este trabajo se asemejan a lo descrito por Overy et al. (2005), quienes señalan que en sus pruebas de patogenicidad, los cormos presentarón moteado, decoloración externa, necrosis de raíces y en su caso, daño interno.
Cuadro 2 Patogenicidad de cuatro aislados de Penicillium sp. en cormos de gladiola var. GrandPrix® 10/12.

Valores con la misma letra representan valores estadísticamente iguales. Prueba de análisis de varianza de una vía con una F = 4.206, F = 8.55, gl (4, 35) y P ≤ 0.007 determinada con comparación de medias por Tukey (P≥0.05). El valor mostrado en daño visual corresponde a la media / Values with the same letter represent statistically equal values. One-way test of analysis of variance with one F = 4.206, F = 8.55, gl (4, 35) y P ≤ 0.007 determined with a Tukey comparison of averages (P≥0.05). The value shown for visual damage corresponds to the average.
Caracterización cultural y morfológica de los aislamientos
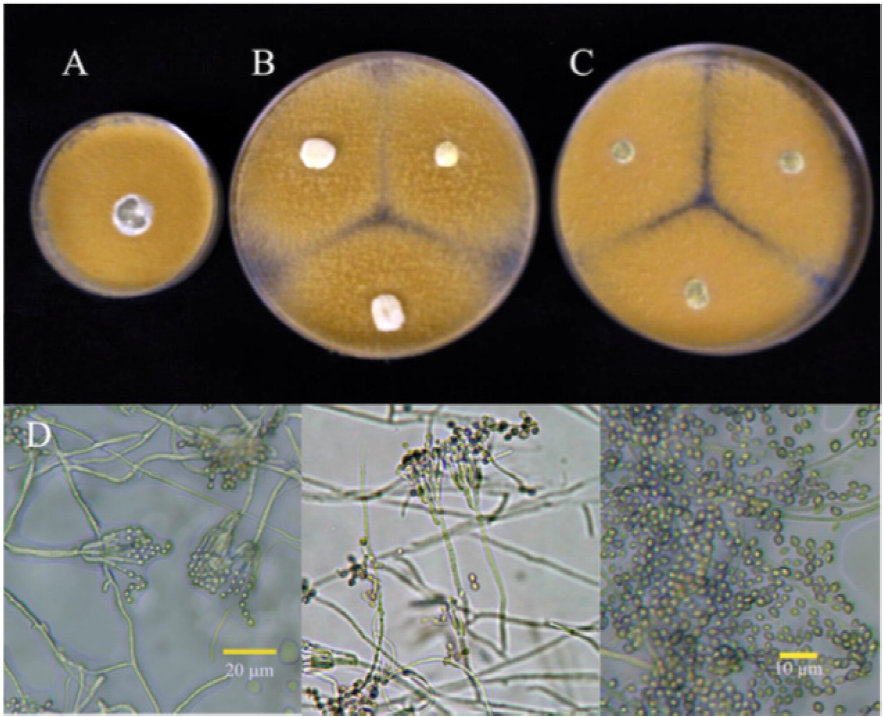
El comportamiento cultural y las características morfológicas de los aislados de Penicillium se encuentran resumidas en los Cuadros 3 y 4; se observa que, las características descritas coinciden en la mayoría de los puntos referidos por la literatura para la especie reportada en la identificación molecular (Crous et al. 2004; Pitt y Hocking, 2009; Frisvad y Samson, 2004). Las características morfológicas del conidióforo y el comportamiento de las colonias en medios específicos han sido reconocidas como carácter taxonómico primario (Comerio, 2000). En las Figuras 1, 2, 3 y 4 se observa el comportamiento cultural en medio Cz’, MEA y PDA. Los aislados 1P, 2P y 4P, pertenecen a la misma especie P. verrucosum; sin embargo, las características culturales difieren entre el aislado 1P y los aislados 2P y 4P, considerándose probablemente la presencia de dos variedades debido a que presentaron tasas de crecimiento menores (.12 a .55 cm2 d-1 ) y esta característica fisiológica permite separar individuos de la misma especie. Por otra parte la región ITS y la subunidad 5.8s del ADNr utilizada en este tipo de análisis son muy conservadas intraespecíficamente por lo que no son las más adecuadas para estudiar grupos subespecíficos. Con respecto al aislado 3P, pertenece a la especie de P. rugulosum, la diferencia se encuentra en el crecimiento máximo de la colonia. La literatura reporta características de comportamiento para la especie referencia en medio agar czapek extracto de levadura (CYA) y el medio usado para esta caracterización fue medio agar czapek (Cz’). Sin embargo, el comportamiento en extracto de malta agar (MEA), reportado en literatura, también difiere; por lo que el uso de medios de cultivo no se considera como parte de la explicación en la discrepancia en el tamaño de las colonias. Esta discrepancia también puede justificarse por la diferencia en las tasas de crecimiento.
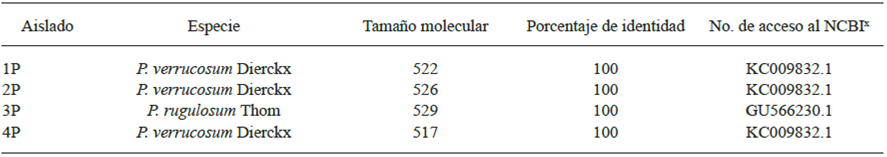
Cuadro 3 Comparación del comportamiento cultural y micromorfológico de aislados de Penicillium en cormos de gladiolo var. GrandPrix® en su tiempo de almacén con la especie de P. verrucosum (KC009832).
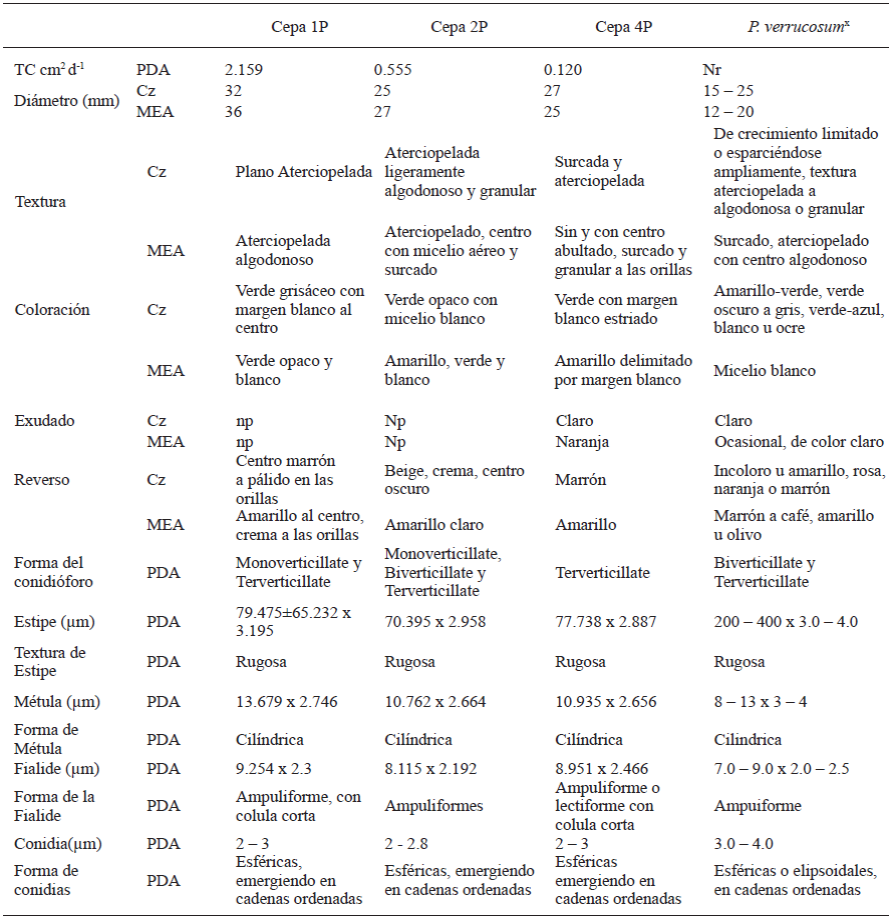
Características en medio agar Czapek (Cz) y extracto de malta agar (MEA) a 25 °C 7días en oscuridad. Presencia de exudados a 25 °C 14 días en oscuridad en medio Cz y MEA; Np: no presente; Nr: no reportado. Montajes en papa dextrosa agar (PDA), observaciones a 3 - 5 días en microscopio compuesto Olympus CX31, objetivo 40X. x Crous et al.2004; Pitt y Hocking, 2009; Frisvad y Samson, 2004
Cuadro 4 Comparación del comportamiento cultural y micromorfológico de aislados de Penicillium en cormos de gladiolo var. GrandPrix® en su tiempo de almacén con la especie de P. rugulosum (GU566230.1).

Características en medio agar Czapek (Cz) y extracto de malta agar (MEA) a 25 °C 7días en oscuridad. Presencia de exudados a 25 °C 14 días en oscuridad en medio Cz y MEA; Np: no presente; Nr: no reportado. Montajes en papa dextrosa agar (PDA), observaciones a 3 - 5 días en microscopio compuesto Olympus CX31, objetivo 40X. x Crous et al.2004; Pitt y Hocking, 2009; y Frisvad y Samson, 2004

Figura 1 Colonias del aislado 1P identificado como P. verrucosum de 7 días, 25 °C en (A) PDA, (B) Cz y (C) MEA. (D) Conidióforos y conidias.
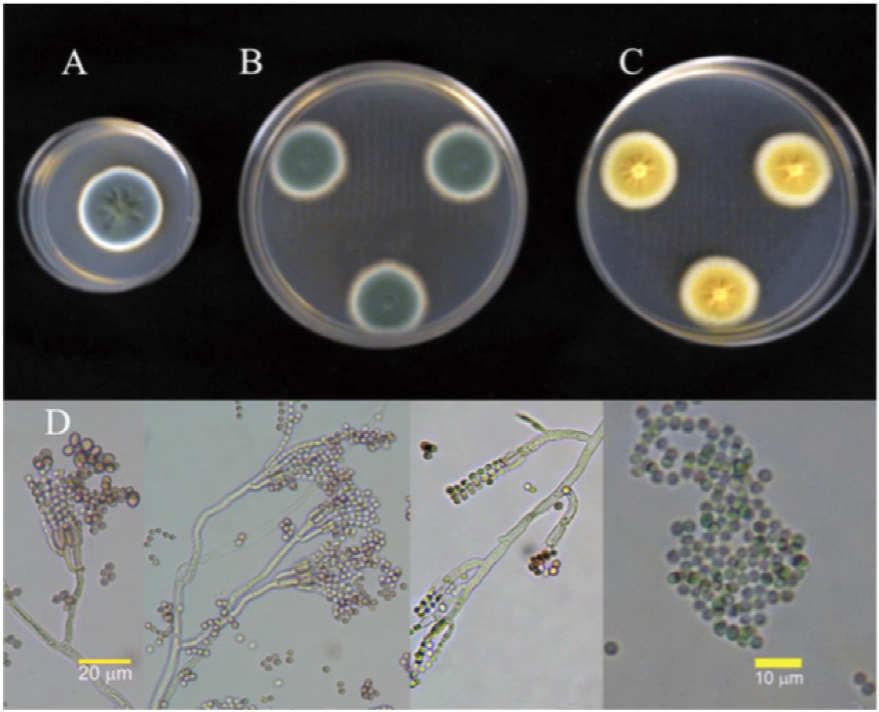
Figura 2 Colonias del aislado 2P identificado como P. verrucosum de 7 días, 25 °C en (A) PDA, (B) Cz y (C) MEA. (D) Conidióforos y conidias.

Figura 3 Colonias del aislado 4P identificado como P. verrucosum de 7 días, 25 °C en (A) PDA, (B) Cz y (C) MEA. (D) Conidióforos y conidias.
Caracterización molecular de los aislamientos
En el Cuadro 5 se muestran los resultados de la amplificación y secuenciación en ambos sentidos del ADNr de los cuatro aislados de Penicillium. Esta prueba reportó que los agentes causales de la pudrición de cormos de gladiolo en almacén son P. verrucosum y P. rugulosum. Tradicionalmente, esta patología es relacionada a P. gladioli (McCulloch y Thom, 1928). Sin embargo, Frisvad y Samson (2004) mencionan que esta especie puede estar extinta a causa del manejo químico que se da a las plantas. Por otro lado, existen reportes de otras especies de Penicillium asociadas a la pudrición del cormo de gladiolo: P. funiculosum (Singh, 1970), P. hirsutum, P. venetum y P. tulipae (Overy et al., 2005), Penicillium sp. (González-Pérez et al., 2009) y P. brevicompactum (González-Pérez, 2011). Crous et al. (2004), mencionan en la base de datos mycobank, que la especie P. verrucosum, reportada en el análisis molecular, se encuentra relacionada con P. hirsutum y P. verrucosum var. corymbiferum, por lo que se asocia como uno de los principales agentes de pudrición de bulbos de flor (Chauhan y Saaltink, 1969; Smid et al., 1995; Overy et al., 2005). Por otro lado, P. rugulosum es conocida como una especie ampliamente distribuida; aislada de tejido enfermo o sano de diversos productos. Prince et al. (1988), aislaron esta especie de bulbos de Tulipan; sin embargo, hasta la fecha no se encuentran reportes de su presencia en cormos de gladiolo.
CONCLUSIONES
Penicillum verrucosum y Penicillum rugulosum se identificaron como agentes causales de la pudrición del cormo de gladiolo durante almacenamiento. La primera especie identificada se consideró como la más agresiva en las pruebas de patogenicidad. Penicillum rugulosum es reportado por primera vez como un agente fitopatogénico para gladiola.











 text in
text in