Notas Fitopatológicas
Comparación de enzimas y compuesto fenólicos en tres especies de cítricos infectadas por Candidatus Liberibacter asiaticus
Lidia Monserrat Flores-Torres1
Alberto Flores-Olivas1
*
Yisa María Ochoa-Fuentes1
J. Isabel López-Arroyo2
Víctor Olalde-Portugal3
Adalberto Benavides-Mendoza4
Susana González-Morales5
Víctor Manuel Zamora-Villa6
1Universidad Autónoma Agraria Antonio Narro, Departamento de Parasitología Agrícola, Buenavista, Saltillo, Coahuila, México. C.P. 25315.
2Campo Experimental INIFAP, Carretera Montemorelos-China Km. 31, Colonia Ex Hacienda Las Anacuas General Terán C.P. 67413, General Terán Nuevo León.
3Centro de Investigación y Estudios Avanzados Unidad Irapuato, Instituto Politécnico Nacional, km 9.6 Libramiento Norte carretera. Irapuato-León, Irapuato, Guanajuato, CP 36821, México.
4Universidad Autónoma Agraria Antonio Narro, Departamento de Horticultura, Buenavista, Saltillo, Coahuila, México. C.P. 25315.
5CONACYT-Universidad Autónoma Agraria Antonio Narro, Buenavista, Saltillo, Coahuila, México. C.P. 25315.
6Universidad Autónoma Agraria Antonio Narro, Departamento de Fitomejoramiento, Buenavista, Saltillo, Coahuila, México. C.P. 25315.
Resumen.
El objetivo fue determinar diferencias en la actividad enzimática antioxidante y la concentración de fenoles totales en plantas de limón mexicano (Citrus aurantifolia (Christm.) Swingle), limón persa (Citrus latifolia Tanaka); y naranja dulce Valencia (Citrus sinensis (L.) Osbeck), infectadas bajo condiciones naturales de campo con Candidatus Liberibacter asiaticus (CaLas), en Bustamante, Tamaulipas, México. Se determinó la presencia de CaLas por qPCR; la actividad enzimática de fenilalanina amonio liasa (PAL), que se activa ante el ataque de patógenos; peroxidasa que interviene en la lignificación de paredes como respuesta a la infección; α-amilasa que degrada el almidón y se acumula en el tejido vascular, y compuestos fenólicos que cumplen funciones de defensa. Se realizó un análisis de contrastes. La concentración de proteínas totales mostró diferencias significativas entre especies (P<0.0001). Con una media de 6.1 y 6.37 mg de proteínas por g de tejido fresco para árboles infectados de limón mexicano; y naranja dulce negativa a CaLas. La actividad peroxidasa presentó diferencia significativa para limón persa (P=0.0341), con una media de 1.96 U.mg de proteína-1. En naranja dulce se observó mayor actividad de α amilasa en los árboles infectados por CaLas (1.19 U.mg de proteína-1). La concentración de PAL y fenoles totales no mostraron diferencias significativas entre especies. En el presente estudio se observó que CaLas influye en la actividad enzimática de cítricos.
Palabras clave: Huanglongbing; Fenilalanina amonio liasa; peroxidasa; α-amilasa; proteínas totales; fenoles totales
Abstract.
The objective was to determine differences in antioxidant enzyme activity and total phenol concentration in Mexican lime plants (Citrus aurantifolia (Christm.) Swingle), Persian lime (Citrus latifolia Tanaka); and Valencia sweet orange (Citrus sinensis (L.) Osbeck). Infected under natural field conditions with Candidatus Liberibacter asiaticus (CaLas), in Bustamante, Tamaulipas, Mexico. The presence of CaLas was determined by qPCR. We determined the enzymatic activity of phenylalanine ammonia lyase (PAL), which is activated by pathogen attack; the peroxidase involved in wall lignification in response to infection; the α-amylase which degrades starch and accumulates in vascular tissue; and phenolic compounds involved in defense functions. A contrasts analysis was performed. Total protein concentration showed significant differences between species (P<0.0001). With a mean of 6.1 and 6.37 mg of protein per g of fresh tissue for infected Mexican lime trees, and sweet orange negative CaLas. The peroxidase activity presented a significant difference for Persian lime (P=0.0341), with a mean of 1.96 U.mg of protein-1. In sweet orange, higher α-amylase activity was observed in CaLas infected trees (1.19 U.mg protein-1). The concentration of PAL and total phenols did not show significant differences between species. In the present study it was observed that CaLas influences the enzymatic activity of Citrus species.
Key words: Huanglongbing; Phenylalanine ammonia lyase; peroxidase; alpha amylase; total proteins; total phenols
Candidatus Liberibacter asiaticus (CaLas), afecta las zonas productoras de cítricos en México (DGSV-SENASICA y Mora-Aguilera, 2012); reduce 18.6 % el volumen de jugo y 17.3 % el peso de fruto de limón persa en Yucatán, México; lo que provoca pérdidas de producción de 2.4 t.ha-1 (Flores-Sánchez, et al., 2015). La infección inducida por HLB, altera la exportación de fotoasimilados, provocada por la retención de almidón, lo que genera la expresión de síntomas en el árbol (Kim et al., 2009; Koh et al., 2012).
CaLas provoca cambios bioquímicos y estructurales en plantas de cítricos para evitar la diseminación de la bacteria, mediante la activación de proteínas de respuesta (Albrecht y Bowman, 2008). Como respuesta a la infección de plantas de cítricos con HLB, el metabolismo de carbohidratos en el que interviene la α amilasa, es alterado (Albrecht y Bowman, 2008; Etxeberria et al., 2009).
La fenilalanina amonio-liasa (PAL) interviene en respuesta al ataque de patógenos (Almario et al., 1994). En cítricos, se ha observado que el flavedo posee la capacidad de responder al ataque por patógenos, mediante el aumento de los niveles de transcrito de la PAL así como de su actividad (Ballester et al., 2006). La enzima peroxidasa (POD) protege a las plantas del daño causado por radicales libres o ROS generados por diferentes tipos de estrés, participa también en la lignificación de la pared celular y en la degradación del ácido indolacético (Robinson, 1991). Se ha demostrado que los fenoles poseen una función importante en la defensa de las plantas frente a distintos factores bióticos y abióticos (Lu et al., 2015). Éstas se pueden modificar por efectores que secretan las bacterias Ca. Liberibacter dentro del hospedante y que alteran genes relacionados con la defensa; CaLas codifica salicilato hidroxilasa como mecanismo para evadir la defensa de las plantas (Aritua et al., 2013). Mora-Aguilera et al., 2014, señalan que el manejo del HLB debe considerar la susceptibilidad de las especies de cítricos y la carga del inóculo. Entender el comportamiento enzimático de árboles infectados con CaLas en diferentes especies permitiría desarrollar alternativas para la protección o defensa de la planta. El estudio se desarrolló con el objetivo de determinar diferencias en la actividad enzimática antioxidante y concentración de fenoles en tres especies de cítricos en Bustamante, Tamaulipas, México.
Las muestras se recolectaron en Felipe Ángeles, Bustamante, Tamaulipas. Se realizó un muestreo dirigido hacia árboles de 10 a 12 años de edad de limón mexicano (Citrus aurantifolia (Christm.) Swingle), limón persa (Citrus latifolia Tanaka); y naranja dulce (Citrus sinensis (L.) Osbeck), bajo condiciones de temporal, en la etapa fenológica de amarre de fruto. Se tomaron muestras de dos árboles con síntomas por especie y uno sin síntomas. El material se recolectó en cada uno de los puntos cardinales del árbol (norte, sur, este y oeste), se tomaron tres repeticiones de cinco hojas por punto; y se conservaron en nitrógeno líquido.
Para la extracción de ADN se usó la técnica citada por Almeyda-León et al. (2001) modificada: se trituraron 100 mg de tejido en nitrógeno líquido, se adicionó 1 mL de solución de extracción 2 ME/CTAB precalentado a 65 °C. Se mezcló en vortex por 30 seg y se incubó a 65 °C por 45 min. Se agregó 500 μL de cloroformo alcohol isoamílico 24:1, se agitó la mezcla por inversión y se centrifugó a 12,000 rpm durante 10 min. Se recuperó la fase acuosa y se adicionó un volumen igual de cloroformo alcohol isoamílico 24:1, se repitió ciclo de centrifugado. Se recuperó la fase superior y se añadió 0.6 volumen de isopropanol para precipitar el ADN a -20 °C durante 24 h. Se centrifugó a 12,000 rpm por 20 min, se lavó la pastilla con etanol al 70 %, se centrifugó a 12,000 rpm por 15 min, se dejó secar la pastilla y se resuspendió en 50 μl de agua inyectable (Pisa). La presencia de la bacteria se determinó de acuerdo al protocolo de SENASICA-SAGARPA, (2010), usado en la Estación Nacional de Epidemiología y Saneamiento Vegetal (SENASICA-ENECUSaV); en el estado de Querétaro, México.
El extracto crudo para cuantificación de proteínas totales, fenilalanina amonio liasa, peroxidasa y α-amilasa, se tomó de Díaz et al. (2010), modificado: se colocó 1 g de muestra macerada en nitrógeno líquido, en una solución tampón fosfato de sodio 100 mM, pH 7. Las muestras se centrifugaron a 12,000 rpm durante 20 minutos a una temperatura de 4 ° C, posteriormente se colectó el sobrenadante y se almacenó a -20 °C. Para la extracción de fenoles se utilizó la metodología B usada por Kähkönen et al. (1999) con algunas modificaciones; se colocaron 250 mg de la muestra macerada en un tubo eppendorf de 2 mL y se agregó 1 mL de metanol al 80 %, se agitó en vortex por un minuto, se centrifugó a 10,000 rpm por 15 minutos. El sobrenadante se recuperó en un tubo eppendorf ámbar de 1.5 mL. Se re extrajo con 500 μL de metanol absoluto, repitiendo el proceso; y se conservó a -20 °C hasta su uso.
La concentración de proteínas se determinó según la técnica de Bradford (1976), la cual consistió en mezclar 1 mL de reactivo de Bradford con 100 μL de extracto crudo. Los valores de absorbancia de proteínas totales se determinaron a una λ=595 nm en un thermo spectronic Biomate 3. El contenido de proteínas se expresó en mg de proteínas por mg de tejido fresco. La curva patrón se obtuvo con albúmina de suero bovino según García y Vázquez (1998).
La determinación de la actividad fenilalanina amonio-liasa (PAL) se realizó de acuerdo a la técnica descrita por Rodríguez-Pedroso et al., (2006). Se usó como referencia el coeficiente de extinción molar de 0.0174 M-1cm-1 para calcular la actividad enzimática (Trotel-Aziz et al., 2008).
La actividad peroxidasa se determinó mediante la metodología usada por Ruttimann et al., (1992). La actividad de la enzima se expresó como milimoles de rojo de fenol oxidado por gramo de tejido fresco por minuto (Yedidia et al., 1999).
Para la cuantificación de α amilasa se utilizó el protocolo de SIGMA-ALDRICH, (2015). La curva patrón se realizó con varias concentraciones de maltosa. La actividad α amilasa se definió como μmol.min-1 de maltosa liberados por μg de proteína (Menéndez et al., 2006).
El contenido de fenoles totales se determinó por el método Folin-Ciocalteu (Singleton et al., 1999). Se preparó una mezcla con 200 μL del extracto metanólico, 100 μL del reactivo de Folin-Ciocalteu; y 200 μL de carbonato de sodio al 20 %. Se agitó y se dejó reposar durante 30 min. Transcurrido este tiempo se midió la absorbancia de fenoles totales a una λ=760 nm. Se realizó una curva patrón con diferentes concentraciones de ácido gálico.
Se utilizó el programa estadístico SAS ver. 9.0 para realizar un análisis de contrastes entre los árboles con diagnóstico positivo y negativo a CaLas. Las variables analizadas fueron: proteínas totales, PAL, POD, α-amilasa; y fenoles totales.
Los árboles con síntomas muestreados presentaron un amarillamiento general de la copa y apariencia deshidratada; en las hojas se observaron moteados asimétricos menos visibles. Las muestras sintomáticas fueron positivas a CaLas y las muestras asintomáticas fueron negativas. Para la detección de CaLam todas las muestras fueron negativas.
El análisis de contrastes entre árboles positivos y negativos mostró diferencias significativas entre especies (P<0.0001). La concentración de proteínas para limón mexicano mostró una media de 6.1 mg de proteínas por g de tejido fresco para árboles infectados, mientras que para negativos fue 5.46 mg de proteínas por g de tejido fresco con una significancia de P=0.0238. En naranja dulce hay una diferencia significativa de P=0.0002 con una media de 5.27 y 6.37 mg de proteínas por g de tejido fresco en árboles positivos y negativos respectivamente (Cuadro 1; Figura 1). La determinación de proteínas totales en la planta permite detectar cambios ocasionados por diferentes tipos de estrés biótico y abiótico (Casado, 2004), tal como se muestra en este estudio al encontrar diferencias en la concentración de proteínas entre árboles positivos y negativos a CaLas.
Cuadro 1. Análisis de contrastes entre árboles con diagnóstico negativo y positivo a Ca. Liberibacter asiaticus en el estado de Tamaulipas.
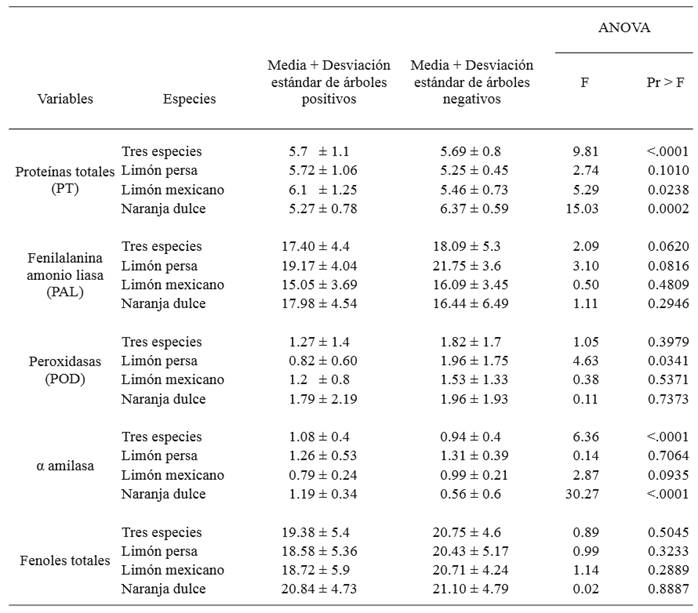
La determinación de PAL no mostró diferencias significativas entre especies, sin embargo se observó mayor concentración de PAL en limón persa y limón mexicano (21.75, 16.09 U.mg de proteína-1), para árboles negativos; por el contrario naranja dulce presentó mayor concentración en los infectados por CaLas (17.98 U.mg de proteína-1) (Cuadro 1; Figura 1). Los resultados de éste estudio coinciden con Chenyang et al. (2001) quienes mencionan que la actividad enzimática de la PAL es modificada por factores bióticos y abióticos en la planta; ya que a pesar de no tener diferencias significativas se pudo observar mayor concentración de PAL en naranja dulce afectada por HLB. Los resultados en limón persa y mexicano coinciden con lo señalado por Martinelli et al. (2016) quienes indican que la regulación de la PAL disminuyó a causa de la infección de CaLas en dos especies de cítricos, una considerada moderadamente tolerante, limón Volkameriana (Citrus × volkameriana); y la otra altamente susceptible, naranja Navel.
Los niveles de actividad peroxidasa presentaron diferencia significativa para limón persa (P=0.0341). Se observó mayor concentración de la enzima en árboles no infectados con CaLas con medias de 1.96 U.mg de proteína-1 para limón persa y naranja dulce, y para limón mexicano de 1.53, U.mg de proteína-1 (Cuadro 1; Figura 1). En la presente investigación se observó mayor actividad enzimática de la peroxidasa de los cítricos en árboles negativos; no obstante, se observaron síntomas de acorchamiento de nervaduras centrales y secundarias de las hojas infectadas con HLB, producto de la lignificación inducida por ésta enzima como menciona Robinson (1991).
En la cuantificación enzimática de α-amilasa se presentaron diferencias significativas entre especies y entre árboles positivos y negativos de naranja dulce (P<0.0001). En árboles negativos de limón persa y limón mexicano se observó mayor concentración de α-amilasa (1.31, 0.99 U.mg de proteína-1), respectivamente; en árboles positivos la mayor concentración se detectó en limón persa (1.26 U.mg de proteína-1) (Cuadro 1; Figura 1). En el estudio de Martinelli et al. (2016), la α-amilasa se expresó en limón Volkameriana (Citrus × volkameriana), señalada como moderadamente tolerante, y la β-amilasa en naranja Navel, material altamente susceptible. En el presente estudio, el estrés ocasionado al árbol provocó que la actividad α-amilasa aumentara en limón persa seguido por naranja dulce.
Los niveles de concentración de fenoles totales se presentaron en un rango mínimo de 18.5 mg de
ácido gálico por g de peso fresco registrado para las muestras infectadas con
CaLas de limón persa. Naranja dulce presentó el valor máximo, 21.10
mg de ácido gálico por g de peso fresco, en árboles negativos. En el análisis de
contrastes la determinación de fenoles totales no se observaron diferencias
significativas entre especies (P=0.5045) (Cuadro
1; Figura 1). Coincidiendo con Yedidia
et al., 1999, quienes señalan que al reprimirse la actividad de la
peroxidasa, también disminuye la producción de compuestos fenólicos, los resultados no
muestran una diferencia significativa en la actividad peroxidasa, ni en compuestos
fenoles.
Conclusiones
El estudio mostró mayor concentración de proteínas en limón mexicano con CaLas, y naranja dulce en los negativos. Se observó mayor actividad enzimática PAL en naranja dulce positiva a CaLas que en los árboles negativos. La actividad de la enzima peroxidasa no fue perceptible en esta etapa de la enfermedad, al igual que la concentración de compuestos fenólicos totales. La actividad α-amilasa fue mayor en limón persa.
Agradecimientos
A la UAAAN y al programa de becas de CONACYT por el financiamiento otorgado. Al Comité Estatal de Sanidad Vegetal de Tamaulipas por el apoyo logístico brindado.
Literatura citada
Albrecht U. and Bowman K. D. 2008. Gene expression in Citrus sinensis (L.) Osbeck following infection with the bacterial pathogen Candidatus Liberibacter asiaticus causing Huanglongbing in Florida. Plant Science. 175: 291-306. http://dx.doi.org/10.1016/j.plantsci.2008.05.001
[ Links ]
Almario, M. F., Ocampo C. y Montes de G. V. 1994. Establecimiento de un método para la determinación de la actividad enzimática de L Fenilalanina amonio liasa (PAL) en Cafeto. Revista de la Academia Colombiana de Ciencias. 19 (72): 137-140. http://www.accefyn.org.co/revista/Vol_19/72/137-140.pdf
[ Links ]
Almeyda-León. I. H., Rocha-Peña. M. A., Piña-Razo. J. and Martínez-Soriano. J. P. 2001. The use of polymerase chain reaction and molecular hybridization for detection of phytoplasmas in different plant species in Mexico. Revista Mexicana de Fitopatología 19:1-9. http://www.redalyc.org/pdf/612/61219101.pdf
[ Links ]
Arfaoui A., El Hadrami A., Mabrouk Y., et al. 2007. Treatment of chickpea with Rhizobium isolates enhances the expresión of phenylpropanoid defense-related genes in response to infection by Fusarium oxysporum sp. Ciceris. Plant Physiology and Biochemistry 45 (6-7): 470-479. http://dx.doi.org/10.1016/j.plaphy.2007.04.004
[ Links ]
Aritua V, Achor D, Gmitter F. G., Albrigo G., Wang N. 2013. Transcriptional and microscopic analyses of citrus stem and root responses to Candidatus Liberibacter asiaticus infection. PLoS ONE 8: doi: 10.1371/journal.pone.0073742
[ Links ]
Ballester A. R., Lafuente M. T., González-Candelas L. 2006. Spatial study of antioxidant enzymes, peroxidase and phenylalanine ammonia-lyase in the citrus fruit- Penicillium digitatum interaction. Postharvest Biology and Technology 39: 115-124. http://dx.doi.org/10.1016/j.postharvbio.2005.10.002
[ Links ]
Bernal L., Martínez B. E. 2006. Una nueva visión de la degradación del almidón. Revista del Centro de Investigación. Universidad La Salle. 7(25): 77-90. http://www.redalyc.org/articulo.oa?id=34202506
[ Links ]
Bradford, M. M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72(1/2): 248-254. doi:10.1016/0003-2697(76)90527-3
[ Links ]
Casado V. J. 2004. Aproximación cinética, molecular y proteómica al studio de la podredumbre apical en frutos de tomate (Lycopersicon esculentum M.): implicación de polifenol oxidase (PPO) y enzimas antioxidants. Tesis de Doctorado. Universidad de Alicante. P-113 http://hdl.handle.net/10045/9919
[ Links ]
Chenyang H., Hsiang T., Wolyn D. 2001. Activation of defense responses to Fusarium infection in Asparagus densiflorus. European Journal of Plant Pathology 107:473-483. http://link.springer.com/article/10.1023/A:1011218304331
[ Links ]
Christopoulos M. V. and Tsantili E. 2015. Participation of phenylalanine ammonia-lyase (PAL) in increased phenolic compounds in fresh col stressed walnut. (Juglans regia L.) Kernels. Postharvest Biology and Technology 104: 17-25 http://dx.doi.org/10.1016/j.postharvbio.2015.03.003
[ Links ]
Díaz M., Pérez Y., Cazaña Y., Prieto M., Wencomo H. y Lugo Y. 2010. Determinación de antioxidantes enzimáticos en variedades e híbridos de Morus alba. Pastos y Forrajes 3 (3) http://scielo.sld.cu/pdf/pyf/v33n3/pyf06310.pdf
[ Links ]
DGSV-Senasica y Mora-Aguilera G. 2012. Ficha técnica HLB Huanglongbing. 31 p. http://senasica.gob.mx/?id=4612
[ Links ]
Etxeberria E., Gonzalez P., Achor D. and Albrigo G. 2009. Anatomical distribution of abnormally high levels of starch in HLB-affected valencia orange trees. Physiological and Molecular Plant Pathology. 74: 75-83 DOI:10.1016/j.pmpp.2009.09.004
[ Links ]
Flores-Sánchez J. L, Mora-Aguilera G., Loeza-Kuk E, López-Arroyo. J. I., Domínguez-Monge S, Acevedo-Sánchez. G. y Robles-García P. 2015. Pérdidas en producción inducidas por Candidatus Liberibacter asiaticus en limón persa en Yucatán, México. Revista Mexicana de Fitopatología 33: 195-210. http://www.redalyc.org/articulo.oa?id=61242145005
[ Links ]
Folimonova S. Y., Robertson C. J., Gansey S. M, Gowda S. and Dawson O. 2009. Examination of the responses of different genotype of citrus to Huanglongbing (Citrus Greening) under different conditions. Phytopathology. 99 (12):1346-1354. http://apsjournals.apsnet.org/doi/pdfplus/10.1094/PHYTO-99-12-1346
[ Links ]
García A. H. y Vázquez D. R. 1998. Cuantificación de proteínas: una revisión. Bitácora. Biotecnología 3: 77-88. www.smbb.com.mx/revista/Revista_1998_2/bitacora.pdf
[ Links ]
Kähkönen, M.P., Hopia A. I., Heikki J. V., Jussi P. R., Pihlaja K., Kujala T. S., and Heinonene M. 1999. Antioxidant activity of plant extracts containing phenolic compounds. Journal of Agricultural and Food Chemistry 47:3954-3962 http://pubs.acs.org/doi/abs/10.1021/jf990146l
[ Links ]
Kim J.S., Sagaram U. S., Burns J.K., Li J.L., Wang N. 2009 Response of sweet orange (Citrus sinensis) to ‘Candidatus Liberibacter asiaticus’ infection: microscopy and microarray analyses. Phytopathology 99:50-57 http://dx.doi.org/10.1094/PHYTO-99-1-0050
[ Links ]
Koh E-J., Zhou L., Williams D. S., Park J., Ding N., Duam J-P. and Kang B-H. 2012. Callose deposition in the phloem plasmodesmata and inhibition of phloem transport in citrus leaves infected with “Candidatus Liberibacter asiaticus”. Protoplasma. 249: 687-697. DOI: 10.1007/s00709-011-0312-3
[ Links ]
Lozoya S. H., Rivera H. R. y Colinas-León. M. T. 2007. Fenoles, peroxidasa y fenilalanina amonio-lyasa: su relación con la resistencia genética de clones de papa (Solanum tuberosum L.) contra el tizón tardío (Phytophthora infestans Mont. De Bary). Agrociencia 41: 479-489 https://dialnet.unirioja.es/servlet/articulo?codigo=2284649
[ Links ]
Lu L., Wang J., Zhu R., Lu H., Zheng X. and Yu T. 2015. Transcript profiling analysis of Rhodosporidium paludigenum mediated signalling pathways and defense responses in mandarin orange. Food Chemistry. 172: 603-612. http://dx.doi.org/10.1016/j.foodchem.2014.09.097
[ Links ]
Martinelli F., Reagan R. L., Dolan D., Fileccia V. and Dandekar A. M. 2016. Proteomic analysis highlights the role of detoxification pathways in increased tolerance to Huanglongbing disease. BMC Plant Biology 16:167 DOI 10.1186/s12870-016-0858-5
[ Links ]
Menéndez A. O., Evangelista L. S., Arenas O. M., Bermúdez T. K., Del Villar M. A., Jiménez A. A. 2006. Cambios en la actividad de α-amilasa, pectinmetilesterasa y poligalacturonasa durante la maduración del maracuyá amarillo (Passiflora edulis Var. Flavicarpa Degener). Interciencia. 31(10): 728-733. ISSN 0378-1844
[ Links ]
Mora-Aguilera, G., Robles-García, P., López-Arroyo, J. I., Flores-Sánchez, J., Acevedo-Sánchez G., Domínguez-Monge S., Gutiérrez-Espinosa A., Loeza-Kuk E., González-Gómez R. 2014. Situación actual y perspectivas del manejo del HLB de los cítricos. Revista Mexicana de Fitopatología. 32(2): 108-119. http://www.redalyc.org/articulo.oa?id=61243856003
[ Links ]
Paz-Lago. D., Cabrera G., Ramírez M., Pombo R. y Gutiérrez A. 1999. Influencia de derivados de quitina en la interacción tomate-Fusarium oxysporum f.sp. licopersici a nivel de bioensayo. Cultivos Tropicales 20:59-66. http://www.sidalc.net/cgi-bin/wxis.exe/?IsisScript=ctrop.xis&method=post&formato=2&cantidad=1&expresion=mfn=000790
[ Links ]
Robinson, D. S. 1991. Peroxidases and their significance in fruits and vegetables. In: Fox P. F. (ed). Food Enzimology. Vol. 1. Elsevier, London. pp: 399-426.
[ Links ]
Rodríguez-Pedroso A. T., Ramírez-Arrebato M. A., Cárdenas-Traviéso R. M., Falcón-Rodríguez A., Bautista-Baños S. 2006. Efecto de la quitosana en la inducción de la actividad de enzimas relacionadas con la defensa y protección de plántulas de arroz (Oryza Sativa L.) contra Pyricularia grisea sacc. Revista Mexicana de Fitopatología, 24, 1; 1-7. https://www.researchgate.net/profile/Silvia_Bautista-Banos/publication/237037513_Efecto_de_la_Quitosana_en_la_Induccion_de_la_Actividad_de_Enzimas_Relacionadas_con_la_Defensa_y_Proteccion_de_Plantulas_de_Arroz_Oryza_sativa_L_contra_Pyricularia_grisea_Sacc/links/0deec51b2975c15955000000.pdf
[ Links ]
Rüttimann, C., E. Schwember, L. Salas, D. Cullen, and R. Vicuna. 1992. Ligninolytic enzymes of the white rot basidiomycetes Phlebia breviospora and Ceriporiopsis subvermispora. Biotechnology and Applied Biochemistry 16:64-76.
[ Links ]
Senasica-Sagarpa. 2010. Protocolo de diagnóstico de Candidatus Liberibacter spp mediante la Técnica Reacción en Cadena de la Polimerasa (PCR) en Tiempo Real. Dirección General de Sanidad Vegetal.
[ Links ]
SIGMA-ALDRICH. 2015 http://www.sigmaaldrich.com/technicaldocuments/protocols/biology/enzymaticassayofaamylase.printerview.html
[ Links ]
Singleton, V. L., Orthofer, R., Lamuela-Raventos R. M. 1999. Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteau reagent. Methods in Enzymology 299: 152-178 http://dx.doi.org/10.1016/S0076-6879(99)99017-1
[ Links ]
Trotel-Aziz. P., Couderchet M., Biagianti S. and Aziz A. 2008. Characterization of new bacterial biocontrol agents Acinetobacter, Bacillus, Pantoea and Pseudomonas spp. mediating grapevine resistance against Botrytis cinérea. Enviromental and Experimental Botany. 64: 21-32. http://dx.doi.org/10.1016/j.envexpbot.2007.12.009
[ Links ]
Wang C.Y. 1995. Effect of temperature preconditioning on catalase, peroxidase, and superoxide dismutase in chilling zucchini squash. Postharvest Biology and Technology 1: 33-45. doi:10.1016/0925-5214(94)00020-S
[ Links ]
Zhong Y., Cheng C. Z., Jiang N. H., Jiang B., Zhang Y. Y., Wu B., Hu M. L., Zeng J. W., Yan H. X., Yi G. J., Zhong G. Y. 2015. Comparative transcriptome and iTraq proteome analyses of citrus root responses to Candidatus Liberibacter asiaticus infection. PLoS ONE. 10(6):e0126973. http://dx.doi.org/10.1371/journal.pone.0126973
[ Links ]













 texto en
texto en 


