El viroide exocortis de los cítricos (CEVd) es un patógeno que causa síntomas reducción de crecimiento, desprendimiento y agrietamiento de la corteza, epinastia de hojas y grietas en el peciolo (Bernard et al., 2009) afecta a diferentes especies de cítricos como Poncirus trifoliata y sus híbridos, lima rangpur (Citrus limonia), limón (C. limon) y citron etrog (C. medica) (Lin et al., 2015a), tiene varios hospedantes como vid (Vitis vinifera), jitomate (Lycopersicum esculentum), haba (Vicia faba), pepino (Cucumis sativus), ortiga de terciopelo (Gynura aurantiaca), crisantemo (Crysanthemum morifolium), impatiens (Impatiens walleriana), verbena (Verbena x hybrida) (Škorić et al., 2001; Singh et al., 2009; Palukaitis, 2014) y petunia (Petunia spp.) (Van Brunschot et al., 2014). La transmisión del viroide se lleva a cabo por injerto de yemas infectadas en árboles sanos o de forma mecánica (Lin et al., 2015a) a través del uso de la herramienta de corte y poda contaminada. El control químico para el combate de la enfermedad no existe y el único medio de control es la prevención con el uso de material propagativo libre de viroides (Papayiannis, 2014; Gergerich et al., 2015) que provenga de bancos de germoplasma y viveros que cumplan de forma obligatoria con diagnósticos biológicos y moleculares (NAPPO, 2013).
El diagnóstico biológico por indexado es una herramienta eficiente para comprobar el estado fitosanitario de una planta respecto a una enfermedad mediante la inoculación por injerto de yema o cualquier otro tejido infectado en plantas indicadoras que permitan la replicación del viroide, la manifestación de síntomas (Roistacher, 1991; Hajeri et al., 2011) y el aumento de su concentración. El indexado in vivo para el diagnóstico del CEVd puede durar 90 días (Malfitano et al., 2005; Bani et al., 2015; Lin et al., 2015a), es laborioso, requiere de invernaderos tecnificados y dificulta el análisis de grandes cantidades de plantas, lo que disminuye la posibilidad de crear nuevos bancos de germoplasma para conservar y propagar variedades sanas. Actualmente solo existen dos bancos de germoplasma en México (DGSV, 2016) que cumplen con los requisitos y diagnósticos oficiales establecidos por el SENASICA, uno de los cuales es operado por la misma institución y el otro pertenece al sector privado. Un diagnóstico rápido, exacto y confiable de una enfermedad es la base del éxito para la conservación de germoplasma, la importación, introducción y propagación comercial de yemas de cítricos libres de viroides.
El efecto de los viroides sobre el rendimiento y calidad de la cosecha de los cítricos son altamente dependientes de la especie, variedad, patrón, tipo de aislamiento viroidal y de las condiciones ambientales en que se desarrollan (Pethybridge et al., 2008). El estudio de las condiciones que afectan el desarrollo de una enfermedad permiten generar modelos de predicción, detectar posibles variables climáticas asociadas con cambios, determinar la intensidad de la enfermedad, establecer medidas de manejo para reducir el posible efecto de la incidencia y severidad en campo o acelerar la velocidad de la enfermedad con fines de diagnóstico. El desarrollo de síntomas característicos de viroides en plantas de interés económico mediante el uso de cultivo in vitro ha mostrado ser una herramienta eficaz en estudios relacionados con transmisión (El-Dougdoug et al., 2010; Mahfouze et al., 2010; Černi et al., 2012) y diagnóstico por indexado (Kapari et al., 2008). Técnicas alternativas al diagnóstico oficial por indexado que permitan conocer el comportamiento de los viroides en ambientes controlados pueden ser útiles en el desarrollo de diagnósticos oportunos, la prevención de la enfermedad y el establecimiento de medidas de manejo. Con base en lo anterior, el objetivo de este trabajo fue caracterizar al CEVd en condiciones de indexado in vitro e in vivo comparando la eficiencia de transmisión y el tiempo necesario para el desarrollo de síntomas causados por el viroide para establecer su aplicabilidad en el diagnóstico biológico.
Materiales y métodos
Cultivo de callos y brotes
Varetas de 8 cm longitud y 3 mm de diámetro de citron etrog (C. medica) se disectaron de plantas sanas e infectadas con CEVd aislamiento E811 cultivadas en invernadero. El material vegetal infectado con CEVd fue obtenido de la colección de la DGSV-SENASICA en México procedente de USDA-ARS. Las varetas se lavaron con jabón líquido y agua corriente, se desinfestaron con 0.5 % de hipoclorito de sodio durante un minuto, 70 % de etanol durante 50 segundos y finalmente se enjuagaron tres veces con agua destilada estéril en condiciones asépticas dentro de una campana de flujo laminar. Las varetas se dividieron en segmentos de 3 cm de largo, se disectaron longitudinalmente y se cultivaron in vitro con la superficie cortada en contacto con el medio. Los explantes se cultivaron en cada frasco de 8 cm de diámetro por 12 cm de alto. El medio para inducción de callo contenía sales inorgánicas de Murashige and Skoog (1962) suplementado con i-inositol (100 mg L-1), tiamina HCl (0.1 mg L-1), piridoxina HCl (0.5 mg L-1), ácido nicotínico (0.5 mg L-1), sacarosa (30 g L-1), ácido naftalenácetico (10 mg L-1) y 6-benzilaminopurina (0.25 mg L-1) de acuerdo con el procedimiento de Duran et al. (1989) y Navas et al. (1995). El medio se ajustó a pH de 5.7, se solidificó con 2.8 g L-1 de phytagel® Sigma y se esterilizó en autoclave a 116 °C por 20 minutos. Los cultivos se mantuvieron en oscuridad a 26 °C ± 2 °C durante 3 semanas hasta la formación de callo y se seleccionaron aquellos que no presentaron contaminación por hongos saprófitos o bacterias. Pequeñas porciones de callo de 3 mm se utilizaron para el indexado in vitro una vez que se detectó la presencia de CEVd por RT-PCR.
Se obtuvieron tallos con brotes de 4 a 5 cm de largo de plantas de citron etrog cultivadas en invernadero sin historial de infección y negativas a CEVd por RT-PCR. Los tallos con brotes se lavaron y desinfestaron superficialmente con el procedimiento descrito anteriormente y se sumergieron durante 1 minuto en solución de estreptomicina (200 mg L-1) para eliminar bacterias del tejido. Los brotes se disectaron para cortar secciones de tallo de 1.5 ± 0.5 cm de las plantas y se cultivaron en medio MS (Murashige and Skoog, 1962) adicionando 30 g L-1 de sacarosa. El medio se ajustó a pH de 5.7 y se dispensó 25 ml en tubos de ensayo y se esterilizó en autoclave a 116 °C por 20 minutos. El medio se solidificó con 3.0 g L-1 de phytagel® (Sigma). Los brotes se incubaron a 25 ± 2 °C con fotoperiodo de 12 horas luz y después de 48 horas de incubación los brotes que no presentaron contaminación por hongos saprófitos o bacterias se seleccionaron para indexar.
Indexado in vitro
Los brotes se inocularon por injerto lateral en forma de lengüeta de 2-3 mm de largo con callo. Los brotes inoculados fueron transferidos a tubos nuevos de cultivo que contenían medio MS sólido estéril y se incubaron durante 50 días a 25 ±2 °C con fotoperiodo de 16 horas. Las navajas utilizadas durante la inoculación se desinfestaron entre tratamientos por inmersión en solución con 1 % de hipoclorito de sodio durante 15 segundos para prevenir infecciones cruzadas (Kovalskaya y Hammond, 2014). Durante el ensayo se registró el número de brotes con síntomas y se midió la altura directamente sobre el brote con un vernier digital en la campana de flujo laminar. La presencia de CEVd en los brotes se detectó por reacción en cadena de la polimerasa con transcriptasa reversa (RT-PCR).
Indexado in vivo
Plantas indicadoras de citron etrog con diagnóstico negativo a CEVd por RT-PCR se inocularon con injertos de yema y como testigo se usaron plantas no injertadas. Las yemas injertadas provenían de plantas que se diagnosticaron previamente como libres o infectadas con CEVd. Durante el establecimiento del ensayo, las plantas se podaron a 30 cm de altura y todas las hojas se eliminaron al momento de injertar para permitir el desarrollo de nuevos brotes. El injerto de yema se realizó de acuerdo con el método de Roistacher (1991). Las navajas utilizadas durante la inoculación se desinfestaron entre tratamientos y repeticiones por inmersión en una solución con 1 % de hipoclorito de sodio durante un minuto para prevenir infecciones cruzadas (Kovalskaya y Hammond, 2014). Las plantas fueron cultivadas de forma individual en macetas de plástico de 4 L y mantenidas en invernadero con 28-32 °C. Durante año y cuatro meses se registró el desarrollo de síntomas descritos por Roistacher (1991) y Bernard et al. (2009), se detectó la presencia de CEVd por RT-PCR y se midió la altura del nivel del suelo hasta el brote más alto.
Detección de CEVd por RT-PCR
Las varetas de citron que sirvieron como fuente de material vegetal para el cultivo de callos y brotes fueron diagnosticadas a la presencia o ausencia de CEVd una semana antes de colectar el material. Los brotes indexados se diagnosticaron a los 60 días después de la inoculación y las plantas de citron del indexado in vivo se diagnosticaron una semana antes y 180 días después de injertar. La presencia de CEVd en callos, yemas, brotes indexados cultivados in vitro y en plantas indexadas en invernadero se confirmó por RT-PCR. El RNA total se extrajo con los reactivos y el protocolo de RNeasy Plant Mini® de Qiagen y la síntesis de cDNA se llevó a cabo con la enzima SuperScripTM II Reversa Transcriptasa (Invitrogen Corp.) siguiendo las instrucciones del fabricante. La amplificación del cDNA viroidal por PCR se llevó a cabo con los iniciadores CEVd1 5’-CCC TGA AGG ACT TCT TCC CC- 3’ y CEVd2 5’-ATC CCC GGG GAA ACC TGG AGG AA -3’ que amplifican un fragmento de 371 pb (Yang et al., 1992) de acuerdo con las condiciones de Bernad et al. (2009) usando y Platinum® Taq polimerase high fidelity (Invitrogen Corp.). Los productos de la reacción fueron analizados por electroforesis en gel de agarosa al 2 % teñido con bromuro de etidio (0.5 μg ml-1), visualizado en luz UV y fotodocumentado en un equipo Gel Doc EZ system® (Biorad). Los fragmentos obtenidos de la RT-PCR fueron secuenciados en un equipo Genetic Analyzer 3100 de Applied Biosystem Corp. Las secuencias se editaron con el programa Chromas V. 2.5.0, se alinearon con Clustal W en el programa Mega v.7.0.14 (Kumar et al., 2016) y se obtuvo una secuencia consenso con el programa Seaview v.4.5.4 (Gouy et al., 2010). La secuencia consenso se comparó con la secuencia del aislamiento de origen y con secuencias depositadas en el National center for biotechnology information (NCBI, 2010) a través de la opción BLASTn ver 2.3.0 (Altschul et al., 1990).
Sensibilidad, especificidad y exactitud de la RT-PCR: Los parámetros asociados al diagnóstico por RT-PCR se calcularon para los tratamientos injertados con tejido infectado por CEVd en cada procedimiento de indexado de acuerdo con Papayiannis, 2014. Las fórmulas de cálculo fueron: sensibilidad= (muestras positivas/ muestras positivas+ falsos negativos)* 100; especificidad= (muestras negativas/ muestras negativas+ falsos positivos)* 100; exactitud= (muestras negativas+ positivos/ negativos+ positivos+ falsos negativos+ falsos positivos)* 100.
Eficiencia del indexado: La eficiencia del indexado (Ɵ) se determinó como la probabilidad de expresión de síntomas (P) en muestras inoculadas con tejido infectado (n) con un nivel de confianza del 95 %, de acuerdo a la metodología de Vidalakis et al. (2004). La eficiencia se calculó con la fórmula Ɵ= 1- (1-PL) n usando el límite inferior de probabilidad de Clopper y Pearson (PL= 0.7935 calculado para 16 unidades) y n=4 como el número mínimo de muestras recomendado por Roistacher (1991) y Vidalakis et al. (2004) para el diagnóstico de CEVd por indexado.
Diseño experimental y análisis estadístico: Se utilizó un diseño experimental de parcelas divididas en el tiempo por cada condición de indexado (in vitro e in vivo). La parcela grande fueron los tratamientos y la parcela chica el tiempo transcurrido en días después de la inoculación (ddi). El indexado biológico in vitro de CEVd se conformó de cuatro experimentos separados en tiempo que incluyeron tres tratamientos con cuatro repeticiones: la inoculación de brote con callo infectado por CEVd (T1), la inoculación con callo sano (T2) y brote sin inocular como testigo (Ta) con un total de 48 muestras analizadas. Las variables que se evaluaron fueron incidencia de brotes con síntomas a los 10, 15 y 20 ddi y altura acumulada a partir de la altura inicial a los 10, 20, 30 y 40 ddi.
El indexado biológico in vivo consistió en evaluar cuatro experimentos con tres tratamientos: planta inoculada con yemas infectadas por CEVd (T3), planta inoculada con yemas sin evidencia de infección por CEVd por RT-PCR e indexado (T4) y planta no inoculada como testigos (Tb) con un total de 48 muestras analizadas y cuatro repeticiones por tratamiento. Las variables que se evaluaron fueron incidencia a los 40, 50 y 60 días después de la inoculación (ddi) y altura acumulada a partir de la altura inicial a los 10, 20, 30, 40 y 180 ddi. Los datos de las variables se sometieron a un análisis de varianza y prueba de comparación de medias de Tukey con un nivel de confianza del 95 % con el paquete estadístico Statistical Analysis System ver 9.0 (2002). Se calculó el área bajo la curva del progreso de la enfermedad en brotes y plantas infectados con el método del trapecio en el programa ABCDPE ver 1.1 (Mora y Acevedo, 2016).
Resultados y discusión
Detección por RT-PCR: Las muestras infectadas de ambos indexados resultaron positivas a CEVd con 94 a 100 % de sensibilidad en la RT-PCR (Cuadro 1). Los brotes injertados con callo sano, plantas injertadas con yema sana y los testigos resultaron negativos (Figura 1). La detección de CEVd en las muestras del indexado in vitro de este estudio concuerdan con los resultados obtenidos por Hajeri et al. (2011) quienes lograron detectar la presencia de CEVd en plántulas desarrolladas in vitro inoculadas con protoplastos de callos infectados. Para evaluar la sensibilidad, especificidad y exactitud en este trabajo, se consideró como falsos negativos a muestras que presentaron síntomas de CEVd pero que no amplificaron por RT-PCR lo cual pudo deberse a la presencia de inhibidores en la reacción o al uso de una transcriptasa reversa poco termoestable, estas deficiencias pueden ser superadas con protocolos más sensibles (Guerrero et al., 2013; Papayiannis,2014) que permitan incrementar la temperatura de síntesis de cDNA del viroide y disminuir la formación de estructuras secundarias del ARN de interés. La especificidad y exactitud en los indexados fue del 97 a 100 %, valores que nos indican el estado fitosanitario de las muestras. Los resultados de la secuenciación mostraron que los fragmentos obtenidos correspondían al Citrus exocortis viroid con 99 % de similitud y 99 % de cobertura con un tamaño de 310 pb indicando su presencia en las plantas indicadoras. Probablemente el alto valor de similitud encontrado se deba a que la composición genética del viroide suele no variar cuando es inoculado en el mismo tipo de hospedero de donde se aisló originalmente y a que los viroides se componen de haplotipos estrechamente relacionados (Bernard et al., 2009). La detección de viroides en cítricos por RT-PCR es una herramienta útil (Saponari et al., 2013; Papayiannis, 2014) que no representa una desventaja al diagnóstico biológico ya que las aportaciones del indexado están relacionadas con el estudio de la interacción planta patógeno en un ambiente controlado de desarrollo de la enfermedad. En infecciones asintomáticas en que no hay evidencia visual de la infección por viroides en el hospedante (Kovalskaya y Hammond, 2014) la detección por RT-PCR puede contribuir a determinar la presencia y constitución genética de CEVd y un ensayo de indexado que incluya diferentes hospedantes puede determinar cuáles son potencialmente susceptibles y el grado de daño que puede llegar a causar una enfermedad.
Cuadro 1. Sensibilidad, especificidad, exactitud y eficiencia asociados al diagnóstico de CEVd por RT-PCR e indexado.
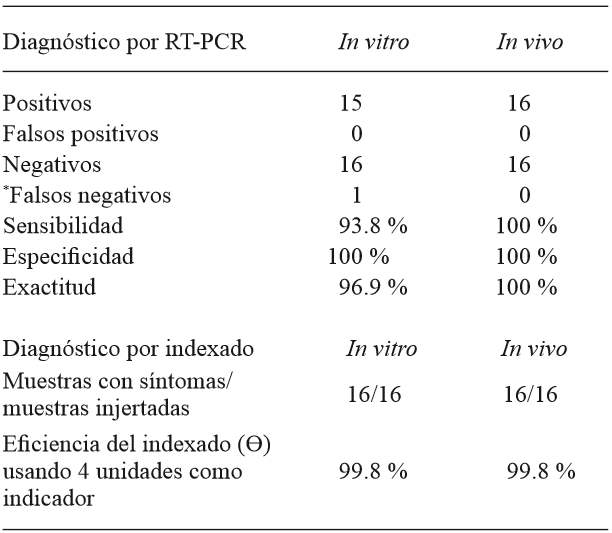
Sensibilidad= (muestras positivas/ muestras positivas+ falsos negativos)* 100; Especificidad= (muestras negativas/ muestras negativas+ falsos positivos)* 100; Exactitud= (muestras negativas + positivos / negativos + positivos+ falsos negativos+ falsos positivos)* 100; Eficiencia (Ɵ)= 1- (1-PL) n; con probabilidad de Clopper y Pearson PL = 0.7935 y n= 4. *Para fines comparativos en éste trabajo se consideró como falso negativo la ausencia de amplificación por RT-PCR en muestras con síntomas.
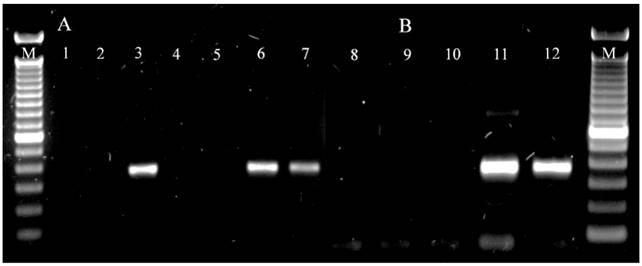
Figura 1. Detección de Citrus exocortis viroid por RT-PCR. (A) Carriles 1-7: Indexado in vitro, M: marcador de 100 pb Invitrogen®, 1: control negativo sin ADN molde, 2: callo sano, 3: callo infectado, 4: brotes no injertados, 5: brotes injertados con callo sano, 6: brotes injertados con callo infectado 7: control positivo de tejido infectado. (B) Carriles 8-12: Indexado in vivo, 8: control negativo sin ADN molde, 9: plantas no injertadas, 10: plantas injertadas con yema sana, 11: plantas injertadas con yema infectada, 12: control positivo de CEVd. El fragmento amplificado corresponde a 371 pb. La imagen es representativa de un total de 48 muestras analizadas in vitro y 48 muestras in vivo.
Altura, incidencia y ABCP
Se presentaron diferencias altamente significativas (p ≤ 0.01) entre tratamientos, tiempo (ddi) y la interacción tratamiento* tiempo para las variables evaluadas en ambos procedimientos de indexado (Cuadro 2). La altura media acumulada de los tratamientos in vitro fue 35.8 mm en testigo; 32.1 mm en brotes injertados con callos sanos y 19.3 mm en brotes injertados con callos infectados; mientras que para indexado en invernadero fueron 156.5 mm para testigo, 162.9 mm para plantas injertadas con yema sin infección y 106.7 mm para plantas injertadas con yemas infectadas. Existieron diferencias significativas en las alturas de los brotes in vitro en todas las fechas de evaluación. En las plantas indexadas en invernadero se encontraron diferencias significativas (p ≤ 0.05) a los 10 días después de la inoculación y altamente significativas a los 180 días. Se observó incremento de altura más o menos constante a través del tiempo en los tratamientos inoculados con callo o yema sana con respecto al testigo mientras que la altura de los tratamientos infectados fue 46 % menor (Figura 2A-B). Las diferencias en la altura de los brotes inoculados y los testigos del indexado in vitro observados en este estudio son parecidos a los resultados obtenidos por Černi et al. (2012) quienes compararon la altura de brotes de Gynura aurantiaca infectados por CEVd cultivados in vitro con valores estadísticos de altura mayores en los brotes sanos. En el indexado in vivo la altura de plantas injertadas con yemas infectadas fue 42 % menor con respecto al testigo, síntoma que se asocia a la infección de CEVd en plantas de cítricos (Kovalskaya y Hammond, 2014). Las diferencias en altura entre tratamientos parecen estar relacionadas con la expresión diferencial de auxinas y citoquininas incluyendo la función de los meristemos ápicales y laterales, los procesos de inmunidad de las plantas y la respuesta al estrés biótico o abiótico (Argueso et al., 2010; Naseem y Dandekar, 2012) como el causado por una infección con CEVd. Probablemente el contenido de auxinas promovió la dominancia apical en los brotes y plantas sanas de éste trabajo resultando en mayor altura, mientras que altos contenidos de citocininas en plantas y brotes infectados por CEVd pudieron inhibirla (Laplaze et al., 2007; Shimizu et al., 2009; Naseem y Dandekar, 2012) debido al impacto de las citoquininas en el flujo, distribución y señalización de la auxina (Shimizu et al., 2009).
Cuadro 2. Cuadrados medios de la altura e incidencia acumulada en dos condiciones de indexado.
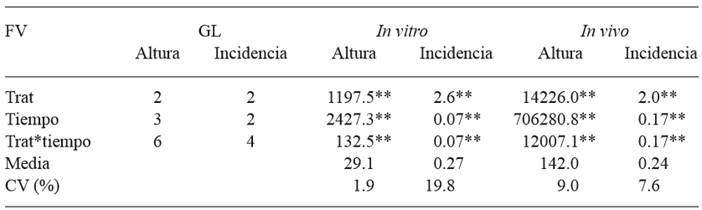
FV: factor de variación, GL: grados de libertad, Trat: tratamiento, CV: coeficiente de variación, **: altamente significativo (p ≤ 0.01).
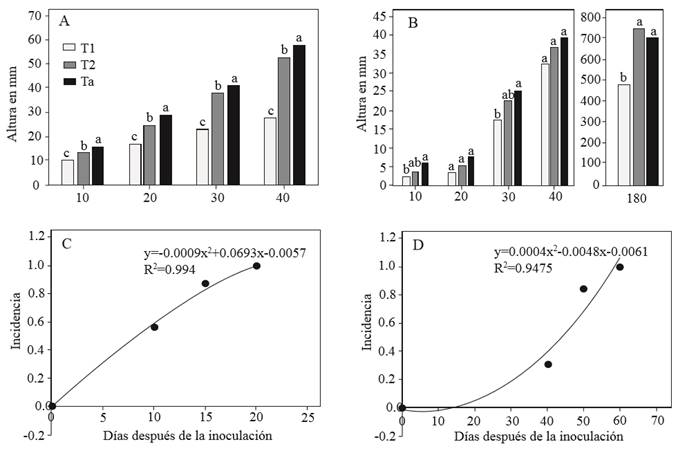
Figura 2. Comparación de medias de altura y curva de incidencia en brotes cultivados in vitro (A, C) y plantas injertadas in vivo (B, D). Letras distintas en las columnas son estadísticamente diferentes con Tukey (p=0.01). T1: brotes injertados con callo infectado, T2: brotes injertados con callo sano, Ta: brotes no injertados, T3: plantas injertadas con yema infectada, T4: plantas injertadas con yema sana, Tb: plantas no injertadas. La línea y el modelo (C, D) representan el ajuste mediante una regresión cuadrática.
La incidencia en los brotes cultivados in vitro se incrementó a través del tiempo alcanzando la tasa más alta 20 ddi por injerto comparado con la curva de progreso de la enfermedad in vivo (Figura 2C-D) donde se alcanzó la máxima tasa el día 60 después de injertar. El indexado in vitro disminuyó 75 % el tiempo requerido para la aparición de síntomas típicos de la enfermedad después de la inoculación comparado con los ensayos del indexado in vivo, los cuales requirieron 30 días más. Una evaluación detallada del tiempo necesario para llevar a cabo un indexado podría incluir el tiempo de formación de callos in vitro (3 semanas). En este estudio solamente se consideró la variable ddi como el momento a partir del cual patógeno y hospedante están en contacto para la expresión de síntomas. Es cierto que el indexado in vitro requiere de tiempo para el desarrollo de los callos que servirán como inóculo, pero existe la posibilidad de utilizar otro tipo de tejido como la corteza de plantas infectadas (Kapari et al., 2008). Además, la presencia de CEVd en brotes y callos cultivados in vitro podría contribuir a desarrollar nuevas líneas de investigación de aspectos relacionados con la patogenicidad de los viroides ya que el cultivo de callo infectado es fácil de conservar y multiplicar y es un tejido útil cuando se requiere homogenizar la muestra. Trabajos futuros que contribuyan a determinar si callos infectados con CEVd pueden infectar plantas cultivadas en invernadero serían de utilidad en el indexado tradicional in vivo.
El progreso de la enfermedad se ajustó a un modelo de regresión cuadrática donde y= -0.0009x2+ 0.0693x– 0.0057, R2= 0.994 con p≤ 0.05 y ABCP= 10.781 para el indexado in vitro, mientras que para el indexado in vivo fueron y= 0.0004x2+ 0.0048x- 0.0061, R2= 0.947 no significativa, y el ABCP= 9.844. El método del área bajo la curva del progreso de la enfermedad permitió una mejor comparación de los ambientes en que se desarrolló el viroide con respecto al modelo de regresión cuadrático que resultó no significativo en el indexado in vivo debido a la forma irregular de los datos con respecto al tiempo. La incidencia inicial mayor in vitro durante la aparición de la enfermedad representó una menor tolerancia al desarrollo de síntoma de CEVd comparado con la incidencia inicial in vivo. El uso de la misma variedad indicadora en ambos indexados indica que la concentración y el tamaño del hospedante entre un indexado y otro (5-30 cm) pudieron ser los principales factores de influencia en el desarrollo de la enfermedad. La rapidez con la que aparecen los síntomas in vitro podría deberse al tiempo que requieren los viroides para replicarse y moverse dentro de la planta inoculada (Kapari et al., 2008). Posiblemente una mayor concentración derivada del tamaño de los brotes (5 cm) con respecto al tamaño de las plantas (30 cm) favoreció el rápido desarrollo de síntomas in vitro en éste estudio. Se ha demostrado que las temperaturas (24-40 °C) a las que se desarrollan los bioensayos contribuye a incrementar la concentración del viroide para la expresión de síntomas de CEVd (Škorić et al., 2001; Bernard et al., 2009; Bani et al., 2015) potenciándose en hospederos más pequeños. Otro factor implicado en el proceso de infección por viroides es el movimiento a larga distancia dentro del floema que permite alcanzar hojas, raíces y órganos lejos de los tejidos inicialmente infectados (Bani et al., 2010). En éste trabajo, la distancia de movimiento de CEVd en plantas con raíces del indexado in vivo fue mayor comparada con los brotes cultivados in vitro retardando el proceso de infección y en consecuencia la expresión de síntomas.
Eficiencia del indexado
Los resultados de este estudio indican que ambos indexados in vitro e in vivo fueron 99 % eficientes (Cuadro 1). Un protocolo de indexado con una cantidad suficiente de indicadores biológicos puede considerarse eficiente si al menos un indicador biológico expresa síntomas. La cantidad de indicadores biológicos está determinada por el tipo de aislamiento, el tipo de infección o coinfección con otros patógenos y la capacidad de tener al menos un 99 % de eficiencia con una confianza del 95 % (Vidalakis et al., 2004). Los brotes cultivados in vitro injertados con callo infectado mostraron síntomas de epinastia, reducción de crecimiento, hojas de tamaño reducido, rugosas y con puntas secas (Figura 3) que coinciden con lo reportado por Kapari et al. (2008) en brotes injertados con corteza infectada de CEVd. No se observaron síntomas en los brotes injertados con callo sano ni en los brotes testigo. Las plantas injertadas con yemas infectadas con CEVd presentaron síntomas de epinastia leve a severa, hojas arrugadas y torcidas hacia el envés con grietas de color café claro a oscuro en peciolo y ramas, ampollas en peciolo y crecimiento reducido que concuerdan con reportes de bioensayos de transmisión de CEVd en plantas de C. medica Arizona 861-S desarrolladas en invernadero (Bani et al., 2015; Lin et al., 2015a). El uso del cultivo in vitro en este estudio demostró ser útil para llevar a cabo la trasmisión y desarrollo de síntomas característicos de CEVd con una eficiencia similar a los procedimientos de indexado in vivo, tal como se reporta en otros estudios para enfermedades asociadas a viroides en plantas de interés económico (El-Dougdoug et al., 2010; Mahfouze et al., 2010; Černi et al., 2012). La presencia de síntomas en las muestras puede facilitar el diagnóstico molecular de los viroides (Camps et al., 2014) porque se distribuyen de manera heterogénea en los tejidos de las plantas (Bani et al., 2015; Lin et al., 2015b) y es difícil determinar si el tejido muestreado corresponde al tejido infectado a menos que la expresión de síntomas sirva como indicador.

Figura 3. Síntomas asociados a Citrus exocortis viroid (CEVd) en brotes de Citrus medica inoculados in vitro (A epinastia y B: puntas secas) y en plantas cultivadas in vivo (D: epinastia y E: grietas en el envés). Brotes (C: sin síntomas) y plantas (F: sin síntomas) testigo.
La evaluación de la eficiencia en los métodos de indexado puede proveer de herramientas para personalizar los procesos a las necesidades específicas. Las condiciones, así como el número de indicadores usados en el diagnóstico puede ajustarse con base en la probabilidad de expresión de síntomas para minimizar el costo general del diagnóstico (Vidalakis et al., 2004). Las condiciones in vitro abren una posibilidad de mejora a la dinámica actual del indexado aplicable en los programas de certificación de material propagativo de cítricos para discriminar el material infectado por CEVd de forma rápida. La prevención de enfermedades viroidales en bancos de germoplasma se realiza a través del diagnóstico conjunto de indexado y pruebas de RT-PCR. El cumplimiento de los programas de certificación establecidos por la Organización Europea y Mediterránea de Protección de Plantas (EPPO) y la Organización de Protección de Plantas en América del Norte (NAPPO) han resultado en un control efectivo de enfermedades causadas por viroides (Barba et al., 2003; Gergerich et al., 2015). El procedimiento de indexado in vitro desarrollado en este estudio se suma a los esfuerzos de los programas de cuarentena y certificación de germoplasma con métodos alternativos al diagnóstico tradicional que minimicen los riesgos de epidemias causadas por viroides.
Conclusiones
El indexado in vitro de CEVd tiene la misma eficiencia que un diagnóstico in vivo y requiere de 20 a 40 días menos para alcanzar la máxima incidencia después de la inoculación. El cultivo de callos durante 3 semanas previo a la inoculación requiere ser sustituido por otro tipo de tejido no cultivado para reducir el tiempo total del indexado in vitro. El indexado in vitro para detección y diagnóstico de CEVd ofrece la posibilidad de sustituir al método tradicional in vivo en los procedimientos de certificación de cítricos para la formación de Bancos de Germoplasma.











 texto en
texto en 


