El chile (Capsicum annuum) es uno de los cultivos agrícolas importantes de México (Castro-Rocha et al., 2012) y es un componente básico de la dieta de la población (Rico-Guerrero et al., 2004). De acuerdo al Sistema de Información Agroalimentaria y Pesquera (SIAP) para el 2014 la superficie sembrada fue de 148,968.51 ha con un rendimiento promedio nacional de 19.05 ton/ha constituyendo un valor estimado de más de 17 millones de pesos. Sin embargo, de la superficie sembrada solo se cosecharon 143,465.17 ha; entre los factores que afectan la producción está el ataque por fitopatógenos que afectan la raíz como Rhizoctonia solani, Fusarium spp, Pythium spp y Phytophthora capsici. (Velásquez-Valle et al., 2001). Este último es considerado un patógeno devastador capaz de infectar tanto las raíces como la parte aérea (Hwang y Kim, 1995; Erwin y Ribeiro, 1996; Ristaino y Johnston, 1999; Lamour et al., 2012), causa la marchitez del chile junto con un complejo fúngico en el que recurrentemente se aíslan R. solani y Fusarium spp (Ramos-Sandoval et al., 2010). El control se ha dirigido principalmente contra P. capsici mediante prácticas culturales, variedades resistentes y aplicación de químicos, siendo estos últimos los más utilizados. Sin embargo, los altos costos de producción y problemas inherentes al uso frecuente de los químicos obligan a buscar alternativas para el manejo de estos patógenos.
Una alternativa de manejo de enfermedades lo constituye el control biológico mediante la introducción de organismos antagónicos, que integrado con otros métodos puede contribuir de manera significativa al manejo efectivo de las enfermedades radicales (Ait-Lahsen et al., 2001). El hongo Saccharicola sp produce metabolitos secundarios denominados “poliquétidos” (Rojas et al., 2011; Chapla et al., 2012), que actúan como antibióticos (eritromicina y tetraciclinas), anticancerígenos (epotilonas), inmunosupresores (rapamicina) y anticolesterémicos (lovastatina) (Kwan y Schulz, 2011; Rojas et al., 2011).
Recientemente (Silva, 2015) se aisló a Saccharicola sp a partir de plantas de tule (Typha domingensis) y sabiendo de su potencial como productor de metabolitos tóxicos, se realizaron ensayos preliminares in vitro para probar sus propiedades antimicrobianas. Con anterioridad Chapla et al. (2012) habían reportado el efecto antifúngico de Saccharicola sp contra Fusarium spp, Cladosporium cladosporioides, C. sphaerospermum y Microbotryum violaceum. El género Saccharicola es un endófito que ha sido aislado de diferentes especies de Saccharum (Leme et al., 2013) y de plantas acuáticas como Eichhornia azurea y E. crassipes (Almeida et al., 2015), entre otras especies de plantas. Con base en lo anterior, se consideró relevante investigar qué potencial tiene el hongo Saccharicola sp como antagonista de patógenos de la raíz que causan las mayores pérdidas en chile. Así el objetivo del presente trabajo fue evaluar el efecto antagónico de Saccharicola sp contra P. capsici, F. oxysporum y R. solani en condiciones in vitro e invernadero.
Materiales y métodos
El presente trabajo se realizó en los laboratorios e invernaderos del Colegio de Postgraduados en Ciencias Agrícolas, Campus Montecillo, ubicado en el municipio de Texcoco, Estado de México. Los aislamientos utilizados fueron: Phytophthora capsici 6143 proporcionado por la Dra. Fernández-Pavía, de la Universidad Michoacana de San Nicolás de Hidalgo; Saccharicola sp, Fusarium oxysporum y Rhizoctonia solani fueron proporcionados en el laboratorio 209 de Fisiología de la Interacción Planta-Patógeno del Colegio de Postgraduados, campus Montecillo.
Pruebas de antagonismo in vitro
Se realizaron confrontaciones duales para evaluar el efecto antagónico de Saccharicola sp. Se estableció un ensayo con siete tratamientos: 1) Antagonista-Phytophthora capsici (A-Pc), 2) Antagonista-Fusarium oxysporum (A-Fo), 3) Antagonista-Rhizoctonia solani (A-Rs), 4) Testigo antagonista (A), 5) Testigo Phytophthora capsici (Pc), 6) Testigo Fusarium oxysporum (Fo) y 7) Testigo Rhizoctonia solani (Rs). Cada tratamiento constó de 10 repeticiones. En cada caja Petri de 90 mm de diámetro conteniendo Infusión Papa Azúcar y Agar (IPAA) se colocó, a 1 cm de la periferia, un cilindro de 5 mm de diámetro con micelio del antagonista y se mantuvieron en oscuridad a 27±1 °C. Cuatro días después, se colocó, en el extremo opuesto de la caja, un cilindro de IPAA de 5 mm conteniendo micelio de Pc, Fo o Rs, y en las cajas de los testigos se colocó en cada extremo un cilindro de Pc, Fo o Rs. Las cajas se mantuvieron en las condiciones antes mencionadas.
Variables evaluadas
Se midió en cm cada 24 h el crecimiento micelial en los diferentes tratamientos y se registró para cada uno el número de días en que entraban en contacto las hifas de los aislamientos confrontados; cuando el micelio de ambos (antagonista y patógeno) estuvieron en contacto se calculó el porcentaje de reducción de crecimiento del fitopatogeno, con la fórmula propuesta por Sid-Ahmed et al. (1999). Considerando el promedio de crecimiento en cm de los patógenos en las cajas testigo, así como el promedio de crecimiento en la confrontación dual.
Las cajas se mantuvieron en observación durante 30 días para registrar el número de días en que el antagonista crecía sobre el micelio de los patógenos. También se evaluó la viabilidad del micelio de los patógenos confrontados con el antagonista cuando éste creció sobre la colonia de los patógenos. Una vez que el antagonista creció sobre la colonia de P. capsici, F. oxysporum y R. solani se tomaron, de cinco cajas Petri de cada tratamiento, tres cilindros de medio con crecimiento micelial del fitopatógeno invadido y se sembraron en IPAA para determinar si el micelio de Pc, Fo y Rs permanecía viable. Después de la siembra se realizaron observaciones cada 24 h durante 5 días para determinar si crecía el fitopatógeno.
Con la finalidad de conocer el efecto del antagonista sobre la producción de propágulos (esporas o zoosporas) del fitopatógeno a los 21 dpc para P. capsici y a los 30 para F. oxysporum. Para el caso de F. oxysporum, de cinco cajas de los tratamientos A-Fo y del correspondiente testigo (Fo), se tomaron de cada caja tres cilindros de 5 mm de diámetro con micelio del lado de crecimiento del patógeno y se colocaron en tubos (Sarstedt®) con 5 ml de agua destilada estéril, se agitaron y con una micropipeta se tomaron 200 μl de la suspensión y se realizó el conteo de microconidios con la ayuda de un hematocitómetro (Marienfeld®).
Para P. capsici, de cada una de cinco cajas Petri se tomaron tres cilindros de 1 cm de diámetro de medio con crecimiento micelial, se colocaron en cajas de 50 mm de diámetro conteniendo agua destilada estéril y se incubaron a 27±1 °C durante 48 h con luz blanca para inducir la formación de esporangios. Transcurrido este tiempo y con la finalidad de inducir la liberación de zoosporas las cajas se mantuvieron a 4 °C durante 20 min y después a 27±1 °C durante 1 h. Enseguida se realizaron observaciones bajo el microscopio estereoscópico para registrar la abundancia relativa de zoosporas con respecto al testigo.
Interacción micelial de Saccharicola sp-P. capsici y Saccharicola sp-R. solani
Para conocer si el antagonista Saccharicola sp parasita el micelio de P. capsici y R. solani, se realizaron microcultivos de acuerdo a la técnica descrita por Riddell (1950) con algunas modificaciones. El experimento constó de cinco tratamientos y cada 24 h durante 15 días se realizaron observaciones en cuatro repeticiones de cada tratamiento, teniendo un total de 60 cajas Petri para cada tratamiento. Los tratamientos evaluados fueron: 1) Antagonista-P. capsici (A-Pc); 2) Antagonista-R. solani (A-Rs); 3) testigo antagonista; 4) testigo Pc; y 5) testigo Rs.
En cajas Petri con IPAA se sembraron a 1 cm de la periferia cilindros de 5 mm con micelio del antagonista. Con una pinza estéril se tomó un cubreobjetos de 18x18 mm previamente esterilizado y se colocó en la parte media de cada caja. Después de 72 y 96 h, en el otro extremo de la caja se colocó un cilindro de 5 mm con micelio de Pc o Rs a 1 cm de distancia. En todos los casos las cajas se mantuvieron en oscuridad a 27±1 °C. En los testigos se procedió de la misma manera. Cada 24 h durante 15 días se realizaron observaciones de los cubreobjetos en cuatro repeticiones de cada tratamiento, una vez que los micelios de ambos microorganismos se encontraron en la parte media del cubreobjetos, éste se retiró del medio de cultivo con una navaja estéril, se colocó en un portaobjetos en una gota de azul de algodón y se observó a 100 X en microscopio compuesto Olimpus®mod. CX31.
Microscopía electrónica de barrido (MEB): Las muestras analizadas se tomaron de la zona de interacción de las confrontaciones entre el antagonista y patógeno (P. capsici) en medio IPAA. Las muestras se analizaron en la Red de Estudios Moleculares Avanzados, Instituto de Ecología A. C., Cluster BioMimic®, Xalapa, Veracruz, México.
Pruebas de antagonismo en invernadero: Se estableció un ensayo en los meses de noviembre de 2015 a enero de 2016 en suelo proveniente de campo colectado de una parcela naturalmente infestada con P. capsici. Una parte se esterilizó (SE) en autoclave a 65 °C y 20 lb de presión en dos ocasiones, cada una durante 2 h y se ventiló durante 7 días. Otra parte del suelo permaneció sin esterilizar (SN). Se probaron 11 tratamientos bajo un diseño de bloques al azar con 10 macetas (cada una con una planta de chile jalapeño variedad “M”) cada uno.
Los tratamientos fueron: 1) Testigo (SE-T), 2) SE-F. oxysporum (SE-Fo), 3) SE-P. capsici (SE-Pc), 4) SE-R. solani (SE-Rs), 5) SE-Antagonista (SE-A), 6) SE-Antagonista-F. oxysporum (SE-A-Fo), 7) SE-Antagonista-P. capsici (SE-A-Pc), 8) SE-Antagonista-R. solani (SE-A-Rs), 9) SE-Antagonista-F. oxysporum- P. capsici-R. solani (SE-A-Fo-Pc-Rs), 10) SN-Antagonista-F. oxysporum-P. capsici-R. solani (SN-A-Fo-Pc-Rs) y 11) SN-F. oxysporum-P. capsici-R. solani (SN-Fo-Pc-Rs). Como referencia de la patogenicidad de la cepa de P. capsici utilizada se establecieron también plantas testigo de chile de la variedad “Yollow wonder”, catalogado como altamente susceptible al oomiceto. El ensayo se realizó en macetas de polietileno conteniendo 500 g de suelo. El ensayo se repitió una vez más.
Germinación de semillas
Semillas de chile jalapeño variedad “M” se desinfestaron con hipoclorito de sodio comercial al 2 % por 3 min y se enjuagaron tres veces con agua destilada estéril. Las semillas de los tratamientos que involucraron al antagonista se introdujeron durante 24 h en una suspensión de 1X108 unidades formadoras de colonia (ufc) de Saccharicola sp, las de los demás tratamientos se mantuvieron en agua de la llave estéril. Las semillas se colocaron en sanitas estériles y se pusieron a germinar en oscuridad a 27±1 °C durante 11 días.
Las plántulas se transfirieron a charolas de poliestireno conteniendo una mezcla de Peat Mos y Agrolita (2:1) previamente esterilizada. A las plántulas correspondientes a los tratamientos con el antagonista se les aplicó una suspensión de 1X108 ufc (10 ml/plántula) inmediatamente después de transferirlas a las charolas. Las charolas se mantuvieron en un cuarto de crecimiento con fotoperiodo de 14 h luz y 10 obscuridad a 25±1 °C hasta que las plántulas desarrollaron el primer par de hojas verdaderas.
Preparación del inóculo del antagonista y patógenos e inoculación
El inóculo del antagonista y de R. solani se preparó en frascos Erlenmeyer de 500 ml conteniendo Infusión Papa Azúcar (IPA). Los frascos se esterilizaron en autoclave a 120 °C durante 15 min. Cinco cilindros de 5 mm de diámetro del antagonista o de R. solani se transfirieron asépticamente en los frascos y se mantuvieron por 10 días en una incubadora con agitación Lab-Line® a 110 revoluciones por minuto (rpm), se retiró el micelio de los frascos y se molió por separado en una licuadora.
De cajas Petri con micelio de F. oxysporum o P. capsici, se tomaron cilindros de 5 mm de diámetro y se sembraron en IPAA y en jugo V8 agar (V8A), respectivamente, enseguida se incubaron en obscuridad a 27±1 °C. Después de 7 días, sobre las cajas con P. capsici se vertieron 10 ml de solución isotónica de cloruro de sodio al 0.9 % (Pisa®) enseguida se retiró la solución y con una aguja de disección se dividió el medio en seis fragmentos. Cada fragmento se transfirió a una caja Petri conteniendo 10 ml de agua de la llave estéril.
Las cajas se mantuvieron durante 48 h en luz a 26 °C y 48 en oscuridad a 28 h °C. Transcurrido este tiempo, se colocaron a 4 °C durante 20 min y después a 27±1 °C durante 1 h para inducir la liberación de zoosporas. El número de propágulos del antagonista y patógenos se cuantificó en un hematocitómetro y se ajustó la densidad de inóculo a 1X108 para el antagonista, 1X107 ufc para F. oxysporum y P. capsici; para R. solani se aplicó 1 g de micelio molido previamente. La inoculación del antagonista se realizó a las semillas, al momento de pasar las plántulas a charolas y dos aplicaciones de 10 ml a 3 y 1 día antes de transferir las plantas a las macetas e inmediatamente después de transplantarlas a las macetas. La inoculación de los patógenos se realizó 3 días después de haber inoculado al antagonista. Todas las aplicaciones se realizaron a la base del tallo.
Variables evaluadas
Se registró la incidencia (%) de plantas con síntomas de la enfermedad y la severidad (nivel de daño), la altura de la planta, el diámetro de la base del tallo y el peso seco de raíz y follaje. Diariamente se realizaron observaciones para registrar las dos primeras variables. La severidad de P. capsici se evaluó con la escala propuesta por Morán-Bañuelos et al. (2010), de F. oxysporum con la escala de Marlatt et al. (1996) y la severidad de R. solani con la escala propuesta por Navarrete-Maya et al. (2009). Al final del experimento (3 meses después del transplante), se midió la altura de la planta y el diámetro de la base del tallo. Las raíces se cortaron en la base del tallo. Tanto la parte del follaje como de la raíz se colocaron en bolsas de papel Kraft y secaron a 60 °C en una estufa (Felisa®) durante 4 días. Cinco plantas de cada tratamiento se tomaron al azar para el registro de peso seco.
Análisis estadístico: Los datos de las variables evaluadas en todos los ensayos se sometieron a la prueba de distribución normal (Shapiro-Wilk y Kolmogorov-Smirnov) y homogeneidad de varianzas (Bartlett). Para los datos obtenidos en el ensayo de invernadero fue necesario llevar a cabo una transformación logarítmica. Con los datos de cada variable se realizó un análisis de varianza (ANOVA) y comparación de medias (Tukey, P≤0.05), utilizando el paquete SAS versión 9.0. El análisis se realizó con los datos de los dos experimentos.
Resultados
Pruebas de antagonismo in vitro: En condiciones in vitro Saccharicola sp causó una reducción significativa de 44.8 % y 45.1 % en el crecimiento micelial de P. capsici y F. oxysporum a los 3 días posteriores a la confrontación (dpc), mientras que para R. solani la reducción fue de 36.2 % a los 2 dpc (Cuadro 1). A los 21 dpc el antagonista creció sobre la colonia de P. capsici y a los 30 dpc sobre la colonia de F. oxysporum. En R. solani el crecimiento de ambos llegó a la parte media de la caja a los 30 dpc y ahí se mantuvo. A pesar de que el antagonista no invadió al patógeno, fue evidente la ausencia de microesclerocios en la colonia de R. solani del lado del cilindro del patógeno, mientras que en ambos cilindros del testigo se desarrollaron (Figura 1).
Cuadro 1. Efecto de Saccharicola sp (A) sobre el crecimiento micelial de P. capsici (Pc), F. oxysporum (Fo) y R. solani (Rs) y sobre la producción de esporangios y zoosporas en P. capsici.

dpc= días posteriores a la confrontación; ddi=días después de la invasión del patógeno por el antagonista; Pc-Pc= Testigo P. capsici; A-Pc= Saccharicola sp-P. capsici; Fo-Fo= Testigo F. oxysporum; A-Fo= Saccharicola sp-F. oxysporum; Rs-Rs= Testigo R. solani; A-Rs= Saccharicola sp-R. solani. (-), (+) y (++): denotan la ausencia y presencia escasa y regular de esporangios y zoosporas, respectivamente. Valores con la misma letra no son significativamente diferentes de acuerdo a la prueba de Tukey (P≤0.05).
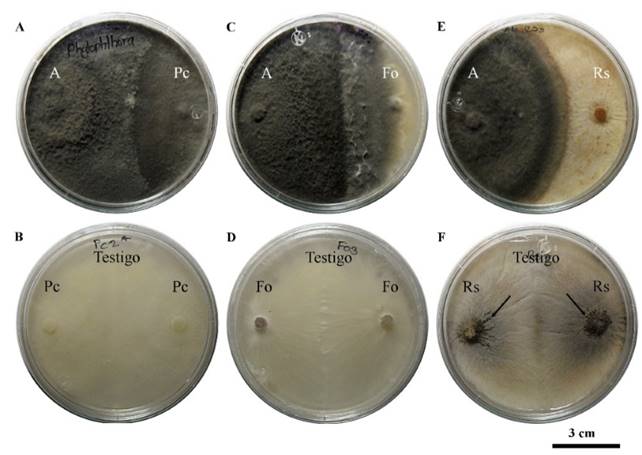
Figura 1. Antagonismo de Saccharicola sp (A) contra P. capsici (Pc), F. oxysporum (Fo) y R. solani (Rs) a los 21 y 30 días posteriores a la confrontación (dpc). A) A-Pc, B) Testigo Pc a los 21 dpc, C) A-Fo, D) testigo Fo, E) A-Rs y F) testigo Rs a los 30 dpc con desarrollo de microesclerocios.
Saccharicola sp causó reducción de crecimiento micelial de F. oxysporum y P. capsici a las 72 h posteriores a la confrontación (hpc), en comparación con sus respectivos testigos que presentaron mayor crecimiento, mientras que con R. solani la reducción de crecimiento se registró desde las 24 hpc (Figura 2). A los 3 días después de sembrar (dds) los cilindros con micelio tomados del lado de los patógenos invadidos por el antagonista, se observó el crecimiento del micelio (Cuadro 1) (Figura 3). En los cilindros del tratamiento antagonista-F. oxysporum tomados del lado del patógeno se registró menor cantidad de microconidios en comparación con los del testigo (Cuadro 2). En el tratamiento antagonista-R. solani se observaron microesclerocios. Solo en los cilindros tomados del tratamiento antagonista-P. capsici se observó el crecimiento del antagonista sobre el micelio de P. capsici a los 5 dds (Figura 3) y en los provenientes del mismo tratamiento colocados en agua, se registró una mayor liberación de zoosporas en comparación con los cilindros testigos (Cuadro 2).
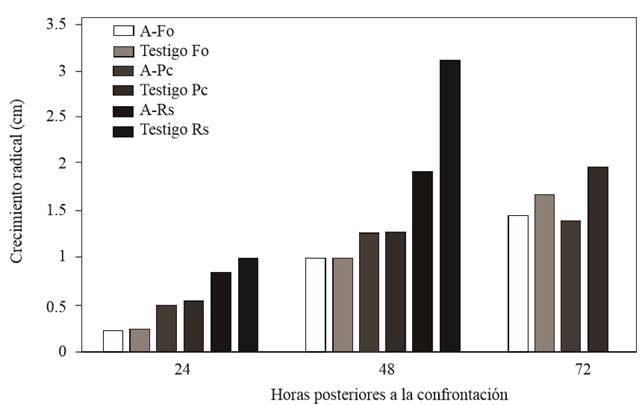
Figura 2. Crecimiento de F. oxysporum (Fo), P. capsici (Pc) y R. solani (Rs) a las 24, 48 y 72 h posteriores a la confrontación con Saccharicola sp.
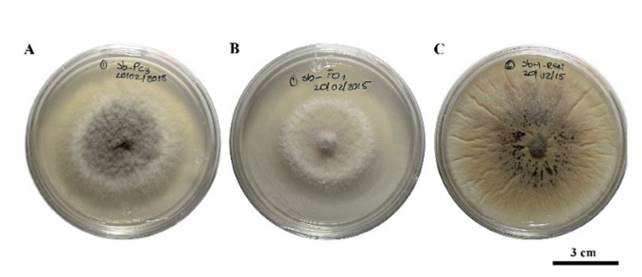
Figura 3. Viabilidad del micelio de P. capsici (Pc), F. oxysporum (Fo) y R. solani (Rs), a partir de cilindros de micelio del lado del patógeno invadido por el antagonista. A) crecimiento de Pc y antagonista 5 días después de la siembra (dds) del cilindro, B) crecimiento de Fo sin presencia del antagonista y C) crecimiento de Rs con presencia de microesclerocios y sin presencia del antagonista.
Cuadro 2. Efecto de Saccharicola sp (A) sobre la producción de propágulos (esporangios y zoosporas) de P. capsici, F. oxysporum (microconidios) y R. solani (microesclerocios).
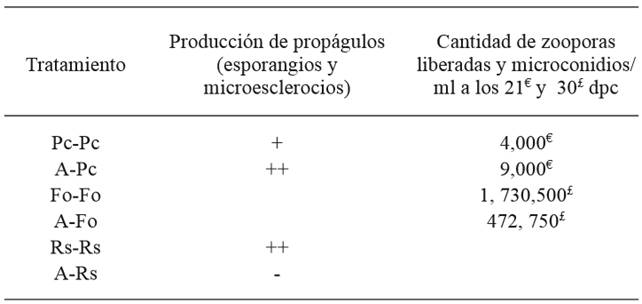
dpc= días posteriores a la confrontación; Pc-Pc= Testigo P. capsici; A-Pc= antagonista-P. capsici; Fo-Fo= Testigo F. oxysporum; A-Fo= antagonista-F. oxysporum; Rs-Rs= Testigo R. solani; A-Rs= antagonista-R. solani; abundancia relativa de propágulos (-) nula, (+) baja y (++) regular.
Interacción micelial de Saccharicola sp-P. capsici y Saccharicola sp-R. solani
En condiciones in vitro la interacción de Saccharicola sp y P. capsici se observó a las 24 h posteriores al momento en que los micelios de ambos microorganismos se encontraron, se presentó el fenómeno de adosamiento (Figura 4). A las 48 h fue evidente la formación de células pseudoparenquimatosas de Saccharicola sp sobre las hifas de P. capsici y a las 72 h el crecimiento alrededor de las hifas de P. capsici (enrollamiento) (Figura 4). A las 96 h se observó la formación de esporangios de P. capsici, mientras que en el testigo éstos se evidenciaron hasta el 5º día. Al 7º día las hifas de P. capsici mostraron vacuolas, granulaciones en el citoplasma, deformación y con apariencia de estar vacías (Figura 4).
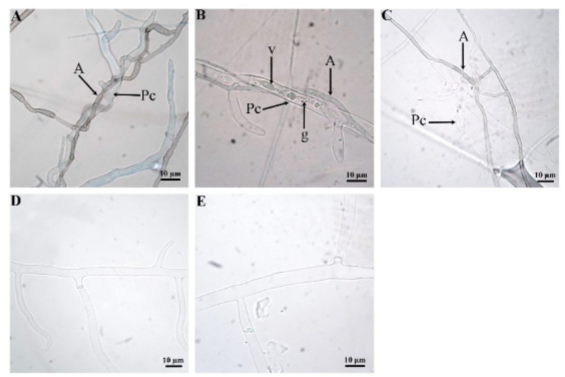
Figura 4. Interacción micelial entre Saccharicola sp-P. capsici. A) Enrrollamiento de Saccharicola sp en la hifa de Pc a las 72 h posteriores al encuentro del micelio de ambos microorganismos (hpem), B) hifas con vacualización (v) y granulaciones en el citoplasma, C) hifas deformes y con apariencia de estar vacías al 7º día posterior al encuentro del micelio de ambos microorganismos, D) y E) P. capsici testigo a las 72 y 7º día respectivamente.
En R. solani desde las 24 h posteriores al encuentro de los micelios de ambos microorganismos se observaron hundimientos en las hifas de R. solani en los sitios de contacto con Saccharicola sp (Figura 5) y en estos puntos también fue evidente la formación de pequeñas estructuras en las hifas de Saccharicola sp. A las 96 h en los sitios de contacto con Saccharicola sp las hifas de R. solani presentaban deformación y el micelio mostraba una coloración menos intensa (Figura 5). En los sitios de interacción entre las hifas del antagonista con los patógenos fue evidente que las hifas del antagonista eran de menor diámetro, lo cual sugiere que el micelio joven es el que establece el contacto con las hifas de los patógenos,

Figura 5. Interacción micelial entre Saccharicola sp-R. solani (A-Rs). A) Hundimientos (h) en la hifa de Rs formados en los sitios de contacto con el micelio de Saccharicola sp a las 24 h posteriores al encuentro del micelio de ambos microorganismos (hpem). B) Hifa de Rs deforme y de coloración menos intensa a las 96 hpem.
Microscopía electrónica de barrido (MEB)
En la interacción Saccharicola sp-P. capsici se observó el enrrollamiento de las hifas del antagonista alrededor del micelio de P. capsici (Figura 6), así como también la formación de estructuras de anclaje sobre el mismo fitopatogeno.
Antagonismo de Saccharicola sp en invernadero
En condiciones de invernadero P. capsici y F. oxysporum fueron patogénicos al chile, el primero ocasionó 100 % de incidencia y el 50 % de mortalidad en plantas enfermas. Con F. oxysporum se registró un 75 % de incidencia y 50 % de plantas muertas, mientras que R. solani no fue patogénico al chile. Cuando se inoculó el antagonista en conjunto con los tres patógenos tanto en suelo estéril como en suelo naturalmente infestado hubo 100 % de incidencia en las plantas de chile. El antagonista no tuvo un efecto favorable en las variables diámetro de la base del tallo, altura y peso seco del follaje y raíz; claramente la aplicación de Saccharicola sp no protegió a las plantas de chile del ataque por fitopatógenos, ni mejoró el desarrollo de las plantas.
Discusión
En condiciones in vitro Saccharicola sp causó reducción significativa de 44.8 % y 45.1 % en el crecimiento micelial de P. capsici y F. oxysporum a los 3 días posteriores a la confrontación (dpc), mientras que para R. solani la reducción fue de 36.2 % a los 2 dpc (Cuadro 1). Chapla et al. (2012), también consignaron un efecto similar de Saccharicola sp contra Fusarium spp, Cladosporium cladosporioides, C. sphaerospermum y Microbotryum violaceum. El hecho de que el micelio de Saccharicola sp haya entrado en contacto con el de los patógenos a los 3 y 2 dpc sugiere que existe agresividad por parte del antagonista y susceptibilidad en el fitopatógeno (Benhamou y Chet, 1993).
En cuanto a la reducción del crecimiento micelial de los fitopatógenos Dennis y Webster (1971) mencionan que la producción de antibióticos por agentes de control biológico, podrían inhibir la tasa de crecimiento del fitopatógeno durante una intensa competencia por nutrientes. Así, la capacidad de Saccharicola sp de crecer sobre el micelio de P. capsici y F. oxysporum, podría deberse a que compiten por los nutrientes del medio de cultivo y a una parasitosis en la que participa la producción de enzimas como: celulasas, xilanasas, amilasas y pectinasas (Paganini-Marques, 2013).
En la interacción R. Solani- Sacharicola sp no se observó inhibición, ni formación de estructura de anclaje del antagonista sobre patógeno, a los 30 dpc; sin embargo, R. solani no produjo microesclerocios (Figura 3). Dennis y Webster (1971) indican que los antibióticos producidos por algunos agentes de control biológico tienen efectos inhibitorios, que varían dependiendo del hongo fitopatógeno.
Saccharicola sp se ha encontrado como endófito en algunas plantas. Un aislamiento endófito aislado de caña de azúcar produjo metabolitos secundarios conocidos como poliquetidos (Rojas et al., 2011); en otro aislamiento obtenido de Eugenia jambolana se detectaron metabolitos bioactivos con capacidad antifúngica (Chapla et al., 2012; Honório, 2013; Borges, 2016). Posiblemente el efecto generado por Saccharicola sp en R. solani se deba a su capacidad de producir dichos metabolitos y que estén ejerciendo una acción inhibitoria en la formación de microesclerocios. Este efecto es importante para el control biológico, ya que muchos hongos forman estructuras de resistencia que les permite sobrevivir bajo condiciones adversas del ambiente hasta por más de 20 años (Higuera-Moros et al., 2003).
En la presente investigación el antagonista afectó la producción de propágulos del hongo fitopatógeno, en P. capsici la estimuló mientras que en F. oxysporum la redujo. El mayor número de esporangios y mayor liberación de zoosporas por P. capsici expuesto al antagonista Saccharicola sp (Cuadro 2), es un fenómeno que ha sido consignado por otros investigadores; por ejemplo, Sid-Ahmed et al. (1999) observaron la producción de esporangios de P. capsici en presencia de Trichoderma harzianum. Estos autores indican que la estimulación en la producción de esporangios está asociado a la inhibición del crecimiento vegetativo de P. capsici como resultado de la acción antagonista (Brasier, 1975; Sid-Ahmed et al, 1999) y del desarrollo de mecanismo de defensa del patógeno (Dennis y webster, 1971; Elad et al., 1999).
El adosamiento observado en este estudio es un indicativo de afinidad de la composición química de las paredes hifales de los micelios de ambos microorganismos y se le considera como el inicio del micoparasitismo (Pérez-Moreno, 1992). El enrollamiento de las hifas de Saccharicola sp alrededor de P. capsici se interpreta como una expresión de parasitismo (Benítez et al., 2004).
En este trabajo se observó el enrollamiento de la hifa del antagonista sobre P. capsici, dicho efecto se constató con microscopia electrónica de barrido, que reveló la formación de estructuras de anclaje, vacuolización, granulaciones en el citoplasma y deformación de las hifas de P. capsici, con apariencia de estar vacías (Figura 4), lo cual posiblemente se deba a la capacidad de Saccharicola sp de producir celulasas (Paganini-Marques, 2013;). Dichas enzimas están involucradas en la desintegración de la celulosa, principal componente de la pared celular (Köhl y Schösser, 1991; Castro-Rocha et al., 2012). Este mismo efecto fue reportado por Sid-Ahmed et al. (1999) quienes observaron la vacuolización y desintegración de las hifas de P. capsici en presencia de Trichoderma harzianum.
En R. solani se observaron hundimientos en sus hifas en los sitios de contacto con Saccharicola sp en donde también se observó la formación de pequeñas estructuras papiladas emergiendo de las hifas de Saccharicola sp. Las hifas de R. solani mostraron deformación y una coloración menos intensa (Figura 5), posiblemente por efecto de los metabolitos bioactivos producidos por Saccharicola sp (Chapla et al. 2012; Honório, 2013; Borges, 2016).
A pesar de que en condiciones in vitro hubo reducción del crecimiento micelial de los fitopatógenos y en las pruebas de interacción micelial se observaron principios de micoparasitismo de Saccharicola sp sobre las hifas de P. capsici y R. solani, esta acción no se expresó en invernadero, probablemte debido a la homeostasis del suelo, que dificulta o impide el establecimiento de cualquier especie introducida (Bautista-Calles et al., 2014). Las aplicaciones de antagonistas tendrían más oportunidad de éxito si se aplican frecuentemente durante el ciclo del cultivo; por ello es importante determinar si aplicaciones semanales de Saccharicola sp ayudarían a reducir la incidencia y severidad de los fitopatógenos en el cultivo de chile u otro cultivo. Así como también, conocer que metabolitos secundarios ejercen efecto in vitro en la reducción micelial de P. capsici, F. oxysporum y R. solani.
Conclusiones
En condiciones in vitro Saccharicola sp causó reducción significativa del crecimiento micelial de Phytophthora capsici, Fusarium oxysporum y Rhizoctonia solani; sin embargo, en condiciones de invernadero la aplicación de Saccharicola sp no protegió a las plantas de chile del ataque por fitopatógenos, ni mejoró el desarrollo de las plantas.











 texto en
texto en 



