La cebolla es un cultivo de importancia económica en el país y es afectada por varias enfermedades, entre ellas las causadas por virus que ocasionan pérdidas considerables y son de difícil manejo. Iris yellow spot virus (IYSV) del género Tospovirus, agente causal de la enfermedad conocida como mancha blanca en cebolla, es uno de los virus de importancia en plantas del género Allium (Brewster, 2008), por su amplia distribución geográfica y un gran rango de hospedantes (Ghotbi et al., 2005; Sampangi y Mohan, 2007; Smith et al., 2011). En México se ha reportado su presencia en los estados de Zacatecas (Velásquez-Valle y Reveles-Hernández, 2011) y Morelos en el cultivo de cebolla (Ramírez-Rojas et al., 2016) y en Guanajuato en el cultivo de ajo (Pérez-Moreno et al., 2010). La especie Thrips tabaci es el principal vector de IYSV. Por otra parte, los hospedantes alternos del virus y su vector toman un papel fundamental en la epidemiología de la enfermedad causada por el IYSV, sobre todo si estos insectos completan su ciclo biológico en dichas plantas (Hsu et al., 2011). Esto resalta la importancia de realizar estudios relacionados con el vector, hospedantes alternos, el virus y las interacciones entre ellos, a fin de generar mayor conocimiento que permitan diseñar mejores estrategias de manejo de la enfermedad, ya que este tipo de interacciones puede influir en la aparición de nuevas variantes del virus (Rodríguez et al., 2007). Así mismo, la capacidad que tienen los trips vectores para desarrollarse en plantas no cultivadas y subsistir de forma permanente en campo puede ser de significancia epidemiológica, sobre todo en la dispersión secundaria del virus (Chatzivassiliou et al., 2007; Syller, 2012). En Morelos, el IYSV es importante debido a la alta incidencia (100 %) y severidad (superior al 90 %) con que se presenta en las zonas productoras de la entidad (Ramírez-Rojas et al., 2016). Por otro lado, en Michoacán, el IYSV ha pasado prácticamente inadvertido por los productores de cebolla a pesar de estar presente en el cultivo. Este contraste en intensidad de la enfermedad en ambos estados puede deberse a diferentes factores relacionados con el ambiente, al hospedante principal y alternos (arvenses), el virus, vectores, entre otros. Con base en lo anterior, el objetivo del presente trabajo fue identificar hospedantes alternos de Iris yellow spot virus (IYSV) y establecer el rango de hospedantes del putativo vector(es), en regiones productoras de cebolla de Morelos y Michoacán, México, y generar información que contribuya a explicar estas diferencias de intensidad epidémica en ambas entidades.
Materiales y métodos
Colecta e identificación de arvenses
Se colectaron arvenses en 10 parcelas destinadas al cultivo de cebolla en los municipios de Puente de Ixtla (una parcela), Ayala (dos parcelas), Axochiapan (una parcela) y Emiliano Zapata (una parcela) en Morelos, así como en Vista Hermosa (dos parcelas) y Tanhuato (tres parcelas) en Michoacán. Los muestreos se realizaron en los meses de diciembre 2014 (Morelos), enero (Morelos y Michoacán), julio (Morelos), octubre de 2015 (Morelos y Michoacán) y enero de 2016 (Morelos y Michoacán) en presencia y ausencia del cultivo. El muestreo fue dirigido en base a cuatro criterios: a arvenses previamente reportados como hospedantes de IYSV (Sampangi et al., 2007; Weilner y Bedlan 2013; Schwartz et al., 2014), plantas con síntomas putativos a virosis (mosaicos, clorosis, deformaciones foliares y manchas blancas), plantas cercanas a plantas de cebolla que presentaban síntomas de virus, y las arvenses más abundantes en el momento del muestreo. Se seleccionaron de preferencia plantas en etapa fenológica avanzada. Estas se colocaron en bolsas de plástico con papel húmedo y se transportaron al laboratorio donde fueron identificadas con claves taxonómicas (Espinosa y Sarukhán, 1997; Rzedowski et al., 2001; Rzedowski et al., 2004; Vibrans y Tenorio, 2012) hasta nivel de especie.
Detección de IYSV en cebolla
Con la finalidad de confirmar la presencia del virus se tomaron muestras de plantas de cebolla en las mismas parcelas donde se realizó la colecta de arvenses. El muestreo fue dirigido a plantas (cinco plantas) que presentaron síntomas típicos del IYSV, considerando la presencia de lesiones cloróticas o blancas alargadas y con presencia o ausencia de una isla verde en el centro (Gent et al., 2006; Weilner y Bedlan, 2013). De plantas sintomáticas se realizó la extracción de ARN total con el método de TRIzol® Reagent de acuerdo con las instrucciones del fabricante (life technologiesTM). Posteriormente, la identificación del patógeno se realizó mediante la técnica de reverso-transcripción de la reacción en cadena de la polimerasa (RT-PCR), con iniciadores específicos que amplifica una banda de 750 pb del gen, que codifica para la proteína de la nucleocápside del virus: IYSV-For (TGG YGG AGA TGY RGA TGT GGT) e IYSV-Rev (ATT YTT GGG TTT AGA AGA CTC ACC) (du Toit et al., 2007). La mezcla de reacción para la PCR fue de un volumen final de 25 μL: 2.5 μL de buffer PCR 5X, 1.25 μL de MgCl2 (25 mM), 0.5 μL dNTP’s (10 mM), 0.5 μL por cada iniciador (10 mM), 0.5 μL de Taq polimerasa (5U/μL) y 2 μL de cDNA, Las condiciones para la PCR consistió en una desnaturalización inicial a 94 °C por 2 min, seguidos por 40 ciclos de 94 °C por 30 s, 51 °C por 30 s y 68 °C por 1 min y una extensión final de 68 °C por 7 min. Los productos de PCR se visualizaron en un fotodocumentador mediante electroforesis en un gel de agarosa al 1 % teñido previamente con bromuro de etidio. De los productos amplificados, se purificaron cuatro muestras (dos de Michoacán y dos de Morelos) con el Wizard® SV Gel and PCR Clean-Up System y se mandaron a secuenciar a la compañía de Macrogen Inc. en Korea del Sur, y las secuencias se compararon en la base de datos del GenBank NCBI (National Center for Biotechnology Information). Solo un aislamiento de IYSV obtenido de Michoacán se inoculó en plantas indicadoras de Nicotiana benthamiana (Kritzman et al., 2001), esto con la finalidad de tener un respaldo del aislamiento para su posterior uso. Para verificar la presencia del virus en las plantas inoculadas se realizó extracción de ARN del tejido inoculado y RT-PCR.
Detección de IYSV en arvenses
Por el número de arvenses colectadas, se utilizó la prueba serológica DAS-ELISA con el anticuerpo específico para el IYSV siguiendo las indicaciones del fabricante (Agdia®). Se analizaron por duplicado muestras compuestas de cada arvense colectada, consistentes en hojas de la parte baja, media y alta. En el caso de arvenses con síntomas se realizó una muestra compuesta de tejido enfermo y tejido sano. Se utilizó el control positivo para el virus y control negativo (tejido de cebolla sano) adquiridos de Agdia®. Las muestras se midieron en un lector de placas ELISA a una longitud de onda de 405 nm (A405). La reacción se consideró positiva si el valor de absorbancia fue tres veces mayor a la media del control negativo (Sutula et al., 1986).
Presencia de trips
El haz y envés de las hojas de plantas arvenses colectadas se revisaron para verificar la presencia de trips. En las plantas donde se detectó la presencia de los insectos, con un pincel de punta fina se colectaron adultos o inmaduros (según fuera el caso) para establecer colonias, estos fueron depositados de forma individual en frascos de plástico con aberturas cubiertas con tela organza para permitir la entrada de aire y dentro de ellos se colocaron ejotes frescos (Phaseolus vulgaris) para su alimentación. Los ejotes deshidratados se sustituyeron por frescos dos veces por semana. Los frascos con los trips se mantuvieron en condiciones de laboratorio con un fotoperiodo de 12 h, temperatura promedio de 24 ±1 °C y 42 % de humedad relativa hasta que se observó el incremento de individuos para su identificación por PCR.
Extracción de ADN y PCR en trips
De las colonias establecidas, se extrajo ADN total con CTAB a partir de 15 adultos y se determinó su calidad y concentración en el espectrofotómetro. La PCR se realizó con iniciadores que amplifican un fragmento de 710 pb del gen citocromo oxidasa I (COI): LCO1490 (5’GGT CAA CAA ATC ATA AAG ATA TTG G3’) y HCO2198 (5’TAA ACT TCA GGG TGA CCA AAA AAT CA3’) (Folmer et al., 1994). La PCR se realizó en un volumen de 25 μL consistente en: 1.25 μL de MgCl2 (25 mM), 0.5 μL de dNTP’s (10 mM), 0.5 μL de cada iniciador (10 mM), 0.5 μL de Taq polimerasa, 2.5 μL buffer de PCR 10X, 4 μL de DNA (10-50 ng/μL) y agua. La PCR se realizó bajo las siguientes condiciones: 94 °C por 4 min para la desnaturalización inicial, seguidos por 30 ciclos de 94 °C por 1 min, 50 °C por 1 min, 72 °C por 1 min y una extensión final a 72 °C por 5 min. Los productos amplificados se visualizaron en electroforesis en gel de agarosa a 1 % que contenía bromuro de etidio. Los productos de PCR se purificaron con Wizard® SV Gel and PCR Clean-Up System y se secuenciaron en ambas direcciones. Las secuencias se analizaron con el programa Chromas LITE versión 2.1.1, posteriormente se crearon secuencias consenso de cada muestra con el programa Vector NTI 8 y se compararon con las depositadas del banco de datos de secuencias genéticas (GenBank).
Resultados
Colecta e identificación de arvenses
Se colectaron 212 arvenses en el estado de Morelos (33 arvenses en 2014, 150 arvenses en 2015 y 29 arvenses en 2016) y 83 en Michoacán (67 arvenses en 2015 y 16 arvenses en 2016), que en conjunto comprendieron un total de 56 especies pertenecientes a 23 familias (Cuadro 1). De estos se identificaron 41 especies pertenecientes a 18 familias para Morelos y 26 especies dentro de 14 familias en Michoacán. Ricinus communis, Acalypha ostryifolia, Parthenium hysterophorus y Tithonia tubiformis fueron más abundantes en el estado de Morelos, mientras que Amaranthus hybridus, Parthenium hysterophorus, Sonchus oleraceus y Chenopodium murale lo fueron en Michoacán.
Cuadro 1. Especies de arvenses colectadas y analizadas para IYSV por DAS-ELISA, y presencia de trips en arvenses en las regiones productoras de cebolla de los estados de Morelos y Michoacán, México.
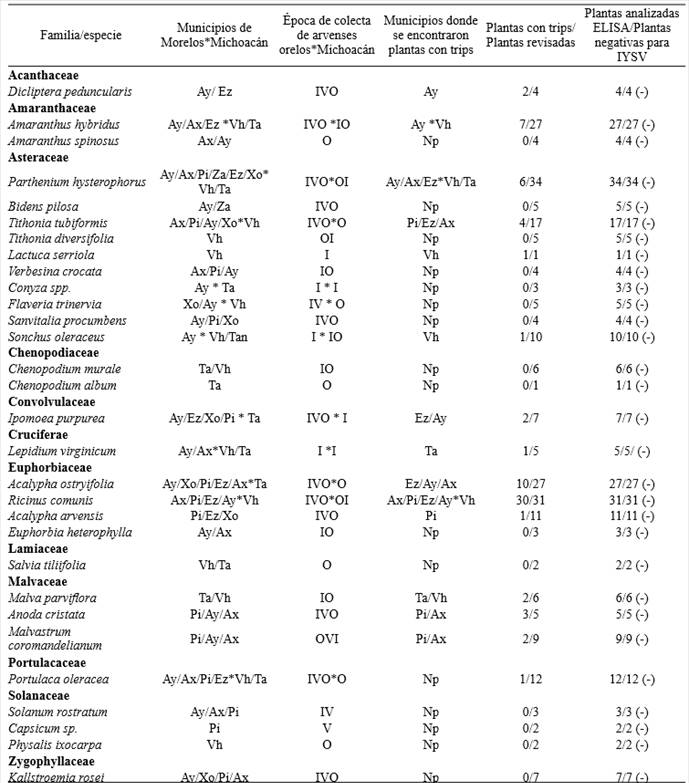
Ay: Ayala, Mor.; Pi: Puente de Ixtla, Mor.; Ez: Emiliano Zapata, Mor. Ax: Axochiapan, Mor.; Xo: Xochitepec, Mor.; Vh: Vista Hermosa, Mich.; Ta: Tanhuato, Mich; I: invierno (diciembre 2014 y/o enero 2015 y/o enero 2016); V: verano (julio 2015); O: Otoño (octubre 2015); Np: No presente.
Detección de IYSV en cebolla
Mediante la técnica de RT-PCR se identificó al IYSV en las 10 parcelas con cultivo de cebolla establecido, las plantas presentaron un bulbo desarrollado. En plantaciones jóvenes (antes de la formación del bulbo) no se detectó al virus. Se confirmó la presencia del patógeno tanto en el estado de Morelos como en Michoacán. Los síntomas fueron lesiones de color blanco pajizo, alargadas y en algunas plantas se detectaron islas verdes en el centro de las mismas, estos síntomas se presentaron con mayor frecuencia en el estado de Michoacán (Figura 1). Las cuatro muestras secuenciadas (dos de Morelos y dos de Michoacán) mostraron un 99 % de identidad con el gen de la nucleocápside para IYSV. Las plantas inoculadas en N. benthamiana con el aislamiento de Michoacán, presentaron síntomas de manchas cloróticas en las hojas inoculadas y no inoculadas, así como necrosis. La presencia de IYSV fue confirmada en el tejido de N. benthamiana por RT-PCR al ser inoculadas por el virus (Figura 2).

Figura 1. Síntomas ocasionados por el Iris yellow spot virus en hojas de cebolla: a) lesiones iniciales y avanzadas colectadas en el estado de Morelos y b) lesiones iniciales y avanzadas con presencia de una isla verde en el centro de la lesión colectadas en el estado de Michoacán.
Detección de IYSV en arvenses
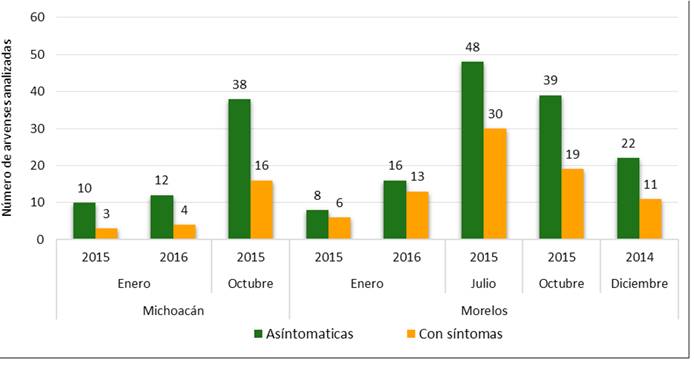
Se analizaron 295 plantas procedentes de ambas entidades en diferentes tiempos de colecta (212 de Morelos y 83 de Michoacán) y ninguna de ellas fue positiva para Iris yellow spot virus por DAS-ELISA, excepto el control positivo. Solo 102 arvenses (34%) mostraron síntomas putativos de virosis como mosaicos, amarillamiento, deformación foliar y manchas cloróticas; no obstante, ningún síntoma fue causado por IYSV. El mayor número de arvenses con síntomas se colectó en Morelos. El resto de las plantas fueron asintomáticas (Figura 3).
Presencia de trips
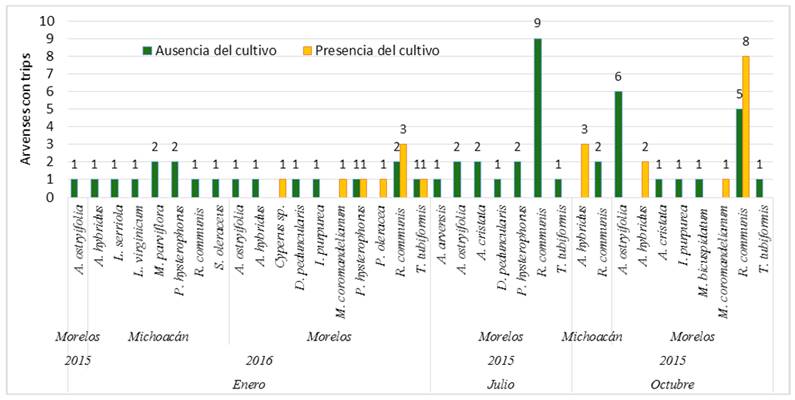
De las 295 plantas observadas de diferentes arvenses, en 75 (25.4 %) se encontraron trips, de las cuales 61 pertenecieron al estado de Morelos y 14 de Michoacán. Estos insectos se observaron en 17 especies de arvenses pertenecientes a las familias Euphorbiaceae, Asteraceae, Amaranthaceae, Cruciferae, Convolvulaceae, Malvaceae y Acanthaceae. Los trips se encontraron en su mayoría en R. communis (30 de 31 plantas analizadas), 27 plantas correspondieron al estado de Morelos y tres a Michoacán, seguido por Acalypha ostryifolia, Amaranthus hybridus y Parthenium hysterophorus pero en menor frecuencia. Por otro lado, de estas 75 arvenses, en el estado de Morelos se colectaron 19 arvenses cuando el cultivo de cebolla estaba establecida y 42 arvenses en ausencia del cultivo. En el caso de Michoacán, 11 arvenses con trips se colectaron en ausencia del cultivo y solo tres en presencia del cultivo (Figura 4). Cabe resaltar que se observó un incremento de las poblaciones de trips en las parcelas con presencia del cultivo de cebolla, principalmente en etapas fenológicas avanzadas (formación del bulbo).
Extracción de ADN y PCR
Se establecieron 75 colonias de trips procedentes del mismo número de plantas colectadas en Morelos y Michoacán. Del total de colonias establecidas, solo 33 lograron incrementar su población (25 de Morelos y ocho de Michoacán). En todos los casos se obtuvo el amplicón esperado de 710 pb y sus secuencias presentaron una identidad de 97 al 100 % para Thrips tabaci (Cuadro 2).
Cuadro 2. Colonias de trips colectadas en diferentes especies de arvenses e identificadas por PCR COI, en las regiones productoras de cebolla de los estados de Morelos y Michoacán.
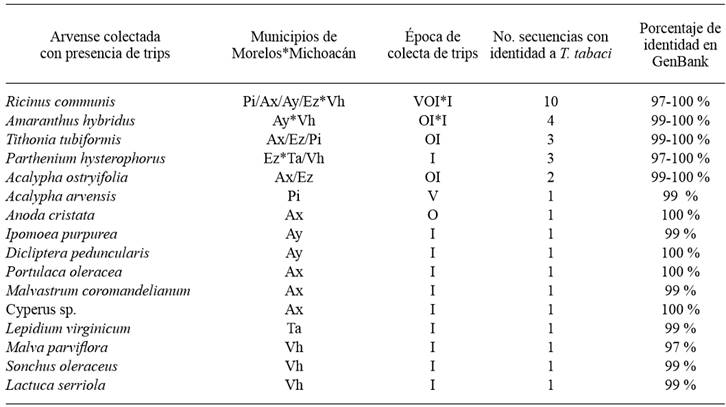
Ay: Ayala, Mor.; Pi: Puente de Ixtla, Mor.; Ez: Emiliano Zapata, Mor. Ax: Axochiapan, Mor.; Vh: Vista Hermosa, Mich.; Ta: Tanhuato, Mich; I: invierno (enero 2016); V: verano (julio 2015); O: Otoño (octubre 2015).
Discusión
Iris yellow spot virus es un virus de importancia agrícola en el mundo por los daños que ocasiona a especies del género Allium (Bag et al., 2009). A la fecha se han reportado numerosos hospedantes infectados de forma natural por este virus (Cosmi et al., 2003; Sampagni et al., 2007; Evans et al., 2009b; Evans et al., 2009a; Hsu et al., 2011; Smith et al., 2012; Weilner y Bedlan, 2013; Schwartz et al., 2014; Szostek y Schwartz, 2015; Karavina y Gubba, 2017), de las cuales algunas fueron encontradas en el presente estudio en los municipios recorridos. En el estado de Michoacán se colectaron S. oleraceus, S. nigrum, C. album, L. serriola, Amaranthus sp. y P. oleracea; así como, R. communis, Amaranthus sp. y P. oleracea en Morelos, mismas que han sido reportadas como hospedantes de IYSV en forma natural al analizarlas por DAS-ELISA (Schwartz et al., 2014; Karavina y Gubba, 2017). La mayor diversidad y frecuencia de arvenses se observó en Morelos, no así para Michoacán, esto debido a que la mayoría de las parcelas muestreadas en Michoacán tenían acolchado, controlando las arvenses entre el cultivo; además, de que los productores realizan deshierbes y/o aplican herbicidas con mayor frecuencia que en Morelos (datos no mostrados).
A pesar de la información reportada internacionalmente de los hospedantes alternos con presencia del virus, en México aún se desconoce el rango de hospedantes. Hasta el momento solo se ha reportado la presencia de IYSV por DAS-ELISA, en Amaranthus spp., Bidens odorata, Brassica campestris, Chenopodium spp., Eruca sativa, Malva parviflora, Medicago sativa, Sisimbrio spp. y S. oleraceus en las zonas productoras de cebolla de Zacatecas; no obstante, los autores no profundizan del número de plantas evaluadas y muestras positivas para el virus (Velásquez-Valle et al., 2013). En el caso del estado de Morelos Ramírez-Rojas et al. (2016) reportaron una incidencia total y una severidad superior al 90 % del virus en todas las zonas productoras de cebolla, pero no evaluaron la presencia del virus en arvenses. Cabe resaltar que aunque en nuestro estudio también se confirmó la presencia del virus en el cultivo de la cebolla, tanto en Morelos y Michoacán durante los ciclos otoño-invierno de 2014 y 2015, también se realizó el análisis en las arvenses asociadas al cultivo y ninguna muestra resultó positiva para IYSV.
Una de las posibles causas del porque el virus no se detectó en las arvenses analizadas, se debe a que es un virus localizado; es decir, no es sistémico, lo que dificulta su detección al momento de hacer pruebas serológicas como DAS-ELISA (Gent et al., 2006) e incluso RT-PCR. Esto se ha demostrado en el caso de la cebolla, donde su distribución del virus en la planta es heterogénea lo que puede dar falsos negativos tendiendo a subestimar su incidencia (Hsu et al., 2010). Por otro lado, los síntomas ocasionados por IYSV no suelen ser consistentes y claros, por lo que al momento de tomar muestras de tejido vegetal para su análisis por RT-PCR y/o DAS-ELISA pueden tenerse resultados inconsistentes (Krauthausen et al., 2012). Dicha expresión de síntomas es influenciado por el período de incubación, la fenología de las plantas al momento de la infección, las condiciones climáticas, nivel de estrés en la planta así como del cultivar (Bag et al., 2012). Así mismo, Ochoa et al. (1996) señalan que obtener muestras negativas en arvenses no implica que no sea reservorio del virus. Es posible también que durante las fechas de colecta de las arvenses no se haya tenido la carga viral detectable por ELISA debido a que se desconoce el tiempo de inoculación por los trips. Aunado a ello, a la fecha se desconocen los períodos de adquisición y transmisión de IYSV por T. tabaci en las arvenses (Smith et al., 2011). En nuestro estudio también se evaluaron por RT-PCR las arvenses más abundantes, y plantas de chile, jitomate y tomate de cascara (datos no publicados) que fueron sembrados posterior a la cosecha de la cebolla, pero ninguna amplificó la banda para el IYSV. Se debe de considerar que el tejido seleccionado para el análisis quizá no contenía el virus. No obstante, se ha reportado su comportamiento sistémico en N. benthamiana, transmitida de forma mecánica (Kritman et al., 2001; Bag et al., 2012). Estos datos concuerdan con nuestros resultados en el mismo hospedante, donde mostró síntomas sistémicos después de la inoculación del IYSV, manchas cloróticas en hojas jóvenes (zona no inoculada), necrosis y posteriormente la muerte de la planta. Hasta el momento no se tiene registros de IYSV transmitido por semilla (Kritzman et al., 2001), pero si se ha observado su presencia desde almácigos de cebolla (Velásquez-Valle et al., 2016) en Zacatecas, siendo una fuente de inoculo en dichos almácigos y aumentando el interés del estudio de su ecología de este virus en nuestra entidad, ya que el comportamiento del virus en diferentes hospedantes, vector y arvenses puede llegar a variar.
Con lo que respecta a los trips, en ambos estados se observó la mayor presencia de los insectos en arvenses en ausencia del cultivo, observándose principalmente estados inmaduros en las partes vegetativas de las plantas, lo cual nos indica que estas plantas pueden ser reservorio de los trips. En las parcelas con presencia del cultivo de cebolla, se colectaron pocas arvenses con presencia de trips, a pesar de que las plantas de cebolla tenían altas poblaciones de estos insectos, principalmente en etapas fenológicas avanzadas del cultivo. Szostek y Schwartz (2015) registraron la presencia de trips vectores de IYSV en ausencia del cultivo en diferentes arvenses. Esta información puede respaldar nuestros datos, al observarse mayores poblaciones de trips en ausencia del cultivo. Se ha sugerido que en ausencia del cultivo, los trips se mueven a plantas aledañas a éste y se reproducen en ellas, ya sea en las partes vegetativas o preferentemente en las inflorescencias (Milne y Walter, 1998). Si bien varias arvenses no se han reportado como hospedantes de IYSV, se sabe que algunas de ellas son hospederas de trips, por lo que resulta importante su consideración en campo como parte de un estudio epidemiológico para el manejo de la enfermedad (Smith et al., 2011). La abundancia de arvenses con presencia de trips en el estado de Morelos (13 especies de arvenses) comparado con el estado de Michoacán (7 especies de arvenses), puede ser una explicación importante de la problemática que se tiene de esta enfermedad en esta entidad, al servir las arvenses como hospederos de los trips con posible potencial de ser transmisores del virus. La práctica de eliminación de las arvenses que realizan en el estado de Michoacán, puede ser el factor importante por el cual se tiene inclusive bajas poblaciones de trips en las plantas de cebolla (datos no publicados), inclusive el bajo registro de arvenses con poblaciones de trips en Michoacán (14 arvenses), comparado con el estado de Morelos (61 arvenses).
Solo en R. communis y A. ostryifolia se observaron mayor presencia de trips en estado inmaduro y adulto, principalmente en el estado de Morelos. En el caso de R. communis, este resultado difiere de lo reportado por Schwartz et al. (2014), quienes encontraron a esta especie como hospedante de IYSV pero no de T. tabaci. Si bien son entidades diferentes, no se debe descartar dicha posibilidad de esta arvense como reservorio del virus y del insecto, ya que nuestros datos mostraron ser el hospedante principal de T. tabaci. Pese a que no se detectó el virus en R. communis, no se debe de subestimar su estudio en esta y demás arvenses, principalmente donde se reproduce el insecto, que hasta el momento es el único vector de IYSV bajo condiciones de campo.
Se ha reportado solo a T. tabaci con alta eficiencia de transmisión del virus (Gent et al., 2004; Diaz-Montano et al., 2011). En México se tiene su presencia en el cultivo de cebolla (Velásquez-Valle et al., 2011), pero solo García- Rodríguez et al. (2014) confirmaron la presencia del virus en T. tabaci localizados en el cultivo de ajo. Todos los trips colectados de las diferentes arvenses que se lograron aumentar su población, correspondieron a T. tabaci; sin embargo, no se determinó si eran portadoras del virus, pero, se considera de importancia estas plantas como reservorios de los trips, mismos que pueden ser potenciales en la dispersión del IYSV en el cultivo de la cebolla (Jones, 2005). Aún no se ha demostrado la trasmisión transovárica de IYSV en trips por lo que los individuos de cada generación deben adquirir al virus para poder transmitirlo (Weilner y Bedlan, 2013). Aumentando el dicho interés en su comportamiento de la ecología del virus.
Como ya se mencionó, muchos de estos insectos vectores pueden reproducirse exitosamente en diversas especies no cultivadas. Estos datos indican que los trips pueden permanecer indefinidamente en determinada zona aún en ausencia del cultivo de cebolla. El adecuado control de las arvenses antes del aumento de las poblaciones de trips, podría reducir su migración (Chatzivassiliou et al., 2007) o su movimiento a plantas voluntarias de cebolla (Ghotbi et al., 2005) que pueden servir de reservorio de IYSV fuera del ciclo del cultivo, aumentando la posibilidad de infecciones tempranas en el siguiente ciclo (Hsu et al., 2011). Nuestros datos son respaldados por lo anteriormente mencionado, que ante el manejo que se tiene de las arvenses en el estado de Michoacán en contraste con el estado de Morelos, puede explicar la prevalencia de las altas poblaciones de trips que existe en Morelos al tener mayor número de hospedantes alternos ante la ausencia del hospedante principal, la cebolla. En el estado de Morelos no se tiene un manejo adecuado de las arvenses y muchas de ellas se detectó la presencia de estados inmaduros de T. tabaci. Además de observarse altas poblaciones de trips en el cultivo de la cebolla.
Nuestros datos sugieren que la diferencia en la intensidad de la enfermedad que se tiene en ambos estados, puede deberse a la diversidad y frecuencia de arvenses que se tiene en la entidad de Morelos, teniendo como consecuencia, mayores poblaciones de trips. Además, en el estado de Michoacán, se observó un mejor manejo de las arvenses y del cultivo, como la rotación, observándose baja diversidad de arvenses y trips, así como bajas poblaciones del insecto en el cultivo. Pese que en nuestro estudio, no se determinó la presencia del virus en los trips obtenidos de las arvenses, se sabe que es el principal vector, y al conocer el amplio rango de hospedantes de T. tabaci en estas entidades, puede ser importante en la epidemiologia de IYSV.
Este trabajo ha confirmado la presencia de IYSV en el estado de Michoacán, donde no se ha reportado previamente. Así mismo, la presencia de T. tabaci en varias arvenses de ambos estados, nos sugiere la importancia como hospederos del insecto en ausencia del cultivo, principalmente las que se encuentran en las orillas de las parcelas y la posibilidad de ser hospederos de IYSV en un futuro. Ante lo mencionado, el tener un amplio conocimiento de dichas interacciones ayudaría a obtener mejores estrategias de manejo del cultivo. Así mismo, confinar los estudios solo a las especies de arvenses donde se reproduce el vector o hacer pruebas de transmisión mecánica en dichas arvenses, así como pruebas de transmisión del virus en los trips recolectados de las arvenses, podríamos obtener datos concisos para entender de forma eficiente la epidemia del virus en el cultivo de cebolla.
Conclusiones
En este estudio no se detectó la presencia de Iris yellow spot virus en las especies de arvenses recolectadas durante los muestreos en parcelas con o sin cultivo de cebolla, en Morelos y Michoacán; sin embargo, se identificó como única especie a T. tabaci en 13 especies de arvenses recolectadas en Morelos y siete en Michoacán como hospedantes alternos del putativo vector de IYSV. Estas arvenses juegan un papel importante en la intensidad de la enfermedad, al ser reservorios de T. tabaci, observándose mayor frecuencia de arvenses en Morelos comparado con Michoacán.











 texto em
texto em