Introducción
Los hongos del género Alternaria pueden causar enfermedades en numerosos productos hortofrutícolas, las cuales pueden presentarse durante el desarrollo del cultivo o en la postcosecha y causar la destrucción generalizada del cultivo y pérdidas en la producción (Mamgain et al., 2013).
Durante la postcosecha, Alternaria tiene la capacidad de mantener una infección quiescente y manifestarse cuando se presentan las condiciones adecuadas, principalmente durante la maduración. En esta etapa, la principal especie que se ha identificado es A. alternata que causa la enfermedad del moho negro en solanáceas, principalmente (Troncoso-Rojas y Tiznado-Hernández, 2014).
Para el control de las enfermedades en frutos y hortalizas, se utilizan tradicionalmente fungicidas sintéticos, los cuales por un mal manejo y presencia de residuos, originan afecciones a la salud humana y generan cepas de hongos resistentes (McCarroll et al., 2002). Debido a esto, en las últimas décadas se ha estudiado el uso de productos naturales para el control de hongos fitopatógenos, entre los que se puede mencionar a los aceites esenciales (Sivakumar y Bautista-Baños, 2014).
Los aceites esenciales (AEs) son derivados volátiles de plantas, los cuales son responsables de su aroma (Krisch et al., 2011). En la planta funcionan como mensajeros, atrayentes de polinizadores y para defensa contra herbívoros y microorganismos que producen enfermedades (Baser y Buchbauer, 2009). Esta característica les confiere sus propiedades para su posible aplicación en el control de hongos fitopatógenos.
El contenido de compuestos y la efectividad de los AEs en el control de hongos fitopatógenos dependen de diversos factores que incluyen entre otros, la parte de la planta qu se utiliza para la obtención del aceite, concentración y condiciones ambientales (Schmidt, 2009; Sánchez-González et al., 2011; Raut y Karuppayil, 2014).
En estudios previos, se ha reportado la eficacia y especificidad de distintos AEs sobre el control de hongos fitopatógenos. Por ejemplo, Badawy y Abdelgaleil (2014) y Dimić et al. (2014) indicaron que el aceite esencial de limón (Citrus limon) inhibió el desarrollo de Botrytis cinerea, Fusarium oxysporum, Aspergillus parasiticus y Penicillium chrysogenum. Manganyi et al. (2015) y Lu et al. (2013) también reportaron la efectividad del aceite esencial de corteza de canela (Cinnamomum zeylanicum) en el control del crecimiento micelial y la germinación de esporas de los hongos Colletotrichum destructivum, Phytophthora parasitica var. nicotianae y F. oxysporum, mientras que en relación al aceite esencial de epazote (Dysphania ambrosioides) se ha reportado también su efecto inhibitorio sobre Phyllosticta citricarpa (Lombardo et al., 2016), F. oxysporum (Jaramillo et al., 2012), A. flavus, A. niger y C. gloeosporioides (Jardim et al., 2010).
Un aceite esencial puede estar constituido por más de 100 compuestos (Dima y Dima, 2015) por lo que, para poder realizar análisis y comparaciones entre ellos es necesario emplear estadística multivariada, la que permitirá describir y analizar observaciones multidimensionales de información obtenida de diversas variables en una misma unidad de estudio (Di Rienzo et al., 2008).
El uso de AEs para el control de hongos fitopatógenos ha generado la necesidad de contar con modelos matemáticos que permitan comprender y predecir el desarrollo de los mismos, a través del tiempo. En un principio, los modelos se desarrollaron para predecir el crecimiento de bacterias (Baranyi y Roberts, 1994). No obstante, debido a la importancia de los hongos, como vectores de contaminación de alimentos, se han adecuado los modelos existentes para evaluar su crecimiento (García et al., 2009).
Dantigny et al. (2007), García et al. (20109 y Longhi et al. (2013) reportaron que existen tres tipos de modelos matemáticos que pueden aplicarse para el análisis de hongos. El primario, permite representar el crecimiento del hongo en el tiempo, dado un conjunto de factores restrictivos. El secundario, representar la influencia de factores restrictivos sobre los parámetros calculados en el modelo primario. El modelo terciario, es una combinación de modelos primario y secundario, y permite predecir la influencia de los factores restrictivos sobre el crecimiento del hongo. En este sentido Basak y Guha (2015) reportaron el uso de modelos matemáticos mediante el uso de datos experimentales del crecimiento micelial y germinación de esporas de P. expansum. Tremarin et al. (2015) ajustaron los datos de crecimiento de Byssochlamys fulva y Neosartorya fischeri, al modelo de Baranyi y Roberts. De la misma manera, García et al. (2009) modelaron el impacto de condiciones ambientales óptimas/subóptimas en el crecimiento de A. carbonarius y P. expansum con el uso de la función de Baranyi.
Los objetivos del estudio fueron: 1. caracterizar químicamente tres aceites esenciales, 2. evaluar su efectividad en el control in vitro de A. alternata, 3. determinar la variabilidad en la composición de los AEs mediante el análisis de componentes principales y 4. modelizar el efecto inhibitorio de los AEs sobre el crecimiento micelial y la germinación de conidios de A. alternata.
Materiales y métodos
Material vegetal y extracción de aceites esenciales
Como material vegetal se utilizó la cáscara de frutos de limón (Citrus limon), parte aérea de epazote (Dysphania ambrosioides) y corteza de canela (Cinnamomum zeylanicum). Los frutos de limón se recolectaron en huertos de Yautepec Morelos, México (18° 53’ 09’’ Norte y 99° 03’ 38’’ Oeste). Mientras que la parte aérea de epazote y la corteza de canela se adquirieron en la Central de Abasto en Cuautla Morelos, México (18° 48’ 44’’Norte y 98° 57’ 21’’ Oeste). Las especies vegetales se identificaron en el Herbario de la Universidad Autónoma del Estado de Morelos (número de especímenes 34057-limón y 34058-epazote).
El material vegetal se utilizó para la obtención de AEs mediante el método de hidrodestilación (Díaz-Cedillo et al., 2013). 1 kg del material vegetal se colocó en un destilador de cristal tipo italiano y se mantuvo en ebullición (97 °C) por 2 h. Los AEs que se obtuvieron, se almacenaron en frascos ámbar a 4 °C y el rendimiento se determinó por gravimetría. Adicionalmente, se adquirieron AEs de limón a la empresa Hersol (Edo. México, México), el de epazote se obtuvo de la empresa Aceites y Esencias (Edo. México, México) y el de corteza de canela de la empresa dōTERRA (México DF, México). De acuerdo con las especificaciones del fabricante, los AEs fueron grado industrial con 99 % de pureza.
Caracterización química de los aceites esenciales por CG-EM
Los AEs comerciales y los que se obtuvieron por hidrodestilación, se disolvieron en cloroformo en una proporción 1:10 v/v. Posteriormente, 1 μL de la disolución se inyectó en un cromatógrafo de gases (CG) SCION 456-GC (Bruker Daltonics, Billerica, USA) acoplado a un detector de masas EVOQ triple cuadrupolo y con inyector automático PAL-COMBI xt (Bruker Daltonics, Inc.). El espectrómetro de masas (EM) se operó en un rango de 50 a 500 masa carga-1 mediante el uso del software MS Workstation versión 8.2 (Bruker Daltonics, Inc.).
El CG-EM se equipó con una columna capilar BR-1ms FS de 30 m de longitud, 0.25 mm diámetro interno y 0.25 μm espesor (Bruker Daltonics, Inc.). Las temperaturas del inyector y del detector fueron 220 °C y 280 °C, respectivamente. El gas acarreador fue Helio (He) a un flujo de 1 mL min-1. La temperatura inicial del horno fue de 55 °C durante 1 min, posteriormente, se aumentó a 155 °C con una velocidad de calentamiento de 20 °C min-1 y se mantuvo por 2 min, posteriormente se aumentó a 255 °C, a una velocidad de calentamiento de 10 °C min-1 con un tiempo total de análisis de 20.14 min por muestra.
Los compuestos que se detectaron se identificaron mediante la comparación de su tiempo de retención y espectro de masas con los datos procedentes de estándares contenidos en la biblioteca del equipo, NIST (National Institute of Standards and Technology, MD, USA).
Cepa del hongo y condiciones de cultivo
La cepa de A. alternata se obtuvo de la colección de hongos del Laboratorio de Tecnología Postcosecha de Productos Agrícolas (Ceprobi, Morelos, México). La especie ya identificada morfológica y molecularmente se cultivó en medio de cultivo papa dextrosa agar (PDA, Bioxon, México) por 14 días a 28 °C.
Ensayo de inhibición del crecimiento micelial
El efecto inhibitorio de los AEs se determinó por el método de dilución en agar reportado por Chen et al. (2014) el cual consistió en mezclar las concentraciones (0.25, 0.5, 1.0 μL mL-1) del aceite esencial con 0.1 % (v/v) de Tween 20 (Hycel, México DF, México) en 150 mL de medio PDA. Posteriormente, se vaciaron 25 mL de la mezcla en cajas Petri de 90 mm de diámetro (6 repeticiones por tratamiento) y se dejaron enfriar a temperatura ambiente (25±2 °C). Adicionalmente, se utilizaron los tratamientos de PDA y PDA-Tween, como controles.
Posteriormente, en el centro de la caja se sembró un disco PDA de A. alternata de 10 mm de diámetro. Las cajas se sellaron e incubaron a 28±2°C. El crecimiento micelial se midió diariamente evaluando el diámetro que alcanzó el micelio a través del tiempo con la ayuda de un vernier. El ensayo se detuvo cuando en el tratamiento control (sólo PDA), el micelio cubrió por completo la caja Petri. Los resultados se reportaron como índice de inhibición del crecimiento micelial (IM) de acuerdo a la ecuación (1), donde CC representa el crecimiento en el control y CT el crecimiento en el tratamiento.
Los tratamientos que presentaron inhibición del 100 % se resembraron en medio PDA sin la adición de aceite esencial para evaluar el efecto fungistático o fungicida de los AEs empleados.
Ensayo de inhibición de la germinación de conidios
El efecto de los AEs sobre la germinación de conidios se evaluó siguiendo la técnica descrita por Bautista-Baños et al. (2008). De un cultivo monospórico de A. alternata de 14 días de edad (105 conidios mL-1) se obtuvo una solución de conidios que se agregó a seis discos de PDA (25 μL disco-1), los cuales se colocaron en portaobjetos. Posteriormente, a cada disco se añadieron 10 μL de AEs (0.25, 0.5, 1.0 μL mL-1) y se incubaron a 28±2 °C, dentro de cajas Petri selladas. La evaluación de la germinación se realizó a las 2, 4, 6 y 8 h. Se consideró que un conidio había germinado cuando se observó la presencia de su tubo germinativo, sin importar su longitud (Costa et al., 2015)
Después del período de incubación, se colocó una gota de azul de lactofenol en cada disco y se evaluaron 100 conidios por disco en un microscopio óptico objetivo 40x (Nikon alphaphot-2 YS2H, Japón). Se determinó el porcentaje de germinación (G(%)) mediante la ecuación (2), donde EG representa el número de conidios germinados y TE el total de conidios.
Ajuste de datos experimentales a modelos matemáticos
Los datos experimentales del crecimiento micelial de A. alternata en medio PDA con y sin AEs en función del tiempo se ajustaron al modelo de Baranyi y Roberts (1994) para estimar la tasa máxima de crecimiento y tiempo de fase lag aparente, con la ecuación (3). Donde D(t) es el diámetro del micelio (cm) a cualquier tiempo t (días), D0 es el diámetro a t=0, μmax (cm día-1) es la tasa máxima de crecimiento y λ (días) es el tiempo de fase lag aparente.
El modelo se desarrolló con el software DMFit versión 3.5 (Microsoft Excel add-in) (Institute of Food Research, Norwich, UK). Para la evaluación del modelo se estimaron la raíz del cuadrado medio del error (RMSE) y el coeficiente de determinación (R2), modelos con valores de RMSE cercanos a cero y R2 cercano a uno se consideraron los mejores (Tremarin et al., 2015). Con los datos del crecimiento (experimentales y predichos por el modelo) se elaboraron gráficos de superficie con el software SigmaPlot 12.0 (Systat Sofware Inc., CA, USA).
El porcentaje de germinación de conidios se ajustó al modelo logístico (Ecuación 4) para estimar los parámetros, tasa de incremento en el porcentaje de germinación y tiempo requerido para alcanzar el 50 % de germinación. Las unidades experimentales que contenían los AEs que no permitieron la germinación del hongo se omitieron en el análisis. Para esto se utilizó el paquete estadístico InfoStat versión 2016 (Universidad Nacional de Córdoba, Argentina). Donde P es porcentaje de germinación, Pmax es el porcentaje máximo de germinación (100 %), k (h-1) es la tasa de incremento en el porcentaje de germinación, r (h) es el tiempo requerido para alcanzar el 50 % de germinación y t (h) es el tiempo (Dantigny et al., 2007).
Análisis estadístico
Los datos de los compuestos volátiles identificados por CG-EM de los seis diferentes AEs se sometieron a un análisis de componentes principales (ACP) con la finalidad de obtener la variabilidad de los sistemas estudiados empleando el paquete estadístico InfoStat versión 2016, mientras que, el crecimiento micelial y la germinación de conidios al final del período de crecimiento, se analizaron a través de un diseño completamente al azar con arreglo factorial con 6 repeticiones. Los factores fueron: 1) tipo de aceite esencial (limón, epazote y canela), 2) procedencia (hidrodestiado o comercial) y 3) concentración (0.25, 0.5 y 1.0 μL mL-1). Se utilizó la prueba de Tukey (p≤0.05) para la comparación de medias y el software InfoStat versión 2016, para el análisis de datos. El experimento se realizó por duplicado.
Resultados
Composición química de los aceites esenciales
Los resultados muestran que hubo diferencias en la composición de los AEs que se evaluaron, en función del material vegetal y de su método de obtención (hidrodestilación o comercial). Los AEs que se obtuvieron por hidrodestilación tuvieron rendimientos de 0.49, 0.33 y 0.015 % para canela, limón y epazote, respectivamente.
Considerando el tipo de material vegetal del que provienen los Aes, se observó que los aceites de limón y epazote se constituyeron principalmente de terpenos como el D-Limoneno, ρ-Cimeno y Ascaridol, mientras que, en el aceite de canela predominaron aldehídos como el cis-Cinamaldehído (Cuadro 1). Sin embargo, al considerar el método de obtención, se apreciaron diferencias en el contenido de los compuestos que se detectaron.
Cuadro 1. Resumen de los principales compuestos orgánicos volátiles de tres aceites esenciales detectados por CG-EM.
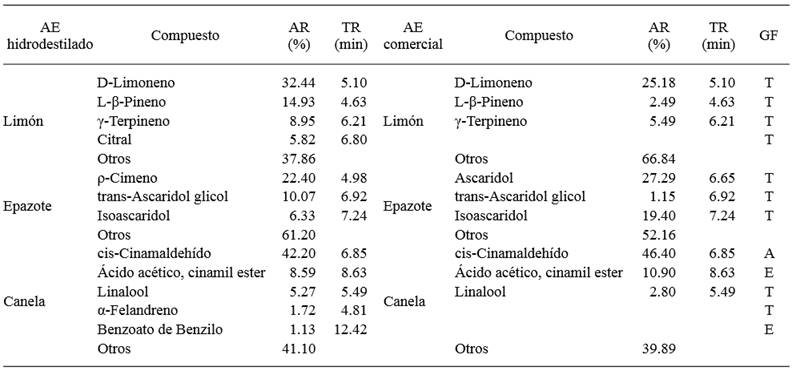
AE-aceite esencial, AR-área relativa, TR-tiempo de retención, GF-grupo funcional, A-aldehído, E-éster, T-terpeno
En el caso del D-Limoneno, se observó un 7.26 % más de contenido en el aceite esencial de limón que se obtuvo por hidrodestilación en comparación con el comercial. Mientras que, en epazote se identificaron dos componentes principales, el ρ-Cimeno en el aceite no comercial (22.40 %) y el Ascaridol en el comercial (27.30 %). Finalmente, el contenido de cis-Cinamaldehído fue superior en el aceite comercial de canela en un 4.20 % con respecto al que se obtuvo por hidrodestilación, siendo este el compuesto mayoritario en ambos AEs.
Análisis de componentes principales
Para el ACP se utilizaron los compuestos que representan un área superior al 1 % en el análisis cromatográfico. De acuerdo con Terrádez (2002) no hay una regla definida sobre el número de componentes principales (CP) que se deban utilizar, pero es importante considerar que uno de los objetivos de este análisis era reducir el número de variables. En este sentido, se seleccionaron los CP que aportaron al menos un 5 % de la varianza total y que la proporción de varianza acumulada explicara al menos el 70 % de la misma (Mora-Aguilera y Campbell, 1997). Los resultados se agruparon en cinco CP que explican el 100 % de la variabilidad en la composición química de los AEs utilizados (Cuadro 2), no obstante, debido a que los CP1 y CP2 explicaron el 74.0 % de la variabilidad, los resultados se describieron en términos de estos.
Cuadro 2. Análisis de componentes principales (eigenvalores) entre los compuestos de tres diferentes aceites esenciales

En la Figura 1A se puede apreciar la formación de tres grupos, considerando el tipo de material vegetal. En el primer grupo se encuentra el aceite de limón que se obtuvo por hidrodestilación, en el segundo grupo los aceites de canela (comercial y no comercial) y en el tercero los aceites de limón (comercial) y epazote (comercial y no comercial). En el CP1 se observó que el aceite esencial de canela fue diferente a los aceites de epazote y limón. Mientras que, con el CP2 se apreciaron diferencias entre los aceites de epazote (comercial y no comercial) y limón (comercial) y los aceites de canela (comercial y no comercial) y limón que se obtuvo por hidrodestilación.
Por otra parte, se encontraron valores significativos en el CP1 por la presencia de compuestos monoterpenicos. Mientras que, el CP2 correlaciona positivamente con aldehídos y ésteres (datos no mostrados). Esto se aprecia con claridad en la figura 1B con la formación de tres grupos, a) el primer grupo incluyó el D-Limoneno y L-β-Pineno, los cuales correspondieron a la composición del aceite de limón, b) en el segundo grupo estuvieron presentes aldehídos, ésteres y monoterpenos no ciclicos como el cis-Cinamaldehído, compuestos constituyentes del aceite de canela y c) el tercer grupo los monoterpenos oxigenados como el Ascaridol, compuestos presentes en el aceite de epazote.
Inhibición del crecimiento micelial
Se observaron diferencias estadísticamente significativas (p<0.0001) en el crecimiento micelial in vitro de A. alternata (al día 9-tiempo en el que el tratamiento control alcanzó su máximo crecimiento) por efecto del tipo de aceite esencial, su procedencia y la concentración (Cuadro 3). Los resultados indicaron que A. alternata no creció en el medio PDA adicionado con aceite esencial de canela (comercial y no comercial) en concentraciones de 0.5 y 1.0 μL mL-1, mismos que tuvieron un efecto fungicida sobre el hongo. Por el contrario, el aceite comercial de limón en concentración de 0.25 μL mL-1 no inhibió el crecimiento de A. alternata, mientras que a la misma concentración, los aceites no comerciales de limón y epazote presentaron una inhibición limitada (4.06 y 3.42 %, respectivamente). Efecto similar se observó con el aceite comercial de limón en concentración de 0.5 μL mL-1 (3.18 % de inhibición).
Inhibición de la germinación de conidios
El porcentaje de germinación de conidios de A. alternata a los que se aplicó directamente los AEs, presentó diferencias estadísticamente significativas (p<0.0001) por efecto de los tratamientos, al ser evaluados después de 8 h (datos no mostrados). En los tratamientos que contenían aceites esencial de canela (0.25, 0.5 y 1.0 μL ml-1), los aceites de limón y epazote no comerciales (0.5 y 1.0 μL mL-1) y los aceites de limón y epazote comerciales (1.0 μL mL-1) no se observó germinación.
Los tratamientos que presentaron el mayor porcentaje de inhibición de la germinación fueron los aceites no comerciales de limón (92.50 %) y epazote (93.33 %) en concentración de 0.25 μL mL-1. Mientras que, en concentración de 0.5 μL mL-1 fueron los aceites comerciales de limón y epazote (91.0 % y 94.17 %, respectivamente), evidenciándose un efecto de dependencia con la concentración del aceite utilizado.
Modelo de crecimiento micelial
Los datos experimentales del crecimiento micelial de A. alternata en PDA con diferentes concentraciones de AEs en función del tiempo se ajustaron al modelo de Baranyi y Roberts. Se observó una tendencia de disminución en el crecimiento micelial con un incremento en la concentración de AEs en el medio de cultivo (Figura 2).

Figura 2. Gráfico de superficie del efecto de diferentes concentraciones de aceites esenciales
sobre el crecimiento micelial de A. alternata.
Aceites esenciales obtenidos por hidrodestilación. a. limón. b.
epazote. c. canela. Aceites esenciales comerciales. d. limón. e.
epazote. f. canela. Datos experimentales (), datos predichos
por el modelo ( ).
).
Con los datos de crecimiento de los tratamientos evaluados se desarrollaron 14 modelos (Cuadro 4). El coeficiente de determinación (R2) promedio fue 0.97, mientras que la raíz del cuadrado medio del error (RMSE) fue 0.15. En los modelos que se desarrollaron, a mayor concentración de aceite esencial se observó una disminución de la tasa máxima de crecimiento (μmax) y un incremento en el tiempo de fase lag aparente (λ).
Cuadro 4. Parámetros obtenidos por el ajuste de los datos experimentales del crecimiento micelial de A. Alternata, incubado en PDA y AEs al modelo de Baranyi y Roberts.

O-AE obtenido;C-AE comercial;µmax -tasa máxima de crecimiento; λ-tiempo de fase lag aparente; SE-error estándar; R2-coeficiente de determinación; RMSE-raíz del cuadrado medio del error
Modelo de germinación de conidios
Los datos experimentales de germinación de conidios se ajustaron al modelo Logístico. Con los tratamientos evaluados se desarrollaron 5 modelos (Cuadro 5). El RMSE promedio fue 1.98. El incremento en la concentración de AEs afectó la germinación, observándose que a mayor concentración de aceite esencial hubo una menor tasa de incremento en el porcentaje de germinación k (h-1) y un mayor tiempo requerido para alcanzar el 50 % de germinación r (h).
Cuadro 5. Parámetros obtenidos por el ajuste de los datos experimentales de la germinación de conidios de A. Alternata, incubado en contacto directo en AEs al modelo logístico.

O-AE obtenido;C-AE comercial; k-tasa de incremento en el porcentaje de germinación; r-tiempo requerido para alcanzar el 50% de germinación; SE-error estándar; RMSE-raíz del cuadrado medio del error
Discusión
Los rendimientos que se obtuvieron debido al proceso de hidrodestilación de los AEs fueron inferiores a lo reportado en la literatura. En el caso del aceite esencial de epazote, Jaramillo et al. (2012) reportaron un rendimiento de 0.4 %. Mientras que, en el aceite de canela, Golmohammad et al. (2012) reportaron un 3.6 % y Saleem et al. (2015) y Unlu et al. (2010) 0.93 %. Las diferencias en los rendimientos de los AEs evaluados, respecto a lo reportado en la literatura, pueden ser atribuidos a factores como la metodología que se utilizó durante la extracción del aceite esencial y su eficiencia (Schmidt, 2009; Golmakani y Moayyedi, 2015).
Por ejemplo, Hamdani y Allem (2015) y Sharma y Vashist (2015) obtuvieron aceite esencial de limón por el método de hidrodestilación utilizando un destilador tipo Clevenger y alcanzaron un rendimiento de 1.0- 1.5 %, que fue de 3 a 5 veces superior al que se obtuvo en la presente investigación, empleando un destilador tipo italiano. De igual manera el estado del material vegetal (fresco o seco) y la variedad tiene influencia en el rendimiento y su efecto fungicida/fungistático; explicándose con ello la variación citada en la literatura (Schmidt, 2009).
A pesar de que existen diversos reportes asociados con la composición de los AEs, no se había contrastado el efecto de un producto comercial y aquel procedente de especies regionales como las que se emplearon en esta investigación. En este sentido, su empleo en la extracción de AEs y en el control de A. alternata es una alternativa viable para el aprovechamiento integral del mismo.
Por otra parte, la reducida capacidad del aceite esencial de limón para inhibir el crecimiento de A. alternata, puede ser debido a que contiene D-Limoneno como el componente más abundante; el cual posee una actividad insecticida, pero no antimicrobiana de acuerdo con lo reportado por Guo et al. (2016).
Respecto al aceite esencial de epazote, no existen estudios de su aplicación en el control de A. alternata. Sin embargo, ya se ha evaluado su efecto en el crecimiento de otros microorganismos. Lombardo et al. (2016) encontraron limitada inhibición del crecimiento in vitro de P. citricarpa en concentración de 1 mg mL-1 y Jardim et al. (2008) reportaron una inhibición total en A. niger, C. gloeosporioides y F. oxysporum, entre otros, a una concentración de 0.3 %. La efectividad en el control de hongos fitopatógenos del aceite de epazote se atribuye a la presencia del Ascaridol (Jardim et al. 2010). No obstante, en el presente trabajo no se identificó este compuesto en el aceite esencial de epazote que se obtuvo por hidrodestilación, pero sí en el aceite comercial (27.29%), esto podría explicar la mayor actividad antifúngica del aceite comercial (76.6 % de inhibición en concentración de 1.0 μL mL-1).
En relación al aceite esencial de canela, este inhibió completamente el crecimiento in vitro de A. alternata y un efecto similar fue reportado por Lu et al. (2013) a una concentración de 240 mg mL-1. También se ha evaluado su efecto en otros hongos. Nasir et al. (2015) reportaron una inhibición del crecimiento de A. niger (100 %) con una concentración de 0.08 μL mL-1 mientras que, Saleem et al. (2015) encontraron una inhibición superior al 50 % en A. Niger y A. flavus a 2 mg mL-1. En todos los reportes, el cinamaldehído es el compuesto principal y el responsable de la actividad antifúngica (Schwab et al., 2008).
Respecto a la inhibición de la germinación de conidios se observó un efecto dependiente de la concentración del aceite; es decir, a mayor cantidad de aceite esencial aplicado se observó un menor el porcentaje de germinación. Este fenómeno puede deberse a que los AEs retrasaron el desarrollo del tubo germinativo o causaron la ruptura de la membrana plasmática de los conidios produciendo una desorganización del citoplasma y destrucción de organelos (Perina et al., 2014). En el trabajo de Lu et al. (2013) se presentó el mismo efecto, con un aumento en la concentración de aceite esencial de canela (20 a 80 μg∙mL-1) en el cual se incrementó la inhibición de germinación de conidios de A. alternata de 30 a 100 %.
La aplicación del ACP en este trabajo, facilitó el análisis y agrupación de los AEs evaluados de acuerdo a su composición química y su procedencia (hidrodestilación o comercial) y con ello fue posible explicar su efecto sobre el crecimiento A. alternata. Se confirmó que el aceite de canela (comercial y no-comercial) fue diferente en composición en comparación con el resto de los aceites. De manera similar, Petretto et al. (2016) realizaron un ACP con los datos de composición del aceite esencial de Myrtus communis y lograron clasificar diferentes especímenes de variedades cultivadas y silvestres, encontrando los compuestos más representativos para cada unas de las variedades. Asímismo, en el trabajo de Méndez-Tovar et al. (2016) el ACP permitió analizar la influencia del año de cosecha sobre la composición química de los AEs de poblaciones de Thymus mastichina, Salvia lavandulifolia y Lavandula latifolia.
Debido a la magnitud del estudio y datos generados sobre el crecimiento micelial y germinación de conidios, el empleo de herramientas matemáticas permite apreciar el efecto combinado de diferentes dosis y aceites, a través del tiempo. El empleo del modelamiento matemático en el hongo A. alternata, es algo novedoso, lo cual permitirá reducir tiempos de análisis de datos, estimar comportamientos considerando diversos factores y optimizar procesos asociados con el control del hongo.
Ya se ha reportado el uso de modelos matemáticos basados en la función de Baranyi y Roberts para modelar los datos de crecimiento micelial de P. expansum cultivado en PDA con aceite esencial de la hoja de betel (Piper betle), observándose que a mayor concentración de aceite esencial en el medio de cultivo, se presentó una disminución en la tasa máxima de crecimiento (μmax) y un incremento en el tiempo de fase lag aparente (λ) (Basak y Guha, 2015). De igual manera, Marín et al. (2008) y Tremarin et al. (2015) presentaron modelos de crecimiento de hongos basados en la ecuación de Baranyi y Roberts pero sin un agente restrictivo (aceite esencial) en el medio de cultivo, sino modificando de los parámetros de cultivo como temperatura y pH. En el estudió se observó un efecto de la modificación de parámetros de cultivo sobre los parámetros la tasa máxima de crecimiento (μmax) y tiempo de fase lag aparente (λ). Adicionalmente Dantigny et al. (2007) y Basak y Guha (2015) emplearon el modelamiento matemático (modelo logístico) en la germinación de esporas de fitopatógenos como P. expansum y P. verrucosum.
Conclusiones
El crecimiento micelial y la germinación de conidios de A. alternata, se afectó por el uso de aceite de canela en concentraciones de 0.5 y 1 μL∙mL-1, independientemente de su procedencia (comercial y no comercial). Por otra parte, el análisis de datos a través de componentes principales resultó ser una metodología apropiada para agrupar los AEs que se evaluaron en función de su composición química y con ello explicar el efecto fungicida o fungistático de los mismos. Finalmente, a través del modelamiento matemático se estableció que, a mayor concentración de aceite esencial en el medio de cultivo, se presenta una disminución en la tasa máxima de crecimiento (μmax) y un incremento en el tiempo de fase lag aparente (λ).











 texto en
texto en 








