Introducción
Agave cupreata es una especie endémica de la Cuenca del Balsas, México. Su cultivo se ha intensificado debido a que a partir de la fermentación del jugo de las piñas de las plantas adultas se produce una bebida alcohólica artesanal conocida como mezcal (Martínez-Palacios et al., 2011). En el estado de Michoacán, en alrededor de 29 municipios se produce mezcal a partir de esta especie de agave. Durante el año 2013, estos municipios obtuvieron la denominación de origen del mezcal (DOM), lo cual traerá beneficios dentro de los que se incluye su exportación (Gobierno de Michoacán, 2012). Debido a esto, se espera un incremento en la superficie cultivada de A. cupreata, por lo que será necesario efectuar un manejo agronómico y fitosanitario adecuados para mantener la sustentabilidad de este cultivo, como se efectúa para otros agaves (A. angustifolia y A. potatorum) empleados en la producción de mezcal en el sureste de México (Aguirre-Dugua y Eguiarte, 2013). El incremento en la superficie del cultivo potencialmente podría incrementar la incidencia de enfermedades como ha sucedido en plantaciones de A. tequilana (Ávila-Miranda et al., 2010). La marchitez causada por el hongo fitopatógeno Fusarium oxysporum es uno de los problemas fitosanitarios que afecta significativamente la productividad del agave tequilero; el proceso de infección se inicia en las raíces, posteriormente se observa un enrollamiento y muerte en las puntas de las hojas, que culmina con la marchitez de toda la planta (Vega-Ramos et al., 2013). Esta problemática fitosanitaria también se presenta en plantaciones de A. cupreata en el estado de Michoacán.
El control convencional de hongos fitopatógenos a través de la aplicación de fungicidas no ha sido efectivo, además de que estos productos originan problemas ambientales, deterioran el suelo, generan resistencia e incrementan los costos de producción (Bernal-Alcocer et al., 2005). En las últimas décadas, el biocontrol ha sido una de las estrategias para controlar diferentes enfermedades en plantas a través del uso de microorganismos benéficos los cuales suprimen la densidad de población o el impacto de patógenos, por lo que se reduce su abundancia o efecto dañino (Eilenberg, 2006). Dentro de los microorganismos con capacidad de biocontrol se encuentran los hongos micorrícicos arbusculares (HMA). Los HMA forman simbiosis con alrededor de 80 % de las plantas terrestres. En esta asociación, las hifas simbióticas del hongo micorrícico transportan nutrientes del suelo hacia la planta y ésta en compensación le brinda espacio y una fuente de carbono al hongo que es intercambiada a través de los arbúsculos (Smith y Read, 2008). Diversos autores han reportado que las plantas micorrizadas pueden originar en la mayoría de los casos una reducción de la incidencia y/o severidad de las enfermedades causadas por diversos fitopatógenos del suelo incluyendo a Fusarium oxysporum (Akhtar y Siddiqui, 2008; Saldajeno et al., 2008; Tripathi et al., 2008). Hage-Ahmed et al. (2013) encontraron que la inoculación de plantas de tomate (Solanum lycopersicum L.) con un inóculo comercial de HMA (Symbivit®) generó una disminución de 35 % en la incidencia de la enfermedad provocada por F. oxysporum f. sp. lycopersici. Hu et al. (2010) inocularon plantas de pepino (Cucumis sativus L.) con un consorcio nativo de HMA (Glomus spp. sensu lato y Acaulospora spp.) y encontraron un efecto en la supresión de la marchitez causada por F. oxysporum f. sp. cucumerinum con respecto a las plantas inoculadas sólo con el patógeno. Jaiti et al. (2007) mostraron que plantas de palma datilera (Phoenix dactylifera L.) inoculadas con un consorcio nativo de HMA presentaron una disminución de la mortalidad de 56 % con respecto a plantas no micorrizadas cuatro meses después de la inoculación con F. oxysporum f. sp. albedinis. A pesar de lo anterior, aun no hay reportes del biocontrol de F. oxysporum en A. cupreata por los HMA. Por otra parte, se ha reportado el uso de HMA en la promoción del crecimiento de algunas especies de agave. Cui y Nobel (1992) encontraron diferencias significativas en el contenido de P en raíz y la parte aérea en plantas de Agave deserti inoculadas con un consorcio nativo de HMA integrado por especies del género Glomus sensu lato, en contraste con las plantas no micorrizadas. Robles-Martínez et al. (2013) observaron incrementos en el peso seco de la parte aérea y en el contenido de P en plantas de A. angustifolia inoculadas con diferentes consorcios nativos de HMA o con Rhizophagus intraradices (sinónimo Glomus intraradices) con respecto a plantas no inoculadas. Lo anterior destaca por un lado el efecto benéfico de los HMA en el crecimiento vegetal y por otro su capacidad de biocontrol sobre F. oxysporum. El objetivo del presente trabajo fue evaluar el efecto de la inoculación micorrícica de plantas de Agave cupreata en el biocontrol de Fusarium oxysporum y en la promoción del crecimiento vegetal.
Materiales y métodos
Inóculo micorrícico
Se utilizaron esporas de cuatro consorcios de HMA, nativos del estado de Michoacán contenidas en arena y un inóculo comercial [micorriza INIFAP® (MI)]. Las esporas de los cuatro consorcios nativos fueron obtenidas de cultivos trampa en propagación con sorgo híbrido (Sweet Chow, Western Seed Co.), pertenecientes a la colección de consorcios nativos de HMA del Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco (CIATEJ). Los consorcios nativos empleados fueron denominados El Huizachal (EH) (Acaulospora morrowiae, A. spinosa, Claroideoglomus etunicatum, Funneliformis geosporum y F. mosseae), Cerro del Metate (CM) (A. mellea, A. scrobiculata, C. etunicatum y F. geosporum), Paso Ancho (PA) (A. spinosa, C. claroideum, C. etunicatum y Glomus sp. 1) y Agua Dulce (AD) (A. morrowiae, A. scrobiculata, A. spinosa, C. etunicatum, F. geosporum, F. mosseae y Rhizophagus clarus) (Reyes-Tena et al., 2016). El inóculo comercial MI, contuvo esporas de R. intraradices. Para inocular la cantidad de esporas requeridas en el experimento, se realizó el conteo de esporas de los consorcios nativos y del inóculo comercial tomando 10 g de suelo seco para extraer las esporas mediante la técnica de tamizado húmedo, decantación (Gerdemann y Nicolson, 1963) y centrifugación con sacarosa al 50 % (Brundrett et al., 1996) por triplicado. Las esporas fueron contadas en un estéreomicroscopio (VE-S6, VELABMR). De cada inóculo se tomaron entre 4-10 g para inocular con 100 esporas de HMA por semilla de agave y para el testigo sin HMA se inocularon 10 g de arena esterilizada por semilla.
Inóculo de Fusarium oxysporum FPC (Fox)
La cepa FPC de F. oxysporum fue obtenida de la colección de hongos fitopatógenos de Biotecnología Vegetal del CIATEJ. Esta cepa fue aislada de plantas de A. tequilana con síntomas de marchitez (Qui-Zapata et al., 2011) y previamente (Trinidad-Cruz et al., 2013) se comprobó su actividad fitopatógena en contra de A. cupreata. A partir de un cultivo de conservación de FoxFPC, se realizó una transferencia de micelio para reactivar la cepa en placas Petri (90 mm de diámetro) con medio de cultivo papa-dextrosa-agar (PDA DIFCO) estéril (121 °C, 1.05 kg cm-2, 20 min); las placas fueron incubadas a 27±1 °C durante 11 días en oscuridad, seguidos de cuatro días con un fotoperiodo de 16/8 h (luz/oscuridad). Después de 15 días de crecimiento, se recolectaron las esporas de FoxFPC, para ello se agregaron 15 mL de agua destilada estéril (121 °C, 1.05 kg cm-2, 20 min) en cada placa Petri. Con ayuda de un pincel estéril se realizó un barrido suave sobre la superficie del medio de cultivo y se recuperó el agua destilada con las esporas con ayuda de una micropipeta y puntas esterilizadas. La concentración de esporas se ajustó a 1×106 esporas mL-1 con ayuda de un hematocitómetro. La suspensión de esporas se almacenó en tubos de 50 mL de capacidad a 4 °C hasta su uso.
Preparación del sustrato de F. oxysporum FPC
Previamente a la inoculación del sustrato con Fox, se utilizaron hojuelas de avena para incrementar la cantidad de propágulos de Fox en recipientes de plástico de 1 L de capacidad con 60 g de hojuelas de avena hidratadas con 50 mL de agua destilada, previamente esterilizados (121 °C, 1.05 kg cm-2, 20 min). Las hojuelas de avena fueron inoculadas con 10 mL de la suspensión de esporas a una concentración de 1×106 esporas mL-1 y se incubaron en oscuridad durante 15 días a temperatura ambiente. Al término de este tiempo, se determinó el número de unidades formadoras de colonias (UFC) por gramo de avena. Un gramo de avena se sometió a diluciones decimales seriadas y se sembraron las diluciones 10-4 a 10-6 en placa Petri con medio de cultivo PDA con rosa de bengala (25 mg L-1) por triplicado; las placas fueron incubadas a 27 ± 1 °C durante dos días en oscuridad antes de realizar el conteo. Una vez determinado el número de UFC, las hojuelas de avena con los propágulos de Fox fueron mezclados vigorosamente con una mezcla de sustrato estéril (arena-turba de esfagno-agrolita, 4:1:1, v:v:v) ajustando a una concentración final de 1×104 UFC g-1 de sustrato seco.
Material vegetal
Las plántulas de A. cupreata fueron obtenidas a partir de semillas desinfectadas con una solución de cloro comercial a 3 % (cloro activo al 6 %) durante 10 min y después fueron enjuagadas con agua destilada, tres veces, durante 5 min cada vez. Las semillas se sembraron en charolas de plástico de 38 cavidades y se colocaron dentro de un contenedor de agua de aproximadamente 4 L. Se sembró una semilla por cada cavidad, la cual contenía como sustrato 30 g de una mezcla de arena-agrolita (4:1, v:v) esterilizada (120 °C, 1.05 kg cm-2, 6 h).
Inoculación de HMA en plantas de Agave cupreata
Para evaluar la promoción del crecimiento de los HMA, cada semilla de agave fue inoculada con 100 esporas de HMA directamente al orificio de siembra de cada uno de los cuatro consorcios nativos (CM, PA, EH y AD), el inóculo comercial MI o 10 g de arena estéril para el testigo sin HMA. Las charolas con las semillas inoculadas permanecieron en condiciones de invernadero y fueron regadas con agua destilada dos veces por semana; a partir de los tres meses después de la siembra, fueron fertilizadas con solución nutritiva (Jarstfer y Sylvia, 1992) baja en fósforo (3 μM) con un pH de 6.1±0.1 cada dos semanas. Se adicionó 1.5 L de la solución nutritiva en cada contenedor; si las plantas necesitaban agua entre cada fertilización, se les agregó agua destilada. Seis meses después de la siembra se suspendió la aplicación de solución nutritiva y se regó con agua destilada hasta concluir el experimento.
Para evaluar el efecto de biocontrol de Fox, plantas de A. cupreata micorrizadas de siete meses de edad contenidas en charolas fueron trasplantadas con su cepellón a vasos de poliestireno expandido (unicel) de 250 mL, a los que se les agregaron entre 65 a 75 g de la mezcla de sustrato arena-turba de esfagno-agrolita (4:1:1, v:v:v) esterilizada (120 °C, 1.05 kg cm-2, 6 h); según el tratamiento correspondiente se agregó el sustrato con Fox a una concentración de 1×104 UFC g-1 o sustrato sin Fox. Las plantas fueron separadas para evitar la contaminación; para ello, las plantas previamente trasplantadas e inoculadas con Fox fueron ubicadas dentro de siete charolas de plástico (18 vasos de unicel por charola) y colocadas en una incubadora refrigerada (Thermo ScientificTM, Modelo Precision 3759) a 28 °C de temperatura y fotoperiodo de 16/8 h (luz/oscuridad). El otro grupo de plantas sin inoculación de Fox fueron colocadas en cinco charolas de plástico (23 vasos de unicel por charola) en un cuarto de incubación para crecimiento de plantas a 27±1 °C de temperatura y fotoperiodo de 16/8 h (luz/oscuridad). Todas las plantas fueron regadas con agua destilada dos veces por semana.
Diseño experimental y variables de respuesta
Para evaluar la promoción del crecimiento de las plantas de A. cupreata, se estableció un diseño completamente al azar en donde se evaluaron seis tratamientos, uno para cada HMA (EH, CM, PA, AD y MI) y un testigo sin HMA. Se utilizaron cinco y tres repeticiones para los tratamientos con HMA y testigo, respectivamente. Cada planta representó una unidad experimental. A los siete meses después de la inoculación con HMA, se evaluó el número de hojas, el peso fresco del follaje y de las raíces, así como la biomasa seca total (secado de las muestras de follaje y de raíces en estufa a 60 °C hasta peso constante). Finalmente, con el objetivo de observar la colonización de las raíces de agave por los HMA se realizó el clareo y tinción de raíces mediante la técnica propuesta por Phillips y Hayman (1970); posteriormente se tomaron registros fotográficos de las estructuras típicas de la micorriza con una cámara digital (Leica DFC450C, Leica Application Suite LAS ver. 4.1.0 software) acoplada al microscopio óptico.
Para evaluar el efecto de biocontrol de Fox, se utilizó un diseño completamente al azar con arreglo factorial en donde se evaluaron 12 tratamientos, resultantes de la combinación de los factores: 1) inoculación con HMA (seis niveles: CM, PA, EH, AD, MI y testigo sin hongo micorrícico); 2) inoculación con Fox (dos niveles: con y sin patógeno). Se utilizaron 10 repeticiones por tratamiento; se consideró como unidad experimental a una planta de A. cupreata contenida en una maceta. Se evaluó el grado de severidad de la enfermedad (SE) de acuerdo con la escala propuesta por De Cal et al. (2000): 1 (SE del 0 %)= planta sana; 1.1 a 1.9 (SE de 1 a 24 %)= la primera hoja amarilla; 2 a 2.9 (SE de 25 a 49 %)= más de una hoja inferior amarilla y primera hoja muerta; 3 a 3.9 (SE de 50 a 74 %)= hojas inferiores muertas y algunas hojas superiores amarillas; 4 a 4.9 (SE de 75 a 99 %)= hojas inferiores muertas y hojas superiores marchitas; y 5 (SE del 100 %)= planta muerta. El grado de SE fue determinado a los 240 días después de la inoculación con el patógeno, quince meses después de establecido el experimento inicial.
Análisis estadístico
Las variables de crecimiento vegetal fueron analizadas mediante un análisis de varianza y una prueba de comparación múltiple de medias Tukey (p≤0.05). Los datos de SE fueron analizados con la prueba estadística no paramétrica de KruskalWallis (p≤0.05) e intervalos de confianza de la mediana (p≤0.05). Los análisis se realizaron utilizando el paquete estadístico StatGraphics Centurion XV (StatPoint Inc., 2005).
Resultados
Se encontraron diferencias significativas (Tukey, p≤0.05) entre los consorcios nativos y el testigo sin HMA para todas las variables de promoción de crecimiento evaluadas siete meses después de la inoculación (Cuadro 1). Los consorcios nativos denominados El Huizachal (EH), Agua Dulce (AD) y el inóculo comercial (MI) incrementaron el crecimiento de las plantas de A. cupreata (Figura 1A). En estos consorcios nativos existió un incremento de dos a tres hojas; de peso fresco de follaje del 186, 168 y 154 %; de peso fresco de raíces del 273, 196 y 282 % (Figura 1B); respectivamente, en comparación con el testigo sin HMA. Para la variable biomasa seca total todos los consorcios nativos y MI incrementaron la biomasa entre 148 a 239 % con respecto al testigo sin HMA (Cuadro 1) (Figura 1C).
Cuadro 1. Efecto de distintos consorcios nativos y un inoculante comercial de hongos micorrícicos arbusculares (HMA) en el crecimiento vegetal de plantas de Agave cupreata siete meses después de la inoculación en condiciones de invernadero.

Valores con la misma letra en cada columna son estadísticamente iguales (Tukey, p≤0.05); ± desviación estándar. Tratamientos con HMA, n=5; testigo sin HMA, n=3.

Figura 1. Efecto de los consorcios nativos y un inóculo comercial de hongos micorrícicos arbusculares (HMA) en la promoción del crecimiento de plantas de Agave cupreata a los siete meses después de la inoculación. A) Vista del crecimiento de los agaves micorrizados y testigo sin inoculación de HMA; B, C, D y E) Vista del crecimiento de las raíces; F, G y H) Observaciones de la tinción de raíces de Agave cupreata con azul de tripano, se muestra la colonización intrarradical de los HMA; Barra de A-E= 5 cm; Barra de F-H= 50 μm; T: Testigo; EH: El Huizachal; MI: Micorriza INIFAP®; AD: Agua Dulce; PA: Paso Ancho; CM: Cerro del Metate.
Por otra parte, los síntomas de la marchitez fueron observados desde los 20 días después de la inoculación con Fox (ddif), a este tiempo la severidad de la enfermedad (SE) en los tratamientos con FoxFPC fue en promedio entre 1.08 a 1.32 (primera hoja inferior amarilla, daño en planta entre 2.8 a 8 %). Los síntomas típicos como clorosis (Figura 2A), enrollamiento y muerte en las puntas de las hojas (Figura 2B y 2C) y marchitez de toda la planta (Figura 2D) fueron observados durante el transcurso del experimento. La SE en los tratamientos PA+Fox y MI+Fox (240 ddif) fue menor que en el tratamiento testigo+Fox (Kruskal-Wallis, p≤0.05) (Figura 3). Los tratamientos PA+Fox y MI+Fox presentaron en promedio 41 % menos daño en las plantas de agave (SE de 2.3, más de una hoja inferior amarilla y la primera hoja muerta) con respecto al tratamiento Testigo+Fox que presentó en promedio 74 % de daño en las plantas (SE de 3.9, hojas inferiores muertas y algunas hojas superiores amarillas). Los tratamientos con los consorcios EH, CM y AD no mostraron tener un efecto en el biocontrol de F. oxysporum FPC (Figura 3).

Figura 2. Presencia de síntomas asociados a la marchitez provocado por Fusarium oxysporum FPC (Fox) en plantas de Agave cupreata. A) Hoja con clorosis; B y C) Hojas con enrollamiento y necrosis; D) Planta con marchitez severa; E) Vista del marchitamiento de las raíces a los 240 días después de la inoculación de Fox; Barra= 5 cm.
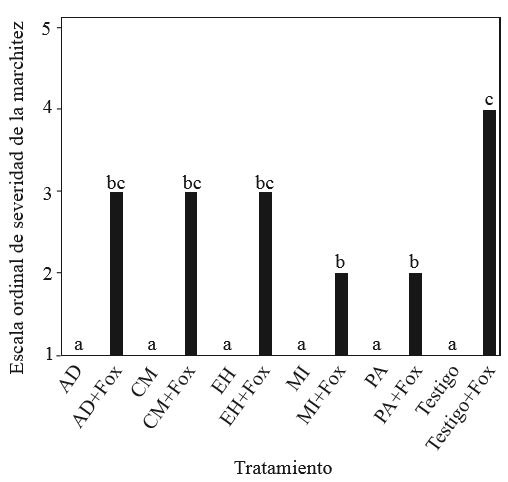
Figura 3. Severidad de la marchitez en plantas de Agave cupreata inoculadas con Fusarium oxysporum FPC (Fox) a los 240 días después de la inoculación. Letras distintas indican diferencias significativas (Kruskal-Wallis, p≤0.05) e intervalos de confianza (95 %) de la mediana. Hongos micorrícicos arbusculares (HMA): EH: El Huizachal; MI: Micorriza INIFAP®; AD: Agua Dulce; PA: Paso Ancho; CM: Cerro del Metate; Testigo: sin HMA.
Discusión
La inoculación con los consorcios de HMA nativos y el inóculo MI promovieron significativamente el crecimiento de las plantas de A. cupreata, sin embargo, la respuesta a la inoculación con HMA en otras especies de agave ha sido variable. Para A. tequilana, Ruiz et al. (2011) encontraron que plantas in vitro inoculadas con R. intraradices no mostraron diferencias significativas en las variables evaluadas como el número de hojas, altura de planta, peso fresco y seco con respecto al control no inoculado, 263 días después de la inoculación. Pimienta-Barrios et al. (2009) tampoco encontraron diferencias significativas en el crecimiento de plantas de A. tequilana inoculadas con R. intraradices o R. fasciculatus con respecto a las plantas no inoculadas con HMA. En contraste, Robles-Martínez et al. (2013) encontraron diferencias significativas con respecto a las plantas sin HMA para el peso seco del follaje de plantas de A. angustifolia inoculadas con R. intraradices o con al menos un consorcio nativo, a los 98 días después de la inoculación. Esta variabilidad en la respuesta de crecimiento de las plantas de agave asociadas con HMA puede deberse a varios factores como las especies de HMA (consorcios nativos o cultivos monoespecie), la complementariedad funcional o sinergismo de los HMA y a la respuesta de cada hospedero (alta o baja dependencia a los HMA) (Gustafson y Casper, 2006; Jansa et al., 2008; Camprubi et al., 2011). La capacidad y la eficiencia de los HMA para absorber P varían entre diferentes especies (variación interespecífica) y entre cepas de la misma especie (variación intraespecífica) aún con la misma especie vegetal hospedera (Pearson y Jakobsen, 1993; Munkvold et al., 2004; Abdel-Fattah y Asrar, 2012). Los consorcios EH y AD que mostraron un efecto positivo significativo en el crecimiento de A. cupreata contuvieron las mismas cinco especies de HMA (A. morrowiae, A. spinosa, C. etunicatum, F. geosporum y F. mosseae), más dos especies (A. scrobiculata y R. clarus) sólo presentes en el consorcio AD. De estas especies, F. mosseae (George et al., 1992; Ozgonen y Erkilic, 2007) y A. scrobiculata (Shukla et al., 2012) se han reportado como eficientes para la adquisición de P; mientras que F. geosporum se ha encontrado que produce respuestas diferenciales en el hospedero de acuerdo con el origen del aislado (Oliveira et al., 2010).
Por otra parte, se demuestra parcialmente lo encontrado por otros autores, es decir, que la micorrización influye en la disminución de la severidad de la enfermedad (Akhtar et al., 2011), aunque de manera diferencial. Sólo uno de los consorcios nativos (PA) y el inóculo comercial (MI) mostraron un efecto en la disminución de la severidad de la marchitez causada por la cepa FPC de F. oxysporum. El consorcio PA contuvo cuatro especies de HMA (A. scrobiculata, A. spinosa, C. claroideum y C. etunicatum). De estas especies, se sabe que C. claroideum en combinación con otras especies de HMA (F. geosporum, F. mosseae y R. intraradices) inducen el biocontrol de Pythium ultimum (Del Fabbro y Prati, 2014). Efectos de biocontrol como resultado de la micorrización fueron encontrados por Fierro-Coronado et al. (2013) quienes mostraron que la micorrización de plantas de tomate (Solanum lycopersicum L.) con R. intraradices crecidas con una concentración baja en P (20 μM) disminuyó significativamente el índice de pudrición radical causado por F. oxysporum f. sp. lycopersici con respecto a las plantas no micorrizadas; Gardezi et al. (2001) evaluaron el efecto de un consorcio nativo (Glomus sp. Zac-19) y Glomus aggregatum de manera individual en el biocontrol de Fusarium sp. en plantas de gladiola (Gladiolus grandiflorus Andrews) encontrando que los HMA disminuyeron significativamente la pudrición radical con respeto a las plantas sin inocular; mientras que Hernández-Montiel et al. (2013) encontraron que la inoculación de plantas de papaya (Carica papaya L.) con un consorcio nativo MTZ01 (R. intraradices, F. mosseae, C. etunicatum y Gigaspora albida) disminuyeron significativamente el índice de la severidad de la enfermedad en 56 % y la colonización radical de F. oxysporum en 54 % con respecto al control. Los HMA juegan un papel importante en el control de diversos fitopatógenos a través de mecanismos directos o indirectos (Jung et al., 2012). Mecanismos directos como la competencia por sitios de colonización (Cordier et al., 1998; Larsen et al., 2012; Hernández-Montiel et al., 2013; Reyes-Tena et al., 2016), cambios en la composición de exudados radicales (Scheffknecht et al., 2006; Ren et al., 2015) e indirectos como la resistencia inducida por la micorrización de los diferentes mecanismos de defensa vegetal (Jung et al., 2012; Cameron et al., 2013). Jaiti et al. (2007) encontraron que plantas de palma datilera (Phoenix dactylifera) inoculadas con un consorcio nativo (Glomus sp., Sclerocystis sp., Acaulospora sp. y Scutellospora sp.) indujo cambios en las actividades de dos enzimas relacionadas con la defensa vegetal (peroxidasa y polifenoloxidasa) sólo cuando fueron confrontadas con Fusarium oxysporum f. sp. albedinis. Estos mecanismos pueden estar implicados en la disminución de la severidad de la marchitez en los tratamientos PA+Fox y MI+Fox. La aparición de los síntomas de la marchitez originados por el patógeno inoculado en las plantas de A. cupreata fue de manera lenta y diferencial pero progresiva, similar a lo reportado por Ávila-Miranda et al. (2010) quienes al inocular plantas de A. tequilana con dos cepas de F. oxysporum para evaluar su patogenicidad observaron los síntomas iniciales de la enfermedad en las puntas de las hojas (clorosis, enrollamiento y marchitez) a los 200 días después de la inoculación.
Conclusiones
Los consorcios nativos de HMA y el inóculo comercial micorriza INIFAP® mostraron un efecto significativo en el crecimiento de plantas de A. cupreata en condiciones de invernadero a los siete meses después de la inoculación, por lo que pueden considerarse como potenciales biofertilizantes para A. cupreata en la etapa de vivero. Se encontró un efecto de biocontrol de dos inóculos, el consorcio nativo Paso Ancho (PA) y el inóculo comercial micorriza INIFAP® al disminuir en 41 % la severidad de la marchitez en las plantas de A. cupreata inoculadas con F. oxysporum FPC, ambos inóculos pueden ser considerados como posibles agentes de biocontrol. Este es el primer reporte del uso de HMA para la promoción del crecimiento vegetal y en el biocontrol de F. oxysporum en A. cupreata.











 texto en
texto en 


