La producción de árbol de navidad Douglas-fir [Pseudotsuga menziesii (Mirb.) Franco] en plantaciones forestales ubicadas en Valle de Bravo, estado de México, México, requiere anualmente una fertilización edáfica y foliar con un balance: 5N:1P:1K para favorecer el crecimiento de los brotes nuevos. Aunque éstos brotes y todas las acículas del follaje son susceptibles a Phaeocryptopus gaeumannii (Rhode) Petrak un Ascomycota (Shaw et al., 2011) que crece intercelularmente en las acículas (Stone et al., 2008), y forma pseudotecios globosos y negros que se alinean sobre los estomas en el envés (Dennis, 1978), e induce defoliación severa (Skilling, 1981). La fertilización se ha usado para controlar la enfermedad. El exceso de N incrementa la severidad del tizón suizo (El-Hajj et al., 2004), y en balance con P no la incrementa (Mulvey et al., 2013); y acículas sanas en proporción al N, tienen baja dosis de P (Mohren et al., 1986). El silicio (Si) no ha sido empleado para el control del tizón suizo. En otras coníferas se considera puede ayudar a disminuir la toxicidad por Aluminio (Hodson y Sangster, 1999). El Si no se incluye en las formulaciones nutritivas por no ser esencial. En forma natural las plantas lo acumulan en los espacios intercelulares, en la pared celular, lumen de la célula, epidermis y cutícula; y actúa posiblemente como un factor adverso en la adecuada nutrición de hongos. Esto en base que en diversos cultivos agrícolas coadyuva a reducir sus enfermedades (Datnoff et al., 2011). Con base en los conceptos generales de Griffin (1994) y Jennings (2007) sobre nutrición y crecimiento micelial de hongos, se puede extrapolar que, al adherirse el Si a la pared celular, las enzimas de las hifas no actuan eficientemente en desdoblar la celulosa a glucosa, y la nutrición del hongo es afectada negativamente por lo que la enfermedad se reduce (Datnoff et al., 2011). En México esta enfermedad se ha detectado en 11 estados, en poblaciones silvestres de P. menziesii (Cibrián et al., 2007; Cibrián et al., 2014), y en 2005 en la región de estudio con severa defoliación y su control es solo químico (Stone et al., 2007). El objetivo del estudio fue evaluar in vitro el efecto de diferentes macronutrimentos y micronutrimentos y el Si sobre el crecimiento in vitro de P. gaeumannii. Se hipotetizó que los macronutrimentos y micronutrimentos agregados al medio de cultivo afectan el crecimiento del hongo, que el Si le es toxico, y en presencia del Si el hongo no puede absorber adecuadamente las fuentes de carbón del medio de cultivo reduciendo su tasa de crecimiento hifal.
El estudio se hizo con un aislamiento de P. gaeumannii (# JN204508, NCBI) de la Colección de Cultivos del Colegio de Postgraduados-Fitopatología (# CP-A032), aislado de árboles de navidad de P. menziesii en Valle de Bravo. La colonia se incrementó en medio de cultivo al 2 % de Extracto de Malta-Agar (MEA) (Crous et al., 2009) (Oxoid LTD, LM0059, Inglaterra) a temperatura constante de 21 °C y oscuridad total durante 20 días. Para comparar las respuestas de crecimiento y como una doble evaluación en tiempo, se condujeron dos experimentos in vitro. Uno en medio solido (2 % MEA) y otro en medio líquido de Papa Dextrosa (PD).
Primer experimento. En un experimento factorial con diseño completamente al azar, cinco repeticiones y 50 unidades experimentales en total, se evaluaron diez tratamientos (Cuadro 1). La solución nutritiva de macronutrimentos tuvo el balance nutrimental de 3N: 1P: 3K (100 mL-1 por tratamiento), y metasilicato de sodio (44 % Si; Na2SiO3) como fuente de Si. Los micronutrimentos se prepararon y aplicaron como lo describe Hewitt y Smith (1975). A las soluciones (Cuadro 1) se adicionó 2 % MEA, se esterilizaron a 120 °C por 20 min, se midió el pH y se ajustó a 5.5 con 0.01N H2SO4, y se vació el medio en cajas Petri de plástico estériles de 8.5 cm de diámetro (diám.). Por caja se sembraron fragmentos de 1 mm de diám. de la colonia de P. gaeumannii de 20 días edad de edad, e incubaron a temperatura constante de 21 °C y oscuridad total por 42 días. El crecimiento del diám. colonial (mm) se registró cada siete días y los datos se analizaron con la técnica de análisis de crecimiento de Fisher (1921). Los datos se convirtieron a logaritmo natural (Ln) y se hizo una regresión lineal (Hunt, 2003). La Tasa de Crecimiento Relativo instantáneo (R o TCRi) se obtuvo con el siguiente modelo: Ln a = b + R (DDIE) [Dónde: a = variable evaluada, b = valor donde la recta cruza la ordenada, R = TCRi, y DDIE = Días Después de Iniciado el Experimento]. La TCRi del testigo se restó a cada tratamiento y los datos se muestran en Figura 1 A. Los valores arriba (+) del eje de las “x” fueron las diferencias en que cada tratamiento superó la TCRi del testigo, y los valores abajo (-) del eje de las “x” fueron las diferencias en que cada tratamiento fue menor a la TCRi del testigo.
Cuadro 1. Nutrimentos y dosis de Silicio utilizados en dos experimentos in vitro en medio solido 2 % de MEA y líquido PD para determinar el crecimiento de la colonia (cm) y el peso seco (mg) del micelio de Phaeocryptopus gaeumannii.
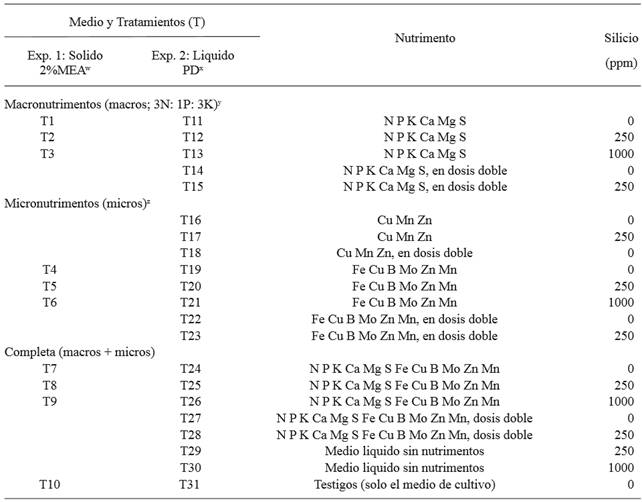
wExtracto de Malta-Agar; xPapa Dextrosa; yFormulación en texto; zHewitt y Smith, 1975.

Figura 1. Crecimiento de P. gaeumannii en medios sólido y liquido suplementado con diferentes nutrientes y dosis de Silicio. A) Tasa de Crecimiento Relativo instantáneo (TCRi) en medio solido de 2 % Extracto de Malta-Agar por 42 días, B) Crecimiento relativo (mg) en medio liquido de Papa Dextrosa determinado a los 35 días. Barras arriba del eje de las “x” (+) indicaron que la diferencia de crecimiento del tratamiento fue mayor en relación al testigo, y por debajo del eje (-), que fue menor con relación al testigo. Macros = macronutrimentos, Micros = micronutrimentos, Si = Silicio.
Segundo experimento. Este fue en un diseño completamente al azar con cinco repeticiones, 21 tratamientos (11-31) (Cuadro 1), y un total de 105 unidades experimentales. El testigo (T31) fue sólo el medio líquido [PD; caldo de 200 g de papa blanca libre de cascara, cortada en pequeñas piezas, y hervida por 20 min en agua destilada, y 14 g de dextrosa (J.T. Baker, 1916-01, México) por litro de agua destilada] más el hongo. Al medio se agregó la misma solución nutritiva arriba mencionada, algunas dosis cambiaron (Cuadro 1) e incubación por 35 días. La colonia desarrollada en cada tubo se extrajo del medio líquido, se colocó en papel aluminio estéril y se registró peso húmedo en una balanza electrónica con aproximación de 0.001 g (AP210-O, Ohaus, New Jersey, EE. UU.). Las muestras de micelio se transfirieron a cajas Petri (Pyrex) de cristal estériles de 5.0 cm, y se deshidrataron en estufa de cultivo (Craft Instrumentos Científicos, México) a 35 °C por 48 h y se registró el peso seco. A cada variable de peso húmedo y seco, se hizo un análisis de varianza y comparación de medias por Tukey (α=0.05) con el paquete estadístico SAS (2009) versión 9.3 (SAS The Power to Know, USA). A cada media de peso seco de los tratamientos se les resto la media del testigo. Datos en Figura 1B.
Los resultados de los dos experimentos fueron estadísticamente significativos.
Primer experimento. En todos los tratamientos hubo crecimiento de la colonia de P. gaeumannii (Figura 1A). Los macronutrientes (T1) solos favorecieron la TCRi, no obstante, cuando se adicionaron los micronutrientes (T7) el estímulo de crecimiento se incrementó como se espera en una formulación balanceada. Por otro lado, cuando sólo hubo microelementos en el medio (T4) se redujo la TCRi. Con la presencia de macronutrientes (T1 y T7) el hongo dispuso de N y P, elementos básicos para la formación de substancias proteínicas y metabolitos secundarios que contribuyeron al crecimiento del hongo. El efecto negativo de los microelementos (T4) se redujo debido a la presencia de macroelementos (T7) lo cual favoreció un balance nutritivo para la TCRi. Por el contrario, la adición de Si en los otros tratamientos disminuyó la TCRi (Figura 1A). La mayor reducción en el crecimiento de la colonia se observó cuando el medio contenía micronutrientes (T5) y 250 ppm de Si (Figura 1A).
La concentración más alta de Si (1000 ppm) (T6), no superó el efecto inhibitorio debido a la combinación micronutrientes-250 ppm de Si (T5). Lo anterior lleva a inferir que la concentración de los microelementos debe estar balanceada con la del Si para una efectiva inhibición del crecimiento del hongo. El efecto inhibitorio del Si se corroboró en el tratamiento en el que se adicionaron al medio macronutrientes, micronutrientes más 1000 ppm de Si (T9). Dado que no hay reportes en la literatura sobre el efecto inhibitorio del Si en el crecimiento de hongos in vitro, se hipotetiza que ésta podría ser una respuesta de toxicidad. Además, al considerar que en la nutrición de las plantas (incluye a los árboles de navidad, P. menziesii) se requiere de una formulación balanceada entre macronutrientes y micronutrientes, el tratamiento T9 debería continuarse estudiando. Aunque el tratamiento T5 fue el mejor de todos, los micronutrientes por si solos no nutren a las plantas, no obstante indicó que la concentración de éstos fue clave para reducir la TCRi del hongo.
Segundo experimento. Los resultados se basaron en el peso seco (no hubo diferencias significativas con el peso húmedo). Los tratamientos que mejor estimularon el crecimiento micelial de P. gaeumannii fueron siete (barras arriba del eje de las “x”), y donde sobresalieron los tratamientos con doble concentración de macronutrientes sin o con Si (T14, T15) (Figura 1 B). Esto, como ya se indicó pudo deberse al N y P que favorecieron un mayor crecimiento micelial. Aunque en dosis normal su efecto fue negativo (T11). Esto pudo atribuirse a que en medio solido (T1) las hifas tuvieron mayor eficiencia de crecimiento por ser un hongo aeróbico (Griffin, 1994), y en medio liquido el tratamiento T14 requirió el doble de macros para favorecer el crecimiento en una condición adversa. El tratamiento T30 con solo dosis alta de Si también promovió el desarrollo del hongo aunque en baja cantidad. Posiblemente, esto pudo deberse a los nutrientes propios del medio líquido como almidones (N) y trazas de proteínas derivados del extracto de papa (PD). Por el contrario, en baja dosis (T29), el Si inhibió el crecimiento del hongo. Ambos resultados deben continuar estudiándose empleando un tratamiento solo con agua y Si. Además sería recomendable usar otras fuentes de Si como el Silica Gel, NaSiO3 (Griffin, 1994), etc. Los otros 14 tratamientos mostraron un efecto inhibitorio en el crecimiento del hongo (barras abajo del eje de las “x”) (-). En relación a los micronutrientes completos (Cuadro 1; seis elementos) en dosis normal y con o sin Si se comportaron como en el primer experimento, y también en dosis doble (T22, T23), y restringieron el crecimiento del hongo. Al reducir los micronutrientes a tres elementos (Cuadro 1; Cu, Mn, Zn), el tratamiento T18 se comportó igual a T19 (seis elementos). Lo que ayudo a inferir que estos tres micronutrientes pueden ser los que inhibieron el crecimiento micelial y en particular el Mn. Griffin (1994) señaló que el exceso de Mn como en tratamiento T18, actúa inhibiendo el crecimiento fungal. No obstante, al adicionar el Si el crecimiento del hongo no se afectó (T17; dosis normal) y el crecimiento fue similar al testigo. Habría que diseñar otros experimentos con dosis dobles de micronutrientes + Si. Los macronutrientes más micronutrientes en dosis doble, y sin o con Si, estimularon el crecimiento micelial (causas arriba expuestas); y en dosis normal la restringieron (Figura 1). El tratamiento que sobresalió fue el T25 con la mayor inhibición micelial. La formulación balanceada de macroelementos y microelementos esperada en la nutrición de plantas, que incluyó además al Si como coadyuvante, indican que T25 es el mejor tratamiento en medio liquido lo cual también se observó en el tratamiento T9 en medio sólido. Así considerando que con la ayuda del Si se podría coadyuvar en reducir la enfermedad (Datnoff et al., 2011), y en complemento a una adecuada formulación de fertilización se contribuiría a balancear el contenido nutrimental de la planta (Mohren et al., 1986), por ello, las posibilidades del control del Tizón Suizo pueden ser factibles en futuros estudios. En conclusión, este es el primer estudio sobre el efecto del Si y los micronutrientes Cu, Mn, Zn, en la inhibición del crecimiento in vitro del hongo P. gaeumanni, agente causal de P. menziesii en plantaciones de árboles de navidad.











 texto en
texto en 


