En México, Sinaloa es el principal estado productor de hortalizas. En Sinaloa, durante el 2014, la superficie de siembra de calabacita (Cucurbita pepo L.), tomate (Solanum lycopersicum L.), tomatillo (Physalis philadelphica Lam.) y pepino (Cucumis sativus L.) fue de 31,716 ha mientras que la de frijol (Phaseolus vulgaris L.) y mango (Mangifera indica L.) fue de 122,412 ha y 31,180 ha, respectivamente (SAGARPA, 2014). Aun cuando Sinaloa no se ubica como uno de los principales estados productores de rosas, la superficie de siembra se ha incrementado por la demanda que esta ornamental representa. En Sinaloa, las enfermedades de origen fúngico constituyen uno de los principales factores limitantes en estos cultivos (León-Gallegos, 1988; Cruz-Ortega et al., 1998; Ramírez-Villapudúa et al., 2006; Ramírez-Villapudúa y Sáinz-Rodríguez, 2006) y entre aquellas que afectan al follaje resaltan las cenicillas, las cuales invariablemente se presentan en todos los ciclos agrícolas y su incidencia y severidad varían con las condiciones ambientales prevalentes.
Las cenicillas, también llamadas cenicillas polvorientas o mildiu polvorientos, son causadas por un grupo de hongos diversos, complejos en su forma, en sus estructuras reproductivas, rango de hospedantes y distribución geográfica (Bélanger y Labbé, 2002). Se ubican en la familia Erysiphaceae del orden Erysiphales; son parásitos obligados (biótrofos) y parasitan alrededor de 9,838 especies de plantas que pertenecen sólo a las angiospermas (Amano, 1986). El 93% de las plantas hospedantes son dicotiledóneas, mientras que el 7 % son monocotiledóneas (Takamatsu, 2013).
Los Erysiphales producen ascocarpos esféricos llamados casmotecios (previamente denominados cleistotecios) así como conidióforos e hifas hialinas, septadas uninucleadas, y conidios que al desarrollarse en grandes cantidades sobre las superficies afectadas de la planta forman un polvillo blanco a manera de ceniza, lo que las hace fáciles de reconocer. Dichas estructuras se producen principalmente sobre las hojas, yemas, flores y frutos, y producen haustorios en las células epidermales de sus hospedantes (Boesewinkel, 1980). Su daño en las plantas es lento y son vulnerables a los fungicidas debido al hábito epífito en su interacción con el hospedante (Yarwood, 1973). Aunque las cenicillas son comunes y causan daños considerables en áreas frescas, son aún más comunes y severas en lugares con clima cálido y seco, porque en estas condiciones el viento fácilmente desprende y disemina los conidios (Romero-Cova, 1988); además se ha establecido que, las cenicillas se presentan en tejido suculento del hospedante en ambientes sombreados y frescos (Yarwood, 1973). La vida de los conidios es corta y les favorecen altos niveles de humedad relativa, pero no son favorecidos por lluvia e inmersión en agua (Sivapalan, 1993a; Sivapalan, 1993b). En general, el micelio es epifítico excepto en los géneros Leveillula, Phyllactinia, Pleochaeta el micelio es hemiendofítico y ocasionalmente en especies de Cystotheca; en este caso, las hifas penetran las hojas a través de los estomas y forman micelio en el interior, sin embargo, el micelio de las especies de Leveillula es más abundante en el interior de la hoja del hospedante (Braun et al., 2002).
El desarrollo de la taxonomía de los Erysiphales es basta y controversial y ha sido ampliamente discutida en un gran número de publicaciones (Braun, 1999; Braun et al., 2002; Braun y Cook, 2012). En años recientes, con base en filogenia molecular, se ha demostrado que los Erysiphales pertenecen a los Leotiomycetes (Discomycetes inoperculados) y no a los Pirenomycetes como se consideró durante muchos años (Glawe, 2008). Con los trabajos clásicos sobre los Erysiphales (Yarwood, 1957), era imposible referirse al anamorfo de los agentes causales de la cenicilla; sin embargo, el surgimiento de trabajos como los de Boesewinkel (1980) y Braun y Cook (2012) contribuyó al conocimiento del anamorfo y la relación de éste con el teleomorfo; estos autores introdujeron nuevos caracteres y un concepto de especie más amplio y natural; al mismo tiempo demostraron que muchas especies de cenicillas tienen un rango de hospedantes más amplio que el que se conoce.
Como lo establece Boesewinkel (1980), en la naturaleza las cenicillas se encuentran principalmente en su fase asexual. En ocasiones los investigadores subestiman una amplia variedad de características morfológicas en los anamorfos, las cuales son útiles para la identificación a nivel especie. Las estructuras que se consideran, entre otras son: la ubicación del micelio en el hospedante; el diámetro y coloración de las hifas; las características de los haustorios, apresorios y su ubicación en el micelio; los conidióforos simples o ramificados; la producción individual o en cadena de conidios; las características de la célula basal del conidióforo; la forma de los conidios que varía desde ovoides a cilíndricos o lanceolados; así como, la presencia de cuerpos de fibrosina en los conidios (Boesewinkel, 1980). En la mayoría de las especies los conidios son monomórficos, aunque las especies de Leveillula, Pleochaeta (Braun et al., 2002) y Phyllactinia (Liberato, 2007) producen conidios dimórficos.
En los Erysiphales, muchas especies están asociadas a ciertas familias y géneros de plantas lo que también es de utilidad en el proceso de identificación del anamorfo. Las características morfológicas se conjugaron y se elaboraron claves para la identificación de miembros de la familia Erysiphaceae (Boesewinkel, 1980). Posteriormente, el microscopio electrónico de barrido mostró que la pared de los conidios turgentes presenta una amplia variación (desde lisos hasta con diversas ornamentaciones) y cuando están deshidratados sus patrones de arrugamiento sinuoso, pueden ser longitudinales o transversales, reticulados, lineales, rectangulares, entre otros (Braun et al., 2002). De igual manera, se encontraron diferentes patrones en la ornamentación del extremo del conidio, las cuales difieren de aquellas del resto del conidio (Cook et al., 1997; Braun et al., 2002; Braun y Cook, 2012). Algunos autores sostienen que las características de la pared celular son constantes pues se forman desde las capas interiores de la misma (Plumb y Turner, 1972), lo que contrasta con los apéndices del casmotecio, los cuales son modificables por la edad y factores ambientales (Cook et al., 1997).
El manual de taxonomía de los Erysiphales (Braun y Cook, 2012) ubica las tribus y géneros, y considera la morfología del teleomorfo, la germinación de los conidios y las características de la pared de éstos bajo el microscopio electrónico; contiene claves con base en las características del anamorfo y teleomorfo, y presentan claves adicionales únicamente para el anamorfo. De manera ordenada muestra claves para especies en cada género, así como claves tabulares para especies con base en las familias y géneros de los hospedantes. La ubicación de las tribus y géneros se basa en la clasificación filogenética molecular reciente de los Erysiphales y se describen 873 especies que incluyen 853 figuras. Esta obra sin duda contribuye a la identificación de los agentes causales de las cenicillas.
La identificación de las cenicillas resulta difícil dependiendo del estado reproductivo del hongo (Braun y Cook, 2012), de ahí que las herramienta moleculares sean de gran utilidad, particularmente si se aplican a especímenes donde no se presenta el teleomorfo, así como en material de herbarios (Cunnington et al., 2003). En los estudios taxonómicos a nivel molecular, la región de los espaciadores transcritos internos (ITS; por su abreviatura en inglés) del ADN ribosomal (ADNr) pueden ser de utilidad para relacionar el anamorfo de los especímenes con su respectivo teleomorfo. Estudios al respecto indican que al secuenciar las regiones del ITS de 25 especímenes anamorfos y al compararse con el ITS de sus potenciales teleomorfos, en la mayoría de los casos arrojaron similitudes mayores de 99 %; aun cuando el estudio no fue concluyente para algunos especímenes, esta técnica provee información que al complementarse con morfología y rango de hospedantes, contribuye a la identificación de agentes causales de cenicillas, tal como se indica en trabajos previos (Cunnington, et al., 2003; Monkhung et al., 2011). Los sistemas taxonómicos actuales recurren a las características morfológicas, al rango de hospedantes, así como a la información filogenética molecular (Glawe, 2008). El uso de secuencias ITS y 18S del ADNr para inferir relaciones filogenéticas de Erysiphales inició en los años 90 (Saenz et al., 1994; Saenz y Taylor, 1999).
Por otro lado, al igual que en la taxonomía de los hongos, los códigos de nomenclatura también han cambiado. En el simposio “Un hongo = Que nombre” con sede en Amsterdan en 2012, se abordaron cambios en la nomenclatura de los hongos pleomorfos; se concluyó que los hongos de este tipo serán tratados como plantas y otros grupos de organismos (Braun, 2012); por lo tanto, el principio “un hongo = un nombre” es válido como se especifica en el nuevo Código de Melbourne (ICN), Art. 59 (McNeill et al., 2012). Dicho principio es aplicable a la nomenclatura de las especies causantes de cenicilla y se propone asignar únicamente el nombre del teleomorfo en las especies de los Erysiphales (Braun, 2013), lo que implica que se asignará sólo un nombre para cada especie.
A continuación se hace un análisis de la información disponible sobre la situación actual de las cenicillas en cultivos económicamente importantes en Sinaloa y se proponen líneas de investigación sobre este tipo de enfermedades.
Etiología de las cenicillas en cultivos de Sinaloa
Cenicilla de las cucurbitáceas
Aun cuando estudios previos habían consignado a Erysiphe cichoracearum como agente causal de la cenicilla de las cucurbitáceas (Alvarez, 1976; Cebreros et al., 1991), la primer publicación en la que se incluyó morfometría del anamorfo y el teleomorfo para la identificación de la cenicilla de las cucurbitáceas en Sinaloa, se publicó en 2005. De los signos del patógeno colectados en varios tipos de calabaza, melón, sandía y bule (Lagenaria siceraria (Molina) Standley), se realizó un análisis morfométrico tanto del anamorfo como del teleomorfo, recurriendo a microscopía de luz y microscopía electrónica de barrido (Figura 1. A-F). Las imágenes de los conidios tipo Euoidium bajo el microscopio electrónico de barrido, el tipo de hospedante y las características del anamorfo permitieron la identificación preliminar de Podosphaera (sect. Sphaerotheca) xanthii (Castagne) U. Braun y N. Shishkoff, (sin. Sphaerotheca fuliginea (Schelechtend.:Fr.) Pollacci) como la especie asociada a la cenicilla de las cucurbitáceas (Félix-Gastélum et al., 2005). Estudios del teleomorfo en diferentes tipos de calabaza permitieron confirmar la identidad del hongo, tal como se realizó en California, EUA (Kontaxis, 1978), pero esta fase del organismo no se encontró en melón, bule y sandía aun cuando plantaciones comerciales de estos cultivos se encontraban dañados por cenicilla y en ocasiones colindaban con lotes de pepino o calabaza donde se encontraba el teleomorfo (Félix-Gastélum et al., 2005). Estudios posteriores sobre la cenicilla del pepino en el Valle de Culiacán, Sinaloa, permitieron la identificación del anamorfo y teleomorfo de P. xanthii en pepino, mediante estudios morfológicos y moleculares. Se consignó además, la presencia de las razas fisiológicas 1, 2F, 4, y 5 (Bojórquez-Ramos et al., 2012). De acuerdo a Ballantyne (1975)Erysiphe cichoracearum (sin. Golovinomyces cichoracearum (DC.) V.P. Heluta), Leveillula taurica (Lév.) G. Arnaud, Erysiphe communis (Wallr.) Schltdl., Erysiphe polygoni DC. y Erysiphe polyphaga Hammarl. se han encontrado asociadas a la enfermedad en otras partes del mundo; sin embargo, estas especies no se encontraron en las diferentes cucurbitáceas estudiadas durante cuatro ciclos agrícolas (2000 a 2004) en el norte de Sinaloa (Félix-Gastélum et al., 2005), lo cual coincide con estudios sobre la cenicilla del pepino en el Valle de Culiacán (Bojórquez-Ramos et al., 2012). Sin embargo, en la República Checa se encontró a P. xanthii y G. cichoracearum en una misma especie de cucurbitácea (Lebeda et al., 2004).
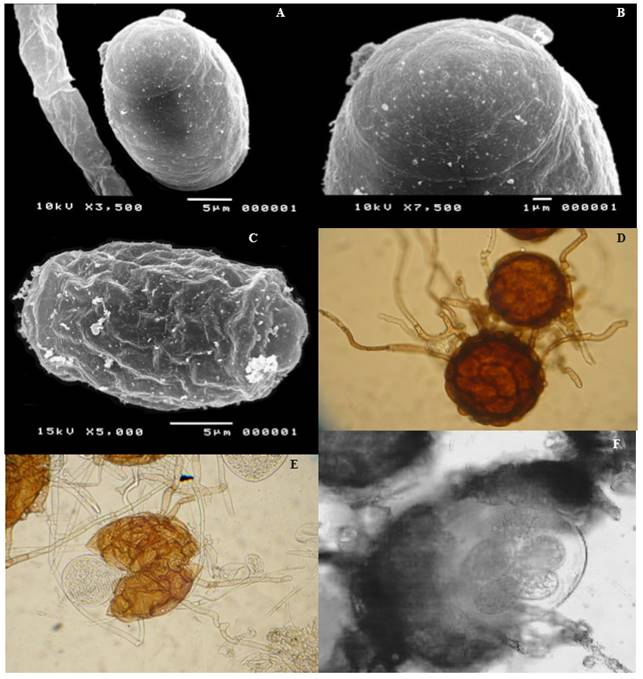
Figura 1. Micrografía con microscopía electrónica de barrido de Podosphaera xanthii en calabaza: A) Pared lisa del conidio, B) Parte terminal del mismo con anillos concéntricos tenues y proyecciones lobulares, C) Conidio parcialmente deshidratado con ondulaciones longitudinales y transversales. D) Casmotecios con apéndices miceliales septados. E) Asca hialina inmadura en un casmotecio parcialmente abierto. F) Asca con ascosporas en su interior.
La ausencia del teleomorfo en plantas de melón, bule y sandía en Sinaloa resulta difícil de explicar; sin embargo, puede ser que el hongo sea heterotálico tal como sucede en P. xanthii (McGrath, 1994) y otras especies causantes de cenicillas (Yarwood, 1935; Schnathorst, 1959; Smith, 1970, Coyier, 1972). Los casmotecios no se forman en todas las especies y variedades de cucurbitáceas (Khan y Khan, 1970); y en Sinaloa éstos se encontraron en los diferentes tipos de calabaza y pepino, al final del ciclo de cultivo (Félix-Gastélum et al., 2005). Estudios previos indican que la formación de casmotecios inicia cuando la formación de conidios disminuye o cesa por la senescencia del hospedante, o bien por factores ambientales y de manejo tales como las condiciones de nutrición limitadas, bajos niveles de humedad y baja temperatura (Yarwood, 1935). Las condiciones ambientales altamente favorables para el desarrollo de las cenicillas también influyen en el desarrollo del teleomorfo, pues a mayor área foliar cubierta por el hongo las probabilidades de apareamiento de los diferentes tipos de compatibilidad se incrementan y con ello la formación de casmotecios (Schnathorst, 1965).
Cenicilla del tomatillo
(Physalis philadelphica Lam.). El agente causal de la cenicilla del tomatillo se identificó como P. xanthii mediante el estudio de las características morfométricas del anamorfo e imágenes de los conidios bajo el microscopio compuesto (Figura 2 A y B) y el microscopio electrónico de barrido (Figura 2 C); no se encontraron estructuras que revelaran la presencia del teleomorfo del hongo en plantas infectadas (Félix-Gastélum et al., 2007). De nuevo, se demostró que las características del anamorfo contribuyeron en la identificación preliminar de la cenicilla del tomatillo, tal como se menciona por otros autores (Boesewinkel, 1980; Braun et al., 2002; Braun y Cook, 2012). Es importante señalar que, en la literatura sólo existen dos reportes de esta enfermedad: uno en California, EUA (Koike y Smith, 1988) y otro en Taiwán (Cheng et al., 2006). Resultados preliminares indican que el agente causal de la cenicilla de la calabaza no ataca al tomatillo y la de tomatillo no ataca a calabaza (Félix-Gastélum, resultados no publicados), lo cual coincide con estudios previos donde se menciona que la mayoría de las especies causantes de cenicillas son específicas para ciertos hospedantes; sin embargo, existen varias especies de este grupo de hongos que poseen un amplio rango de hospedantes, como el caso de Erysiphe quercicola S. Takam. y U. Braun el cual ataca a plantas de climas templados y algunas especies de árboles tropicales (Takamatsu et al., 2007).
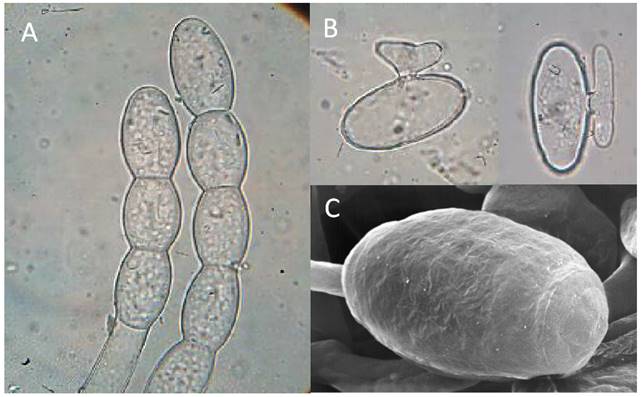
Figura 2. A) Conidióforos tipo Euoidium de cenicilla de tomatillo con conidios inmaduros y márgenes crenados característicos de Podosphaera (sect. Sphaerotheca) xanthii. B) Conidios con tubo germinativo bifurcado originándose en la parte media del conidio. C) Micrografía con microscopía electrónica de barrido de conidio maduro con pared lisa.
Cenicilla del frijol (Phaseolus vulgaris L.)
La literaura regional se ha referido a E. polygoni como agente causal de la cenicilla del frijol (León-Gallegos, 1988). El primer estudio donde se aborda la morfometría del anamorfo y la identificación molecular del agente causal de la enfermedad en Sinaloa se publicó en años recientes (Félix-Gastélum et al., 2011). Ante la ausencia del teleomorfo del hongo, se recurrió a estudios morfométricos del anamorfo, lo cual se complementó con imágenes de conidios al microscopio electrónico de barrido (Figura 3 A y B.). Adicionalmente, la amplificación de ITS del ADNr confirmó al agente causal como Pseudoidium (Cook et al., 1997), anamorfo de Erysiphe diffusa (Cooke y Peck) U. Braun y S. Takam. (Takamatsu et al., 2007).

Figura 3. Micrografía con microscopía electrónica de barrido de Erysiphe diffusa en frijol: A) Conidio inmaduro unido al conidióforo tipo Pseudoidium y B) Conidio maduro, con reticulación en su pared.
Afortunadamente, la cenicilla no es una enfermedad importante en frijol Azufrado Higuera, la variedad predominante en la región, pero es severa en variedades de frijol de hábito postrado, los cuales representan menos del 10 % de la superficie sembrada en Sinaloa. Al igual que en Brasil (Almeida et al., 2008), el teleomorfo de E. diffusa no se ha observado en Sinaloa, por lo que se infiere que algunos hospedantes alternos podrían representar un papel importante en el ciclo de vida y supervivencia del patógeno. Algunas leguminosas silvestres podrían actuar como puente para la sobrevivencia del patógeno en ausencia de frijol. Esta línea de investigación, una vez explorada, seguramente contribuirá al entendimiento de la biología del patógeno y a la epidemiología de la enfermedad.
Cenicilla del mango (Mangifera indica L.).
La cenicilla del mango es una de las enfermedades más comunes y más ampliamente diseminadas en el mundo (Nasir et al., 2014), causando pérdidas hasta del 90 % cuando se presenta en floración (Misra, 2001). En Sinaloa, aunque en ocasiones subestimada por los productores, esta enfermedad puede causar hasta 70 % de pérdidas cuando ocurre al inicio de la floración durante los meses de enero y febrero. El hongo ataca principalmente al tejido joven incluyendo hojas, peciolos, escamas florales, yemas florales, y frutos en estados iniciales de desarrollo (Singh, 1960), síntomas que también se han observado en Sinaloa desde hace décadas. La literatura regional se refirió a Oidium mangiferae Berthet como agente causal de la enfermedad durante muchos años (Ramírez-Villapudúa et al., 2006).
Con base en estudios morfométricos, imágenes de conidios al microscopio electrónico de barrido (Figura 4 A y B), así como estudios moleculares y análisis filogenéticos del anamorfo, se determinó que el agente causal de la enfermedad en Sinaloa es Pseudoidium anacardii (F. Noack) U. Braun y R.T.A. Cook con E. quercicola como teleomorfo (Félix-Gastélum et al., 2013). Al igual que en otras zonas productoras de mango en el mundo (Nasir et al., 2014), en el Norte de Sinaloa no se encontró el teleomorfo en especímenes colectados en mango vars. Kent y Keith en árboles de huertas comerciales y de traspatios (Félix-Gastélum et al., 2013). En otras partes del mundo el hongo inverna como micelio o haustorios en yemas o puede permanecer en el follaje denso de los árboles (Nasir et al., 2014); se desconoce la forma de supervivencia durante el verano en Sinaloa. El dilucidar la forma de sobrevivencia del anamorfo de P. anacardii permanece como futura línea de investigación. Por otro lado, estudios realizados en Guerrero y Michoacán indicaron que la severidad máxima de la cenicilla del mango coincidió con períodos de temperatura de 20 °C y humedad relativa de 22-60 % en los dos primeros flujos de floración; sin embargo, el tercer flujo de floración coincidió con temperaturas de 2025 °C y humedad relativa de 60-80 %. Las etapas fenológicas 1 a 6 (yema hinchada y elongación de panículas) se comportaron como tolerantes, mientras que las etapas 7 y 8 (apertura floral) se consideraron susceptibles y la 9, 10 y 11 (floración plena e inicio del desarrollo del fruto) como muy suceptibles (Guillen-Sánchez et al., 2004). El manejo eficiente de la cenicilla del mango en Sinaloa requiere de la implementación de este tipo estudios, en los que se integren la relación entre la humedad relativa, la temperatura y la fenología del hospedante con la severidad de la enfermedad. Además, deberá contemplarse, el factor inherente a las variedades, pues aunque predomina la variedad Kent, otros cultivares como Ataulfo, Haden, Keith y Tommy Atkins, se han incluido en la producción de mango en años recientes.
Cenicilla del rosal (Rosa spp.).
A nivel mundial, la cenicilla es la enfermedad más común e importante en rosas (Leus et al., 2006) en invernadero y a campo abierto (Hosseini et al., 2014). Sin embargo, en Sinaloa no se habían realizado estudios para dilucidar la identidad del agente causal. Ante la ausencia del teleomorfo, la identificación del anamorfo se logró mediante la aplicación de morfometría, microscopía de luz y microscopía electrónica de barrido, así como la amplificación de la región ITS del ADNr. Se concluyó que el agente causal de la enfermedad es Oidium (=Euoidium) leucoconium con Podosphaera pannosa (Wallr.) de Bary como teleomorfo (Félix-Gastélum et al., 2014). Aun cuando el teleomorfo no se ha observado en Sinaloa, éste se ha consignado en Korea (Shin, 1999; Lee et al., 2011) y Yugoslavia (Ranković y Čomić, 1997). En otras latitudes, en rosales cultivados en campo abierto, el hongo inverna como micelio en primordios de yemas de las hojas; en primavera, cuando el nuevo tejido emerge de las yemas el hongo produce abundante inóculo el cual se dispersa e infecta el tejido sano. Aun cuando se han encontrado casmotecios sobre el tejido dañado, su presencia es errática, por lo que su eficacia como medio de supervivencia es poco probable (Horst, 1983). En Sinaloa, la supervivencia del hongo durante el verano podría ocurrir en primordios de yemas o en hojas que permanecen adheridas después de las podas, de tal manera que durante el invierno y primavera, la enfermedad se presenta de nuevo en los rosales.
Cenicilla del tomate (Solanum lycopersicum L.)
Esta enfermedad se reportó por primera vez en Sinaloa en el ciclo hortícola 1979-1980 (Sánchez-Castro, 1983). El agente causal se identificó como Oidiopsis taurica (Lév.) E.S. Salmon, lo cual sólo se sustentó con morfometría del anamorfo, pues el teleomorfo no se encontró en dicho ciclo agrícola ni en los subsiguientes. De acuerdo a Hirata (citado por Correl et al., 1987) el patógeno infecta a 710 especies de plantas incluidas en 290 géneros de 59 familias, predominantemente anuales, aunque también infecta a plantas perennes como el olivo y otras plantas perennes. La enfermedad también ha sido consignada en berenjena en el Valle de Culiacán donde se le considera de menor importancia, debido a que se presenta en forma esporádica y porque los daños que ocasiona no son de trascendencia (Cebreros-Sánchez y Sánchez-Castro, 1998). Es importante señalar que los síntomas de cenicilla, similares a los observados en tomate y berenjena, también se han observado en la planta ornamental denominada cereza de Jerusalén (Solanum pseudocapsicum L.) y la planta ruderal conocida como trompillo (Solanum elaeagnifolium Cav.) (Félix-Gastélum, no publicado). Aun cuando la cenicilla del tomate se ha presentado en niveles epidémicos, no existen estudios que sustenten la identificación del patógeno en plantas cultivadas así como en la ornamental y en la ruderal antes mencionadas, además de que su papel en la ecología del patógeno y la epidemiología de la enfermedad se desconoce.
Futuras líneas de investigación sobre las cenicillas en Sinaloa
El conocimiento de las cenicillas en Sinaloa y el resto de México es limitado. Aun cuando se ha identificado el anamorfo de algunas especies, considerando su morfometría, incluyendo imágenes de conidios al microscopio electrónico de barrido, así como estudios moleculares en algunas de ellas, existe un amplio espacio por explorar en lo relativo a la identificación de los agentes causales de este tipo de enfermedades; por ejemplo, en melón, sandía, bule y tomatillo el hongo asociado a la cenicilla se identificó preliminarmente como el anamorfo de P. xanthii; sin embargo, se justifican estudios adicionales donde se incluyan análisis moleculares y filogenéticos como elementos de soporte para la identificación del patógeno.
En virtud de que el teleomorfo del agente causal de la cenicilla del frijol, mango y rosal tampoco se ha descrito, la identidad de un grupo más amplio de especímenes asociados a sus respectivos hospedantes se deberá desarrollar en Sinaloa, pues en trabajos preliminares se incluyeron en promedio diez especímenes del norte de Sinaloa. Además, es importante el desarrollo de investigación sobre sus potenciales hospedantes alternos u otras formas de supervivencia en ausencia de los hospedantes económicamente importantes, ya que esto contribuirá al conocimiento del ciclo de vida de estos patógenos, aspecto esencial para diseñar estrategias de manejo de la enfermedad.
Aun cuando el teleomorfo de muchas especies de Erysiphales se desconoce, principalmente en áreas tropicales y subtropicales (Monkhung et al., 2011), las características del anamorfo tal como lo describe Boesewinkel (1980), así como imágenes de la pared de los conidios al microscopio electrónico de barrido (Cook et al., 1997; Braun et al., 2002), el rango de hospedantes (Cook et al., 1997), además de análisis moleculares y filogenéticos (Cunnington et al., 2003) son elementos que de manera integral contribuyen a la identificación de las especies causantes de cenicillas, lo cual es importante en el manejo de este tipo de enfermedades y en los programas de mejoramiento genético orientados hacia la obtención de híbridos y variedades resistentes.
El rango de hospedantes de los Erysiphales se ha estudiado ampliamente y se sabe que un número limitado de especies poseen un amplio rango de hospedantes como en los casos de L. taurica (Braun y Cook, 2012; Palti, 1988) y E. polygoni (Salmon, 1900). Con base a estos antecedentes, es importante determinar la patogenicidad de P. xanthii de tomatillo en cucurbitáceas y viceversa, pues ambos hospedantes presentan síntomas de la enfermedad durante el ciclo agrícola otoño-invierno en el Norte de Sinaloa. Por lo general, una especie de planta sólo es hospedante de una especie de cenicilla pero en especies de Quercus se identificaron Erysiphe trina Harkn., Microsphaera alni (DC.) G. Winter y Phyllactinia corylea (Pers.) P. Karst. (Yarwood, 1973).
En Sinaloa en los dos únicos estudios en varias especies de cucurbitáceas, sólo se encuentra P. xanthii (Félix-Gastélum et al., 2005; Bojórquez-Ramos et al., 2012), aun cuando por muchos años se mencionó a G. cichoracearum como agente causal de la enfermedad (León-Gallegos, 1988). Actualmente se desconocen las razones y cuándo P. xanthii desplazó a G. cichoracearum en la región o quizás no se realizaron esfuerzos previos para la identificación correcta del patógeno. La presencia de P. xanthii como única especie asociada a las cucurbitáceas en Sinaloa (Félix-Gastélum et al., 2005; Bojórquez-Ramos et al., 2012) coincide con reportes previos que la registran en España, Israel y Turquía como la única especie presente en cucurbitáceas; mientras que, en algunos países G. cichoracearum y P. xanthii se encontraron en coinfecciones o en forma individual (Křístková et al., 2009).
Aun cuando los casmotecios de P. xanthii se han encontrado en diversos tipos de calabaza y pepino en Sinaloa, se desconoce su potencial como fuentes de inóculo primario para el brote de epidemias en cucurbitáceas en el ciclo agrícola siguiente. Son pocas las especies de agentes causales de cenicilla en las que se ha determinado el proceso de infección de las ascosporas (Jarvis et al., 2002), tal es el caso de Erysiphe necator Schwein. cuyas ascosporas germinaron, produjeron apresorios 12 h después de la inoculación a 20°C y enseguida se observaron estructuras somáticas típicas del patógeno sobre las hojas inoculadas (Pearson y Gadoury, 1987). La supervivencia de los casmotecios durante el verano después de su incorporación junto con los residuos de cultivos que ocurre en postcosecha, en suelos de Sinaloa es cuestionable, pues a diferencia de los esclerocios, dichas estructuras de origen sexual no poseen la capacidad de sobrevivir en el suelo durante el verano; aunque también se debe considerar su supervivencia en cucurbitáceas silvestres. En este sentido, en Sinaloa se han observado síntomas de cenicilla en meloncillo (Cucurbita foetidissima Kunth.), como ocurre en la República Checa (Lebeda et al., 2004). Estudios sobre el papel de ésta y otras cucurbitáceas silvestres como potenciales fuentes de inóculo merecen atención, pues P. xanthii se ha encontrado infectando a especies de las familias Asteracea, Lamiaceae, Scrophulariaceae y Solanaceae (Pérez-García et al., 2009). En años recientes, el hongo se ha encontrado asociado a papaya y melón amargo (Momordica charantia L.) (Huang y Wuang, 2007; Tsay et al., 2011; Joa et al., 2013; Liu y Kirschner, 2015), así como a miembros de Solanaceae que incluyen a Petunia (Kiss et al., 2008; Brielmaier-Liebetanz et al., 2015) y berenjena (Liu et al., 2015). En virtud de que varios de los hospedantes de P. xanthii, consignados en otras partes del mundo, se encuentran en Sinaloa, la asociación del patógeno con dichos hospedantes debe determinarse en esta región.
Estudios básicos de biología molecular que involucren procesos de la patogénesis en las cenicillas merecen atención en Sinaloa; por ejemplo, la pre-penetración y pos-penetración del hongo al hospedante requiere biosíntesis de altos niveles de proteínas de novo (Both 2005); en este caso, se deberían incluir aspectos de proteómica específicos en la formación de haustorios y otras fases de la patogénesis (Noir et al., 2009).
Por otro lado, estudios sobre la cenicilla de la calabaza zucchini causada por P. xanthii indican que la combinación de alta concentración de CO2 (800 ppm) y altas temperaturas (28 °C durante el día y 22 °C durante la noche) estimulan el desarrollo y severidad del patógeno (Pugliese et al., 2012). Estudios de este tipo en Sinaloa podrían explicar si el incremento de temperatura derivado del cambio climático podría ser la causa de la presencia de P. xanthii en lugar de G. cichoracearum, como ha ocurrido en algunas regiones de la República Checa (Lebeda et al., 2009).
También se debería determinar la distribución espacio temporal de especies y razas causantes de cenicilla y su respectiva virulencia en diferentes híbridos de cucurbitáceas y otros cultivos en Sinaloa, lo cual es esencial en estudios sobre ecología, epidemiología y particularmente en el desarrollo de híbridos resistentes a la enfermedad (Coffey et al., 2006).
En vista de que los estudios de efectividad biológica de sustancias amigables para el control de cenicilla se han llevado a cabo principalmente en condiciones de invernadero (Pérez-Ángel et al., 2010; Yáñez et al., 2012), es importante desarrollar investigación orientada a la búsqueda de organismos antagónicos endémicos y determinar su efectividad biológica en invernadero y en campo abierto y que a través de estos estudios se determine el efecto de parámetros climáticos que afecten el control de la enfermedad.
Conclusiones
Las cenicillas (Ascomycota, Erysiphales) son enfermedades que se presentan con frecuencia en plantas cultivadas y silvestres a nivel mundial. Aun cuando estas enfermedades afectan rendimiento y calidad en cultivos como tomate, tomatillo, chile, cucurbitáceas, entre otros, su conocimiento sobre etiología, epidemiología y control en Sinaloa y el resto de México es limitado. El advenimiento de herramientas moleculares, y la utilización de microscopía de luz y microscopía electrónica de barrido han contribuido de manera significativa en la identificación del anamorfo de los agentes causales de las cenicillas en regiones donde no se encuentra el teleomorfo del hongo. Existen varias líneas de investigación en las que se debe de incursionar en este tipo de enfermedades en Sinaloa. Por ejemplo, la búsqueda de los potenciales teleomorfos de la cenicilla del tomate, tomatillo, chile, mango, rosal y algunas cucurbitáceas como sandía, melón y bule contribuirá al conocimiento del ciclo de vida de estos patógenos en dichos cultivos. Atención especial merece también la determinación del rango de hospedantes de los agentes causales de este tipo de enfermedades, pues esto contribuirá al conocimiento de la ecología y la epidemiología de las cenicillas, en lo que sustentarán medidas más eficaces para su control, donde se deberá privilegiar el uso de medidas amigables con el ambiente tales como productos orgánicos e inorgánicos, así como agentes de biocontrol endémicos de Sinaloa.











 texto en
texto en 



