El cultivo de papa (Solanum tuberosum) tiene gran importancia económica y agrícola, ya que la papa es el tercer alimento más consumido en el mundo (FAO, 2014). La producción que se cosecha en el campo mexicano representa el 0.5 % de su oferta a nivel mundial (SIAP, 2014). El municipio de Zinacantepec, Estado de México, en el año 2014 registró una producción de 17,535 t, equivalente a $115,239.06 (SIAP, 2014). El rendimiento de este tubérculo se ve afectado por la presencia de agentes fitopatógenos, tal es el caso del oomiceto Phytophthora infestans (Mont) De Bary que causa la enfermedad conocida como “tizón tardío” (Kerroum et al., 2015). Este oomiceto provoca lesiones foliares que se desarrollan de tres a siete días, lo que deriva en una epidemia (Rekanović et al., 2011). En los últimos años este patógeno ha causado grandes pérdidas económicas en Zinacantepec (López et al., 2013). El control químico es el método más utilizado, se aplica a la semilla, follaje y suelo, con resultados eficientes, pero con efectos de residualidad, lo que provoca que los productos químicos se acumulen en cuerpos de agua, suelo, plantas y animales (Miller et al., 2000; Aceves et al., 2008).
Lo anterior sugiere buscar estrategias ecológicas como el control biológico, que consiste en el uso de microorganismos que ayuden a disminuir la presencia de patógenos (Aceves et al., 2008). Algunas especies del género Trichoderma son reconocidas como agentes de biocontrol con amplio espectro de acción hacia fitopatógenos de cultivos agrícolas (Schuster y Schmoll, 2010). Este género utiliza mecanismos de acción tales como: competencia, micoparasitismo y antibiosis (Monte, 2001; Harman et al., 2004; Bailey et al., 2008). Las formulaciones comerciales compuestas por varias especies de Trichoderma (T. harzianum, T. viride y T. atroviride) que se aplican en campo (Lorito et al., 2010; Mazyar et al., 2010) generalmente pertenecen a una región diferente a la que se aplica, lo que deriva en la ineficacia del control (Harman et al., 2010). Al respecto Altieri (1999) recomienda la utilización de especies nativas adaptadas a las condiciones ecológicas de la región de aplicación para garantizar la acción exitosa de biocontrol. Sin embargo, algunas empresas requieren cepas con capacidad de biocontrol y adaptación a diferentes regiones y sobre diversos agentes patógenos (PHC, 2016).
En el control biológico es importante la evaluación del potencial antagónico in vitro y en planta, así como la caracterización taxonómica de los aislados, ya que esto permite conocer los requerimientos de la especie para su crecimiento y establecer criterios de selección como agente de biocontrol, debido a que no todas las especies de Trichoderma tienen esta capacidad (Munir et al., 2013). La caracterización convencional de las especies de Trichoderma basada en características morfológicas no es suficiente, debido a la plasticidad de caracteres, por lo que es importante realizar estudios moleculares para tener un diagnóstico con mayor certeza taxonómica (Hermosa et al., 2000). Los análisis filogenéticos son una herramienta que apoya y valida los estudios moleculares, mediante la evidencia evolutiva que puede demostrar relaciones convergentes o divergentes entre especies (Morrone, 2001).
En estudios previos a este trabajo (García-Núñez et al., 2012), se aislaron 10 cepas nativas de Trichoderma de suelos hortícolas del Valle de Toluca, México, algunas de las cuales en pruebas de antagonismo in vitro mostraron alto potencial para el control de Sclerotinia sp., agente causal de la pudrición blanda en lechuga. Las cepas no se identificaron a nivel molecular, por lo que es importante conocer a que especie pertenecen, así como su posible efecto de biocontrol sobre otros patógenos. Por ejemplo, se ha demostrado que cepas de Trichoderma asperellum son antagonistas de hongos y oomicetos fitopatógenos (Taghdi et al., 2015). Por lo anterior, el objetivo del presente trabajo fue caracterizar mediante técnicas convencionales, moleculares y filogenéticas 10 cepas nativas de Trichoderma, así como evaluar su potencial de biocontrol contra Phytophthora infestans, agente causal del tizón tardío en cultivo de papa.
Materiales y métodos
Zona de estudio y origen de las cepas
Las 10 cepas nativas de Trichoderma (TL2, TL4, TL5, TL6, TX7, TX8, TT6, TF8, TF10 y TJ6) utilizadas para este estudio fueron aisladas en un trabajo previo (García-Núñez et al., 2012). Los puntos de aislamiento se ubican en localidades de la zona hortícola del Valle de Toluca (Cuadro 1).
Se aisló una cepa de Phytophthora infestans de una parcela de cultivo de papa de La Peñuela, localidad del municipio de Zinacantepec, Estado de México. Se seleccionaron follajes con signos y síntomas de tizón tardío, es decir tejido de tallos y peciolos con necrosis, con apariencia de manchas oscuras y en el envés de las hojas presencia de un halo de micelio blanco con esporulación color gris. La muestra fue colocada en papel húmedo y se trasladó al laboratorio, donde fue colocada en papel filtro esterilizado y después en placas Petri con algodón húmedo, generando así cámaras húmedas que se mantuvieron a temperatura ambiente durante siete días para propiciar la presencia de micelio y esporulación del patógeno. Cuando se obtuvo micelio suficiente se procedió siguiendo la técnica de Sutton (1980), tal como se describe a continuación: se tomó una muestra de micelio activo esporulado con una asa bacteriológica y se inoculó en una placa Petri con medio de cultivo papa dextrosa agar (PDA, Bioxon). Se incubó a 22±2 °C por 12 días, posteriormente de estas muestras se obtuvo un aislado monospórico mediante la técnica de punta de hifa para obtener una cepa pura. A partir de la cepa pura de P. infestans se realizaron las pruebas de los postulados de Koch para validar su patogénesis.
Las cepas se encuentran resguardadas en el Instituto de Ciencias Agropecuarias y Rurales (ICAR), de la Universidad Autónoma del Estado de México.
Caracterización morfológica macroscópica de las cepas
Una vez obtenidas las cepas puras de Trichoderma y de P. infestans se realizó su caracterización morfológica. Las cepas de Trichoderma se identificaron siguiendo la guía de Barnett y Hunter (1972), considerando características morfológicas macroscópicas como: textura del micelio, formación de anillos concéntricos y la pigmentación de las conidias. La cepa de P. infestans se caracterizó a través de la guía de Erwin y Robeiro (1996), considerando la textura, tipo de micelio y la pigmentación de las esporas.
Caracterización morfológica microscópica
Para cada cepa se hicieron cámaras de cultivo en placas Petri de acuerdo con el método modificado de Harris (1986) como se describe a continuación: se colocó un triángulo de vidrio que contenía un porta objetos con un disco de medio PDA (Bioxon) de 15mm de diámetro, en el que se inoculó una asada de esporas de la cepa de Trichoderma. Se cubrió la muestra con un cubreobjetos, se cerró la caja Petri y se incubó a 25 °C por siete días. Posteriormente se retiró el cubreobjetos que contenía micelio activo y esporas del aislado y se colocó sobre un portaobjetos, se tiñó con una gota de azul de algodón. Se realizaron observaciones en microscopio óptico (Image Motic Plus 2.0) acoplado a una cámara digital. Las imágenes se capturaron bajo el objetivo de 100X usando aceite de inmersión. Para Trichoderma la descripción se realizó de acuerdo a las siguientes características: forma y número de conidias, fialides, y conidióforos, para lo cual se utilizó la guía de identificación de Barnett y Hunter (1972). Para P. infestans las características morfológicas que se tomaron en cuenta fueron: tipo de hifa; forma y tamaño de esporangios; tipo de papila y presencia o ausencia de clamidosporas, según lo recomendado para Oomycetes (Erwin y Robeiro, 1996).
Caracterización molecular de Trichoderma
Obtención del micelio. Cajas petri con medio de cultivo PDA (Bioxon) y una membrana circular de celulosa de 76 mm de diámetro (Sigma) esterilizada se inocularon con 100 μL de una suspensión de 1X108 esporas por mL de cada una de las cepas. Las placas se incubaron a 25 °C por tres días. El micelio se recuperó de la membrana por raspado con una espátula en condiciones de esterilidad, se congeló y liofilizó. La extracción de ADN genómico del hongo se realizó de acuerdo a la técnica descrita por Hermosa et al. (2000).
Reacción en cadena de la polimerasa (PCR). Se amplificó la región ITS1-ITS4, zona del ADN ribosómico nuclear como se describe a continuación: se utilizaron los primers comerciales ITS1f (5’-TCCGTAGGTGAACCTGCGG-3 ́) e ITS4r(5’-TCCTCCGCTTATTGATATGC-3 ́) comprobados por Hermosa et al. (2012), esperando una amplificación de 600 pb. Se preparó cada reacción con un volumen final de 50 μL que contenía 5 μL de Buffer + MgCl2 (50 mM), 0.3 μL dNTPs (2 mM/μL), 2 μL de primer (10 μM), 1 μL de Taq polimerasa (5U); 1.5 μL de DNA genómico; 38.2 μL de agua miliQ. La reacción se corrió en un termociclador (MJ Research, Inc.) bajo el siguiente programa: Primera etapa, desnaturalización inicial a 94 °C por 3 min. Segunda etapa, 35 ciclos cada uno comenzando con desnaturalización a 94 °C por 1 min, seguido por alineación a 53 °C por 1 min con 30 s, y extensión a 72 °C por 2 min. Tercera etapa, extensión final a 72 °C por 7 min. El producto se mantuvo a 4 °C. Los fragmentos de DNA productos de la amplificación (3 μL) mezclado con 2 μL de buffer de carga, fueron separados en gel de agarosa (0.8 %) mezclado con 3 μL de bromuro de etidio. Se utilizaron 5 μL de marcador de peso molecular de 100 pb (Gene ruler, Thermo Scientific). Las condiciones de corrida de la cámara de electroforesis fueron 81 volts por 30 min. Los fragmentos de ADN fueron visualizados con un fotodocumentador de luz ultravioleta.
Los fragmentos producto de PCR se purificaron siguiendo el protocolo del kit clean-up, gel extracción (NucleoSpin Extract II, Macherey-Nagel). Se evaluó la calidad y concentración del ADN en un Nanodrop. Se visualizaron las bandas de ADN en un gel de agarosa al 1 %. Este mismo procedimiento se realizó para amplificar un fragmento del gen translation elongation factor 1 alpha (tef1α) con el par de primers EF1278f 5’-CATCGAGAAGTTCGAGAAGG-3’ (Chaverri y Samuels, 2003) y TEF1LLEr 5’-AACTTGCAGGCAATGTGG-3 ́ (Jaklistch et al., 2005). Las condiciones de amplificación fuero las siguientes: desnaturalización inicial 94 °C por 3 min, 35 ciclos de desnaturalización a 94 °C 30 s, alineación 58 °C por 1 min, extensión 72 °C 1 min, extensión final de 72 °C por 7 min.
Preparación de las muestras para secuenciación. Se colocaron en tubos eppendorf 3 μl de producto de PCR purificado (50 ngμL-1), 3 μL de primer (1μM) y 2 μl de agua miliQ. Las muestras se enviaron al Departamento de Secuenciación de la Universidad de Salamanca, España.
Análisis de secuencias en bases de datos genómicos. Las secuencias obtenidas se analizaron con los programas FinchTV versión 4.1 y DNAstar para obtener las secuencias consenso. Posteriormente se realizó el análisis de alineamiento BLAST en la base de datos Genbank.
Análisis filogenéticos. Con la finalidad de conocer la relación filogenética de las cepas se utilizaron como grupos externos a Trichoderma viride y Trichoderma longibrachiatum (Mohammad et al., 2014). Se alinearon ambas secuencias mediante el programa BioEdit Sequence Alignment ver. 7.05 (Hall, 2004) y las relaciones filogenéticas se realizaron mediante el programa Past ver.207 (Harmer et al., 2001). Se obtuvo el análisis cladístico de parsimonia, mediante un Bootstrap Heuristic.
Pruebas de antagonismo
Se realizaron pruebas de confrontación in vitro entre las 10 cepas nativas de Trichoderma y Phytophthora infestans, por el método modificado de Larralde et al., (2008), como se describe a continuación: en cajas Petri con PDA se confrontaron antagonistas contra patógenos, colocando frente a frente un disco de 5 mm de diámetro de micelio activo de cada uno de ellos, separados 5 cm aproximadamente, se incubaron a 25±2 °C por siete días. Este ensayo se hizo por triplicado, con tres repeticiones de cada cepa de Trichoderma. El porcentaje de inhibición del crecimiento radial fue monitoreado cada 24 h, usando la siguiente formula: PIRG=[(R1-R2)/R1] x100, donde R1 es el crecimiento radial del control no confrontado con la cepa de P. infestans y R2 es el crecimiento radial del crecimiento de Trichoderma confrontado con P. infestans. Las pruebas de confrontación se realizaron de acuerdo a un diseño experimental completamente al azar, para cada una de las 10 cepas nativas de Trichoderma que se enfrentaron contra P. infestans. El potencial de cada cepa de Trichoderma como agente de biocontrol para la infección por P. infestans se evaluó mediante análisis de varianza y comparación múltiple de medias (Tukey, p<0.05), utilizando el software Sistema de Análisis Estadístico (SAS) versión 9.
Resultados y discusión
Caracterización morfológica macroscópica de Trichoderma y P. infestans
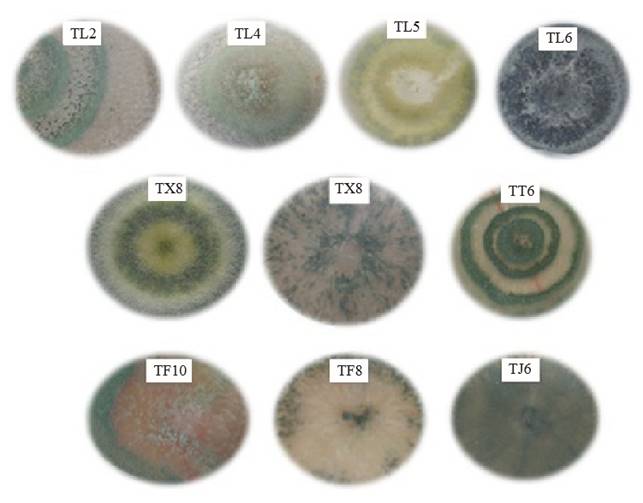
Con excepción de la cepa TF10, las cepas nativas de Trichoderma presentaron micelio de consistencia esponjosa abundante (Figura 1). Las cepas TL2, TL4, TX8 y TT6 presentaron de dos a tres anillos concéntricos bien definidos, blancos (micelio) y verdes (conidias). La cepa TL5 presentó pigmentación amarilla y anillos concéntricos. Mientras tanto, en TX7, TF10, TL6 TF8 y TJ6 no se observaron los anillos y el micelio se extendió de manera homogénea en las placas. La pigmentación conidial de las cepas fue desde una tonalidad verde claro a verde oscuro. Aunque las cepas son de la misma localidad presentaron pigmentación diferente, tal es el caso de San Francisco Tetetla donde TL2, TL4, TL5 y TL6 tuvieron pigmentación verde con diferentes tonalidades. La forma y cantidad de la conidiación observada en las placas, puede ser estimulada por factores que propician un ambiente de estrés, como son: la exposición a la luz, la falta de nutrientes o cambios en pH (Osorio-Concepción et al., 2013). La forma y la pigmentación del micelio observado en las cepas nativas corresponden al género Trichoderma de acuerdo a los criterios de identificación taxonómica de Barnett y Hunter (1972). Estas características difieren entre las cepas nativas y ninguna se parece entre sí, por esta razón es difícil agruparlas y definir especies a partir de estos datos (Gupta et al, 2013).
La cepa de P. infestans mostró micelio blanco de consistencia esponjosa abundante y con una tonalidad ligeramente beige por la presencia de los esporangios. No se apreció formación de anillos concéntricos (Figura 2).
Caracterización morfológica microscópica de Trichoderma y P. infestans
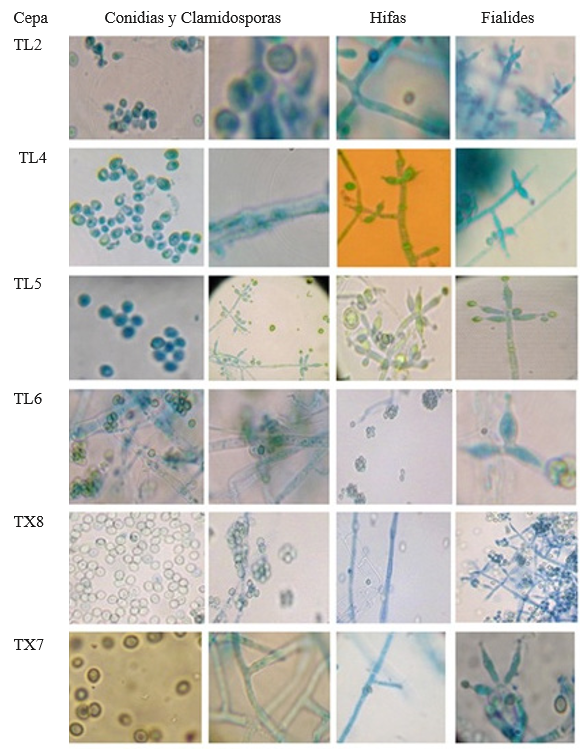
Para P. infestans se observaron hifas hialinas y ramificadas con diámetro 5-8 μm, esporangióforos alargados con pedicelo de 5 μm y esporangios elipsoidales (28.2 ± 11 X 17.6 ± 1.0 μm) con papilas caducas (Figura 3). Estos resultados se apegan a las características que reportan Erwin y Robeiro (1996) para P. infestans. También coinciden con la descripción de los aislados de P. infestans reportados por López-Orona et al. (2013).
Los resultados de las observaciones microscópicas de Trichoderma mostraron que las cepas TF8, TX7, TX8, TT6 y TL2 presentaron conidias ligeramente ovoides, dispuestas en roseta en grupos de 4 a 6, clamidosporas abundantes y globosas, fiálides apicales arregladas en verticilos cruzados en grupos de 3 a 4, ornamentación finamente espinosa y conidióforos ramificados (Figura 4). Estas características coinciden con los estudios reportados por Samuels et al., (2010). La cepa TL4 presentó conidias ovoides y fiálides en par o triadas a lo largo del conidióforo, más anchas en el centro que en la base, características que permiten clasificarla como T. asperelloides. Las cepas TL5, TL6, TF10, TJ6 presentaron hifas hialinas, conidióforos largos con ramificación, fialides anchas por el centro y alargadas en la base agrupadas piramidalmente, conidias globosas de pared lisa y abundantes clamidosporas terminales, características que revelan un acercamiento a Hypocrea (Chaverri y Samuels, 2002; Druzhinina y Kubicek, 2005; Ortiz-García et al., 2015). Debido a que las características morfológicas macroscópicas y microscópicas son variables, no permiten discriminar entre especies, lo cual muestra la importancia de la caracterización molecular para clasificar taxonómicamente a las cepas, ya que un diagnóstico a nivel de especie basado en caracteres morfológicos puede derivar en un diagnóstico erróneo, tal como sucedió en los estudios realizados por Hermosa et al., (2000) quienes realizaron la caracterizaron molecular de cepas de una colección que habían sido clasificadas morfológicamente como T. longibranchiatum; encontrando que se trataba de T. asperellum.
Caracterización molecular
La amplificación del ADN genómico de las cepas con los primers ITS1 y ITS4 fue de 600 pb, observándose bandas bien definidas (Figura 5). La amplificación del ADN genómico de los aislados con el par de primers tef1 278f y tef1ller fue de 1200 pb (Figura 6). Los resultados obtenidos del GenBank mediante el análisis Blast de las secuencias amplificadas de los dos pares de primers, mostró que de las 10 cepas, seis (TL2, TL4, TF8, TT6, TX7 y TX8) tienen una identidad del 99 % con T. asperellum. Las cuatro cepas restantes (TJ6, TL5, TL6 y TF10) presentaron una identidad del 99 % con Hypocrea lixii, el teleomorfo de T. harzianum (Cuadro 2). Por la variabilidad de los ITS a veces es difícil discriminar entre especies, por lo que se amplificó un fragmento del gen tef1α, lo cual ayudó a corroborar la taxonomía de los aislados nativos. Esto coindice con lo reportado por Druzhinina y Kubiceck (2005) y Kredics et al. (2014), quienes indican que estos marcadores son básicos para la caracterización de Trichoderma/Hypocrea. Así mismo, los estudios de Ortiz-García et al. (2015) demuestran que las secuencias ITS permiten identificar exitosamente aislados de Trichoderma/Hypocrea.
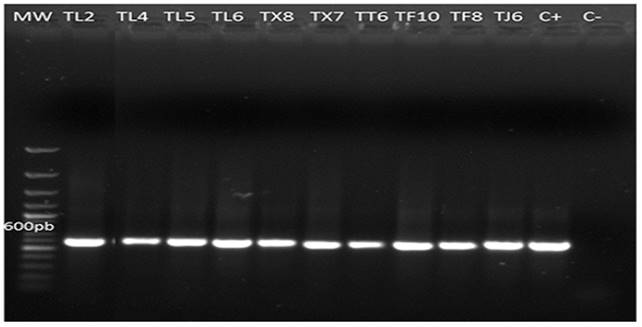
Figura 5. Productos de amplificación de PCR a partir de ADN genómico de 10 cepas nativas de Trichoderma (TL2, TL4, TL5, TL6, TX8, TX7, TT6, TF10, TF8 y TJ6) a 600pb con los primers ITS1, ITS4. MW= marcador de peso molecular (Gene ruler 100bp plus DNA ladder Thermo Scientific). C+ = Control positivo (T. asperellum). C= Control negativo. Gel de agarosa al 0.8 %.

Figura 6. Productos de amplificación por PCR a partir de ADN genómico de los aislados nativos de Trichoderma (TL2, TL4, TL5, TL6, TX8, TX7, TT6, TF10, TF8 y TJ6) a 1200pb con los primers, tef1α 278f y tef1ller. MW= marcador de peso molecular (Gene ruler 100bp plus DNA ladder Thermo Scientific). C+ = Control positivo (T. asperellum). C= Control negativo. Gel de agarosa al 0.8 %.
Cuadro 2. Especies de Trichoderma/Hypocrea presentes en la zona hortícola del Valle de Toluca, México, identificadas mediante la amplificación de los espaciadores internos transcritos (ITS) y un fragmento del gen translation elongation factor 1 alpha (tef1α).
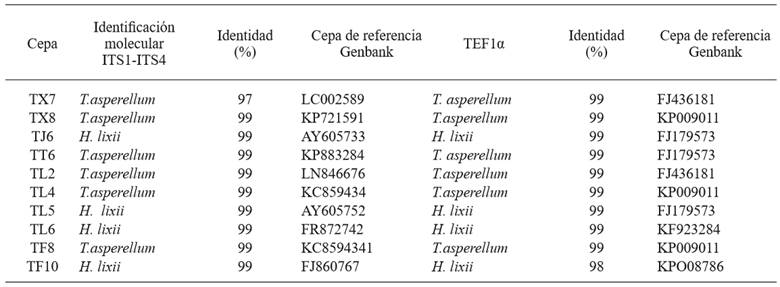
Los resultados obtenidos indican que las cepas TL2, TF8, TT6, TX7 y TX8 identificadas por caracteres morfológicos como T. asperellum efectivamente pertenecen a esta especie. La cepa TL4, que inicialmente fue clasificada como T. asperelloides, fue reclasificada con base en los estudios moleculares como T. asperellum. De esta manera queda demostrado que la identificación molecular respalda la descripción morfológica y estos elementos permiten tener un diagnostico taxonómico acertado y confiable. Por otra parte, estos resultados coindicen con los estudios de Guigón et al., (2010), quienes reportan la presencia de cepas de T. asperellum en cultivos hortícolas. La cepas TJ6, TL5, TL6 y TF10 que inicialmente fueron clasificadas como Hypocrea, fueron ubicadas taxonómicamente a partir de los análisis moleculares como H. lixii.
Los resultados obtenidos de la caracterización de las cepas nativas de la zona hortícola del Valle de Toluca, son significativos, ya que H. lixii y T. asperellum son especies que no se habían reportado para esta región y son de uso importante como agentes de control biológico en cultivos hortícolas (Monte, 2001; Harman et al., 2004; Woo et al., 2006; Hermosa et al., 2012).
Análisis filogenético
El análisis se realizó de manera heurística y se obtuvieron 82 árboles filogenéticos igualmente parsimoniosos, con índice de consistencia de 0.97 y reescalado de 0.99, lo cual indica que están bien soportados (Figura 7). El estadístico bootstrap para el soporte de las ramas se obtuvo con 100 repeticiones y se consideraron valores de 60 y 100 % como indicadores de ramas estadísticamente fuertes. Esto es importante, ya que indica que los grupos analizados corresponden a las especies esperadas, lo que coincide con los estudios reportados por Sadfi-Zouaoui et al. (2009). El árbol filogenético indica que la especie más frecuente fue T. asperellum con una mayor distribución en la zona de estudio, ya que las cepas pertenecen a cuatro de las cinco localidades muestreadas (Figura 7). En Tenango del Valle se encontró T. asperellum, lo cual no coincide con estudios de Osorio et al., (2005) quienes reportan la presencia de T. harzianum y T. lignorum. Sin embargo, dicho estudio solo se limitó a caracterización morfológica, lo cual pudo conducir a una determinación errónea. De aquí la importancia de rescatar las especies nativas con potencial de biocontrol hacia fitopatógenos, tales como T. asperellum e H. lixii. Este último se encontró en las localidades de San Francisco Putla (TF10), San Francisco Tetetla (TL5, TL6) y San Juan la Isla (TJ6). Al parecer las condiciones geográficas y ambientales establecieron este patrón de distribución, ya que estas localidades están geográficamente cercanas. Esto se muestra en el análisis filogenético, sustituyendo a los taxones por sus localidades, donde se observa una estrecha relación entre las especies encontradas en las tres localidades mencionadas. Por otra parte, es importante mencionar que aunque las 10 cepas corresponden a dos especies, en el árbol se agrupan de manera separada, lo que coincide con los resultados de la descripción morfológica macroscópica tan diversa, ya que aunque la pigmentación y la forma de crecimiento micelial son diferentes entre sí, pertenecen a una misma especie.
Pruebas de antagonismo
Los resultados de las pruebas de antagonismo entre los 10 aislados nativos de Trichoderma y Phytophthora infestans mostraron diferencias significativas (p<0.05). Para el caso de T. asperellum, TX8 y TF8 presentaron los porcentajes más altos de biocontrol hacia el patógeno, con 98 y 76 % respectivamente (Figura 8), mientras que TL4 presentó el valor más bajo (49 %). A pesar de esto, se puede afirmar que T. asperellum ejerció un mayor biocontrol sobre P. infestans. La variación de estos porcentajes coincide con los estudios in vitro reportados por Kerroum et al. (2015), quienes reportan biocontrol de T. harzianum hacia P. infestans con un rango de 56 a 86 %. Los porcentajes de biocontrol encontrados en este estudio son similares a los reportados por Al-Mughrabi (2008), donde especies de T. atroviride evaluadas in vitro muestran un 92 % de control sobre P. infestans. Además superan a los obtenidos por Debebe et al., (2011) donde el valor mínimo de biocontrol de T. viride fue de 36.7 % hacia este oomiceto. Por otra parte, a pesar de que H. lixii presenta los porcentajes más bajos de biocontrol, están por arriba del 50 %. Los resultados son consistentes con de los Santos et al. (2013), quienes reportan porcentajes de control mayores para T. asperellum comparado con H. lixii en estudios de antagonismos contra Colletotrichum gloeosporoides, causante de la antracnosis en mango.Los resultados obtenidos en este estudio difieren de los realizados con las mismas cepas por GarcíaNúñez et al. (2012), en los que los valores más altos de inhibición contra Sclerotinia sp corresponden a las cepas de T. asperellum TX8 y TL4, con 88 y 86 %, respectivamente (Cuadro 3). Sin embargo, en este estudio el aislado TL4 (T. asperellum) registró el valor más bajo de inhibición contra P. infestans (49 %). Este mismo caso lo presentó TF10 (H. lixii) que registró 80 % para el control de Sclerotinia sp. y un 66 % para P. infestans. TF8, TX7, TL2, TT6, TJ6, TL5 y TL6 registraron porcentajes menores de biocontrol para Sclerotinia sp., no así para P. infestans. Estos resultados coinciden con Matroudi et al, (2013) quienes reportan especies de Trichoderma con un bajo efecto de biocontrol sobre Sclerotinia sclerotiorum, ya que no rebasan el 80%. Por otra parte, Aceves et al., (2009) reportan especies de Trichoderma con un biocontrol del 5.35 % al 62.9 %. Por todo lo anterior, los resultados son interesantes, ya que P. infestans es un patógeno agresivo que tiene la capacidad de mutar con facilidad (López et al., 2013), a pesar de lo cual se encontraron aislados de T. asperellum con potencial para el control de este oomicete. Los aislados de H. lixii que registraron un potencial por arriba del 50 % se pueden potenciar en estudios posteriores para un biocontrol más efectivo, para realizar pruebas in vivo en una siguiente etapa con las cepas más virulentas.
Conclusiones
La caracterización morfológica, molecular y el análisis filogenético generan un diagnóstico confiable, que permitió identificar a las cepas de Trichoderma aisladas de la zona hortícola del Valle de Toluca, México como Trichoderma asperellum e Hypocrea lixii. Estas especies son consideradas con actividad biológica de amplio espectro de acción sobre fitopatógenos de cultivos. El análisis filogenético refleja la relación que existe entre la distribución geográfica de las dos especies encontradas, donde T. asperellum fue más frecuente. La cepa TX8 identificada como T. asperellum, al presentar un alto porcentaje de biocontrol sobre P. infestans y Sclerotinia sp., puede ser candidata para el control de estos fitopatógenos, lo que representaría una alternativa agroecológica para el control del tizón tardío en el Estado de México, ya que se trata de una cepa nativa que puede tener mayores posibilidades de adaptabilidad y éxito en comparación con las cepas disponibles actualmente de manera comercial. Por ello es recomendable realizar estudios a nivel de invernadero y posteriormente en campo, incluyendo diferentes dosis y métodos de aplicación. Las cepas identificadas pueden evaluarse así mismo como agentes de biocontrol sobre otros patógenos en futuras investigaciones.











 texto en
texto en